El carcinoma basocelular (CBC) es una neoplasia cutánea común.
ObjetivoExaminar los patrones de expresión de las proteínas CD10, p63, BCL-2 y antígeno epitelial de la membrana (EMA) en el CBC.
Materiales y métodosUtilizamos inmunohistoquímica para evaluar el patrón de expresión de estas proteínas en 45 muestras de CBC y su piel normal adyacente.
ResultadosEncontramos variaciones del patrón de expresión de estas proteínas entre las pieles normales y el CBC. En las pieles normales observamos una fuerte expresión citoplasmática de EMA (estructuras anexiales). Se objetivó una fuerte expresión nuclear de la proteína p63 en los queratinocitos basales y algunos suprabasales, células de la vaina de la raíz externa de los folículos pilosos, células basales de las glándulas sebáceas, y glándulas sudoríparas. La expresión de la proteína CD10 se observó en las células fusiformes mesenquimales perianexiales y las células mioepiteliales de las glándulas sudoríparas. La expresión de la proteína BCL-2 se confinó en los queratinocitos de las células basales, melanocitos epidérmicos, vaina de la raíz externa e infundíbulo del folículo piloso. En CBC encontramos expresión de las proteínas p63 (difusa, fuerte tinción nuclear), CD10 (reactividad citoplasmática focal y moderada) y BCL-2 (reactividad citoplasmática focal y moderada) en las células neoplásicas. El CBC fue consistentemente negativo para EMA (excepto en zonas de diferenciación escamosa).
ConclusionesExiste una alteración de la expresión de estas proteínas en CBC, quedando abiertos los mecanismos moleculares subyacentes a investigaciones adicionales.
Basal cell carcinoma (BCC) is common cutaneous malignancy.
AimsTo examine the expression patterns of CD10, p63, BCL-2, and epithelial membrane antigen (EMA) proteins in BCC.
Materials and methodsWe used immunohistochemistry to evaluate the expression pattern of these proteins in 45 BCC specimens and their adjacent normal skin.
ResultsWe found variations in the expression pattern of these proteins among normal skins and BCC. In normal skins, we found strong EMA cytoplasmic expression (adnexal structures). A strong nuclear p63 protein expression was found in basal and some suprabasal keratinocytes, external root sheath cells of the hair follicles, basal cells of the sebaceous glands, and in sweat glands.CD10 protein expression was seen in peri-adnexal mesenchymal spindle cells and myoepithelial cells of sweat glands.BCL-2 protein expression was confined to the basal cell keratinocytes, epidermal melanocytes, outer root sheath, and infundibulum of the hair follicle. In BCC, we found p63 (diffuse, strong nuclear staining), CD10 (focal, moderate cytoplasmic reactivity), and BCL-2 (focal, moderate cytoplasmic reactivity) protein expression in the neoplastic cells. BCC was consistently negative for EMA (except in areas of squamous differentiation).
ConclusionsThere is an altered expression of these proteins in BCC. The underlying molecular mechanisms are open to further investigations.
El carcinoma de células basales o basocelular (CBC) es el cáncer de piel no melanoma más frecuente en todo el mundo. Generalmente se localizará en áreas que están expuestas al sol, especialmente en la cabeza y en el cuello. Aunque el CBC suele ser una neoplasia indolente y poco agresiva, ya que usualmente se limita a invadir localmente los tejidos circundantes, existen variantes que son localmente más agresivas e incluso algunas, aunque rara vez, pueden llegar a dar metástasis (la tasa de metástasis es del 0,1%) a los ganglios linfáticos1,2.
El gen TP63 es un miembro de la familia de genes p53, que se encuentra en el cromosoma 3q27-293. Este gen codifica para varias isoformas de proteínas con efectos tanto de transactivación (TA) como un efecto dominante-negativo (ΔN) en el gen supresor de tumores p53. La isoforma ΔNp63 α puede estimular las primeras fases de la tumorigénesis al inhibir la detención del crecimiento y la apoptosis, mientras que al mismo tiempo puede suprimir las metástasis al mantener las características epiteliales de las células tumorales4. A nivel molecular, el p63 es un factor de transcripción nuclear que desencadena la diferenciación de los queratinocitos. En la piel normal, el p63 se expresa de manera intensa en las células madre queratinocíticas, mientras que en las células bien diferenciadas su expresión está inhibida5.
Las mucinas son glicoproteínas muy glicosiladas que tienen funciones protectoras y lubricantes. El gen MUC1 humano (locus del gen Mucin-1: 1q21) codifica una proteína que sufrirá glicosilación6. Su producto proteico se conoce como el antígeno epitelial de membrana (EMA), antígeno que se aísla en las membranas de los glóbulos de grasa de las secreciones mamarias, la mucina epitelial polimórfica y la sialomucina7. El EMA es una proteína intensamente glicosilada de 40–425kDa compuesta por un dominio transmembrana con una parte citoplásmica y un gran dominio extracelular que consta de un número variable de repeticiones en tándem que se someten a una O-glicosilación específica, lo que generará una amplia gama de variantes glicosiladas de MUC1. La integridad de los lúmenes en las células secretoras dependerá de las propiedades físicas y químicas (tamaño grande, rigidez y carga negativa) de este dominio extracelular6. Algunos estudios han sugerido la ausencia de expresión de la proteína EMA en el CBC; esto puede deberse a una alteración en su expresión a nivel de transcripción, de una glicosilación aberrante y de una localización celular anormal8–10.
CD10 es una glicoproteína transmembrana conocida como el antígeno común de la leucemia linfoblástica aguda. En la piel normal, CD10 se expresará en la vaina interna de los folículos pilosos, la matriz del pelo y en la vaina perifolicular. Este puede integrar señales del entorno celular o del compartimento intracelular mediante la escisión de péptidos a través de la actividad enzimática o de vías de señalización intracelular variables11. Hasta la fecha, hay pocos estudios disponibles sobre el patrón de expresión de la proteína CD10 en la piel normal y en el CBC.
El gen BCL-2 (linfoma de células B-2) codifica para una proteína que previene la apoptosis celular. En la piel normal, las células basales positivas para BCL-2 actúan como células de reserva para la renovación continua del epitelio escamoso12. Se cree que el CBC surge de estos queratinocitos basales y, por lo tanto, la expresión de la proteína BCL-2 se observará en la mayoría de estos tumores. Alternativamente, la expresión de la proteína BCL-2 suele ser negativa en el carcinoma de células escamosas, que se supone surge de los queratinocitos suprabasales13.
El poder distinguir el CBC de otras neoplasias cutáneas malignas, y en particular del carcinoma epidermoide, es importante para poder planificar un manejo terapéutico adecuado. Sin embargo, a veces no será fácil diferenciar el CBC del carcinoma de células escamosas de origen cutáneo, especialmente cuando las características citoarquitecturales de estos son difíciles de evaluar, como por ejemplo, cuando las biopsias de tejido son pequeñas. Aunque algunos estudios previamente han abordado este problema, y han descrito un patrón de expresión en el CBC de las proteínas CD10, BCL-2, p63 y EMA de forma individual, los resultados siguen siendo controversiales8,14,15.
Hasta el momento, no se han realizado estudios previos en los que se haya comparado de manera simultánea el patrón de expresión de estas cuatro tinciones (incluyendo p63, EMA, CD10 y BCL-2) en el CBC o en la piel normal adyacente. Además, las correlaciones entre la expresión de estas proteínas y las características clínico-patológicas del CBC, así como su rol patogénico en el desarrollo del CBC no han sido abordados previamente. Con dicha finalidad, en este estudio se buscó demostrar las diferencias en la distribución de estas proteínas, tanto en la piel normal como en el CBC. Asimismo, se presentaron los aspectos diagnósticos como patogénicos de estos hallazgos.
Materiales y métodosPacientesSe realizó un estudio retrospectivo en el Departamento de Anatomía Patológica de la Facultad de Medicina del Hospital Universitario de Asiut. Este estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Asiut (IRB #: 17300540). Se incluyeron un total de 45 casos de CBC, cuyos datos clínico-patológicos se obtuvieron de los informes de anatomía patológica (fichas de consulta de los autores). Se registraron todas las características patológicas. Todos los materiales (bloques de tejido incluidos en parafina, laminillas y los informes de anatomía patológica) fueron codificados. La información fue analizada y registrada de tal forma que no se pudiera identificar a los participantes. El estudio no incluyó ninguna interacción o intervención en los sujetos a estudio; asimismo, no se tuvo acceso a ninguna información confidencial que permitiera identificar a los pacientes.
InmunohistoquímicaLa presencia de las proteínas p63, CD10, BCL-2 y EMA se estudió utilizando el complejo de inmunoperoxidasa avidina-biotina, reproduciendo lo realizado previamente por otros grupos16. Los cortes de tejido de 4-μm fueron colocados en las laminillas para luego ser desparafinizados y rehidratados. La peroxidasa endógena se inhibió con el peróxido de hidrógeno al 3% en metanol durante cinco minutos. Luego, los cortes se sumergieron en una solución de restablecimiento (tampón de citrato de sodio 10 mM, pH 7,3) y se sometieron al restablecimiento del antígeno inducida por calor durante 10 min. Las laminillas se colocaron en frascos Coplin de plástico que contenían solución de restablecimiento y se calentaron en un microondas a una temperatura elevada (∼700 W). La unión a proteínas no específica se inhibió con 10 min de exposición a suero de cabra normal al 10%. Luego, las secciones se incubaron con anticuerpos monoclonales generados contra el p63, CD10, BCL-2 y EMA (Agilent/DAKO, 5301 Stevens Creek Blvd, Santa Clara, CA 95051, EE. UU.) durante 30 min a temperatura ambiente (clon 56C6 para CD10, Clon: DAK-p63 para p63, Clon: E29 para EMA y Clon: 124 para BCL-2). Se utilizó un sistema de detección según las instrucciones del fabricante. A continuación, los cortes se trataron con estreptavidina marcada con peroxidasa durante 30 min a temperatura ambiente y se incubaron con 14-diaminobencidina y H2O2 al 0,06% durante cinco minutos. Se contrastaron con hematoxilina Mayer, se deshidrataron en alcohol, se aclararon en xileno y se cubrieron con un cubreobjetos. La tinción fue evaluada de manera independiente por los dos autores.
Control positivoSe incluyeron cortes de amígdalas (BCL-2), próstata (p63) y riñón (EMA y CD10) como controles positivos. La positividad para EMA se identificó como una tinción pardusca citoplasmática y de membrana. La positividad para el p63 se identificó como una tinción pardusca localizada en los núcleos. La positividad para el CD10 y el BCL-2 se identificó como una tinción citoplasmática pardusca.
Control negativoComo control negativo se hicieron tinciones adicionales de los cortes omitiendo la presencia de los anticuerpos primarios. Los controles positivo y negativo fueron positivo y negativo, respectivamente, lo que indica la validez de los resultados. Todas las laminillas fueron evaluadas sin conocer la información del paciente, así como los informes clínicos.
Análisis estadísticoSe utilizó la versión 16 del paquete del programa estadístico SPSS IBM (SPSS Inc., Chicago, EE. UU.). Se realizaron las pruebas de χ2 y exacta de Fisher según correspondió. El valor de p de menos de 0,05 se consideró como estadísticamente significativo.
ResultadosEn este estudio de tipo retrospectivo se incluyeron un total de 45 pacientes con CBC; de ellos, 26 eran mujeres y 19 varones, con una edad media de 65,5 ± 11,25 años (media ± DE). La mayoría de los CBC estaban localizados en la región de la cabeza y el cuello, exceptuando algunos casos que se presentaron en las extremidades y en la espalda. Las variantes histológicas que se incluyeron fueron el patrón nodular, el patrón micronodular, pigmentado, adenoide, basoescamoso y morfeiforme. Las características clínico-patológicas se resumen en la tabla 1.
Características clínico-patológicas del carcinoma basocelular
| Variables | Núm. total de casos = 45 |
|---|---|
| Género | |
| Masculino | 19 (42,2%) |
| Femenino | 26 (57,8%) |
| Localización | |
| Cabeza y cuello | 30 (66,7%) |
| Piel del ala lateral izquierda | 3 |
| Oreja | 3 |
| Párpado | 2 |
| Frente | 4 |
| Línea de implantación del cabello | 3 |
| Hélix media izquierda | 1 |
| Labios | 3 |
| Cuello | 4 |
| Nariz | 1 |
| Periauricular | 3 |
| Cuero cabelludo | 3 |
| Extremidades y tronco | 15 (33,3%) |
| Hombro | 4 |
| Brazo | 3 |
| Espalda | 3 |
| Clavícula | 2 |
| Antebrazo | 2 |
| Región lumbar | 1 |
| Apariencia clínica | |
| Lesión ulcerada | 35 (77,8%) |
| Nódulo no ulcerado | 10 (22,2%) |
| Variantes histológicas | |
| CBC nodular | 15 (33,3%) |
| CBC micronodular | 7 (15,6%) |
| CBC pigmentado | 6 (13,3%) |
| CBC adenoide | 4 (8,9%) |
| Patrón morfeiforme | 2 (4,5%) |
| Basoescamosos | 11 (24,4) |
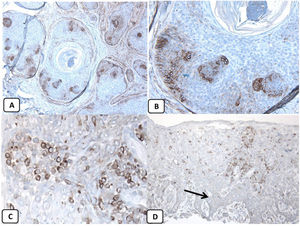
Los controles positivo y negativo fueron positivo y negativo, respectivamente, lo que indica la validez de los resultados. Se detectó positividad nuclear de la proteína p63 en los queratinocitos epidérmicos basales y en algunos suprabasales, en células de la vaina radicular externa de los folículos pilosos, y en las células basales de las glándulas sebáceas y de las glándulas sudoríparas. EMA mostró una fuerte expresión en el citoplasma de las glándulas sebáceas, las membranas luminales, los canalículos de las glándulas sudoríparas y en la capa externa de las células de los conductos sudoríparos, mientras que la expresión de esta proteína estuvo ausente en la epidermis. La expresión de la proteína CD10 se detectó en las células fusiformes mesenquimatosas perianexiales que rodean los apéndices dérmicos, algunos axones nerviosos, la papila pilosa de los folículos pilosos y las células mioepiteliales de las glándulas sudoríparas. La expresión de la proteína BCL-2 se limitó a los queratinocitos y melanocitos basales epidérmicos. La expresión de la proteína BCL-2 también se observó en la vaina radicular externa queratinizante del istmo y el infundíbulo del folículo piloso. Un resumen de estos hallazgos se muestra en las figuras 1, 2 y 3.
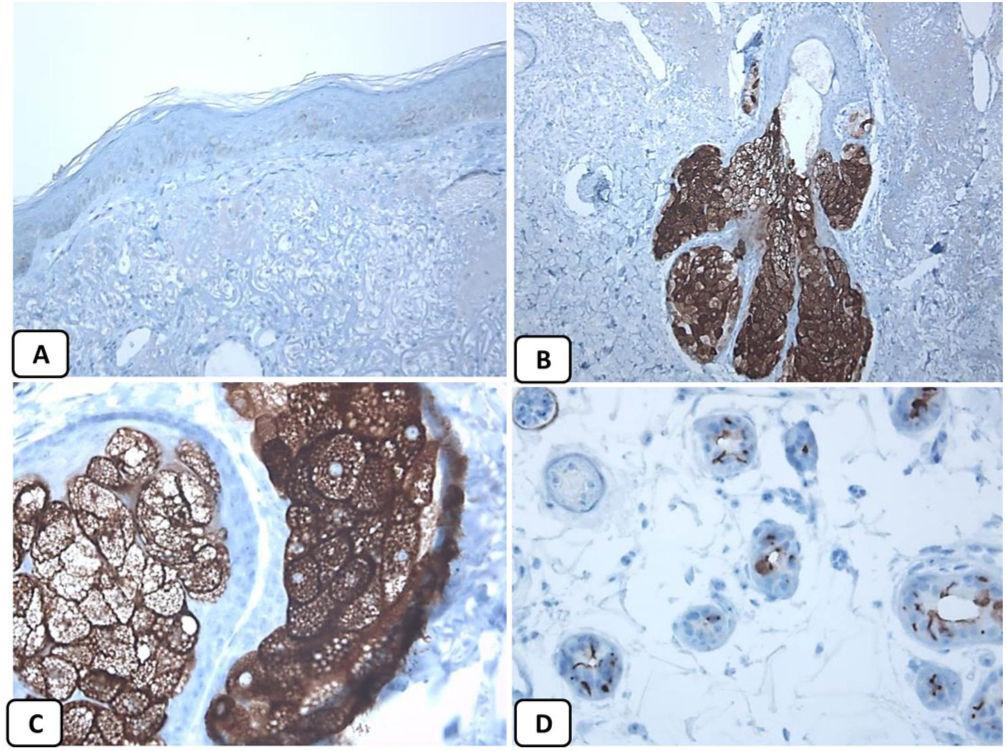
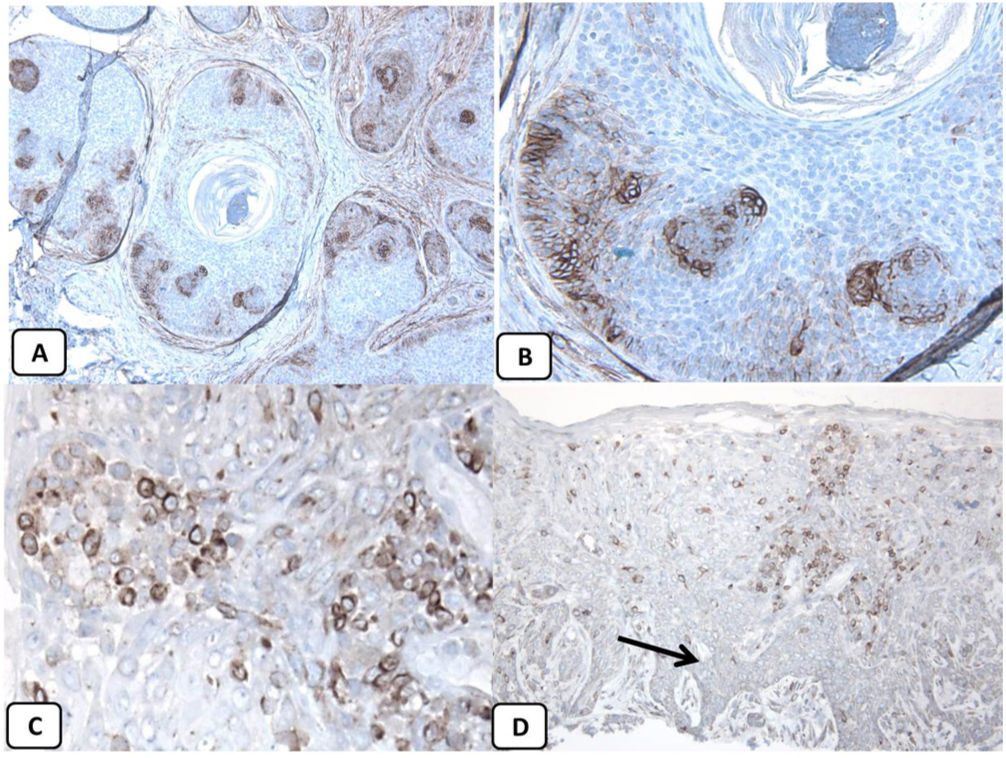
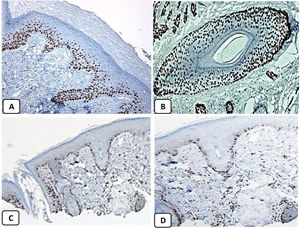
Expresión inmunohistoquímica de EMA en la piel normal. Tinción negativa de EMA en la epidermis (A, ×200), fuerte expresión de EMA en el citoplasma de las glándulas sebáceas maduras (B, ×200 y C, ×400). D) EMA positivo en la membrana luminal y los canalículos de la glándula sudorípara y la capa externa del conducto sudoríparo (D, ×200).
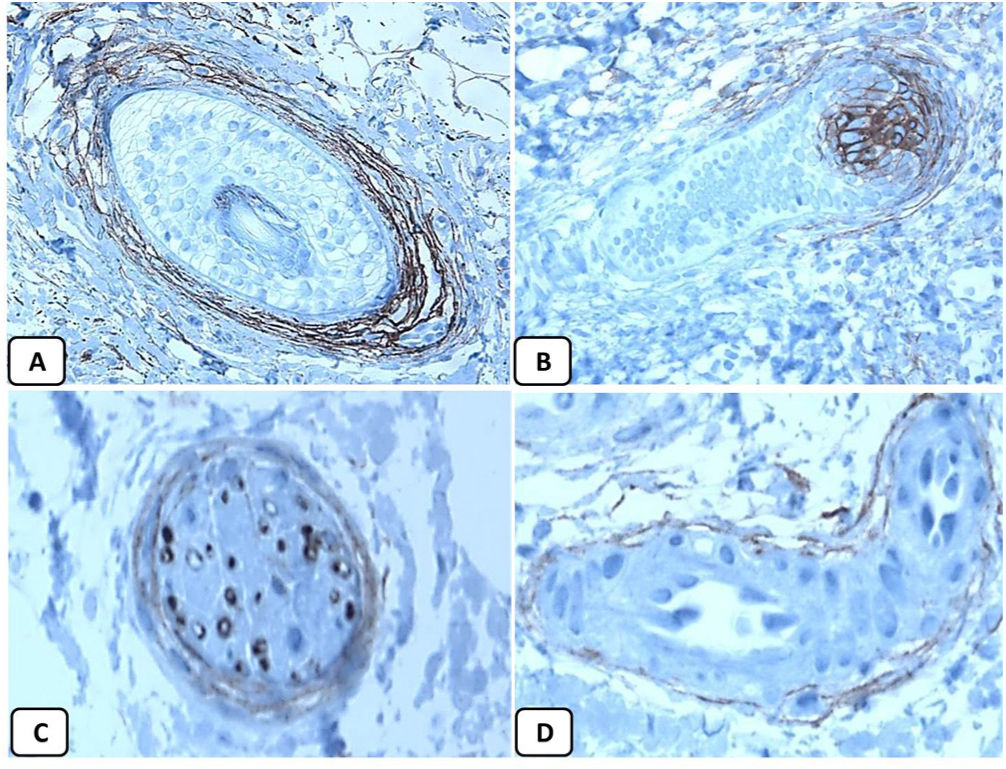
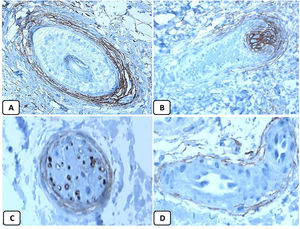
Expresión inmunohistoquímica de CD10 en la piel normal. CD10 citoplásmico positivo en células fusiformes mesenquimatosas perianexiales (A, ×400), papila pilosa de folículos vellosos (B, ×400). Algunos axones nerviosos (C, ×400) y células mioepiteliales de las glándulas sudoríparas (D, ×400).
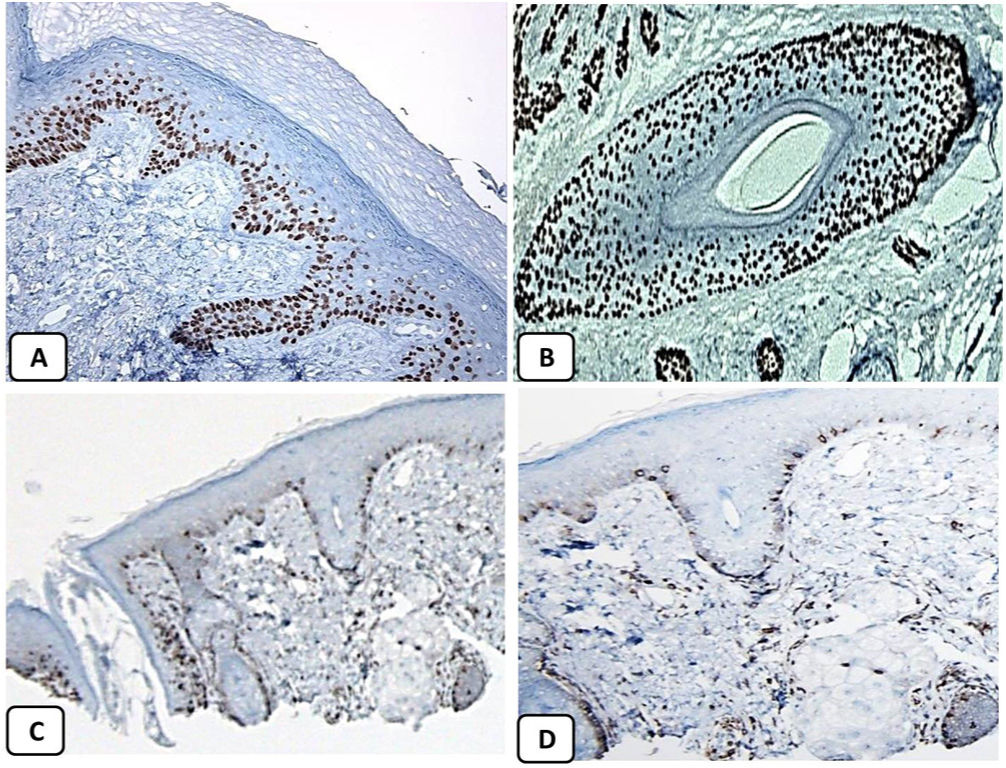
Expresión inmunohistoquímica de p63 y BCL-2 en la piel normal. Positividad nuclear de p63 en las células epidérmicas basales y algunas suprabasales (A, ×400) y en las células de la vaina radicular externa de los folículos pilosos (B, ×400). Expresión positiva de BCL-2 en los queratinocitos basales de la epidermis y en la vaina radicular externa queratinizada del istmo y en el infundíbulo del folículo piloso (C, ×200 y D, ×400).
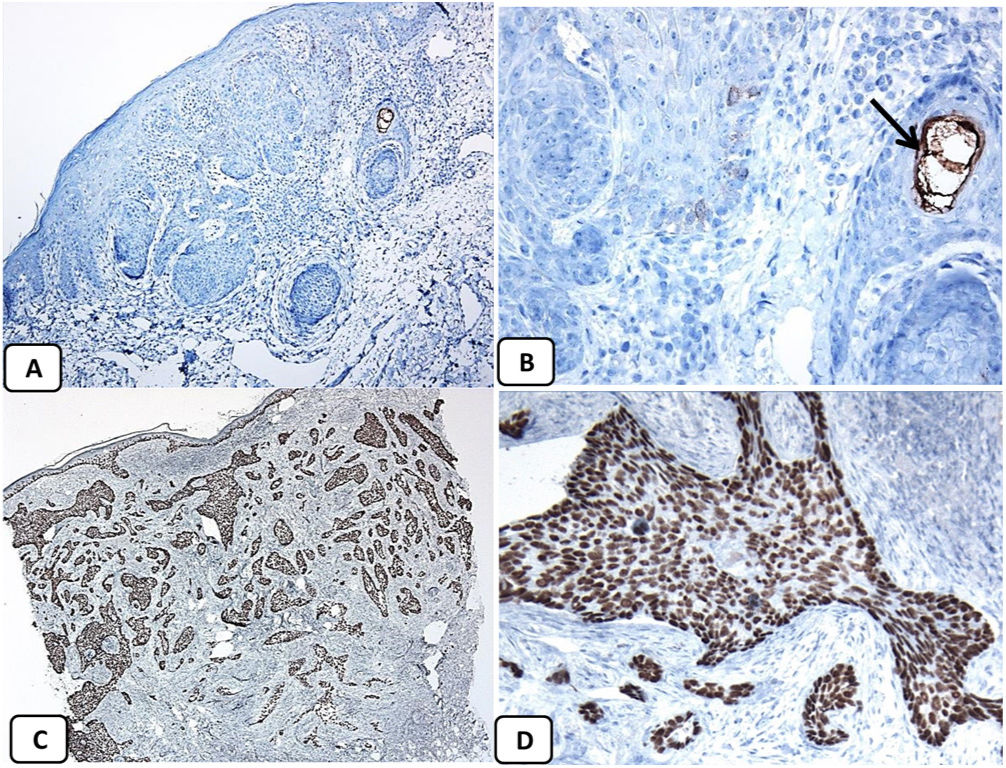
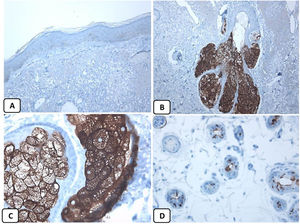
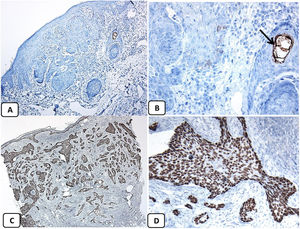
La presencia de la proteína p63 se observó en todos los casos de CBC y se presentó de una manera consistente, difusa e intensamente positiva (tinción nuclear) en las células tumorales de todos los subtipos histológicos. La expresión de la proteína EMA estuvo ausente en todas las muestras de CBC excepto en las áreas de diferenciación escamosa. La expresión de la proteína CD10 se observó en 31 de las muestras de CBC (68,9% de los casos), observándose una mayor reactividad en las células periféricas. En todos los casos de CBC, particularmente entre las células periféricas, se pudo objetivar una tinción focal con una intensidad que oscilaba entre débil a moderada de la tinción con BCL2; la expresión de la proteína BCL-2 estaba disminuida en las áreas más infiltrativas de los CBC.
Teniendo en cuenta que todos los casos fueron positivos con p63 y BCL-2, negativos con EMA, y que el 68,9% de ellos fueron positivos para el CD10, la asociación entre las características clínico-patológicas y la expresión de estas proteínas únicamente se pudo analizar con respecto a la expresión de CD10. Finalmente, no se observaron asociaciones significativas entre la expresión de CD10 y los parámetros clínico-patológicos de CBC (tabla 2). Un resumen de estos hallazgos se muestra en las figuras 4 y 5.
Asociación entre la expresión de CD10 y las características clínico-patológicas de los carcinomas basocelulares
| Características clínico-patológicas | Expresión de CD10 | ||
|---|---|---|---|
| + | − | Valor de p | |
| (%) | (%) | ||
| Género | |||
| Masculino | 15 (78,9) | 4 (21,1) | 0,213 |
| Femenino | 16 (61,5) | 10 (38,5) | |
| Localización | |||
| Cabeza y cuello | 19 (63,3) | 11 (36,7) | 0,255 |
| Extremidades y tronco | 12 (80) | 3 (20) | |
| Apariencia clínica | |||
| Lesión ulcerada | 24 (68,6) | 11 (31,4) | 0,931 |
| Nódulo no ulcerado | 7 (70) | 3 (30) | |
| Variantes histológicas | |||
| CBC nodular | 11 (73,3) | 4 (26,7) | 0,442 |
| CBC pigmentado | 5 (83,3) | 1 (16,7) | |
| CBC micronodular | 3 (42,9) | 4 (57,1) | |
| Basoescamoso | 9 (81,8) | 2 (18,2) | |
| Morfeiforme | 1 (50) | 1 (50) | |
| CBC adenoide | 2 (50) | 2 (50) | |
Expresión inmunohistoquímica de las proteínas CD10 y BCL-2 en el carcinoma de células basales. A y B) Tinción citoplasmática de CD10 en células de CBC, con una mayor positividad en las células periféricas (A, ×100 y B, ×400). C y D) Expresión citoplasmática positiva de BCL2 en el CBC, especialmente entre las células periféricas (C, ×400). Se observa una expresión reducida de BCL2 en las áreas infiltrativas (flecha) (D, ×200).
En el presente estudio se describen los patrones de expresión de las proteínas p63, EMA, CD10 y BCL-2 en la piel normal y en el CBC. Se pudo demostrar lo siguiente: (i) no hay correlación entre la expresión de estas proteínas y las características clínico-patológicas, y (ii) existen diferencias en el patrón de expresión de estas proteínas cuando se compara el de la piel normal con el CBC.
Expresión nuclear intensa de la proteína p63 en el CBCDe forma similar a lo evidenciado en estudios previos5,17,18 se objetivó que la proteína p63 presentaba una expresión nuclear difusa e intensa en el CBC, mientras que en la piel normal la presencia del p63 se observó únicamente en los queratinocitos basales y suprabasales. La expresión nuclear del p63 en el CBC permite distinguir las variantes pigmentadas de estos tumores de los melanomas malignos. La expresión difusa e intensa del p63 en las células progenitoras/basaloides de la epidermis normal, así como en las células neoplásicas de CBC frente a su ausencia en las células escamosas bien diferenciadas sugiere que el p63 actúa como una proteína de células madre de queratinocitos. La expresión de la proteína p63 en el CBC no solo indica que las células neoplásicas se derivan de las células progenitoras basaloides de linaje escamoso, sino que también sugiere su papel en la tumorigénesis de esta neoplasia5.
Hasta la fecha, se desconoce el papel de la proteína p63 en el desarrollo del CBC. El gen p63 codifica seis proteínas con efectos tanto de transactivación (TA) como dominante-negativo (ΔN) en el gen p53. La proteína p53 promueve la apoptosis e induce la detención del ciclo celular. Las isoformas N-p63 desempeñan sus funciones oncogénicas al inhibir la detención del ciclo celular mediada por el p53 y la apoptosis en las células basales17,19. La isoforma ΔN-p63α puede mediar en la oncogénesis a través de diferentes mecanismos, incluida la activación de la vía de la β-catenina20, la supresión de la proteína proapoptótica de unión al factor de crecimiento similar a la insulina-320, la regulación positiva del Hsp-7021, y la supresión de la apoptosis dependiente del p7322. La p63 endógena puede suprimir genes implicados en las metástasis tumorales, lo que explica la asociación entre la pérdida del p63 y el mal pronóstico de los cánceres4. La pérdida del gen p63 parece dar lugar a la sobrerregulación de genes implicados en la invasión y metástasis como la N-cadherina4. Johnson et al. describieron la expresión de la proteína p63 en el CBC cutáneo primario vs. su pérdida en el CBC con metástasis en los ganglios linfáticos23. En conjunto, se propone que el desarrollo del CBC podría estar relacionado con la expresión de p63 a través de su efecto negativo-dominante sobre el gen supresor de tumores p53. Además, la ausencia del potencial metastásico del CBC puede estar relacionado con la fuerte expresión de la proteína p63 en estos tumores. Curiosamente, el p63 puede interactuar con la vía de señalización de sonic hedgehog que comúnmente está involucrada en la patogénesis del CBC24.
Ausencia de la expresión de la proteína EMA en el CBCSe evidenciaron diferencias en el patrón de expresión de EMA entre la piel normal y el CBC. La expresión de EMA en la piel normal de esta serie concuerda con la de estudios previos. Modrzynsk et al. objetivaron la expresión de EMA en las glándulas ecrinas, sebáceas y apocrinas de la piel normal. El epitelio escamoso normal es EMA negativo, excepto el que recubre las amígdalas25. Como en estudios previos, se pudo observar la ausencia de expresión de la proteína EMA en el CBC, excepto de manera focal en áreas con diferenciación escamosa8,15,26. Asimismo, en estudios previos se describió la frecuente expresión de la proteína EMA en el carcinoma de células escamosas10,27. Si se analizan de manera conjunta, estos hallazgos resaltan el valor diagnóstico que pude tener esta proteína para poder hacer el diagnóstico diferencial entre el CBC y carcinoma de células escamosas.
Aunque los mecanismos moleculares subyacentes a la expresión de la proteína EMA en las áreas con diferenciación escamosa en el CBC, son desconocidos en su mayoría, esta puede deberse a una localización errónea de la proteína EMA, a una glicosilación aberrante o a una regulación transcripcional alterada. En estas áreas escamosas, la proteína EMA puede estar despolarizada (localización equivocada), es decir, la expresión de la proteína ya no está restringida al dominio apical, sino que se expresa en toda la superficie celular y en el citoplasma. Esta expresión despolarizada permite interacciones entre la proteína EMA localizada en la membrana y otras proteínas celulares, como la familia de receptores de tirosina quinasa epidérmica humana. Esto conllevará a la subsiguiente activación de las vías de señalización, dando como resultado la proliferación y la supervivencia celular6,28. Es posible que la expresión aberrante de la proteína EMA en las áreas escamosas se deba a su glicosilación aberrante (hipoglicosilación y diferente composición de carbohidratos) dentro de las células escamosas. Esta hipoglicosilación da como resultado la exposición de la proteína central de la región de repetición en tándem6.
Expresión de CD10 en el CBCEn concordancia con los estudios realizados previamente, en este estudio también se observó una expresión variable del CD10 en la mayoría de los CBC. Esta expresión se caracterizó por una tinción focal, de intensidad débil a moderada, del CD10 periférico en las células neoplásicas del CBC8,29–32. ShamsiMeymandi et al. utilizaron técnicas de inmunohistoquímica para determinar la expresión de las proteínas CD10, CD1a, SMA, Ki67, CD34 y P53 en los tumores CBC1 o de bajo riesgo (tipo nodular, superficial) y de CBC2 o de riesgo elevado (tipos micronodular, morfeiforme, infiltrante y basoescamoso). Los recuentos de células epidérmicas de Langerhans en el tumor fueron más elevados en el CBC1 en comparación con el CBC2. El porcentaje de células tumorales positivas para p53 fue elevado en el CBC2 en comparación con el CBC1. Los recuentos medios de vasos sanguíneos (CD34) fueron bajos en el CBC1 en comparación con el CBC232.
Wagoner et al. evaluaron la expresión de CD10 en el CBC y encontraron una expresión intensa de esta proteína en el CBC superficial vs. una pérdida de su expresión en las áreas profundas infiltrantes de los tumores29. Los autores sugirieron que la intensa expresión de CD10 en las células tumorales del CBC superficial está relacionada a su naturaleza indolente, lo que sugiere un posible papel en el desarrollo de estos tumores29. Por otro lado, en otro estudios realizados anteriormente se ha reportado la ausencia de la expresión de la proteína CD10 en el carcinoma de células escamosas13.
Por el momento, los mecanismos responsables de la expresión variable de CD10 en el CBC no están del todo claros. En la carcinogénesis, el CD10 se comportará como una espada de doble filo, es decir, tendrá un comportamiento dual que dependerá de los péptidos presentes en el microambiente tumoral circundante, los que a su vez modularán la progresión de la neoplasia33. Apoyando este hecho, se ha visto que la expresión elevada de CD10 se asociará a una progresión y a una migración neoplásica en el carcinoma escamoso de esófago11,34. Este papel en la progresión tumoral está relacionado con la capacidad del CD10 para crear un microambiente tumoral que facilite la migración de las células tumorales y la metástasis, esto debido a su similitud estructural con las metaloproteinasas de la matriz35. Sin embargo, la disminución de la expresión de CD10 en el carcinoma escamoso cervical se asoció con una mayor progresión de la neoplasia36. Esto debido a que la disminución de la expresión se asociara a mayores concentraciones de péptidos en el microambiente tumoral, lo que puede facilitar la señalización intracelular y así la proliferación tumoral33. Por otro lado, el CD10 también puede comportarse como un supresor tumoral en algunos tumores al inhibir diversos eventos involucrados en la progresión tumoral. En conjunto, se propone que la expresión débil de CD10 en la zona profunda del CBC está relacionada con un aumento de la agresividad de estos tumores.
Expresión de la proteína BCL-2 en el CBCLa expresión de la proteína BCL-2 se objetivó en la capa basal de la epidermis, en las papilas de los folículos pilosos y en las protuberancias foliculares. Estos hallazgos concuerdan con los evidenciados en estudios previos37,38 que sugieren un papel de BCL2 en la homeostasis de la piel. De acuerdo con otros estudios, este estudio también reveló una expresión focal de la proteína BCL2 en el CBC, con una intensidad que oscilaba entre débil a moderada, y que se localizó especialmente en las células periféricas. Sin embargo, dicha expresión disminuyó en las áreas más infiltrativas del tumor14,39–41. La expresión de la proteína BCL2 en el CBC respalda la idea de que estos tumores se derivan de las células basales de la epidermis o de las células madre ubicadas en la protuberancia del folículo piloso42. Crowson et al. informaron expresiones diferentes de la proteína BCL-2 en los subtipos de CBC según fuesen indolentes o agresivos, y sugirieron que BCL-2 puede desempeñar un papel esencial en la patogénesis y en el comportamiento biológico del CBC, así como en el desarrollo del CBC no agresivo, bien circunscrito y superficial. La vida prolongada de estas células resultó en una exposición excesiva a la luz ultravioleta y a la adquisición de alteraciones genéticas adicionales que serían las responsables de la transformación del CBC indolente en una forma más agresiva39.
Deng et al. abordaron los cambios moleculares (BCL-2 y Ki67) en el CBC. Los autores indicaron una relación entre estos cambios y las características clínicas y pronósticas del CBC. Algunas características macroscópicas (como la friabilidad) y las características histológicas (retracción del tumor) están relacionadas con la adhesión célula-célula y las características de la membrana basal de estos tumores41.
Zhang et al. examinaron las características inmunohistoquímicas del tricoblastoma (58 casos) y del CBC (40 casos). Utilizaron inmunotinciones BCL-2, Ber-EP4, CD10, CK20 y Ki-67. El CK20 fue negativo en el CBC pero positivo en la mayoría de los casos de tricoblastoma. La proporción de CBC con reactividad BCL-2 fue mayor que la de los tricoblastomas. La proporción de células con reactividad Ber-EP4 fue mayor en el CBC que en el tricoblastomas. La expresión de la proteína CD10 se observó en el estroma folicular de la mayoría de los tricoblastomas, mientras que la expresión fue focal en el estroma del CBC31.
En conclusión, en este estudio se abordaron los patrones de expresión de CD10, BCL-2, p63 y EMA en la piel normal y en el CBC. EMA parece ser el marcador más fiable para poder diferenciar el CBC del carcinoma de células escamosas. Además, las diferencias evidenciadas en el patrón de expresión entre la piel normal y el CBC sugieren un posible rol patogénico de estas proteínas en el posterior desarrollo de estas neoplasias. Los mecanismos moleculares subyacentes dependerán de futuras investigaciones.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Contribución de los autoresMH concibió la idea y generó los datos, AA analizó e interpretó los datos de los pacientes. MH y AA realizaron el análisis histológico, y tanto MH como AA contribuyeron por igual a escribir el manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.