La dermatología y la medicina preventiva se han convertido en especialidades inseparables desde la introducción de fármacos biológicos con actividad inmunomoduladora e inmunosupresora. La realidad es que en los últimos años se han incorporado múltiples y nuevas terapias para la psoriasis, la hidradenitis supurativa o la dermatitis atópica, donde todas ellas precisan una preparación previa como la actualización del calendario de vacunación1. De hecho, existe una recomendación ministerial para la vacuna del herpes zóster recombinante, Shingrix®. El objetivo principal de la vacuna del herpes zóster es evitar el desarrollo del mismo2.
El virus de la varicela-zóster (VVZ) (familia herpesviridae) es responsable de 2 entidades clínicas. La primoinfección es la varicela, mientras que la reactivación del virus latente acantonado en los ganglios de la raíz nerviosa dorsal o craneal da lugar al herpes zóster3. Se estima que el 90% de la población ha estado en contacto con el VVZ, del cual el 30% desarrollará en un futuro el herpes zóster (HZ), aumentando dicha cifra hasta el 50% en pacientes de más de 85 años de edad4. Según los datos publicados por RENAVE, CNE y ISCIII, la incidencia del HZ desde 2014 hasta 2018 se ha mantenido estable, en torno a 339/100.000 habitantes en 20185, sin embargo, el número de hospitalizaciones y defunciones sí ha aumentado en los registros desde 2017 y 2018 comparado con los años anteriores6. Estas cifras aumentan hasta alcanzar unos máximos de incidencia de 877.1/100.000 habitantes en la franja da pacientes entre 80-84 años debido a la asociación entre la inmunosenescencia celular y el riesgo de HZ7. Hasta el 68,8% de los casos diagnosticados de HZ son entre pacientes mayores de 50 años, siendo más frecuente entre las mujeres. La infección por el virus del HZ asocia una baja tasa de mortalidad, sin embargo, las complicaciones son realmente un problema de salud pública. Entre los factores de riesgo se han incluidos las enfermedades autoinmunes, los inmunosupresores y el asma8. Todos ellos presentan una relación estrecha con la dermatología. Enfermedades como la psoriasis o la dermatitis atópica cada vez más son diagnosticadas en edad avanzada, donde la administración de terapias inmunosupresoras aumenta el riesgo de sufrir un HZ9.
Clínicamente el HZ comienza con dolor de intensidad variable, picor o sensación de quemazón a lo largo del recorrido del dermatomo(s) afecto(s). Más del 50% de los casos se desarrollarán entre T1 y L2, mientras que entre el 8-15% de los casos afectará al trigémino10. La erupción vesicular sobre fondo eritematoso es fácilmente reconocible, aunque también existe un «zóster sine zóster»11, donde no aparece las lesiones clásicas, y en ocasiones el paciente es erróneamente diagnosticado de enfermedad musculoesquelética.
La complicación de mayor impacto en la calidad de vida de los pacientes que han sufrido un HZ es la neuralgia postherpética12. El dolor localizado en la zona del dermatoma(s) afecto(s) persiste más allá de 3 meses tras resolverse por completo las lesiones cutáneas (si las hubiera). En ocasiones puede asociar limitación funcional. No disponemos de un tratamiento específico para la neuralgia postherpética, aunque los tratamientos más frecuentemente prescritos son analgésicos, anestésicos tópicos, GABAérgicos (pregabalina, gabapentina, etc.), capsaicina tópica, entre otros13. Por este motivo, es fundamental las estrategias preventivas como la vacunación.
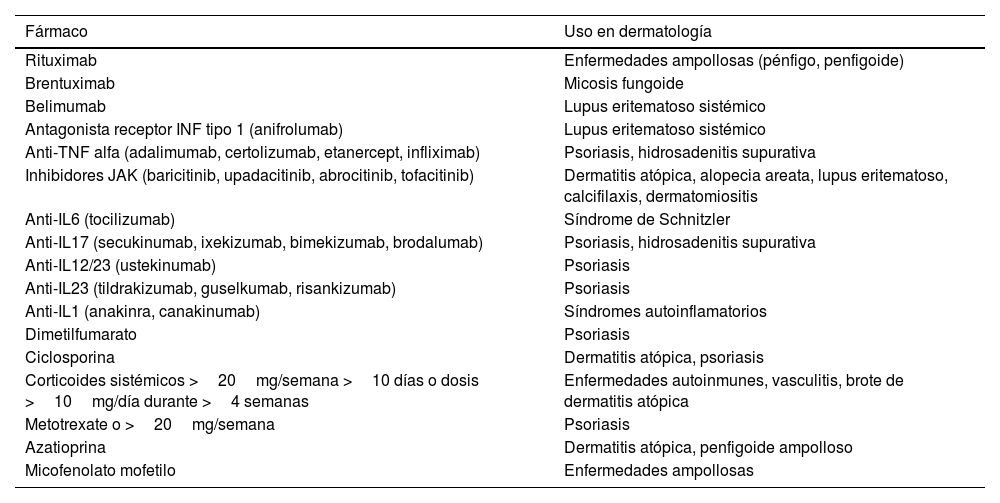
El impacto de la recomendación ministerial de la vacunación del HZ ha impactado notablemente en el número de derivaciones de pacientes dermatológicos a las unidades de medicina preventiva desde el inicio de su disponibilidad en los centros públicos. No solo implica a los pacientes tratados con los fármacos más recientes como los inhibidores de la JAK, sino que los inmunosupresores clásicos como la ciclosporina o el metotrexate también conforman el grupo de pacientes que deben vacunarse. En la tabla 1 se muestran los fármacos e indicaciones dermatológicas, con efecto inmunosupresor y, por tanto, potencial aumento del riesgo de HZ.
Relación de fármacos incluidos en la indicación de realizar vacunación completa con Shingrix® antes de iniciar el tratamiento. Usos más frecuentes en dermatología (tanto en ficha técnica como usos fuera de indicación)
| Fármaco | Uso en dermatología |
|---|---|
| Rituximab | Enfermedades ampollosas (pénfigo, penfigoide) |
| Brentuximab | Micosis fungoide |
| Belimumab | Lupus eritematoso sistémico |
| Antagonista receptor INF tipo 1 (anifrolumab) | Lupus eritematoso sistémico |
| Anti-TNF alfa (adalimumab, certolizumab, etanercept, infliximab) | Psoriasis, hidrosadenitis supurativa |
| Inhibidores JAK (baricitinib, upadacitinib, abrocitinib, tofacitinib) | Dermatitis atópica, alopecia areata, lupus eritematoso, calcifilaxis, dermatomiositis |
| Anti-IL6 (tocilizumab) | Síndrome de Schnitzler |
| Anti-IL17 (secukinumab, ixekizumab, bimekizumab, brodalumab) | Psoriasis, hidrosadenitis supurativa |
| Anti-IL12/23 (ustekinumab) | Psoriasis |
| Anti-IL23 (tildrakizumab, guselkumab, risankizumab) | Psoriasis |
| Anti-IL1 (anakinra, canakinumab) | Síndromes autoinflamatorios |
| Dimetilfumarato | Psoriasis |
| Ciclosporina | Dermatitis atópica, psoriasis |
| Corticoides sistémicos >20mg/semana >10 días o dosis >10mg/día durante >4 semanas | Enfermedades autoinmunes, vasculitis, brote de dermatitis atópica |
| Metotrexate o >20mg/semana | Psoriasis |
| Azatioprina | Dermatitis atópica, penfigoide ampolloso |
| Micofenolato mofetilo | Enfermedades ampollosas |
En España, hasta julio 2022, coexistían 2 opciones de vacuna para la prevención del HZ: Zostavax® y Shingrix®. Sin embargo, la comercialización de Zostavax® cesó debido, en gran parte, a su contraindicación en pacientes con inmunodeficiencia primaria o adquirida por estar compuesta de virus vivos atenuados. Como alternativa, se consolida Shingrix® como la única vacuna disponible en el país para abordar la prevención del HZ y la neuralgia postherpética, ofreciendo una opción segura, especialmente para aquellos con sistemas inmunológicos comprometidos14. Se trata de una vacuna inactivada que contiene la glicoproteína E como antígeno y el adyuvante AS01B15. El diseño de la vacuna de Shingrix induce respuestas inmunes humorales y celulares antígeno-específicas en individuos con inmunidad preexistente frente al VVZ al combinar el antígeno específico del VVZ (gE) con el sistema adyuvante AS01B. Los estudios preclínicos muestran que el sistema AS01B provoca una activación local y temporal del sistema inmunitario innato mediante vías moleculares específicas. Esto favorece la atracción y activación de las células presentadoras de antígeno que transportan antígenos derivados de la gE en el ganglio linfático correspondiente, lo que, a su vez, da lugar a la generación de anticuerpos y células T CD4+ específicas para la gE. El efecto adyuvante del AS01B surge de las interacciones entre el MPL y el QS-21, ambos formulados en liposomas. Este mecanismo inmunógeno de Shingrix® proporciona al menos una década de protección contra el HZ después de la vacunación inicial16.
Su uso está autorizado en adultos a partir de los 50 años, independientemente de si tienen alguna enfermedad subyacente, así como en adultos a partir de los 18 años con condiciones de base que presentan un mayor riesgo de herpes zóster, según la información proporcionada en la ficha técnica17.
Inicialmente, se incorporó la vacunación con Shingrix® en las personas con las siguientes condiciones de riesgo: a partir de los 18 años de edad, trasplante de progenitores hematopoyéticos, trasplante de órgano sólido, VIH, hemopatías malignas, tumores sólidos en tratamiento quimioterápico, y tratamiento con fármacos inhibidores de la Janus quinasa (iJAK). Estos últimos especialmente se han incorporado al arsenal terapéutico dermatológico para la dermatitis atópica, alopecia areata, y están en investigación para otras múltiples enfermedades como vitíligo, lupus y otras enfermedades autoinmunes. En los últimos años esta vacuna ha despertado interés en dermatología18, inicialmente por la incorporación de los iJAK, aunque actualmente la lista de terapias que requieren inmunización previa ha aumentado considerablemente.
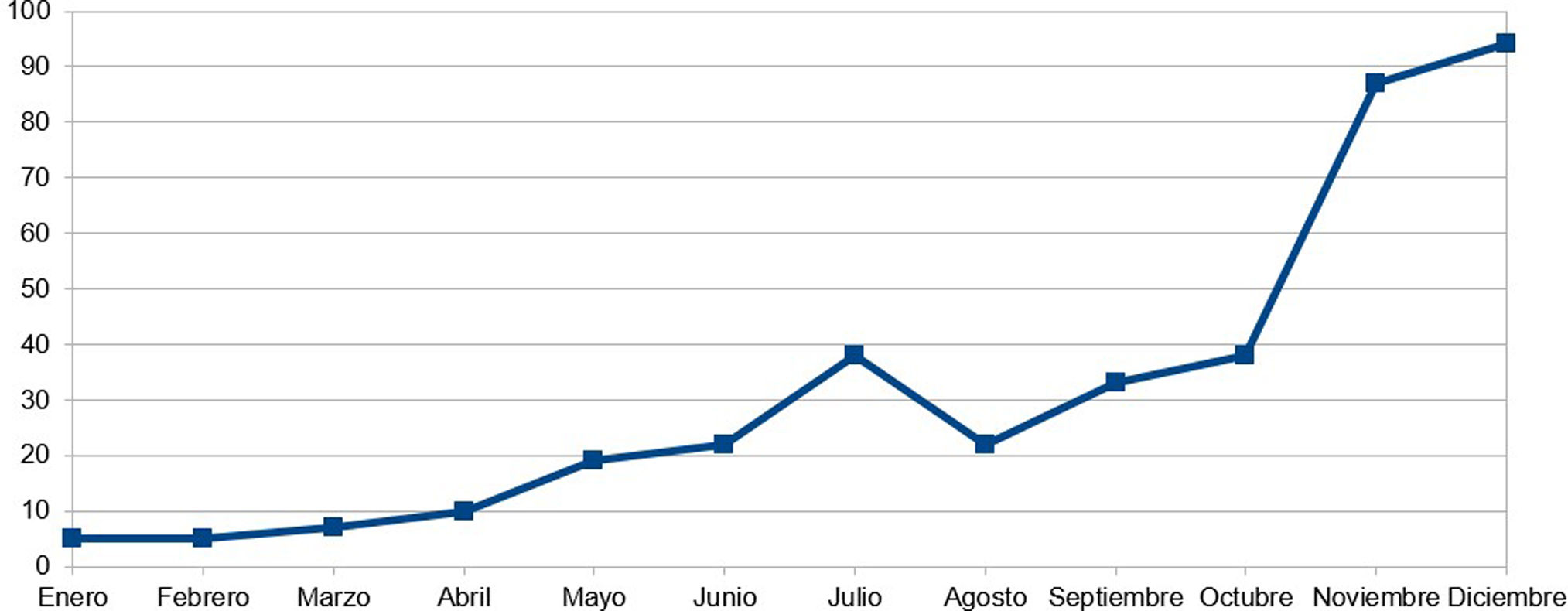
En noviembre de 2023 han sido ampliadas las recomendaciones de vacunación con Shingrix®: pacientes con antecedentes de 2 o más episodios de HZ (se ha estimado que afecta hasta el 5-6% de los pacientes infectados)19, y se ha ampliado la lista de fármacos para los cuales se recomienda la vacunación previa del HZ. Esta reciente situación ha incrementado de forma considerable la derivación de pacientes de numerosas especialidades, generando una demanda importante de atención por parte de medicina preventiva. La consecuencia del actual aumento del flujo de pacientes a medicina preventiva puede desencadenar un incremento en la lista de espera para ser valorados en la consulta de vacunas, lo cual puede retrasar el inicio del tratamiento inmunosupresor requerido, y por tanto, perder la ventana de oportunidad para el tratamiento en el momento óptimo. En la figura 1, podemos observar el incremento de pacientes del Hospital Clínico Universitario San Cecilio vacunados frente HZ en medicina preventiva durante 2023.
El aumento constante en la utilización de fármacos inmunomoduladores en dermatología destaca la importancia de mantenernos al día con las terapias y vacunas contemporáneas. La comunicación entre los servicios de dermatología y medicina preventiva, así como la creación de flujos de derivación será crucial para evitar retrasos en la introducción del tratamiento seleccionado. La ausencia de control de la patología asocia una mayor asistencia a urgencias, el consumo/abuso de fármacos como los corticoides sistémicos, e incluso la presentación sin cita del paciente para una atención no programada, todo ello con los costes que supone. Por ello, es necesario completar la vacunación de forma prioritaria en estos pacientes, que puede alcanzarse si existe un circuito específico entre dermatología y medicina preventiva. En nuestro hospital existe una consulta de vacunación específica para valorar a este perfil de paciente. El tiempo medio de atención de estos pacientes es de 15 días.
En nuestro hospital, el número de derivaciones desde este servicio a medicina preventiva se ha incrementado año tras año, con un total de 28 derivaciones de pacientes en 2021, 89 en el año 2022, alcanzado 169 en el pasado año 2023 (fig. 1). Estos datos reflejan la importancia de la consulta de vacunación de medicina preventiva para pacientes de dermatología.
Estos cambios observados en el 2023 reiteran la necesidad de crear circuitos de derivación específicos entre unidades, cuya finalizar es mejorar la eficiencia del sistema, y permitir homogeneizar los criterios de derivación, mejorando la práctica clínica. Es posible que existan diferencias con otros hospitales nacionales y de otros países, motivo por el que compartimos nuestra opinión en este campo. La estandarización de protocolos beneficia al paciente y al profesional en cualquier ámbito. En última instancia, al buscar la cohesión en el conocimiento y las prácticas clínicas, podemos fortalecer nuestra capacidad para brindar atención médica de calidad y personalizada.
Es necesario ponderar la prescripción de los fármacos comercializados en función del riesgo/beneficio, así como trabajar en consonancia con las recomendaciones basadas en la evidencia científica para tomar la mejor decisión en relación a la vacunación del paciente, principalmente para evitar complicaciones relacionadas con el desarrollo del HZ en pacientes más vulnerables. Aunque Shingrix® es considerada una vacuna segura en todos los grupos de edad, se han publicado algunas complicaciones relacionadas con la vacunación, principalmente la reactivación del virus20. A pesar de ello, la vacunación del HZ con Shingrix® es considerada una estrategia coste/eficiente21, siendo también de utilidad para la prevención de complicaciones relacionadas con el HZ, sobre todo en pacientes de edad avanzada22.
La coordinación entre los servicios de medicina preventiva y los servicios de dermatología es esencial para determinar el momento óptimo para iniciar la vacunación, siempre que sea factible. La administración de la vacuna frente HZ debería llevarse a cabo preferentemente antes de iniciar el tratamiento inmunosupresor. Por lo tanto, en caso de que el médico prevea el inicio de un tratamiento inmunomodulador o inmunosupresor en un futuro cercano, es recomendable referir al paciente de manera temprana a la consulta especializada en vacunación. No obstante, la vacunación no debe posponerse si el tratamiento es esencial23. Se aconseja completar ambas dosis de Shingrix® antes de iniciar el tratamiento si es posible, e iniciar el tratamiento 4 semanas después de la 2.ª dosis.
En conclusión, el evidente crecimiento de derivaciones de pacientes desde dermatología a medicina preventiva obliga a la creación de protocolos y circuitos de derivación adecuados para mejorar la asistencia sanitaria, evitar retrasos en el inicio de tratamientos, así como reducir el número de complicaciones asociadas al uso de fármacos inmunosupresores, entre ellas el desarrollo del HZ.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este artículo.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.