El Grupo de Psoriasis de la Academia Española de Dermatología y Venereología (GPs) diseño en 2017 la medida Actividad Mínima de Enfermedad en Psoriasis (AME). Se presentan los resultados de un estudio observacional, transversal y multicéntrico de la aplicación de esta escala a nivel nacional.
Material y métodosSe realizó un muestreo no aleatorizado, estratificado para alcanzar representación autonómica y provincial, de pacientes consecutivos con psoriasis (Ps) vulgar sin artritis activa. Se incluyeron 830 pacientes: 493 eran varones (59,5%), con una edad media de 51,4 años (DE=14,2), de todas las autonomías del país (excepto Ceuta y Melilla) y 44 (88%) de las 50 provincias. Se obtuvo un cuestionario recogiendo datos demográficos, DLQI, valoración subjetiva en escalas de 0 a 10 de picor, eritema, descamación y visibilidad; y el PASI y el BSA del paciente.
ResultadosMás de la mitad no cumplían criterio de AME (491; 59,2%), con diferencia significativa entre regiones, por el sexo y por la edad. También había diferencias según el tratamiento realizado (p<0,001). El uso de un medicamento biológico se asoció a un mayor cumplimiento AME frente al uso de otro tipo de medicamentos (59,4 vs. 23,3%). No se observaron diferencias entre los tratamientos biológicos.
ConclusionesEl porcentaje global de cumplimiento AME es bajo, con diferencias por la localización geográfica, el sexo, la edad y el fármaco utilizado, si bien ninguno de esos factores por separado las justifica.
In 2017, the Spanish Academy of Dermatology and Venereology Psoriasis Working Group (PWG) designed the Minimal Disease Activity (MDA) criteria to determine the level of disease activity. We hereby present the results of an observational, cross-sectional, multicenter study of the nationwide application of these criteria.
Material and methodsWe conducted a non-randomized sampling, stratified to achieve autonomic and provincial representation of consecutive patients with psoriasis (Ps) vulgaris without active arthritis. A total of 830 patients were included: 493 men (59.5%), with a mean age of 51.4 years (SD, 14.2), from all autonomous regions of Spain (except for Ceuta and Melilla) and 44 (88%) out of the 50 provinces. A questionnaire was obtained with demographic data, DLQI, subjective assessment—on a scale from 0 to 10—of itching, erythema, desquamation, visibility, and the patients’ PASI and BSA.
ResultsMore than 50% failed to meet the MDA criteria (491; 59.2%), with significant differences being reported by region, sex, and age. Additionally, significant differences were reported based on the therapy used (P<.001). The use of biological therapies was associated with higher MDA compliance compared to other therapies (59.4% vs 23.3%). No differences were reported among various biological therapies.
ConclusionsThe overall rate of MDA compliance is low, with differences being based on geographic location, sex, age, and drug used, yet none of these factors separately justify them.
La psoriasis (Ps), según la Organización Mundial de la Salud (OMS), es una enfermedad crónica, no declarable, dolorosa, desfigurante e incapacitante, sin cura y con un importante impacto negativo en la calidad de vida (CdV) del paciente1.
A pesar del avance terapéutico algunos pacientes no consiguen blanquear completamente las manifestaciones cutáneas o tienen otros problemas que siguen alterando su CdV2. Esto, unido a las diferentes expectativas y prioridades de dermatólogos y pacientes en su control3, obliga a hacer modificaciones con el fin de ajustar el tratamiento de forma personalizada y midiendo el resultado obtenido de manera objetiva4,5 para conseguir un manejo holístico de la enfermedad6.
Las medidas de la afectación de la enfermedad pueden ser objetivas (Psoriasis Activity Skin Index [PASI]; el Body Surface Area [BSA], o porcentaje de piel afectada,; el Physician Global Assesment [PGA]), o subjetivas, realizadas por el paciente (Dermatology Life Quality Index [DLQI]); aunque todas tienen limitaciones intrínsecas a cada índice, como ya se ha comentado7.
El Grupo de Psoriasis (GPs) de la Academia Española de Dermatología y Venereología en 2017 diseñó un proyecto para la creación de una medida que valorara conjuntamente entre paciente y dermatólogo la afectación de la enfermedad y se definió la Actividad Mínima de Enfermedad en Psoriasis (AME)7. La AME incluye la valoración por parte del dermatólogo del BSA, la presencia o no de localización especial y la exclusión de artritis. Por su parte el paciente puntúa el DLQI y cuantifica la intensidad del picor (0-10), del eritema (0-10), de la descamación (0-10) y de la visibilidad (0-10). Se cumple AME cuando no hay artritis activa, más 3 de los siguientes ítems: picor ≤1/10; descamación ≤2/10; enrojecimiento ≤ 2/10; visibilidad ≤2/10; BSA≤2; DLQI≤2 y no hay lesiones en localizaciones especiales.
El objetivo de nuestro estudio fue describir la situación de la AME en la práctica clínica en España.
Material y métodosSe realizó un estudio observacional, transversal y multicéntrico nacional. Cada región aportó la información de 10 dermatólogos a través de un coordinador. Los dermatólogos participantes recogieron de forma consecutiva los datos de 5 pacientes con Ps en placas y sin artritis activa. Se recogieron el consentimiento informado, datos epidemiológicos y clínicos (sexo, edad, situación terapéutica y fármaco utilizado; afectación o no de localización especial; y confirmación de ausencia de artritis activa), PASI, BSA, DLQI; y valoración de la intensidad de picor, eritema, descamación y visibilidad por parte del paciente.
Los datos fueron introducidos por cada coordinador regional en una web diseñada ad hoc por la unidad de investigación de la AEDV, encargada del análisis.
Se realizó un análisis descriptivo dónde las variables continuas se expresaron como media y desviación estándar (DE), mediana, primer y tercer cuartil y, máximo y mínimo. Las diferencias se evaluaron mediante la prueba de la t de Student o la prueba de Mann-Whitney. Las variables cualitativas se estimaron con frecuencias absolutas y relativas y las diferencias se evaluaron mediante la prueba de la χ2. Se realizó un gráfico suavizado de la probabilidad de no cumplir criterios AME según PASI para determinar un punto de corte óptimo, a través de una regresión logística. Por último, se realizó una regresión logística multivariable ajustada por región, para determinar la asociación entre cumplir criterios de la AME y las diferentes características epidemiológicas y clínicas.
El estudio ha sido aprobado por el Comité Ético de Investigación del Hospital Universitario de Gran Canaria Dr. Negrín (2022-299-1). Todos los pacientes dieron su consentimiento para participar en el estudio.
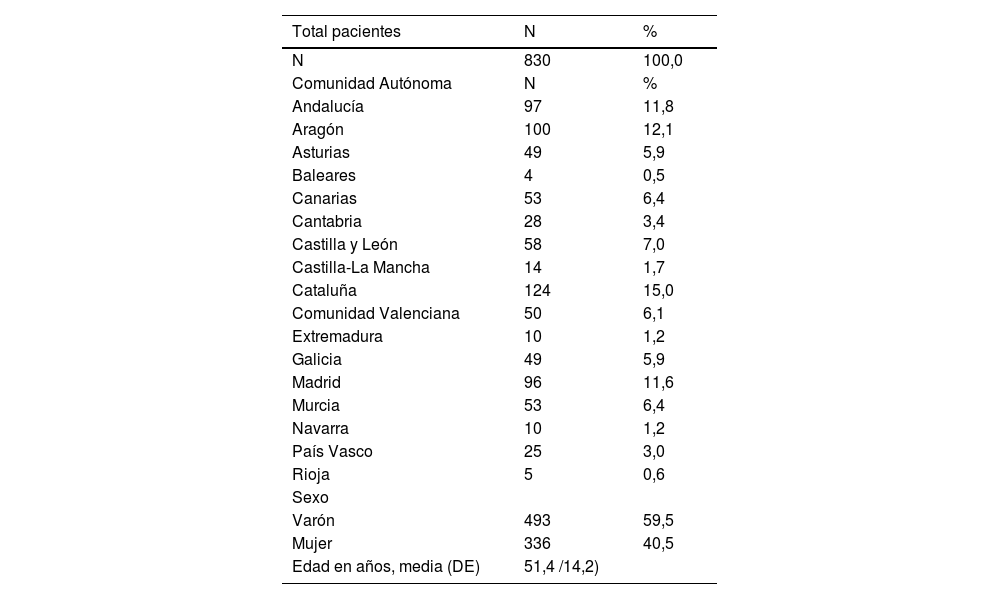
ResultadosParticiparon 18 coordinadores y 180 dermatólogos de toda España que recogieron datos de 830 pacientes con Ps vulgar que no presentaban artritis activa. Se obtuvieron datos de las 17 comunidades autónomas (excepto Ceuta y Melilla) y de 44 provincias de entre las 50 del país, con diferencias entre las distintas regiones (Cataluña 124 pacientes, máximo; Baleares, 4 pacientes, mínimo). De ellos 493 eran varones (59,5%) con una edad media de 51,4 años (DE: 14,2 años) (tabla 1).
Datos demográficos
| Total pacientes | N | % |
|---|---|---|
| N | 830 | 100,0 |
| Comunidad Autónoma | N | % |
| Andalucía | 97 | 11,8 |
| Aragón | 100 | 12,1 |
| Asturias | 49 | 5,9 |
| Baleares | 4 | 0,5 |
| Canarias | 53 | 6,4 |
| Cantabria | 28 | 3,4 |
| Castilla y León | 58 | 7,0 |
| Castilla-La Mancha | 14 | 1,7 |
| Cataluña | 124 | 15,0 |
| Comunidad Valenciana | 50 | 6,1 |
| Extremadura | 10 | 1,2 |
| Galicia | 49 | 5,9 |
| Madrid | 96 | 11,6 |
| Murcia | 53 | 6,4 |
| Navarra | 10 | 1,2 |
| País Vasco | 25 | 3,0 |
| Rioja | 5 | 0,6 |
| Sexo | ||
| Varón | 493 | 59,5 |
| Mujer | 336 | 40,5 |
| Edad en años, media (DE) | 51,4 /14,2) |
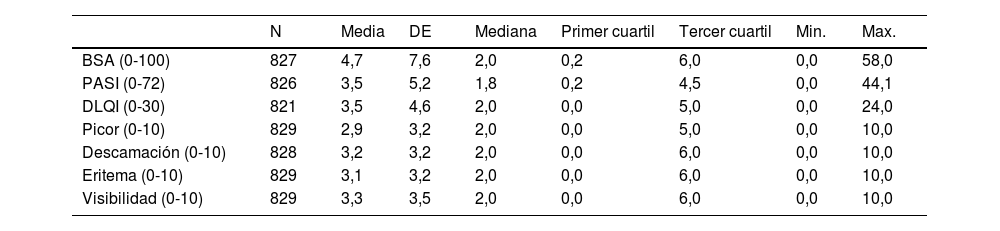
Los valores medios de afectación de enfermedad medidos por el dermatólogo y por el paciente fueron: BSA: 4,7; PASI: 3,5; DLQI: 3,5; picor: 2,9; descamación: 3,2; eritema: 3,1; visibilidad: 3,3 (tabla 2).
Descripción Clínica Global
| N | Media | DE | Mediana | Primer cuartil | Tercer cuartil | Min. | Max. | |
|---|---|---|---|---|---|---|---|---|
| BSA (0-100) | 827 | 4,7 | 7,6 | 2,0 | 0,2 | 6,0 | 0,0 | 58,0 |
| PASI (0-72) | 826 | 3,5 | 5,2 | 1,8 | 0,2 | 4,5 | 0,0 | 44,1 |
| DLQI (0-30) | 821 | 3,5 | 4,6 | 2,0 | 0,0 | 5,0 | 0,0 | 24,0 |
| Picor (0-10) | 829 | 2,9 | 3,2 | 2,0 | 0,0 | 5,0 | 0,0 | 10,0 |
| Descamación (0-10) | 828 | 3,2 | 3,2 | 2,0 | 0,0 | 6,0 | 0,0 | 10,0 |
| Eritema (0-10) | 829 | 3,1 | 3,2 | 2,0 | 0,0 | 6,0 | 0,0 | 10,0 |
| Visibilidad (0-10) | 829 | 3,3 | 3,5 | 2,0 | 0,0 | 6,0 | 0,0 | 10,0 |
DE: Desviación estándar
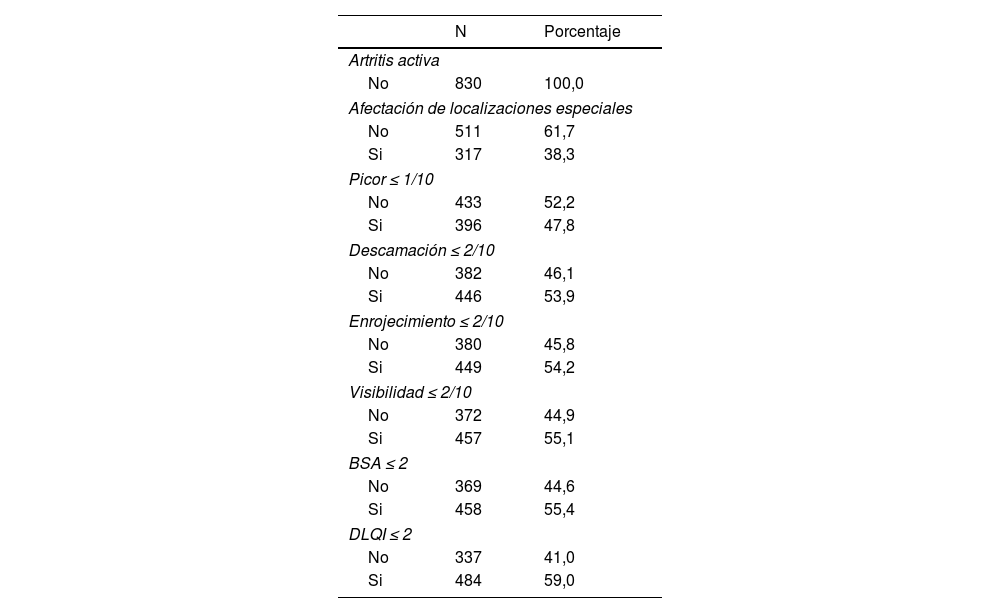
El 61,7% no tenía lesiones en localizaciones especiales, el 47,8% tenía picor ≤1/10, el 53,9% descamación ≤2/10, el 54,2% enrojecimiento ≤2/10, el 55,1% visibilidad ≤2/10, el 55,4% BSA≤2, y el 59% DLQI≤2 (tabla 3).
Valores parámetros criterios AME
| N | Porcentaje | |
|---|---|---|
| Artritis activa | ||
| No | 830 | 100,0 |
| Afectación de localizaciones especiales | ||
| No | 511 | 61,7 |
| Si | 317 | 38,3 |
| Picor ≤ 1/10 | ||
| No | 433 | 52,2 |
| Si | 396 | 47,8 |
| Descamación ≤ 2/10 | ||
| No | 382 | 46,1 |
| Si | 446 | 53,9 |
| Enrojecimiento ≤ 2/10 | ||
| No | 380 | 45,8 |
| Si | 449 | 54,2 |
| Visibilidad ≤ 2/10 | ||
| No | 372 | 44,9 |
| Si | 457 | 55,1 |
| BSA ≤ 2 | ||
| No | 369 | 44,6 |
| Si | 458 | 55,4 |
| DLQI ≤ 2 | ||
| No | 337 | 41,0 |
| Si | 484 | 59,0 |
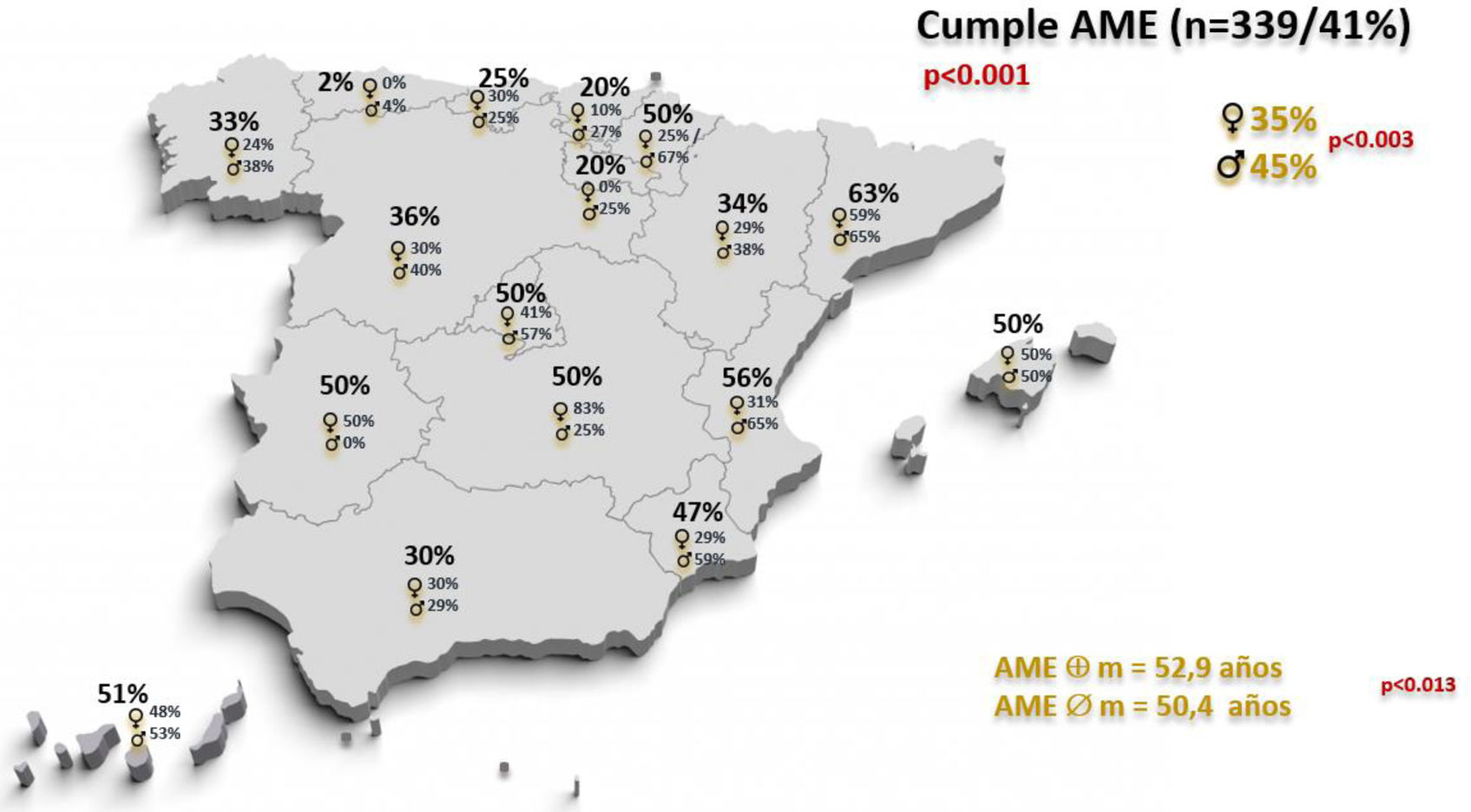
Más de la mitad de los pacientes (491; 59,2%), no cumplían criterio de la AME y encontramos diferencias significativas entre regiones (máxima frecuencia Asturias: 98% y mínima Cataluña: 37,1%) (p<0,001) (Gráfico 1).
El cumplimiento de la AME mostró diferencias significativas por sexo y por edad. Los varones presentaban mayor porcentaje de cumplimiento AME (222 pacientes, 45,0% vs. 117 mujeres, 34,8%) (p<0,003), así como los pacientes con mayor edad media (52,9 años, DE: 14,3) mostraban también mayor cumplimiento AME que los de menor edad (50,4 años, DE: 14) (p<0.013). Además, también se apreciaron diferencias de cumplimiento por sexo entre las distintas regiones (Gráfico 1).
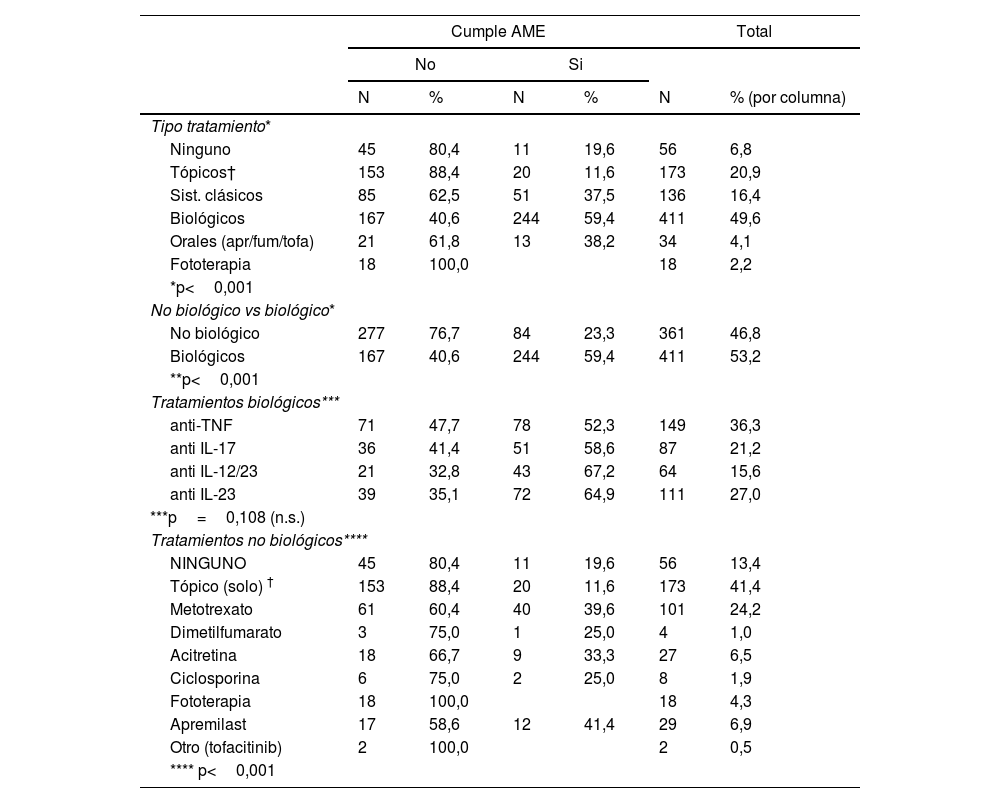
Se observaron diferencias de cumplir la AME en función del tratamiento (p<0,001). El tratamiento biológico se asoció a un mayor cumplimiento de la AME frente al tratamiento no biológico (59,4 vs. 23,3%). No se observaron diferencias entre los distintos tratamientos biológicos (p=0,108), pero sí frente a los no biológicos (p<0,001) (tabla 4).
Cumplimiento AME y Tratamiento antipsoriásico
| Cumple AME | Total | |||||
|---|---|---|---|---|---|---|
| No | Si | |||||
| N | % | N | % | N | % (por columna) | |
| Tipo tratamiento* | ||||||
| Ninguno | 45 | 80,4 | 11 | 19,6 | 56 | 6,8 |
| Tópicos† | 153 | 88,4 | 20 | 11,6 | 173 | 20,9 |
| Sist. clásicos | 85 | 62,5 | 51 | 37,5 | 136 | 16,4 |
| Biológicos | 167 | 40,6 | 244 | 59,4 | 411 | 49,6 |
| Orales (apr/fum/tofa) | 21 | 61,8 | 13 | 38,2 | 34 | 4,1 |
| Fototerapia | 18 | 100,0 | 18 | 2,2 | ||
| *p<0,001 | ||||||
| No biológico vs biológico* | ||||||
| No biológico | 277 | 76,7 | 84 | 23,3 | 361 | 46,8 |
| Biológicos | 167 | 40,6 | 244 | 59,4 | 411 | 53,2 |
| **p<0,001 | ||||||
| Tratamientos biológicos*** | ||||||
| anti-TNF | 71 | 47,7 | 78 | 52,3 | 149 | 36,3 |
| anti IL-17 | 36 | 41,4 | 51 | 58,6 | 87 | 21,2 |
| anti IL-12/23 | 21 | 32,8 | 43 | 67,2 | 64 | 15,6 |
| anti IL-23 | 39 | 35,1 | 72 | 64,9 | 111 | 27,0 |
| ***p=0,108 (n.s.) | ||||||
| Tratamientos no biológicos**** | ||||||
| NINGUNO | 45 | 80,4 | 11 | 19,6 | 56 | 13,4 |
| Tópico (solo) † | 153 | 88,4 | 20 | 11,6 | 173 | 41,4 |
| Metotrexato | 61 | 60,4 | 40 | 39,6 | 101 | 24,2 |
| Dimetilfumarato | 3 | 75,0 | 1 | 25,0 | 4 | 1,0 |
| Acitretina | 18 | 66,7 | 9 | 33,3 | 27 | 6,5 |
| Ciclosporina | 6 | 75,0 | 2 | 25,0 | 8 | 1,9 |
| Fototerapia | 18 | 100,0 | 18 | 4,3 | ||
| Apremilast | 17 | 58,6 | 12 | 41,4 | 29 | 6,9 |
| Otro (tofacitinib) | 2 | 100,0 | 2 | 0,5 | ||
| **** p<0,001 | ||||||
Los síntomas subjetivos referidos por los pacientes (picor, descamación, eritema, visibilidad) fueron la mayor causa de no cumplimiento de la AME, principalmente el picor >1 (72,5%) (ver material suplementario).
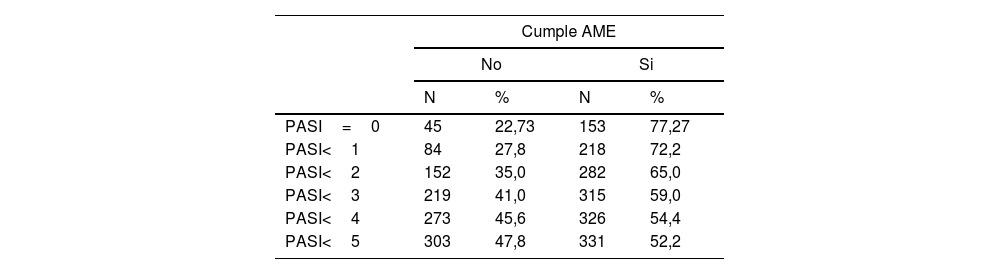
Un 23% de pacientes con PASI: 0 (45, 22,3%) no cumplían la AME (tabla 5). Y por cada incremento en el PASI de una unidad, prácticamente se duplicaba el riesgo de no cumplir la AME (con independencia del tratamiento), OR: 1,84 (IC 95%: 1,61-2,10). En dicho riesgo, se aprecia un cambio de tendencia a partir de puntuaciones PASI: 5, donde los incrementos no son tan pronunciados (Gráfica 2).
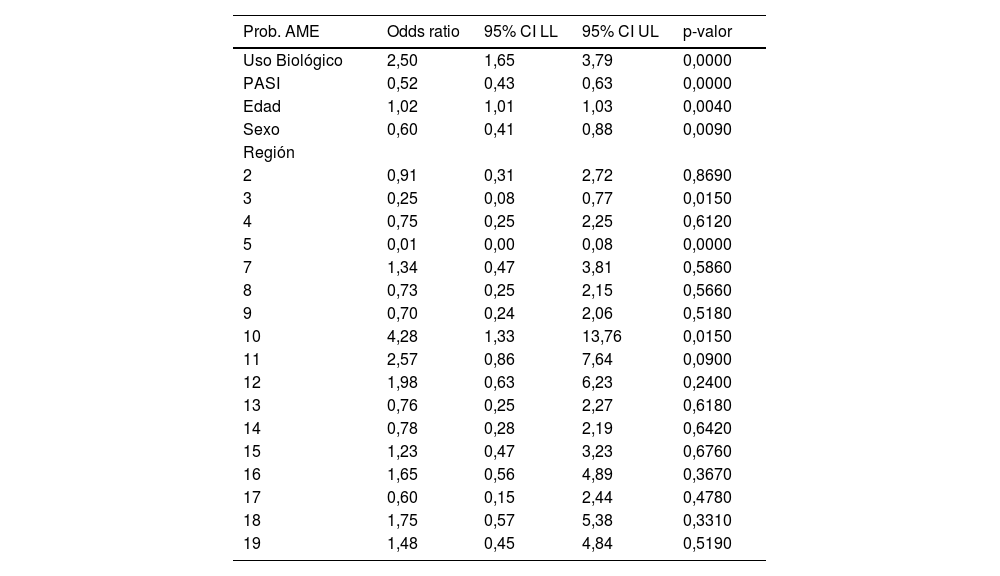
Utilizando un modelo logístico multivariable, se comprobó que la probabilidad de cumplir/no cumplir la AME implicaba de forma simultánea el uso de fármaco biológico, el PASI, la edad, el sexo y la región geográfica. De tal forma que, ninguno de ellos en exclusiva (ni siquiera el uso de fármaco biológico) explicaba las diferencias encontradas (tabla 6).
Modelo multivariable probabilidad de cumplir o no AME
| Prob. AME | Odds ratio | 95% CI LL | 95% CI UL | p-valor |
|---|---|---|---|---|
| Uso Biológico | 2,50 | 1,65 | 3,79 | 0,0000 |
| PASI | 0,52 | 0,43 | 0,63 | 0,0000 |
| Edad | 1,02 | 1,01 | 1,03 | 0,0040 |
| Sexo | 0,60 | 0,41 | 0,88 | 0,0090 |
| Región | ||||
| 2 | 0,91 | 0,31 | 2,72 | 0,8690 |
| 3 | 0,25 | 0,08 | 0,77 | 0,0150 |
| 4 | 0,75 | 0,25 | 2,25 | 0,6120 |
| 5 | 0,01 | 0,00 | 0,08 | 0,0000 |
| 7 | 1,34 | 0,47 | 3,81 | 0,5860 |
| 8 | 0,73 | 0,25 | 2,15 | 0,5660 |
| 9 | 0,70 | 0,24 | 2,06 | 0,5180 |
| 10 | 4,28 | 1,33 | 13,76 | 0,0150 |
| 11 | 2,57 | 0,86 | 7,64 | 0,0900 |
| 12 | 1,98 | 0,63 | 6,23 | 0,2400 |
| 13 | 0,76 | 0,25 | 2,27 | 0,6180 |
| 14 | 0,78 | 0,28 | 2,19 | 0,6420 |
| 15 | 1,23 | 0,47 | 3,23 | 0,6760 |
| 16 | 1,65 | 0,56 | 4,89 | 0,3670 |
| 17 | 0,60 | 0,15 | 2,44 | 0,4780 |
| 18 | 1,75 | 0,57 | 5,38 | 0,3310 |
| 19 | 1,48 | 0,45 | 4,84 | 0,5190 |
Se puede acceder a los datos a través del visor:
https://aedv.es/grupos-de-trabajo/psoriasis/visualizador-de-casos-de-proyecto-ame/
DiscusiónControl de enfermedad al aplicar criterios de la AME: global y por regionesA pesar de que los valores medios de PASI y BSA reflejan que se incluyeron pacientes con enfermedad leve o bien controlados4 (tabla 2), el cumplimiento de la AME es muy bajo: 491 pacientes (59,2%) no cumplen la AME.
También es clara la diferencia encontrada entre comunidades (Gráfico 1). Cataluña es la región con mayor cumplimiento de la AME, aunque más de un tercio de los pacientes (37,1%) no lo cumplen. El hecho de que para nuestro estudio en esta comunidad se haya encontrado un mayor porcentaje de pacientes en tratamiento biológico podría favorecer su mayor cumplimiento. Este aspecto, el de mayor o menor dificultad de acceso a determinados fármacos biológicos, es un hecho conocido, pues algunas comunidades permiten utilizar cualquier fármaco biológico desde primera línea y, sin embargo, otras requieren biosimilar de anti-TNF inicialmente o incluso una determinada secuencia8.
Sin embargo, no es solo el mayor uso de biológico el que justifica esa diferencia regional, pues sabemos que además del biológico, la edad, el sexo, y el PASI de los pacientes, influyen; pero si incluimos estos factores, siguen existiendo diferencias entre regiones, aunque es cierto que las diferencias regionales tienden a minimizarse (pero no a desaparecer del todo) cuando consideramos estos factores. Tal como se aprecia en la tabla 6, al existir diferencias significativas en todos los factores (simultáneamente) implica que todos están asociados y que el uso de biológico por sí solo no es capaz de explicar las diferencias existentes.
Cumplimiento de la AME por sexo y edadLas preferencias de tratamiento por parte del paciente tienen un papel importante en la consulta. La edad parece influir en las preferencias de elección de terapia, tanto en tópicos como en biológicos, mostrando las personas más jóvenes mayor interés en las probabilidades de beneficio de dicho tratamiento9. Sin embargo, nosotros comprobamos que los pacientes de mayor edad son los que más cumplen la AME, lo que estaría acorde con la peor puntuación en escalas de CdV de los más jóvenes10, pero contrastaría con lo observado en otros estudios en los que parece que los pacientes mayores con problemas cutáneos tienen peor CdV, debido a otros problemas de salud añadidos11.
En nuestro estudio también comprobamos que los varones cumplen con mayor frecuencia la AME que las mujeres (Gráfico 1). En otros estudios se ha encontrado que existe una distinción por sexos, a favor de las mujeres, en la prescripción de fármacos biológico12, también se sabe que ellas parecen tener mayores puntuaciones de picor13, mayor afectación en su CdV14 y mayor frecuencia de alteraciones del sueño15. Estos parámetros no se encuentran entre las escalas de gravedad utilizadas habitualmente (BSA, PGA, PASI), por lo que pueden infravalorar la gravedad de la enfermedad en ciertos subgrupos de pacientes.
Cumplimiento de la AME por grupo terapéuticoEl uso de fármacos más eficaces podría ser el factor más determinante para la consecución de la AME. De hecho, comprobamos en nuestro estudio que el uso de fármaco biológico, en contra de fármacos de síntesis química o fototerapia es el que mayor porcentaje de cumplimiento de la AME asocia. Además, se ha comprobado en pacientes psoriásicos con la medida del Psoriasis Symptoms and Signs Diary (PSSD) que incluye eritema, prurito, dolor y otros síntomas, que diversos fármacos mejoran estos síntomas, si bien no hay comparativos entre fármacos aún que permitan elegir entre unos y otros16.
Sin embargo, no hemos observado diferencias significativas entre los fármacos biológicos, algo que podría deberse a un sesgo de selección por tratarse de un estudio no controlado, en el que seleccionamos en cada paciente el fármaco que consideramos que tiene mejor probabilidad de éxito; o a la tendencia a utilizar los fármacos biológicos con niveles de eficacia más pobre en pacientes con mayores probabilidades de éxito (pacientes näive, normopeso, poca duración de la enfermedad, baja comorbilidad), y a la inversa, reservando los fármacos de mayor tasa de repuesta para los pacientes más complejos. Esto podría haber influido en la obtención de resultados más positivos (mejores) en el primer grupo y resultados inferiores en el segundo, lo que podría haber resultado en tasas de efectividad similares entre ambos grupos17–20.
Sorprende que ningún paciente en fototerapia consiga la AME, y los altos porcentajes de no consecución de la AME en los que están sin tratamiento (80,4%), o solo con tópicos (88,4%).
Valoración de correlación entre PASI y cumplimiento de la AMEEl índice PASI es la medida estandar para valorar la gravedad de la Ps, pero no siempre se correlaciona directamente con la percepción del paciente7. Se recogió en el estudio con el fin de compararlo con la AME.
El PASI como medida única de gravedad resulta poco precisa especialmente en casos muy leves, con poca área afecta. De hecho, en nuestro estudio el 23% de los pacientes con PASI 0 no cumplen criterios de la AME. Además, no tiene en cuenta la localización de las lesiones, que sabemos puede ser muy limitante para el paciente, como uñas, pliegues, genitales o, palmas y plantas. Más aún, el PASI no es una medida lineal ya que cambios del 9 al 10% de área afecta en una de las localizaciones hace que se doble la puntuación, sin que haya cambios en otros síntomas como el eritema, la infiltración o la descamación21.
En este sentido, es entendible que hasta un 28% de pacientes con PASI<1 o un 35% de pacientes con PASI<2 de nuestro estudio no cumplan criterios de la AME por lo expuesto anteriormente, pero llama la atención el hecho de que un paciente que no tenga lesiones de Ps (PASI 0) ni artritis psoriásica no cumpla criterios de la AME y hablaría a favor de otros condicionantes, probablemente de origen psicológico, que puedan influir en la sensación de enfermedad o podría indicar ciertas limitaciones de especificidad en la medición para la que está destinada.
Qué ha supuesto introducir la medida de la AMELas manifestaciones subjetivas más importantes de la enfermedad son valoradas en la AME por el propio paciente, quién define cuánto de intensas son sus placas, cuánto descaman, cuánto pican, cuánto molestan y cuánto se ven. La importancia que estos valores tienen para los afectados se ve reflejada en que, de los 491 pacientes del estudio que no cumplen la AME, alrededor del 70% incluye estos síntomas subjetivos como motivo de su incumplimiento, siendo el prurito el de mayor porcentaje (72,5%) de los 4 (ver material suplementario).
De hecho, el síntoma más molesto para los pacientes psoriásicos es el prurito, que está presente entre el 60 y el 90% de ellos22. Este dato coincide con el de un estudio multicéntrico en el que se evaluaban factores psicológicos relacionados con la Ps donde el 69,5% de los pacientes refería prurito y, de estos, en casi el 75% era crónico23.
La visibilidad de la Ps puede causar rechazo social y conductas de evitación que llegan a condicionar a muchos pacientes24. En nuestro estudio 372 pacientes no cumplían la AME por este criterio, reforzando la idea que la inclusión de estos síntomas subjetivos, no recogidos en otros índices25,26, es importante para valorar la gravedad de la Ps por medio de factores psicológicos y sociales que afectan negativamente a la CdV del paciente.
La AME no es la suma de PASI, BSA y DLQI, sino una medida global de la situación clínica en la que el paciente y el dermatólogo no ven la necesidad de hacer ninguna modificación terapéutica ni ninguna otra intervención, aportando un valor cualitativo diferente.
No obstante, y aunque el GPs lo considera de utilidad en el manejo del paciente27, aún no se ha extendido su uso y son pocas las publicaciones que especifican la AME como medida de resultado terapéutico y situación clínica del paciente psoriásico28.
Limitaciones del estudioAl tratarse de un estudio nacional es de suponer que la muestra de pacientes obtenida sea heterogénea por su diversidad geográfica, lo que puede influir en las distintas sensibilidades de apreciación de los parámetros subjetivos medidos por el paciente, diferente percepción de los síntomas en función de diferencias culturales, diferencias de experiencia en manejo de la Ps entre los dermatólogos colaboradores (consulta monográfica vs. consulta común, urbe vs. rural), distinto acceso a fármacos de mayor efectividad29, etc.
Los pacientes no fueron aleatorizados, sino que se reclutaron en práctica clínica habitual, en un corto período de tiempo (1-2 días) por lo que podría haber un sesgo de participación y selección, por reclutamiento de los más participativos, o por el azar de los que acudieran a consulta esos días.
ConclusionesTras aplicar la AME a nivel nacional se comprueba que el cumplimiento es relativamente bajo, con diferencias significativas por sexo, edad, región y tipo de tratamiento utilizado, y síntomas referidos por los pacientes. Pero ninguno de estos factores en exclusiva justificó las diferencias encontradas. Tampoco el uso de biológico por sí solo es capaz de explicar las diferencias existentes.
La valoración de la AME frente a PASI supone una mayor aproximación al paciente, al permitirle intervenir en la medición de la gravedad de su enfermedad, lo cual podría suponer un aumento cualitativo en el manejo de estos pacientes.
La utilización de la AME en la práctica clínica habitual es fácil y cómoda y puede aumentar la calidad del manejo del paciente psoriásico al incluir en su medición parámetros no contemplados en otras escalas de gravedad de las comúnmente utilizadas hasta ahora. Por tanto, animamos a los dermatólogos que atiendan pacientes con Ps a usar la AME como medida de valoración de su gravedad y como objetivo terapéutico.
AutoríasG. Carretero Hernández: diseño del estudio, obtención de los datos, interpretación de los resultados, coordinación nacional del estudio, primer autor del manuscrito.
Ara Martín, Mariano: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Aragón, primer autor del manuscrito.
Armesto Alonso, Susana: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Cantabria, primera autora del manuscrito.
Belinchón Romero, Isabel: obtención de los datos, interpretación de resultados, coordinación regional del estudio en Comunidad Valenciana, primera autora del manuscrito.
Eiris Salvado, Noemi: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Andalucía, primera autora del manuscrito.
Ferrán Farrés, Marta: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Cataluña, primera autora del manuscrito.
Galache Osuna, Cristina: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Asturias, primera autora del manuscrito.
García Bustínduy, Marta: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Canarias, primera autora del manuscrito.
García Latasa de Araníbar, Javier: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Aragón, primer autor del manuscrito.
Juliá Manresa, Marc: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en País Vasco, primer autor del manuscrito.
Llamas Velasco, Mar: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Madrid, primera autora del manuscrito.
López Ferrer, Anna: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Cataluña, primera autora del manuscrito
Roncero Riesco, Mónica: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Castilla León, primera autora del manuscrito.
Ruiz Genao, Diana: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Madrid, primera autora del manuscrito.
Ruiz-Villaverde, Ricardo: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Andalucía, primer autor del manuscrito,
Salgado Boquete, Laura: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Galicia, primera autora del manuscrito.
Soria Martínez, Caridad: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Murcia, primera autora del manuscrito.
Vilarrasa Rull, Eva: obtención de los datos, interpretación de los resultados, coordinación regional del estudio en Cataluña e Islas Baleares, primera autora del manuscrito.
Descalzo, MA: análisis de los datos, interpretación de los resultados, elaboración del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los laboratorios Almirall y UCB por el apoyo económico y humano para la elaboración del material documental, distribución y recogida del mismo de los dermatólogos colaboradores y entrega a cada coordinador regional, y para el análisis de datos.
Esta ayuda no ha estado supeditada a ningún requerimiento ni condición en el diseño del estudio, ni en el análisis de datos, ni en la obtención de resultados, ni en la elaboración del manuscrito de publicación.
Abalde Pintos, María Teresa; Alfaro Rubio, Alberto; Aparicio Español, Gloria; Aranegui Arteaga, Beatriz; Arechalde Pérez, Ana; Aróstegui Aguilar, Jorge; Arrue Michelena, Itrziar; Azón Masoliver, Antoni; Bajo del Pozo, Cristina; Ballano Ruiz, Adrián; Baniandrés Rodríguez, Ofelia; Blanco Barios, Susana; Bordel Gómez, María Teresa; Carrascosa Carrillo, José Manuel; Carrizosa Esquivel, Ana María; Castellano González, María; Castro Gutiérrez, Beatriz; Concellón Doñate, María Antonia; Conde Taboada, Alberto; Conejero del Mazo, Raquel; Corral de la Calle, Miriam; Corbalán Vélez, Raúl; Curcó Botargues, Neus; de la Fuente Meira, Sonia; de las Heras, Cristina; de la Torre Gomar, Francisco; del Alcázar Viladomiú, Elena; del Río Gil, Rubén; Delgado Mucienes, Carmen; Delgado Vicente, Sonsoles; Duarte Ferrera, Miguel; Durán Vián, Carlos; Escalonilla García-Patos, Pilar; Fernández Armenteros, José Manuel; Fernández Díaz, María Luisa; Fernández Sánchez, Cristina; Fuentelsaz del Barrio, María Victoria; Fortuño Ruíz, Yolanda; Frías Iniesta, José; Galán Gutiérrez, Manuel; Gallardo Hernández, Fernando; García Arpa, Mónica; García Donoso, Carmen; García Fernández de Villalta, María José; García Font, Mer edes; García Gil, Miguel; García Martínez, Esther; García Sánchez, María; García Souto, Fernando; Garrido Colmenero, Cristina; Gil Faure, Inma; Gil Mateo, María del Pino; Godoy Díaz, Daniel; Godoy Gijón, Elena; Gómez Avivar, Pilar; Gómez Centeno, Pilar; Gómez de Castro, Celia; Gómez Díez, Santiago; Gómez Vila, Borja; González Cantero, Álvaro; González Quesada, Alicia; González Villanueva, Iris; Gracia Cazaña, Tamara; Hergueta Sánchez, Julia Paloma; Hernández Hernández, Zaida; Hernández Montoya, Carlos; Hospital Gil, Mercedes; Lacalle Calderón, Marina; Laso Dosal, Francisco Javier; Lezcano Biosca, Victoria; López Ávila, Angel; López Castillo, Daniel; López-Escobar García-Prendes, María; López Estebaranz, José Luis; Lorda Espés, Marta; Luján Rodríguez, Dunia; Mahiques Santos, Laura; Marcellán Fernández, María; Márquez Henríquez, Juan; Marqués Martín, Laura; Marrón Moya, Servando Eugenio; Martín Alcalde, Javier; Martín González, Isabel; Martín Sáez, Esther; Martínez de Espronceda Esquerro, Iñigo; Martínez de Salinas Quintana, Ana; Mataix Martínez, Javier; Matas Nadal, Clara; Mateu Puchades, Almudena; Medina Montalvo, Susana; Menéndez García-Estrada, Ana; Miralles Botella, Julia; Mitxelena Eceiza, Yosune; Mollet Sánchez, Jordi; Monte Serrano, Juan; Montes Torres, Andrea; Morales Callaghan, Ana; Morales Larios, Elisa; Morales Moya, Ana Luisa; Moreno Suárez, Fátima; Muñoz Santos, Carlos; No Pérez, Nuria; Notario Rosa, Jaume; Ormaetxea Pérez, Nerea; Palacios García, Laura; Pardo Sánchez, José; Pérez Barrio, Silvia; Pérez Caballero, José Antonio; Pérez Gil, Amalia; Pérez Suárez, Beatriz; Pestana Eliche, María; Pousa Martínez, María; Poveda Montoyo, Inés; Prieto Torres, Lucía; Puebla Tornero, Laura, Puig Sanz, Lluis; Pujol Moncusí, Josep; Ramírez Andreo, Antonio; Ramírez Concha, José María; Ramírez Santos, Aquilina; Reguero del Cura, Leandra; Requena López, Sheila; Ribera Pibernat, Miquel; Riera Monroig, Josep; Río García, Irene; Rivera Díaz, Raquel; Rivera Fuentes, Ignacio; Rocamora Durán, Vicenç; Rodríguez Blanco, Sabela; Rodríguez Freire, Lourdes; Rodríguez García, Fernando; Rodríguez Martín, Marina; Rodríguez Nevado, Isabel; Romero Aguilera, Guillermo; Romero Mate, Alberto; Romero Sillero, Estrella; Ruiz Carrascosa, José Carlos; Ruiz Martínez, Javier; Sagristá García; Marc; Saínz Gaspar, Laura; Salas Martínez, Ana; Salleras Redonet, Montserrat; Sánchez Caminero, Prado; Sánchez Largo, Elena; Sánchez Pérez, Javier; Sánchez Salas, María Pilar; Santos-Juanes Jiménez, Jorge; Sahuquillo Torralba, Antonio; Segurado Rodríguez, Agustina; Sidró Sartos, Miriam; Solanas Treviño, Ruth; Suárez Hernández, José; Taberner Ferrer, Rosa; Úbeda Clemente, María Isabel; Urigoitia Ugalde, Peru; Vázquez López, Francisco; Velázquez Tarjuelo, Diana; Vidal Sarro, David; Vilar Alejo, Jaime; Villegas Romero, Isabel y Yanguas Barona, Ignacio.