El pioderma gangrenoso (PG) es un trastorno cutáneo inflamatorio infrecuente caracterizado por úlceras ampollosas o necróticas crónicas y recurrentes, e infiltrado predominantemente neutrofílico en su histopatología1. Existen diversos subtipos de PG tales como ulcerativo, bulloso, pustuloso, periestomal y superficial granulomatoso, pero la variante ulcerativa representa cerca del 85% de los casos1,2. La etiología de esta enfermedad debilitante no se comprende plenamente. El PG puede ser idiopático, o estar asociado al consumo de drogas (cocaína/levamisol)3, enfermedad intestinal inflamatoria (EII), artritis reumatoide (AR), trastornos hematológicos, o formar parte de un síndrome inflamatorio hereditario2. La patogénesis del PG no ha sido completamente definida aún, no habiéndose aprobado actualmente ningún fármaco para el manejo de esta enfermedad. En muchos casos, su manejo se basa en inmunosupresores clásicos y agentes biológicos fuera de indicación4. Los estudios recientes han demostrado que la vía de Jano cinasa (JAK) puede estar implicada en la progresión del PG4,5. Se ha propuesto el tratamiento fuera de indicación de los inhibidores de JAK por parte de algunos autores6–10 como estrategia terapéutica óptima para el manejo del PG refractario en pacientes en que han fracasado otras terapias sistémicas. La experiencia con tofacitinib5–9 ha sido la más ampliamente reportada hasta la fecha. Sin embargo, el uso de inhibidores de JAK más selectivos, tales como Upadacitinib, podría ser efectivo con un mejor perfil de seguridad y, de hecho, se han publicado hasta el momento pocos casos10.
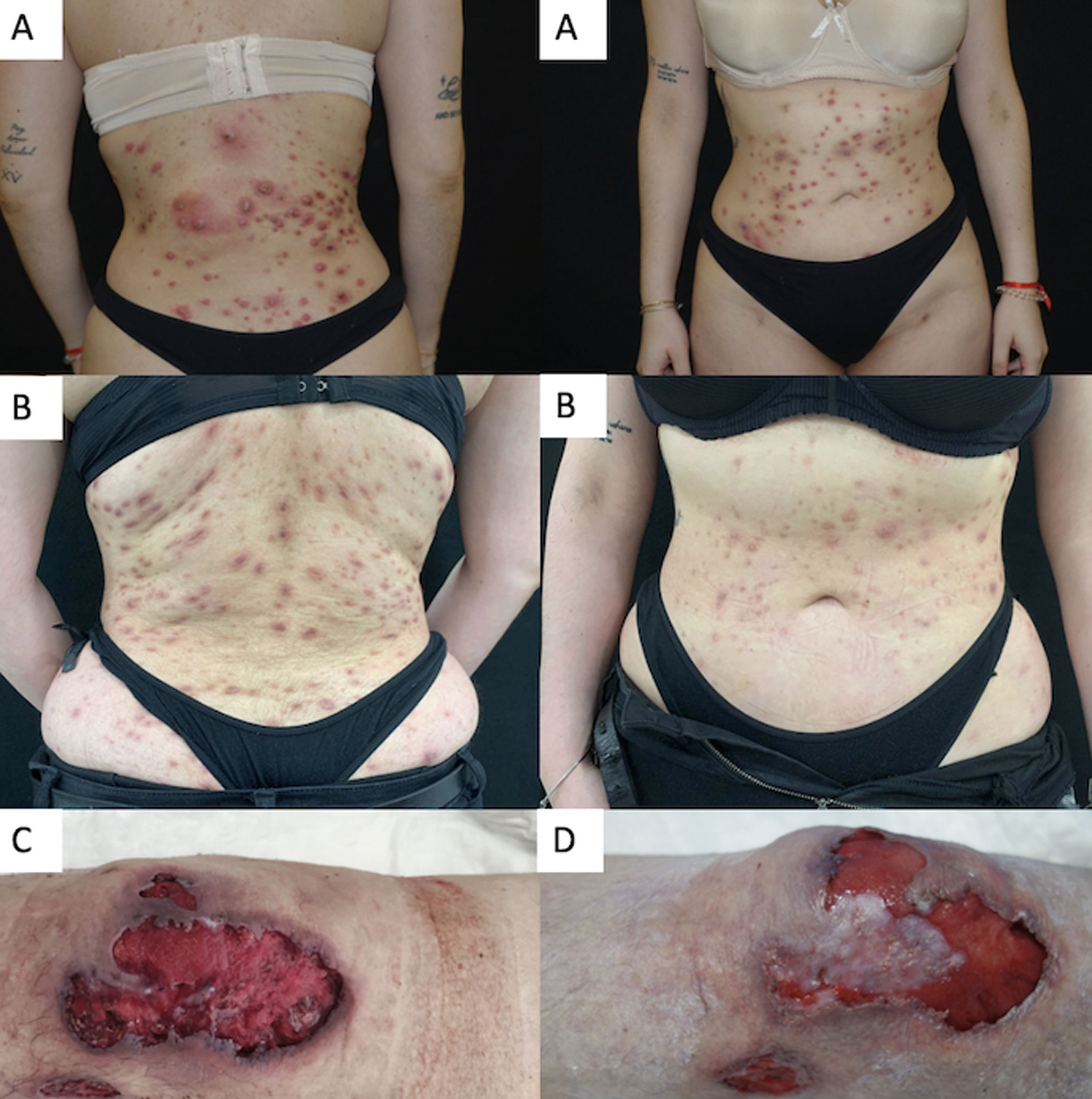
Realizamos una serie de casos retrospectiva bicéntrica que evaluó la seguridad a corto plazo y el perfil de eficacia de 15mg/diarios o 30mg/diarios de upadacitinib para el manejo del PG refractario. La respuesta clínica fue evaluada mediante PGA (Physician Global Assessment) durante el periodo evaluado. Se consideró respuesta óptima al lograrse una PGA ≤2. Se incluyeron cuatro casos de PG recalcitrante. Dos pacientes fueron hombres y dos mujeres, de 26 a 62 años de edad. El valor de la PGA media basal fue de 4 (fluctuando de 0 a 4). El curso medio del PG previo al tratamiento con upadacitinib fue de 4,3 años (rango 1–10). Se identificaron un desencadenante bien conocido o comorbilidad en todos los pacientes. Un paciente tuvo enfermedad inflamatoria intestinal mal controlada, y otro participante artritis reumatoide bien controlada. En los dos últimos pacientes el inicio de PG estuvo asociado al uso de cocaína adulterada con levamisol en un caso, y cirugía de mama en el otro. Dos pacientes tuvieron PG ulcerativa limitada a los miembros inferiores, un paciente tuvo PG pustuloso generalizado, y el otro el subtipo vegetativo generalizado. Previamente al tratamiento con upadacitinib, había fallado una media de 5 (rango 4–6) terapias sistémicas en todos los pacientes. Tres pacientes siguieron tratamientos sistémicos concomitantes durante la iniciación de upadacitinib; sin embargo, habían recibido estos fármacos adicionales durante un periodo de tiempo significativo sin mejora, antes del inicio del tratamiento con upadacitinib. La administración de corticosteroides sistémicos pudo reducirse o retirarse completamente tras la introducción de upadacitinib en la cohorte completa. Todos los pacientes lograron una PGA ≤2 tras un seguimiento medio de 17,5 semanas (rango 12–26), controlando el dolor y sin desarrollar episodios adversos graves secundarios al fármaco ni comorbilidades descontroladas relacionadas con PG. Las características y comorbilidades basales y las terapias previas y concomitantes se reflejan en la tabla 1. La respuesta clínica a upadacitinib en los pacientes 2 y 3 puede observarse en la fig. 1.
Resumen de nuestros casos de PG tratados con upadacitinib (incluyendo regímenes terapéuticos)
| Edad (años) y sexo | Edad del PGa | Factores de riesgo cardiovascular | Fumador | Comorbilidades o factores desencadenantes asociados a PG | Tratamientos sistémicos previos | Dosis de upadacitinib | Concomitant therapies | Basal PGAb (0–4) | Weeks of follow-up (number) | Final PGA (0–4) | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Caso 1Vegetativo | 45, varón | 1 año | No | No | Enfermedad inflamatoria intestinal | CscMetotrexatoCiclosporinaAdalimumab | 15mg día | Adalimumab 40mg/weeklyScs 20mg/daily | 4 | 26 | 1 |
| Caso 2Pustuloso | 26, mujer | 1 año | No | No | Mamoplastia | CsMetotrexatoCiclosporinaAdalimumab | 15mg/día el primer mes, y seguidamente 30mg/día | Adalimumab 40mg/weeklyScs 20mg/daily | 4 | 16 | 2 |
| Caso 3Ulcerativo | 62, mujer | 5 años | Dislipidemia, diabetes | Sí | Artritis reumatoide | CsMetotrexatoCiclosporinaAdalimumabGolimumab | 30mg/día | Scs 75mg/daily | 4 | 16 | 2 |
| Caso 4Ulcerativo | 50, varón | 10 años | Hipertensión arterial | Sí | Abuso de cocaína | CsMetotrexatoAzatioprinaCiclosporinaAdalimumabCertolizumabInfliximab | 30mg/día | No | 4 | 12 | 1 |
A pesar de ser una serie de casos pequeña, con seguimiento corto y basada en nuestras propias observaciones, de acuerdo con Kooybaran et al.10 upadacitinib parece ser una alternativa terapéutica prometedora y posible, además de economizadora de corticosteroides para los pacientes con PG pustuloso, vegetativo o clásico con fracaso de las terapias sistémicas múltiples (combinadas o en monoterapia) según lo previamente reportado para tofacitinib. Sin embargo, el perfil de seguridad del fármaco podría ser mejor10. Actualmente, no se han aprobado terapias por parte de la EMA o la FDA para el manejo del PG. Por tanto, upadacitinib y otros inhibidores de JAK5–10 podrían ser considerados una alternativa razonable (combinada o en monoterapia) especialmente para los pacientes con enfermedad inflamatoria intestinal o artritis reumatoide. Sin embargo, serán necesarios ensayos clínicos futuros y series del mundo real a largo plazo para evaluar el perfil de eficacia de upadacitinib y otros inhibidores de JAK en el manejo del PG refractario.
Consentimiento informadoSe dispone de todos los consentimientos informados.
FinanciaciónEsta investigación no recibió subvenciones específicas de ninguna entidad financiera de los sectores público o privado.
Conflicto de interesesPedro Mercader-García declaró haber recibido honorarios por conferencias y pagos compensatorios por pertenecer a los comités de asesoramiento de Sanofi, Leo Pharma, Lilly y Abbvie, fuera del trabajo presentado. Los autores restantes declararon la ausencia de conflicto de intereses.
Disponibilidad de los datosTodos los datos están disponibles, previa solicitud a los autores.
Nos gustaría expresar nuestro agradecimiento a Almudena Mateu Puchades y Mª del Carmen Hidalgo Boronat por su respaldo en la recopilación de datos.