El tratamiento tópico es fundamental en el paciente con psoriasis. En los últimos años se han producido múltiples avances y cambios en el manejo de la psoriasis que hacen que se precise una revisión y actualización del uso del tratamiento tópico. Expertos del Grupo Español de Psoriasis (GPS) de la Academia Española de Dermatología y Venereología (AEDV) han generado recomendaciones sobre el tratamiento tópico de la psoriasis, basadas en la mejor evidencia disponible y la experiencia de expertos.
MetodologíaSe siguió la metodología de grupos nominales, con ayuda de una revisión sistemática de la literatura. Se designó un coordinador y seleccionó un grupo de expertos con base en su experiencia y conocimiento en el uso del tratamiento tópico en la psoriasis. Tras ello se definieron y consensuaron los objetivos y puntos clave del documento, y con ayuda de una documentalista, se realizó una revisión sistemática de la literatura en Medline, Embase y Cochrane Library. Se seleccionaron revisiones sistemáticas, metaanálisis, ensayos clínicos, así como estudios observacionales. Se revisaron otras guías de práctica clínica y documentos relacionados. Con esta información se crearon una serie de recomendaciones que fueron evaluadas y modificadas por los expertos. Tras varios procesos de revisión, y una evaluación externa se redactó el documento definitivo.
ResultadosSe presentan recomendaciones prácticas, en línea con otros documentos de la AEDV, sobre el uso de los tratamientos tópicos en la psoriasis. Se incluye el uso del tratamiento tópico como tratamiento principal y como coadyuvante del tratamiento sistémico, la selección del tipo de tratamiento tópico, las estrategias de tratamiento, su uso en localizaciones especiales y tipos de psoriasis grave, así como la adherencia y preferencias del paciente. En el documento se valora críticamente la eficacia y seguridad de la terapia tópica.
.
Topical therapy is vital in the management of psoriasis. In recent years there have been multiple advances and changes in the management of psoriatic patients that justify a review and update of the use of topical therapy. Experts from the Spanish Psoriasis Working Group (GPS) of the Spanish Academy of Dermatology Venereology (AEDV) have developed a set of recommendations for the treatment of psoriasis based on the best available evidence and experts’ opinion.
MethodologyWe followed the methodology of nominal groups, with the help from a systematic review. A coordinator was designated, and a group of experts was selected based on their experience and knowledge on topical therapies for the management of psoriasis. Afterwards, the objectives and key points of the document were defined and agreed upon, and with help from a documentary specialist, a systematic review was conducted across Medline, Embase and Cochrane Library. Systematic reviews, meta-analyses, clinical trials, as well as observational studies were selected. Published clinical practice guidelines and related documents were also reviewed. With this information, the coordinator generated a series of recommendations that would be later evaluated and modified by the experts themselves. After several review processes and an external evaluation, the final document was drafted.
ResultsPractical recommendations on the use of topical therapies for the management of psoriasis are presented in line with other documents of the AEDV, including the use of topical treatment as the main therapy, their adjuvant role when using systemic therapies, treatment selection, treatment strategies, their use in special locations and severe psoriasis, and the patients adherence and preferences to the topical therapy. The document critically evaluates the safety and efficacy profile of topical therapy.
El tratamiento tópico constituye un pilar fundamental en el tratamiento de la psoriasis, es eficaz en alrededor del 70% de los pacientes con psoriasis leve o moderada1 y como coadyuvante del tratamiento sistémico en la psoriasis moderada-grave2,3.
El Grupo Español de Psoriasis (GPS) de la Academia Española de Dermatología y Venereología (AEDV) publicó en 2009 unas recomendaciones, basadas en la evidencia, sobre el tratamiento tópico de la psoriasis4. Desde entonces se han producido cambios sustanciales, como la aparición de las terapias biológicas para el tratamiento de la psoriasis moderada-grave5,6. La demostrada superioridad de estos compuestos en términos de eficacia, seguridad y mantenimiento de la respuesta7 ha modificado los objetivos terapéuticos5,6 y ha contribuido al desarrollo de criterios, indicaciones y medidas objetivas de evaluación de la gravedad y de la respuesta terapéutica5,6.
Por otro lado, la implicación de los pacientes en la toma de decisiones es cada vez más importante5,6,8, habiéndose observado incluso que la mala adherencia al tratamiento se asocia con la falta de aceptación de la medicación por parte del paciente9-12.
JustificaciónNos encontramos en un nuevo escenario en el tratamiento de la psoriasis que hace necesaria una revisión del papel de los tratamientos tópicos en el contexto científico y de la práctica clínica actual. Además, teniendo en cuenta la variedad de tratamientos tópicos disponibles, resulta fundamental ofrecer un tratamiento con demostrada eficacia que se adapte y sea aceptado por el paciente. Con esta premisa, el GPS plantea los siguientes objetivos:
- 1.
Evaluar críticamente la evidencia publicada y elaborar una guía de tratamiento tópico para la psoriasis que sirva de referencia a los dermatólogos.
- 2.
Generar un marco de tratamiento para pacientes con psoriasis leve atendidos en atención primaria que pueda ser material de consulta para otros profesionales implicados.
- 3.
Generar valor sobre el uso del tratamiento tópico.
Las recomendaciones emitidas hacen referencia al uso del tratamiento tópico para pacientes adultos con psoriasis leve-moderada y como coadyuvante en la psoriasis moderada-grave.
MetodologíaDiseño del estudio. Este documento de consenso ha sido promovido por el GPS de la AEDV. Se ha utilizado metodología de grupos nominales, junto con revisión sistemática de la literatura. El estudio se llevó a cabo en conformidad con los principios establecidos en la Declaración de Helsinki, referente a la investigación médica en seres humanos en su última versión, y de acuerdo con la normativa aplicable sobre Buena Práctica Clínica.
Selección de participantes y desarrollo del documento. En primer lugar, se designó un coordinador y se seleccionó un grupo de 3expertos más miembros del GPS con base en su experiencia y conocimiento de la psoriasis. A continuación, se definieron los objetivos, alcance, usuarios y apartados del documento.
Revisión sistemática de la literatura (RSL). Una documentalista experta diseñó diferentes estrategias de búsqueda, incluyendo términos Mesh y texto libre, en las principales bases de datos bibliográficas (Medline, Embase y la Cochrane Library) hasta septiembre del 2021, con posterior actualización en octubre del 2023 (ver material suplementario, anexo). Se seleccionaron revisiones sistemáticas y metaanálisis, ensayos clínicos aleatorizados (ECA), estudios de calidad en vida real, guías de práctica clínica y documentos de consenso nacionales e internacionales sobre el uso de tratamiento tópico en la psoriasis.
A partir de la información recogida el coordinador generó una serie de recomendaciones que fueron evaluadas y modificadas por los expertos. Tras la revisión externa por parte de 2miembros del GPS que no habían participado en la generación del contenido y recomendaciones del consenso, se redactó el documento definitivo.
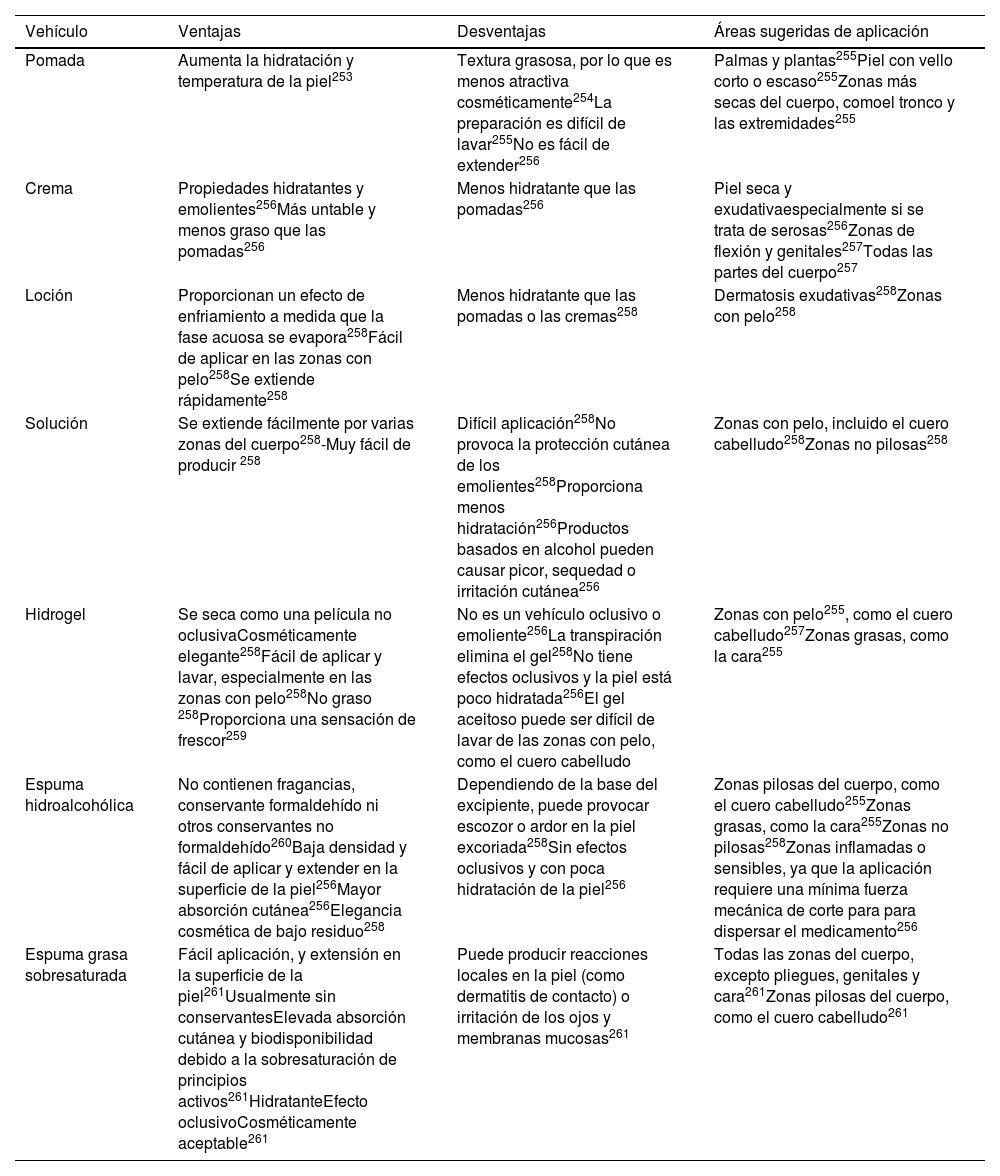
ResultadosConsideraciones generalesCaracterísticas diferenciales del tratamiento tópico en relación con el tratamiento sistémicoEn el tratamiento tópico intervienen 4 elementos que influyen en la respuesta terapéutica: la piel, el principio activo, el vehículo (base o excipiente) y la técnica de aplicación (hidratación cutánea / cura abierta u oclusión). La resistencia de la piel a la penetración de los tratamientos tópicos es variable, siguiendo un orden de menor a mayor: mucosas, escroto, párpados, cara, pecho y espalda, brazos y muslos, antebrazos y piernas, dorso de manos y pies, palmas de manos y pies; y uñas. La potencia del principio activo también condiciona la respuesta, así como el vehículo y la técnica de aplicación, por su efecto en la absorción y duración de la acción.
Debido a sus características, los tratamientos tópicos se han utilizado desde hace décadas con distintas dosis, vehículos, periodos de tiempo, poblaciones y estrategias de tratamiento (de forma aislada y en combinación). Todo ello limita extraordinariamente la comparabilidad y complica el establecimiento de una guía de uso basada en la evidencia, tal y como se ha realizado con los tratamientos sistémicos, pero explica la amplia experiencia de uso de estos compuestos.
Por último, la participación del paciente en la psoriasis es siempre fundamental para conseguir una buena adherencia terapéutica, que es aún más importante en el caso de tratamientos tópicos con implicaciones cosméticas.
Indicación del tratamiento tópico en la psoriasisEl tratamiento tópico está indicado en cualquier paciente con psoriasis, independientemente de sus características, tipo o gravedad. Puede utilizarse como tratamiento principal en la psoriasis leve, y casos individualizados de psoriasis moderada, o bien como coadyuvante de la terapia sistémica en pacientes con psoriasis moderada-grave (ver apartado siguiente). Así, la consecución del objetivo terapéutico dependerá del tratamiento tópico en el primer caso, y de la terapia sistémica en el segundo. Igualmente, la evaluación de la eficacia y seguridad del tratamiento tópico como coadyuvante se restringirá a la/s zona/s de aplicación.
El tratamiento tópico también se puede indicar como monoterapia en pacientes con psoriasis moderada-grave que rechazan el tratamiento sistémico por miedo a efectos secundarios, comorbilidades u otras consideraciones personales. Por último, también puede valorarse en pacientes blanqueados con tratamiento sistémico interrumpido o en las denominadas «vacaciones terapéuticas».
Evaluación de la gravedad de la psoriasisLos criterios para evaluar la gravedad de la psoriasis en el adulto están descritos en el documento del GPS sobre el uso de terapias biológicas5. Con base en estos criterios, los pacientes con psoriasis se clasifican en leves o moderado-graves.
Señalar que los tratamientos tópicos también son prescritos por médicos de atención primaria y otros profesionales de la salud que pueden tener un conocimiento insuficiente de las herramientas de evaluación de la gravedad de la enfermedad como el Psoriasis Area Severity Index (PASI), Body Surface Area (BSA) o el Dermatology Life Quality Index (DLQI). Por ello, el GPS incluye, como alternativa, el uso del Physician's Global Assessment (PGA).
Por otra parte, los tratamientos tópicos se emplean con mucha frecuencia en formas leves en las que algunas de estas herramientas presentan limitaciones, por lo que en ciertos casos el DLQI y la opinión del paciente pueden ser más apropiadas.
Finalmente, es importante indicar que, debido a la extraordinaria heterogeneidad clínica de la enfermedad, en la práctica diaria hay pacientes que, aunque su gravedad (según los criterios aceptados5) es moderada-grave, la percepción clínica puede estar más próxima al concepto moderado que grave, tal y como ha definido un grupo de expertos dermatólogos13. El GPS considera que, en estos casos, y de forma individualizada, se puede valorar junto con el paciente un tratamiento tópico como tratamiento principal antes de indicar una terapia sistémica que es lo que les correspondería con base en la clasificación de la psoriasis aceptada5.
Selección del tratamiento tópicoEn la selección de los tratamientos tópicos se deben tener en cuenta los criterios descritos para los tratamientos sistémicos5, con una serie de consideraciones (tabla 1). Factores especialmente relevantes son las preferencias del paciente y las características de los vehículos, ya que condicionan, en gran medida, la adherencia terapéutica.
Criterios de selección del tratamiento tópico en la psoriasis en placas
| Relacionados con el tratamiento tópico | Relacionados con el paciente y la psoriasis | Relacionados con el sistema sanitario, su organización y el profesional de la salud |
|---|---|---|
| Evidencia disponible (eficacia y seguridad en la inducción y mantenimiento de la respuesta, eficacia comparativa directa e indirecta entre fármacos)PotenciaVelocidad de instauración del efectoVehículoTratamiento principal vs. coadyuvanteEstrategia de tratamiento: monoterapia vs. tratamiento combinado libre, estrategia proactiva vs. reactiva, uso en cura oclusiva, etc.Conveniencia | Tipo de psoriasisGravedad de la psoriasisImpacto de la psoriasis en calidad de vidaSíntomasComorbilidadesPreferencias del paciente | Experiencia del clínico con el uso de tratamientos tópicosDisposición de protocolos específicosFichas técnicas de los medicamentos |
El objetivo terapéutico es el mismo que el descrito para las terapias sistémicas5. El ideal es el blanqueamiento total de la piel, pero también se aceptan criterios clínicos adecuados como alcanzar un PASI 90, un PASI absoluto ≤ 3 o un PGA 0/1. Además de los criterios objetivos, es importante tener en cuenta la visión subjetiva del paciente en relación con sus preferencias y el impacto del tratamiento tópico en su calidad de vida.
Tratamiento tópico de inicio y de mantenimientoEn el tratamiento tópico no se definen líneas de tratamiento (a diferencia del tratamiento sistémico), pero si 2periodos distintos, uno de inducción y otro de mantenimiento.
El tratamiento tópico se pauta de forma continuada durante un periodo de tiempo corto pero flexible (generalmente entre 4-12 semanas), denominado de inducción, en el que se busca alcanzar el objetivo terapéutico. A partir de ahí, y con el fin de mantener el objetivo terapéutico, se pueden seguir distintas estrategias de tratamiento a largo plazo (más allá de la semana 12) como el cese del tratamiento tópico o las modificaciones en relación con la dosis y frecuencia de aplicación.
Evaluación de la respuesta al tratamiento tópicoLa evaluación de la respuesta se realiza de la misma forma que con las terapias sistémicas, tras el periodo de inducción y de forma regular durante el tratamiento de mantenimiento. El fracaso terapéutico al tratamiento tópico es criterio para el inicio de fototerapia o tratamiento sistémico, una vez explicada y consensuada con el paciente5.
En algunos casos individuales se podrá valorar una actitud distinta, por ejemplo, cambiar a otro tratamiento tópico antes de indicar la terapia sistémica.
Características de los tratamientos tópicos disponibles para la psoriasis en placas del cuerpoActualmente se dispone de una amplia gama de tratamientos tópicos, con diferentes mecanismos de acción y vehiculizados en distintos excipientes, que se pueden administrar en monoterapia, tratamiento combinado libre o fijo con otros compuestos tópicos, sistémicos o con fototerapia, en distintas estrategias de tratamiento.
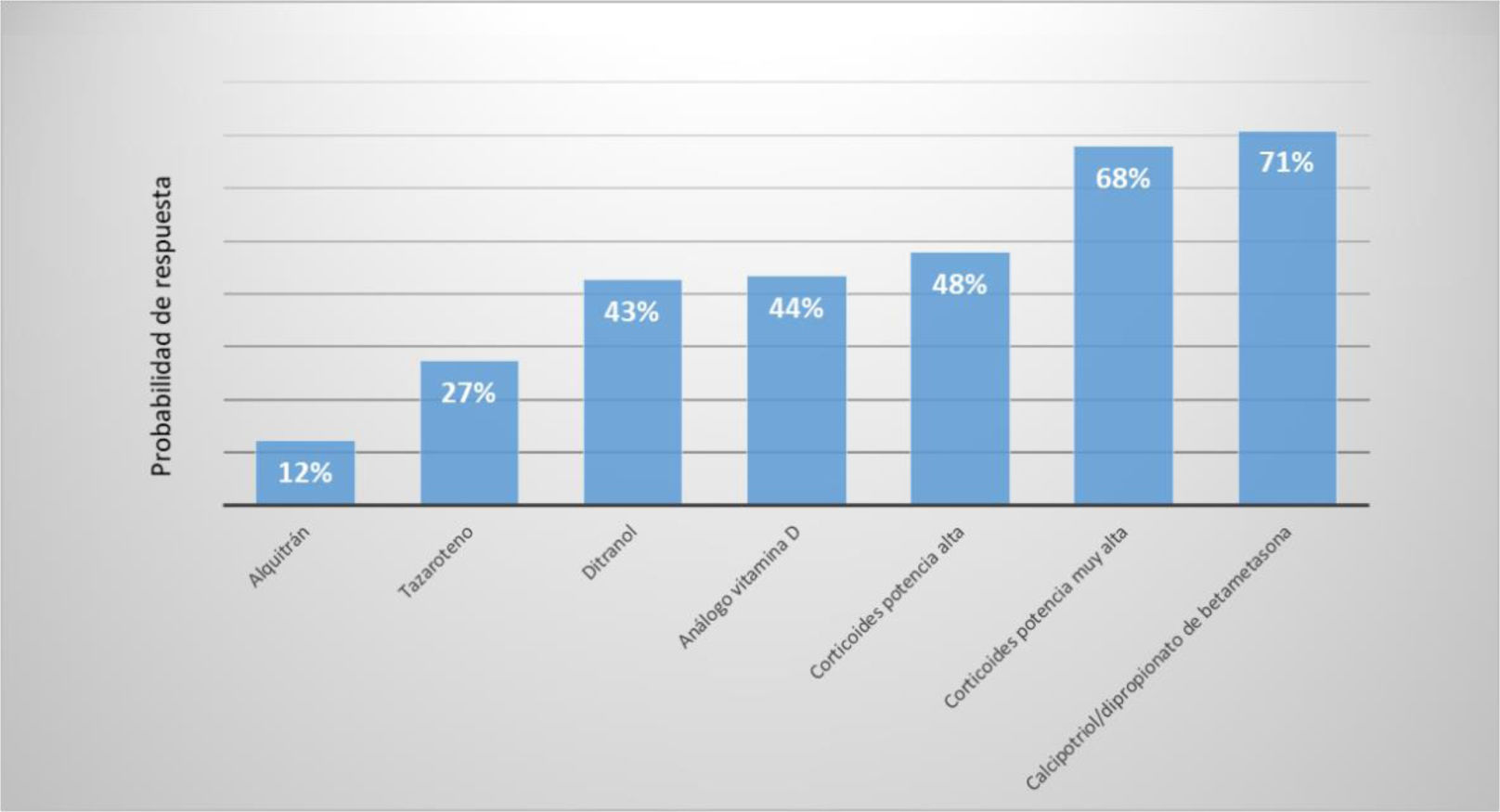
Sin embargo, la evidencia disponible sobre la eficacia y seguridad de estos compuestos es, en muchos casos, de baja calidad. Aunque se dispone de algunos estudios head-to-head14, las comparaciones entre grupos son inconsistentes. Los resultados de metaanálisis en red (que incluyen análisis indirectos)15 y la experiencia clínica demuestran que existen diferencias entre los tratamientos tópicos con relación a su eficacia, siendo los corticoides de potencia muy alta y la combinación fija calcipotriol/dipropionato de betametasona, los más eficaces (fig. 1).
Eficacia comparativa indirecta de los tratamientos tópicos en la psoriasis en placas aplicados una vez al día según evaluación del investigador.
Adaptado y actualizado de Samarasekera et al.15.
El perfil de seguridad de los tratamientos tópicos es bien conocido. Producen pocos acontecimientos adversos que generalmente son de carácter leve y transitorio. El riesgo de acontecimientos adversos disminuye con el seguimiento de las recomendaciones de la ficha técnica y del médico prescriptor, así como con un buen entrenamiento del paciente.
Se describen a continuación las principales características y guía de uso de los tratamientos tópicos (tablas 2 a 5).
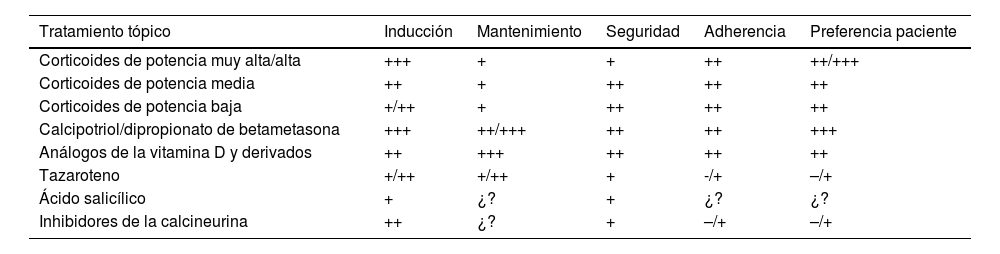
Características principales de los tratamientos tópicos de la psoriasis en placas del cuerpo (no incluye localizaciones especiales ni formas de psoriasis grave)
| Tratamiento tópico | Inducción | Mantenimiento | Seguridad | Adherencia | Preferencia paciente |
|---|---|---|---|---|---|
| Corticoides de potencia muy alta/alta | +++ | + | + | ++ | ++/+++ |
| Corticoides de potencia media | ++ | + | ++ | ++ | ++ |
| Corticoides de potencia baja | +/++ | + | ++ | ++ | ++ |
| Calcipotriol/dipropionato de betametasona | +++ | ++/+++ | ++ | ++ | +++ |
| Análogos de la vitamina D y derivados | ++ | +++ | ++ | ++ | ++ |
| Tazaroteno | +/++ | +/++ | + | -/+ | –/+ |
| Ácido salicílico | + | ¿? | + | ¿? | ¿? |
| Inhibidores de la calcineurina | ++ | ¿? | + | –/+ | –/+ |
Tabla de elaboración propia basada en los datos encontrados en la evidencia analizada (incluyendo comparaciones indirectas) y en la experiencia de los expertos.
+++: muy (eficaz, seguro, adherencia, preferido por el paciente); ++: bastante (eficaz, seguro, adherencia, preferido por el paciente); +: algo (eficaz, seguro, adherencia, preferido por el paciente); –/+: dudoso (eficaz, seguro, adherencia, preferido por el paciente); –: no (eficaz, seguro, adherencia, preferido por el paciente); ¿?: desconocido.
Fuente: Mason et al. y Samarasekera et al.15.
Características y uso de los corticoides tópicos en la psoriasis en placas del cuerpo
| 1 | Características |
|---|---|
| Indicados en inducción según ficha técnica | |
| Potencia muy alta, alta, moderada, baja | |
| Efecto rápido, especialmente corticoides de potencia muy alta/alta | |
| Mayor magnitud del efecto a mayor potencia | |
| Acontecimientos adversos frecuentes, pero en general no graves | |
| Acontecimientos adversos más frecuentes locales como estrías, atrofia cutánea, telangiectasias | |
| Acontecimientos adversos sistémicos excepcionales (p. ej., supresión del eje hipotálamo-hipofisario, diabetes mellitus, glaucoma, necrosis avascular) | |
| Posibilidad de taquifilaxia | |
| Posible efecto rebote en casos de interrupción brusca | |
| Mayor riesgo de acontecimientos adversos a mayor potencia y duración del tratamiento | |
| 2 | En general se prefiere: |
| De potencia muy alta/alta | |
| Uso una vez al día | |
| Uso en monoterapia vs. combinación libre | |
| Uso en combinación fija vs. combinación libre | |
| No sobrepasar los 50g semanales de corticoide tópico de potencia muy alta, ni más de 100g semanales en los de potencia alta | |
| Uso de estrategias en el mantenimiento encaminadas a minimizar la aparición de acontecimientos adversos y evitar taquifilaxia | |
| Pero cada caso deberá individualizarse: | |
| Por ejemplo, uso de corticoides de menor potencia en aquellos contextos donde la absorción esté incrementada (lesiones extensas, pliegues, etc.) | |
| Tener siempre en cuenta las preferencias del paciente |
g: gramos.
Características y uso de los análogos de la vitamina D en la psoriasis en placas del cuerpo
| 1 | Características: |
| Indicados en inducción según ficha técnica | |
| Efecto más lento que los corticoides | |
| Magnitud del efecto bastante similar a los corticoides potentes | |
| Acontecimientos adversos frecuentes, pero en general no graves | |
| Acontecimientos adversos más frecuentes locales, sobre todo irritación | |
| Ausencia de taquifilaxia | |
| No efecto rebote en casos de interrupción brusca | |
| 2 | En general se prefiere: |
| Uso 2veces al día | |
| Uso en combinación fija vs. combinación libre | |
| No sobrepasar los 100g semanales de calcipotriol, 210g con calcitriol | |
| Usar con precaución en situaciones donde la absorción esté incrementada (lesiones extensas, pliegues, etc.) | |
| Individualizar cada caso teniendo siempre en cuenta las preferencias del paciente |
g: gramos.
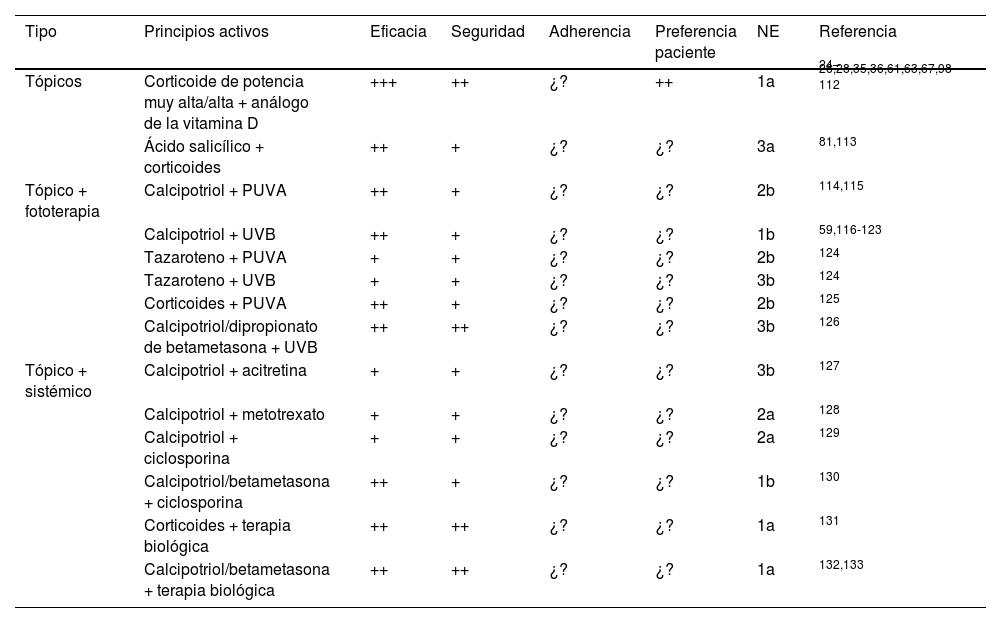
Eficacia y seguridad de los tratamientos tópicos en combinación libre, con fototerapia y con tratamientos sistémicos en la psoriasis
| Tipo | Principios activos | Eficacia | Seguridad | Adherencia | Preferencia paciente | NE | Referencia |
|---|---|---|---|---|---|---|---|
| Tópicos | Corticoide de potencia muy alta/alta + análogo de la vitamina D | +++ | ++ | ¿? | ++ | 1a | 24–26,28,35,36,61,63,67,98-112 |
| Ácido salicílico + corticoides | ++ | + | ¿? | ¿? | 3a | 81,113 | |
| Tópico + fototerapia | Calcipotriol + PUVA | ++ | + | ¿? | ¿? | 2b | 114,115 |
| Calcipotriol + UVB | ++ | + | ¿? | ¿? | 1b | 59,116-123 | |
| Tazaroteno + PUVA | + | + | ¿? | ¿? | 2b | 124 | |
| Tazaroteno + UVB | + | + | ¿? | ¿? | 3b | 124 | |
| Corticoides + PUVA | ++ | + | ¿? | ¿? | 2b | 125 | |
| Calcipotriol/dipropionato de betametasona + UVB | ++ | ++ | ¿? | ¿? | 3b | 126 | |
| Tópico + sistémico | Calcipotriol + acitretina | + | + | ¿? | ¿? | 3b | 127 |
| Calcipotriol + metotrexato | + | + | ¿? | ¿? | 2a | 128 | |
| Calcipotriol + ciclosporina | + | + | ¿? | ¿? | 2a | 129 | |
| Calcipotriol/betametasona + ciclosporina | ++ | + | ¿? | ¿? | 1b | 130 | |
| Corticoides + terapia biológica | ++ | ++ | ¿? | ¿? | 1a | 131 | |
| Calcipotriol/betametasona + terapia biológica | ++ | ++ | ¿? | ¿? | 1a | 132,133 |
NE: nivel de evidencia; PUVA: psoralenos con radiación ultravioleta A; UVB: radiación ultravioleta B; +++: muy (eficaz, seguro, adherencia, preferido por el paciente); ++: bastante (eficaz, seguro, adherencia, preferido por el paciente); +: algo (eficaz, seguro, adherencia, preferido por el paciente); –/+: dudoso (eficaz, seguro, adherencia, preferido por el paciente); –: no (eficaz, seguro, adherencia, preferido por el paciente); ¿?: desconocido.
Los corticoides tópicos se clasifican en potencia muy alta, alta, moderada y baja, según la magnitud de efecto16 y se comercializan en múltiples vehículos. Tienen indicación en ficha técnica para el tratamiento de inducción, pero no para el de mantenimiento. Para el mantenimiento, las recomendaciones de las fichas técnicas varían de un medicamento a otro. Generalmente están enfocadas al uso de dosis menores o menor tiempo posible y siempre bajo evaluación médica.
La evidencia proveniente de ECA de calidad heterogénea, así como de RSL y metaanálisis, muestra que son terapias muy eficaces en la inducción tanto en monoterapia como en combinación libre o fija con otros tratamientos tópicos o terapia sistémica, en la psoriasis en placas del cuerpo independientemente de su gravedad, con un buen perfil de seguridad (tablas 2 y 3)3,14,15,17,18.
El efecto aparece rápidamente y alcanza su máximo a las 2-4 semanas3,14,15,17,18. A mayor potencia del corticoide, mayor magnitud y duración del efecto, pero mayor riesgo de acontecimientos adversos14,18. A las 2 semanas de tratamiento la tasa de respuesta en variables objetivas es del 58-92% para corticoides de potencia muy alta/alta14,18-21; del 70-83% para los de potencia moderada22,23 y del 60-70% para los de potencia baja23. Son eficaces con una24-26 y 2aplicaciones al día19,27-32 y, aunque es algo superior con esta última pauta, tal como indican la mayoría de las fichas técnicas, la diferencia no es clínicamente relevante, especialmente en el caso de corticoides de potencia muy alta/alta4,15.
Con relación al tratamiento de mantenimiento, aunque no está indicado en ficha técnica, el efecto beneficioso de los corticoides tópicos puede prolongarse en el tiempo, especialmente con los de potencia muy alta/alta33-36. Sin embargo, su uso prolongado se asocia a mayor riesgo de acontecimientos adversos y a la aparición de taquifilaxia2,4.
En cuanto a la seguridad, los acontecimientos adversos en general son leves especialmente si se siguen las indicaciones de ficha técnica sobre la gestión del riesgo14. Los más frecuentes, de presentación local, son: la atrofia cutánea, las estrías, la foliculitis, las telangiectasias y la púrpura37,38. La interrupción brusca de su aplicación podría tener un efecto rebote, aunque este fenómeno no está bien caracterizado. Los acontecimientos adversos por absorción sistémica son excepcionales37-42. El riesgo de acontecimientos adversos aumenta: en tratamientos continuados, a mayor cantidad de superficie corporal tratada (BSA ≥ 20%), en aplicaciones oclusivas, en poblaciones especiales como niños y ancianos, en presencia de comorbilidad grave, como insuficiencia renal o hepática; y en ciertas localizaciones como la cara y los pliegues4. En todas estas circunstancias, se recomienda realizar un seguimiento estrecho del paciente.
Combinación fija de calcipotriol/dipropionato de betametasonaLa combinación fija de calcipotriol/dipropionato de betametasona está aprobada para su uso en la inducción y está disponible en crema, pomada, gel y espuma. Además, la espuma tiene indicación en ficha técnica como estrategia de mantenimiento proactiva43,44. Su eficacia y seguridad se ha evaluado en pacientes con psoriasis en placas en múltiples ECA de calidad, tanto en inducción como en mantenimiento, independientemente de la gravedad y la edad del paciente45-48. Presenta un efecto rápido con una reducción media del PASI del 65-74% a las 4 semanas y una eficacia superior a la monoterapia. La aplicación 2veces al día no consigue mayor eficacia que la de una vez al día35.
Los resultados de un ECA comparando la combinación fija en espuma frente a su vehículo mostraron una tasa de éxito terapéutico del 53,3 vs. 4,8% (p < 0,001), con puntuación mPASI final de 2 vs. 5,5 (p < 0,001) tras 4 semanas de tratamiento. El 83,5% de los pacientes refirieron una rápida y significativa disminución del prurito45 y mejoría de la calidad de vida46. La espuma es superior al gel47, con una tasa de éxito terapéutico (PGA 0/1) de 44,1% vs. 34,3%, respectivamente, a la semana 12 de tratamiento46. El subanálisis de pacientes con psoriasis moderada-grave demostró mayor frecuencia de respuesta mPASI75 con la espuma que con el gel (57,1 vs. 35,4%; p = 0,006) en la semana 12. La tasa de éxito terapéutico fue numéricamente mayor con la espuma desde la semana 4 hasta la 1247.
Datos agregados de 2ECA49,50 han mostrado diferencias significativamente superiores de la crema frente al gel, en distintas variables de resultado como la tasa de éxito terapéutico, el mPASI (−64,6% vs. −56,4%; p < 0,001), el mPASI75 y en la mejoría del DLQI (6,5 vs. 5,6; p < 0,001)49,50.
Además la espuma presenta una gran aceptabilidad, satisfacción y conveniencia por parte de los pacientes46, siendo una de las formulaciones que mayor grado de satisfacción ha mostrado46,47,49-56.
En cuanto a la seguridad de la combinación fija de calcipotriol/dipropionato de betametasona, los acontecimientos adversos son poco frecuentes y generalmente leves, siendo los más habituales la irritación y el prurito35.
Análogos de la vitamina DEn España están comercializados el calcitriol, calcipotriol y tacalcitol con distintos vehículos. En ficha técnica tienen indicación como tratamiento de inducción, pero no como tratamiento de mantenimiento.
La eficacia y seguridad de los análogos de la vitamina D, en el tratamiento de la psoriasis en placas, ha sido estudiada en distintas RSL y metaanálisis, y ECA (tablas 2 y 4)18,57,58.
Estos compuestos han demostrado eficacia tras 4-8 semanas de tratamiento, especialmente en psoriasis leve o moderada, aunque también en psoriasis graves, con mejoría significativa de síntomas y signos, PASI, Total Severity Score (TSS), Patient assessment of global improvement (PAGI) y satisfacción del paciente18,57,58. La respuesta clínica es algo más lenta que con corticoides tópicos, pero la magnitud del efecto parece similar a la de los corticoides potentes18. Aunque se precisan más estudios comparativos de calidad, calcipotriol podría ser más eficaz que calcitriol58-60.
La administración una24,61,62 y 2veces al día28,30,62-66 ha demostrado eficacia. Por otro lado, la formulación 2veces al día se ha mostrado superior en un ECA67, tal y como se refleja en ficha técnica.
Con relación al tratamiento de mantenimiento, aunque no disponen de indicación, estos compuestos han demostrado mayor efecto que los corticoides tópicos. En un ECA de calcitriol vs. betametasona aplicados 2veces al día, se observó una reducción media del PASI similar en ambos grupos tras 6 semanas de tratamiento, aunque la tasa de mantenimiento de la remisión fue significativamente superior con el calcitriol (48% vs. 25%; p < 0,01)30. Los resultados de una RSL y datos de práctica diaria han demostrado la eficacia y seguridad de calcipotriol tópico hasta 52 semanas en estrategia reactiva o hasta 20 semanas en estrategia proactiva57. Su uso intermitente junto con corticoides tópicos también ha mostrado eficacia en el mantenimiento34-36.
Los análogos de la vitamina D tópicos son fármacos seguros14. El acontecimiento adverso más frecuente es la irritación lesional y perilesional, descrita hasta en un 35% de los casos. Es más frecuente con calcipotriol que con calcitriol4 y se puede reducir disminuyendo la frecuencia de aplicación o asociando corticoides tópicos. Los acontecimientos adversos tienden a remitir durante el tratamiento de mantenimiento57,64,68 y los de carácter sistémico son muy infrecuentes14.
El riesgo de acontecimientos adversos aumenta con mayor cantidad de superficie corporal tratada (BSA ≥ 30%), en poblaciones especiales (p. ej., ancianos y niños), en presencia de comorbilidad grave (p. ej., insuficiencia renal o alteraciones del metabolismo del calcio) y en la psoriasis pustulosa y eritrodérmica. En estos contextos se recomienda una monitorización más estrecha del paciente y el ajuste de dosis en caso necesario. En relación con el embarazo los análogos de la vitamina D no deben utilizarse durante el embarazo a menos que sean claramente necesario.
TazarotenoEs un retinoide que puede usarse en monoterapia o en combinación con corticoides tópicos para incrementar su eficacia y mejorar la tolerancia.
Los estudios sobre tazaroteno tópico se han desarrollado fundamentalmente en la psoriasis leve o moderada y en tratamiento de combinación en la psoriasis moderada-grave69-71, con distintos vehículos, a concentraciones del 0,05 y el 1%, una vez al día y, en algún estudio aislado, 2veces al día72 (tabla 2).
El uso de tazaroteno durante 6-12 semanas (en la psoriasis ungueal hasta las 24 semanas73) ha demostrado eficacia sobre los síntomas y signos de la psoriasis, así como en el BSA, el PGA, la satisfacción o aceptabilidad del paciente. La instauración del efecto es rápida, aunque algo más lenta que la de los corticoides tópicos74. A falta de estudios comparativos robustos, su eficacia parece ser inferior a otros tratamientos tópicos (fig. 1)75-77. No se dispone de datos consistentes sobre el tratamiento de mantenimiento, aunque podría ser eficaz69.
La dosis máxima recomendada es de 100 g por semana, en una aplicación al día, y en combinación con corticoides.
El tazaroteno es un compuesto seguro, con una absorción sistémica mínima. Los acontecimientos adversos más frecuentes son la irritación local lesional y perilesional que aumentan a mayor concentración del compuesto78. Algunas estrategias para reducir el riesgo de acontecimientos adversos son el uso de formulación en crema, el uso de una concentración menor, la aplicación intermitente con humectantes en contacto corto (de 30 a 60 min) o la combinación con corticoides tópicos2,78,79. No se han demostrado efectos mutagénicos ni cardiogénicos80. Sin embargo, al ser un retinoide, su uso está contraindicado en el embarazo.
SalicilatosLa eficacia y la seguridad de los salicilatos tópicos a distintas concentraciones se ha evaluado en la psoriasis leve o moderada y también en la psoriasis moderada-grave, especialmente en combinación con corticoides tópicos (tabla 2)81.
El tratamiento con ácido salicílico (desde 2 a 12 semanas) ha demostrado eficacia (mejoría de síntomas y signos, PASI, PGA y aceptación del paciente) en múltiples ECA, tanto en monoterapia como en combinación con otros tratamientos tópicos81-86. En este sentido, se ha observado que la eficacia de la combinación de salicilatos y corticoides tópicos es superior a la de los corticoides tópicos en monoterapia81,86,87, probablemente debido a que el ácido salicílico favorece la penetración del corticoide en la piel.
Se ha demostrado eficacia con la administración de salicilatos una vez85,88,89 y 2veces al día81,82,86,87, así como con distintos vehículos. Los datos comparativos (fuera de las combinaciones) con otros tratamientos tópicos son escasos y no se dispone de información para el tratamiento de mantenimiento.
El acontecimiento adverso más frecuente es la irritación local (sensación de quemazón y prurito) y no se han descrito acontecimientos adversos sistémicos de gravedad. La absorción sistémica es mayor en pacientes con enfermedad renal o hepática, y cuando se aplica en una superficie corporal mayor (BSA > 20%); por lo tanto, debe utilizarse con precaución en estos grupos de pacientes81,84,87,90. Por último, el ácido salicílico tópico no debe emplearse antes de la fototerapia UVB porque puede reducir su eficacia91.
Inhibidores de la calcineurinaEl tacrolimús (TAS) y el pimecrolimús tópicos no tienen indicación en ficha técnica para el tratamiento de la psoriasis en placas.
Su tamaño molecular y escasa capacidad de penetración en la piel limitan su eficacia en la psoriasis del tronco y las extremidades por lo que generalmente se emplean en zonas de piel más fina (cara y pliegues) y como ahorradores de corticoides.
En localizaciones especiales han demostrado eficacia a distintas concentraciones (TAS 0,1% y 0,03%, pimecrolimús 1%) durante 4-12 semanas, en aplicaciones una92,93 y 2veces al día82,93-96, con el uso de distintos vehículos. La instauración del efecto es rápida. Sin embargo, fuera de las localizaciones especiales no se han observado diferencias significativas entre el TAS tópico y el placebo a las 6 semanas de tratamiento93.
No se dispone de datos robustos sobre su eficacia en el tratamiento de mantenimiento.
Los datos de seguridad proceden fundamentalmente de estudios en pacientes con dermatitis atópica97. Los acontecimientos adversos más frecuentes son el ardor y prurito, que pueden mejorar con el uso continuo y evitando su aplicación sobre la piel húmeda.
Selección y estrategias de tratamiento tópicoA la hora de seleccionar el tratamiento tópico se debe decidir: 1) principio activo a utilizar; 2) tratamiento de inducción (primeras 4-2 semanas): monoterapia o terapia combinada libre o fija, técnica de aplicación (cura abierta o cura oclusiva), número de aplicaciones diarias, y tipo de vehículo, y 3) estrategia durante el mantenimiento (proactiva o reactiva).
El GPS recomienda seguir los criterios definidos previamente y tener siempre en cuenta las preferencias del paciente, ya que su implicación en la toma de decisiones compartidas es fundamental para conseguir una buena adherencia.
Con base en la evidencia publicada (perfil riesgo-beneficio, y aceptación del paciente), y en ausencia de contraindicaciones, el GPS recomienda priorizar el uso de un corticoide tópico de potencia muy alta/alta y la combinación fija calcipotriol/dipropionato de betametasona, excepto en localizaciones y tipos especiales de psoriasis (véanse los apartados correspondientes). Esta decisión deberá individualizarse en cada paciente.
El beneficio «extra» de la aplicación 2veces al día no es clínicamente relevante para la mayoría de los tratamientos y puede afectar negativamente a la adherencia o a la seguridad, por lo que se prefiere la pauta de una vez al día.
A continuación, describimos los aspectos más relevantes (consultar también tablas previas).
Tratamiento tópico combinado libre vs. monoterapiaEn monoterapia se utiliza un único principio activo, en combinación fija 2principios activos en una sola aplicación y en combinación libre 2o más principios activos administrados por separado (p. ej., de forma alterna).
- –
Debido a los problemas de adherencia asociados a la terapia combinada libre, el GPS prefiere el uso de monoterapia o de terapia combinada fija, especialmente en las formas leves de psoriasis.
- –
A mayor gravedad de la psoriasis se valorará el uso de tratamiento tópico buscando la mayor eficacia posible (p. ej., el uso de corticoides de potencia muy alta, la combinación fija calcipotriol/dipropionato de betametasona, etc.).
- –
En casos más graves, y siempre de forma consensuada con el paciente, se valorará el uso de terapia combinada libre.
- –
En pacientes con fracaso terapéutico tras tratamiento tópico de inducción en monoterapia o en combinación fija, en los que todavía no se contempla la terapia sistémica, se valorará preferiblemente la combinación libre con otro tratamiento tópico. No obstante, siempre se individualizarán otras opciones como: la monoterapia 2veces al día (si se utilizaba solo una vez), el aumento de la potencia del corticoide (si se utilizaba alguno de potencia más baja) o el cambio a otro tratamiento en monoterapia con distinto mecanismo de acción.
Las combinaciones libres han sido ampliamente utilizadas en la práctica clínica, aunque actualmente han sido sustituidas por la combinación fija, especialmente en los casos de combinación de corticoides y análogos de la vitamina D (tabla 5).
La combinación libre de corticoides tópicos y análogos de la vitamina D se ha empleado en pacientes con psoriasis de distinta gravedad y localización (tabla 5). Se han combinado corticoides de distinta potencia (generalmente muy alta/alta) como el dipropionato de betametasona con calcipotriol como análogo de la vitamina D. Los resultados de RSL de calidad y ECA individuales14,18,43,47,51-57,134-136 han demostrado su eficacia, tanto en la inducción como en el mantenimiento, con un efecto superior de la combinación libre de corticoides de potencia muy alta con análogos de la vitamina D frente a la monoterapia67. El efecto se instaura de forma rápida, incluso durante las 2 primeras semanas en los casos más graves, y se mantiene a largo plazo57,137,138. En cuanto a la seguridad, los acontecimientos adversos no son muy frecuentes, la mayoría son leves-moderados57,139 siendo la irritación cutánea lesional y perilesional el más común.
La eficacia de la combinación libre de corticoides tópicos y salicilatos (tabla 5) ha sido analizada en múltiples estudios, incluyendo una RSL140, aunque la mayoría son de baja calidad81,86,87,90,141. Su uso se basa en el aumento de la penetración de los corticoides tópicos en presencia de ácido salicílico142. El empleo de esta combinación durante 3-15 semanas ha demostrado eficacia (síntomas y signos, PGA, PASI o calidad de vida) en pacientes con psoriasis de distinta gravedad y localización con una instauración de efecto rápida y en general superior, a la de sus componentes en monoterapia140,143. No se dispone de datos sobre el mantenimiento excepto en la psoriasis ungueal (véase el capítulo correspondiente). Los datos de seguridad son los esperables con el uso de estas terapias tópicas.
Por otro lado, recientemente se ha publicado un estudio observacional prospectivo de 12 semanas de duración en el que el uso de la combinación fija de calcipotriol/dipropionato de betametasona en espuma y fototerapia (UVB) fue significativamente superior a la fototerapia en monoterapia (aclaramiento de la piel, PASI o picor) y consiguió reducir el número y la dosis acumulada de la fototerapia126 (consultar la tabla 5).
La calidad de la evidencia sobre eficacia y seguridad de otras combinaciones libres de tratamientos tópicos es baja y, además, no suelen utilizarse en la práctica clínica. Incluyen la combinación libre de corticoides tópicos con tazaroteno69,74,77,144-148, e inhibidores de la calcineurina149, análogos de la vitamina D con tazaroteno150, e inhibidores de la calcineurina151,152, y salicilatos con inhibidores de la calcineurina82 (tabla 5).
Tratamiento tópico proactivo vs. reactivo en el mantenimiento- –
El objetivo del tratamiento de mantenimiento es conservar el objetivo terapéutico hasta la suspensión (idealmente) del tratamiento tópico.
- –
El tratamiento de mantenimiento debe de ser flexible (intensificación y desintensificación) y adaptarse a las características del paciente, la psoriasis y los tratamientos utilizados.
- –
El uso de una estrategia proactiva o reactiva debe decidirse de forma individual y consensuada con el paciente.
- –
Si con el tratamiento de inducción el paciente mejora, pero no consigue el objetivo terapéutico, este se prolongará 4-8 semanas más y, en los casos sin respuesta, se valorará el tratamiento sistémico o la fototerapia.
- –
Si con el tratamiento de inducción se consigue el objetivo terapéutico con el aclaramiento completo de la piel, se valorarán distintas estrategias de mantenimiento como la suspensión del tratamiento tópico, la disminución gradual (p. ej., cada 2 días, después 2 veces por semana), el cambio a corticoide de menor potencia o a un análogo de la vitamina D, con posterior suspensión.
- –
Si con el tratamiento de inducción se consigue el objetivo terapéutico, pero no el aclaramiento completo de la piel, se valorará el empleo de una estrategia de mantenimiento más conservadora.
- –
Si con el tratamiento de mantenimiento se pierde el objetivo terapéutico, se planteará su intensificación o la vuelta al tratamiento tópico original durante 4-8 semanas con valoración posterior del mantenimiento.
Muchos pacientes con psoriasis alcanzan el objetivo terapéutico con ciclos cortos de tratamiento (8-12 semanas y, en algunos casos, incluso en 4 semanas), aunque otros precisarán más tiempo. En cualquier caso, en el tratamiento a largo plazo siempre hay que considerar la posibilidad de brotes o fases de empeoramiento. Una RSL con metaanálisis de calidad ha puesto de manifiesto que, tras la suspensión del tratamiento tópico, el riesgo de rebrote es del 20%-80% a las 4-8 semanas, pudiendo aumentar hasta el 88% a los 6 meses15. Por consiguiente, es importante mantener el objetivo terapéutico, una vez alcanzado, para prevenir la aparición de nuevos brotes.
En la selección del tratamiento de mantenimiento hay que tener en cuenta el perfil riesgo/beneficio del tratamiento tópico, las preferencias del paciente y la adherencia. Además, debe utilizarse una terapia flexible que permita la intensificación o desintensificación y ayude a minimizar la necesidad de tratamiento sistémico153,154.
Las estrategias de mantenimiento se clasifican en proactivas o reactivas. La estrategia proactiva, preventiva o intermitente, consiste en mantener el tratamiento de las áreas previamente afectadas 1 o 2 veces por semana para prevenir brotes. La reactiva se basa en la suspensión o desintensificación progresiva del tratamiento tópico hasta su suspensión (p. ej., la reducción de dosis o frecuencia, el uso de un corticoide de potencia más baja o de un análogo de la vitamina D en monoterapia), con uso posterior (a demanda) en caso de brote o empeoramiento.
Aunque no existe evidencia sobre estrategias proactivas para todos los tratamientos tópicos, los expertos consideran que pueden utilizarse con cualquiera de ellos2. Del mismo modo, no existe evidencia robusta sobre la superioridad de una estrategia concreta sobre otra.
Los resultados de distintos ECA han mostrado que el efecto beneficioso de los corticoides tópicos durante la inducción se puede prolongar con estrategias proactivas (intermitentes) o reactivas (a demanda), especialmente con los de potencia muy alta/alta, con o sin otros tratamientos tópicos asociados33,155,156.
Datos de estudios de calidad señalan que el calcipotriol tópico en monoterapia es eficaz y seguro hasta 52 semanas, en estrategia reactiva, o hasta 20 semanas en régimen proactivo57. En tratamientos reactivos a un año, el perfil de eficacia y seguridad de la combinación fija calcipotriol/dipropionato de betametasona es mejor que el de calcipotriol en monoterapia57.
Es importante destacar un ECA en el que tras 8 semanas de tratamiento de inducción con la combinación fija calcipotriol/dipropionato de betametasona en gel una vez al día, los pacientes respondedores (aclaramiento total o casi) fueron aleatorizados a 8 semanas de tratamiento de mantenimiento con alguna de las siguientes estrategias: reactiva a demanda una vez al día; proactiva (dosis fija) una vez al día; proactiva (intermitente) 2veces por semana157. La tasa de respuesta fue del 69,9% con la estrategia a demanda o reactiva y del 67,5% con la estrategia proactiva a dosis fija, significativamente superiores al 31,4% con la proactiva intermitente (p < 0,050 en ambos casos). En este ECA no hubo diferencias en la seguridad entre las distintas estrategias157.
Recientemente se han publicado los resultados de un ECA de calidad diseñado para evaluar el mantenimiento a 52 semanas con una combinación fija de calcipotriol/dipropionato de betametasona en espuma, siguiendo 2estrategias (proactiva y reactiva)43. En una fase abierta anterior se seleccionaron pacientes con respuesta (aclaramiento total o casi) a esta terapia una vez al día durante 4 semanas44 que se aleatorizaron a estrategia de mantenimiento proactiva (intermitente, combinación 2veces por semana), o reactiva (uso del vehículo 2 veces por semana y combinación una vez al día si brote). Los pacientes del grupo proactivo presentaron mayor duración de la remisión (41 días más) que los del reactivo (p < 0,001) con menor número de brotes (3,1 vs. 4,8, respectivamente)43.
La combinación fija calcipotriol/dipropionato de betametasona ha demostrado eficacia en la psoriasis de cuero cabelludo, tanto en estrategia proactiva como reactiva, aunque con mejores resultados para la primera158.
En un estudio de intervención de un programa de mejora de la adherencia y optimización del tratamiento tópico en la psoriasis (topical treatment optimization treatment [TTPO]) participaron 1.800 pacientes con psoriasis leve-moderada que recibieron la combinación fija de calcipotriol/dipropionato de betametasona en gel una vez al día durante 8 semanas, seguidas de otras 56 semanas con una estrategia reactiva (a demanda). Se aleatorizó a los pacientes a un programa específico para mejorar la adherencia o al seguimiento habitual. A las 8 semanas de tratamiento la tasa de respuesta (aclaramiento total o casi según PGA) fue significativamente superior en el grupo TTPO (36,3% vs. 31,3%; p = 0,026). Estas diferencias se mantuvieron de la semana 8 a la 64, sin que se observaran diferencias en otras variables de resultado como el BSA, la valoración del paciente, o el DLQI159.
Tratamiento tópico coadyuvante al tratamiento sistémico y a la fototerapia- –
Se recomienda valorar el uso de tratamiento tópico como coadyuvante en lesiones residuales sin respuesta completa al tratamiento sistémico o a la fototerapia, como ahorrador de tratamiento sistémico en pacientes con problemas de seguridad o para optimización de costes.
- –
Los criterios de selección y la estrategia de tratamiento son los mismos que los previamente comentados para los otros escenarios.
El uso de tratamientos tópicos como coadyuvante de fármacos sistémicos biológicos, no biológicos y fototerapia, puede mejorar la eficacia, por ejemplo, en lesiones aisladas sin respuesta completa, pero también la seguridad y los costes, ya que, al actuar como ahorradores de tratamiento sistémico, disminuyen el riesgo de acontecimientos adversos y el coste del tratamiento (tabla 5).
Diferentes estudios han demostrado la eficacia del cuso de calcipotriol con psoralenos con radiación ultravioleta A (PUVA) o readición ultravioleta B (UVB)59,116-123,160,161. Se ha publicado que el tazaroteno tópico al 0,1% puede mejorar la eficacia de la fototerapia y disminuir la cantidad de radiación necesaria para lograr la mejoría clínica124. Por otro lado, asociar corticoides tópicos a la fototerapia (PUVA) también ha demostrado ser eficaz en pacientes con psoriasis palmo-plantar125.
En un ECA que incluyó a 135 pacientes con psoriasis grave se observó que la combinación de acitretina con pomada tópica de calcipotriol 2veces al día producía una tasa de aclaramiento significativamente mayor que la acitretina en monoterapia (67% vs. 41%; p = 0,006), sin diferencias de seguridad162.
En cuanto a tratamientos sistémicos clásicos, un ECA ha demostrado que, en pacientes tratados con metotrexato (MTX) a dosis estándar semanal, el uso coadyuvante de calcipotriol tópico en pomada 2veces al día disminuye las dosis de MTX necesarias para mantener la respuesta (de 9,9 a 6,5mg por semana; p = 0,002), y aumenta el tiempo hasta la aparición del brote128.
La combinación de calcipotriol con ciclosporina a dosis bajas ha sido empleada en diferentes estudios. Los resultados de un ECA sobre 69 pacientes con psoriasis grave demostraron que el uso de calcipotriol pomada como coadyuvante del tratamiento con ciclosporina a dosis de 2mg/kg/día producía una mayor tasa de aclaramiento total o PASI 90 que la ciclosporina en monoterapia (50% vs. 11,8%; p = 0,002), sin diferencias en seguridad129. En otro ECA abierto con pacientes con psoriasis moderada-grave, se observó que la asociación de ciclosporina 2mg/kg/día con la combinación fija calcipotriol/dipropionato de betametasona en pomada una vez al día, alcanzaba un PASI 75 significativamente mayor tras 8 semanas de tratamiento que la ciclosporina en dosis bajas en monoterapia (87% vs. 37%; p = 0,0001)130.
Con respecto al uso coadyuvante de tratamientos tópicos con terapias biológicas se dispone información de los anti-TNFα131,163-166 e ixekizumab167. Un ECA realizado sobre 600 pacientes con psoriasis, analizó el uso de etanercept (ETN) con o sin clobetasol tópico en espuma a demanda como tratamiento coadyuvante. A las 12 semanas de tratamiento, el porcentaje de pacientes con PASI 90 fue significativamente superior con la combinación que con ETN en monoterapia (29,7% vs. 19,4%; p = 0,009)131. Sin embargo, no se observaron diferencias significativas a las 24 semanas en la eficacia ni en la seguridad131. Estos resultados fueron muy similares a los descritos en otro ECA abierto en el que utilizó ETN con distintos tratamientos tópicos a demanda (hidrocortisona, valerato de betametasona, dipropionato de betametasona, clobetasol, calcitriol, o calcipotriol/dipropionato de betametasona)163,168.
Los resultados obtenidos con adalimumab (ADA) son muy similares a los de ETN. En un ECA el uso como tratamiento coadyuvante de la combinación fija de calcipotriol/betametasona una vez al día con ADA mostró una eficacia significativamente superior al ADA en monoterapia, pero solo durante las 4 primeras semanas de tratamiento132. Un subanálisis de este estudio demostró los mismos resultados en pacientes con psoriasis de cuero cabelludo, ungueal o palmo-plantar133.
Un estudio abierto en pacientes con psoriasis y respuesta no satisfactoria a ETN o ADA analizó el uso coadyuvante de la combinación fija de calcipotriol/dipropionato de betametasona en espuma165. Este se asoció a mejorías notables en el BSA o PGA así como en los costes al no cambiar a terapias biológicas más costosas165.
Por otro lado, en 25 pacientes con psoriasis residual tras 24 semanas de tratamiento con ixekizumab, el uso coadyuvante de la combinación fija de calcipotriol/dipropionato de betametasona en espuma, una vez al día durante 4 semanas y cada 2 días durante otras 8-12 semanas, produjo importantes mejorías en parámetros como el BSA o PGA167.
Cura abierta o tratamiento oclusivo- –
El tratamiento tópico en cura oclusiva se puede valorar, de forma individualizada, en placas bien definidas localizadas y en placas recalcitrantes, con mucha precaución y durante el menor tiempo posible debido al riesgo de acontecimientos adversos.
La cura oclusiva favorece la penetración del fármaco e incrementa su eficacia y rapidez de acción, pero también la frecuencia y gravedad de los acontecimientos adversos debido al aumento de la absorción sistémica. En general, se recomienda que el tiempo de oclusión no exceda las 12 h y su uso preferentemente por la noche. La oclusión se puede realizar con parches hidrocoloides, apósitos autoadhesivos, films de plástico, membranas trasparentes, etc., siendo muy importante la instrucción a los pacientes.
Esta técnica se ha utilizado en lesiones de psoriasis recalcitrantes y localizadas en cualquier parte del cuerpo169-171, incluyendo cuero cabelludo172, uñas73,173, palmas y plantas89,174,175 y en la psoriasis pustulosa localizada176.
Los corticoides tópicos (generalmente de potencia muy alta/alta) son los más utilizados en cura oclusiva169,177, durante periodos variables (de 11 días a 5 semanas)169,177.
En un ECA se comparó el uso del valerato de betametasona en cura oclusiva una vez al día versus pomada 2 veces al día durante 3-5 semanas en 231 pacientes con psoriasis leve-moderada. El aclaramiento de la piel, la PGA y la satisfacción del paciente fueron significativamente mejores con cura oclusiva, a las 3 y a las 5 semanas169, sin diferencias en la frecuencia de brotes a los 3 meses de la suspensión del tratamiento (13,6% en cura oclusiva y 10,4% en crema tópica). En otro ECA de no inferioridad en psoriasis leve-moderada se observó que la eficacia (PGA, calidad de vida) y seguridad del valerato de betametasona en cura oclusiva durante 4 semanas no fue inferior a la combinación fija de calcipotriol/dipropionato de betametasona en pomada170.
Se ha realizado un ECA abierto en 61 pacientes con psoriasis leve-moderada comparando la cura oclusiva, con parche hidrocoloide, de clobetasol loción una vez a la semana, frente a clobetasol tópico en pomada, 2veces al día durante 6 semanas171. La cura oclusiva produjo un efecto más rápido y consiguió el aclaramiento del 100% de los pacientes frente al 69% de los tratados con aplicación tópica (p = 0,005). El tiempo hasta la aparición de brote tras la suspensión del tratamiento también fue menor con el tratamiento oclusivo (25 vs. 40 días), aunque las diferencias no fueron estadísticamente significativas. Los acontecimientos adversos fueron poco frecuentes y leves, siendo la irritación cutánea la más frecuente171.
Se han comunicado, aunque de forma aislada, buenos resultados con el uso en cura oclusiva, de análogos de la vitamina D, inhibidores de la calcineurina, tazaroteno, combinaciones libres de corticoides y tazaroteno, de corticoides con TAS 0,1%, así como con la combinación fija de calcipotriol/dipropionato de betametasona en pomada73,149,172-174,178.
Utilidad e idoneidad del uso de tratamiento tópico en localizaciones especiales y tipos de psoriasis graveEl resumen de la evidencia y el posicionamiento del GPS sobre el uso de tratamiento tópico en localizaciones especiales y tipos de psoriasis grave se muestra en las tablas 6 y 7. A continuación lo describimos con más detalle.
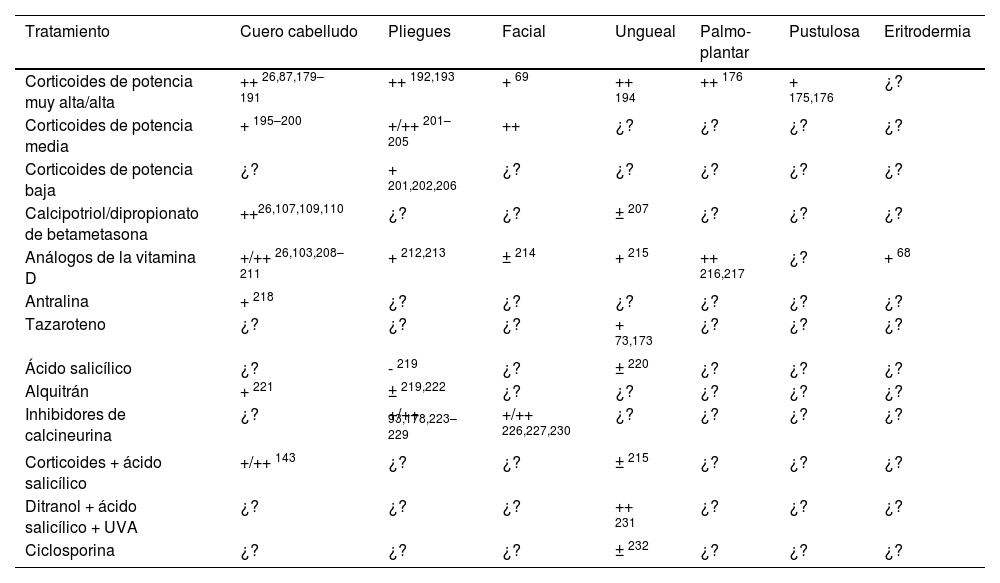
Eficacia de los tratamientos tópicos en localizaciones especiales y formas graves de psoriasis
| Tratamiento | Cuero cabelludo | Pliegues | Facial | Ungueal | Palmo-plantar | Pustulosa | Eritrodermia |
|---|---|---|---|---|---|---|---|
| Corticoides de potencia muy alta/alta | ++ 26,87,179–191 | ++ 192,193 | + 69 | ++ 194 | ++ 176 | + 175,176 | ¿? |
| Corticoides de potencia media | + 195–200 | +/++ 201–205 | ++ | ¿? | ¿? | ¿? | ¿? |
| Corticoides de potencia baja | ¿? | + 201,202,206 | ¿? | ¿? | ¿? | ¿? | ¿? |
| Calcipotriol/dipropionato de betametasona | ++26,107,109,110 | ¿? | ¿? | ± 207 | ¿? | ¿? | ¿? |
| Análogos de la vitamina D | +/++ 26,103,208–211 | + 212,213 | ± 214 | + 215 | ++ 216,217 | ¿? | + 68 |
| Antralina | + 218 | ¿? | ¿? | ¿? | ¿? | ¿? | ¿? |
| Tazaroteno | ¿? | ¿? | ¿? | + 73,173 | ¿? | ¿? | ¿? |
| Ácido salicílico | ¿? | - 219 | ¿? | ± 220 | ¿? | ¿? | ¿? |
| Alquitrán | + 221 | ± 219,222 | ¿? | ¿? | ¿? | ¿? | ¿? |
| Inhibidores de calcineurina | ¿? | +/++ 93,178,223–229 | +/++ 226,227,230 | ¿? | ¿? | ¿? | ¿? |
| Corticoides + ácido salicílico | +/++ 143 | ¿? | ¿? | ± 215 | ¿? | ¿? | ¿? |
| Ditranol + ácido salicílico + UVA | ¿? | ¿? | ¿? | ++ 231 | ¿? | ¿? | ¿? |
| Ciclosporina | ¿? | ¿? | ¿? | ± 232 | ¿? | ¿? | ¿? |
UVA: radiación ultravioleta A; +++: muy eficaz; ++: bastante eficaz; +: algo de eficaz; ±: dudosa eficacia; –: no es eficaz; ¿?: eficacia desconocida.
Selección del tratamiento (recomendado y alternativo) en localizaciones especiales y formas graves de psoriasis
| Localización o tipo psoriasis | Tratamiento tópico recomendado y alternativa (tras línea de puntos) | Tiempo esperado de aparición de respuesta |
|---|---|---|
| Cuero cabelludo | Corticoides de potencia muy alta/altaCalcipotriol/dipropionato de betametasonaCombinación libre de corticoides y ácido salílicoAnálogos de la vitamina D | 4 semanas |
| Pliegues | Corticoides de potencia media/bajaInhibidores de la calcineurina | 2 semanas |
| Cara | Corticoides de potencia media/bajaInhibidores de la calcineurina | 2 semanas |
| Ungueal | Corticoides de potencia muy alta/altaCalcipotriol/dipropionato de betametasonaInhibidores de la calcineurina o tazaroteno | 4 semanas |
| Palmo-plantar | Corticoides de potencia muy alta/altaCalcipotriol/dipropionato de betametasonaAnálogos de la vitamina D | 4 semanas |
| Eritrodérmica | Corticoides de potencia muy alta/alta | 4 semanas |
| Pustulosa localizada | Corticoides de potencia muy alta/alta | 4 semanas |
- –
La psoriasis del cuero cabelludo puede ser difícil de tratar. El GPS recomienda usar corticoides tópicos de potencia muy alta/alta o la combinación fija de calcipotriol/dipropionato de betametasona. Otras alternativas pueden ser la combinación libre de corticoides y ácido salicílico o los análogos de la vitamina D.
Los estudios de eficacia de los tratamientos tópicos en la psoriasis del cuero cabelludo, incluidas las combinaciones, han producido resultados variables3,15,17 (tabla 6).
En relación con los corticoides tópicos, destacamos una RSL de la Cochrane de 2017 que analizó 59 ECA que incluyó a 11.561 pacientes con psoriasis del cuero cabelludo, la mayoría leve-moderada. Esta RSL mostró que los corticoides y su combinación, libre o fija, con análogos de la vitamina D, fueron significativamente superiores a los análogos de la vitamina D en monoterapia, en la valoración global del médico y del paciente, la calidad de vida y en retirada del tratamiento por acontecimientos adversos17. Otros estudios han puesto de manifiesto que los corticoides tópicos de potencia alta han mostrado una eficacia similar a los de potencia muy alta95,181,187,189,197,199,200,233, aunque con menor grado de evidencia.
En general, en los estudios publicados la duración del tratamiento con corticoides tópicos es de 4 a 8 semanas, pero existen datos hasta las 12 semanas de tratamiento17,158. No se han observado diferencias entre la administración una o 2veces al día180 y varios estudios han encontrado que la aplicación en espuma es superior a la solución, pero no a la loción190,196.
Del mismo modo, se ha observado que la eficacia de la combinación fija de calcipotriol/dipropionato de betametasona es superior a los corticoides tópicos en monoterapia, pero con una magnitud del efecto pequeña26,107,109,110.
Por otro lado, un ECA comparó 2 estrategias de tratamiento con una combinación fija de calcipotriol/dipropionato de betametasona en gel, proactiva (2 veces por semana) vs. reactiva (a demanda). Los autores encontraron que ambas estrategias fueron eficaces pero el uso 2 veces por semana fue significativamente más eficaz que su uso a demanda158.
Los acontecimientos adversos más frecuentes con el uso de corticoides y análogos de la vitamina D tópicos (en monoterapia o combinación) en pacientes con psoriasis del cuero cabelludo, son la irritación local, el dolor y la foliculitis. Los acontecimientos adversos sistémicos son muy infrecuentes y probablemente sin relación con los tratamientos17.
Como hemos señalado, existen pocos datos a largo plazo con el uso de corticoides o análogos de la vitamina D en la psoriasis del cuero cabelludo111. Los resultados de un ECA de 52 semanas de duración mostraron que la combinación fija de dipropionato de betametasona/calcipotriol en gel fue significativamente superior al calcipotriol en monoterapia (ambos a demanda), en términos de adherencia al tratamiento (71% vs. 59%), PGA y satisfacción del paciente. La tasa de acontecimientos adversos relacionados con la medicación también fue significativamente inferior con la combinación111.
El uso de ácido salicílico en la psoriasis del cuero cabelludo ha sido analizado en distintos ECA de calidad moderada-baja y corta duración, sobre todo en combinación libre con corticoides, pero también en monoterapia, con buenos resultados84,113,141,234-236.
Aunque existen análisis de eficacia y seguridad de otros tratamientos tópicos, el volumen y calidad de los artículos publicados es bajo-moderado, por lo que no pueden extraerse conclusiones robustas237.
Psoriasis en pliegues y genitalesLa psoriasis en pliegues produce un importante impacto en la calidad de vida de los pacientes238 y plantea dificultades de tratamiento debido a la fricción y humedad de estas zonas ocluidas y a que su piel es más fina y sensible239. Por ello, y tal y como se recoge en las fichas técnicas, es preferible evitar los corticoides de mayor potencia.
- –
En estos pacientes el GPS recomienda tratamiento tópico con corticoides de potencia media/baja con una monitorización estrecha y estrategias de mantenimiento encaminadas a usar las menores dosis posibles de los mismos (tratamientos intermitentes, a demanda, etc.). Como alternativa se pueden valorar los inhibidores de la calcineurina.
Un estudio observacional prospectivo analizó la eficacia de fluticasona tópica al 0,005% (corticoide de potencia media) 2veces al día durante 2 semanas, en 20 pacientes con psoriasis facial y en pliegues240. Los resultados mostraron una mejoría del 50% o superior en el PGA. Estos resultados se mantuvieron en la mayoría de los pacientes que continuaron el tratamiento 8 semanas más con aplicación una vez al día, 2días consecutivos por semana. No se describieron eventos adversos de interés240.
Un ECA analizó 80 pacientes con psoriasis en pliegues tratados durante 4 semanas con betametasona tópica (corticoide de potencia alta), calcipotriol, pimecrolimús 1%, o placebo una vez al día92. La puntuación media del M-PASI descendió en el 86,4% de los pacientes con betametasona; en el 62,4% con calcipotriol; hasta un 39,7% de los pacientes con pimecrolimús; y en el 21,1% en el grupo placebo. Esta mejoría en el M-PASI fue significativamente superior con la betametasona que con pimecrolimús, pero no hubo diferencias con el calcipotriol, ni entre calcipotriol y pimecrolimús. La puntuación media de la EVA de prurito disminuyó un 78% en el grupo betametasona; un 57% con calcipotriol; un 35% con pimecrolimús; y un 43% con placebo. Finalmente, no se detectaron problemas importantes de seguridad92.
Otro ECA con comparación intraindividual en pacientes con distintos tipos de psoriasis incluyendo la psoriasis en pliegues, analizó la aplicación 2veces al día de 50μg/g de calcipotriol frente a 3μg/g de calcitriol durante 6 semanas214. La tasa de respuesta (blanqueamiento total o casi) fue significativamente superior con calcitriol (67% vs. 33%; p < 0,05)214.
En un ECA fase III se analizó la eficacia de la combinación calcipotriol 25μg/g con hidrocortisona (corticoide de potencia media), frente a tacalcitol 4μg/g pomada y placebo en 322 pacientes con psoriasis en pliegues y facial. El porcentaje de pacientes controlados a las 8 semanas de tratamiento fue del 57% para la combinación vs. 46% para tacalcitol y 36% para placebo241.
Con respecto a los inhibidores de calcineurina, en un ECA de 6 semanas de duración en pacientes con psoriasis en pliegues, genital y facial, el TAS produjo mayor porcentaje blanqueamiento (según PGA) que el calcitriol (60% vs. 33%; p < 0,05), con menor número de acontecimientos adversos locales irritativos96. En otro ECA, sobre 167 pacientes con psoriasis en pliegues y facial, la frecuencia de mejoría clínica «excelente» (definida como > 90% en PGA) tras 8 semanas de tratamiento fue significativamente superior con TAS vs. placebo (66,7% vs. 36,8%; p = 0,002). El grupo TAS también mostró mayor frecuencia de desaparición de lesiones en pliegues que el placebo (65,2% vs. el 31,5%; p < 0,001)95. Los resultados de un estudio abierto con TAS tópico aplicado durante 8 semanas en pacientes con psoriasis facial y en pliegues fueron muy similares224.
En relación con pimecrolimús, un ECA doble-ciego, placebo-control, de 8 semanas de duración con 57 pacientes con psoriasis en pliegues moderada-grave94, encontró que el 71% del grupo pimecrolimús obtuvo una puntuación de 0 o 1 en el IGA, frente al 21% del placebo (p < 0,001)94.
Se dispone de pocos datos sobre la eficacia a largo plazo y de otros tratamientos en estas localizaciones219,222.
Psoriasis facial- –
En pacientes con psoriasis facial, al igual que en pacientes con psoriasis en pliegues, el GPS recomienda tratamiento tópico con corticoides de potencia media/baja con un seguimiento estrecho, y estrategias de mantenimiento encaminadas a usar la menor cantidad posibles de los mismos (tratamientos intermitentes, a demanda, etc.). Como alternativa se recomiendan los inhibidores de calcineurina que también podrían utilizarse como ahorradores de corticoides en el mantenimiento.
La fluticasona tópica (corticoide de potencia media), administrada durante 2 semanas ha mostrado una mejoría clínica importante, según el PGA, mantenida en la mayoría de los pacientes con un tratamiento posterior intermitente de otras 8 semanas240. Se han visto resultados similares con hidrocortisona241.
En cuanto a los análogos de la vitamina D, en un ECA de 6 semanas de duración que comparó calcitriol y TAS, el porcentaje de reducción de la media del target area score con calcitriol fue del 51% frente al 67% con TAS (p < 0,05). Más pacientes consiguieron el blanqueamiento total o casi total (según PGA) con el inhibidor de la calcineurina (60% vs. 33%; p < 0,05), y los acontecimientos locales irritativos también fueron menores con el TAS96.
En un ECA doble-ciego, placebo-control, sobre 167 pacientes con psoriasis en pliegues y facial, la mejoría clínica «excelente» (definida como > 90% en PGA) tras 8 semanas de tratamiento, fue significativamente superior con TAS comparativamente con el placebo (66,7% vs. 36,8%; p = 0,002)95, con resultados similares en otros estudios224,237.
Los datos a largo plazo y sobre otros tratamientos tópicos son muy limitados69.
Psoriasis unguealLa psoriasis ungueal también puede provocar un impacto muy importante en la calidad de vida de los pacientes, con alteración de la movilidad fina o problemas estéticos, psicológicos, y sociales242.
- –
En la psoriasis ungueal el GPS recomienda el uso de corticoides de potencia muy alta/alta y, como alternativa, los inhibidores de calcineurina o el tazaroteno. En casos individualizados igualmente se podrán valorar las curas oclusivas.
En 2 ECA doble-ciego, controlados con placebo, se analizó la eficacia de clobetasol 8% (corticoide de potencia muy alta) en laca de uñas incolora194, observándose una mejoría o resolución completa en el 80% de los pacientes. En este estudio la respuesta se asoció a la duración del tratamiento194.
Los resultados de otro ECA que incluyó a 15 pacientes con psoriasis ungueal mostraron la eficacia y seguridad de 3 concentraciones de clobetasol tópico en laca de uñas (0,05%, 1% y 8%) 2 veces al día durante 16 semanas. La respuesta clínica objetivada con el Nail Psoriasis Severity Index (NAPSI) y mNAPSI fue significativamente superior a mayor concentración de clobetasol243.
Un ECA comparó la eficacia del clobetasol y tazaroteno tópicos, ambos en crema y en oclusión nocturna, durante 12 semanas. Ambos fármacos consiguieron una mejoría estadísticamente significativa en el pitting, onicólisis, hiperqueratosis, y manchas de salmón (con relación a la situación basal), pero no se encontraron diferencias entre grupos173.
Por otro lado, un pequeño estudio abierto reveló que la combinación fija de calcipotriol/dipropionato de betametasona en pomada, una vez al día durante 12 semanas, mejoraba significativamente el NAPSI, la hiperqueratosis y la onicólisis ungueal244. La mejoría en las manchas de aceite y en el pitting fue moderada y leve, respectivamente244.
Desde un punto de vista de la seguridad, hay que señalar que existen datos aislados de atrofia ósea con el uso crónico y persistente de corticoides tópicos244.
En cuanto a los análogos de la vitamina D, los resultados encontrados en distintos ECA con calcipotriol en pacientes con psoriasis ungueal han sido modestos207,215,245.
En relación con el tazaroteno, en un ECA se objetivó que su administración en gel durante 24 semanas fue significativamente más eficaz que el placebo en la reducción de la onicólisis en uñas ocluidas (semanas 4 y 12), y no ocluidas (semana 24)73, con una mejoría significativa del pitting en su aplicación ocluida (semana 24), pero sin cambios en las no ocluidas ni en otras variables como la hiperqueratosis subungueal, leuconiquia o tasa de crecimiento ungueal73. La combinación de tazaroteno con fototerapia también ha demostrado eficacia en la psoriasis ungueal246,247. Por el contrario, no se han observado diferencias entre tazaroteno y clobetasol en este tipo de pacientes173.
En un ECA abierto sobre 21 pacientes con psoriasis ungueal, se administró TAS 0,1% en pomada en algunas uñas durante 12 semanas, sirviendo el resto de las uñas como control. Los resultados mostraron diferencias significativas en el NAPSI a favor del TAS (cambio absoluto medio de 13 puntos)248.
Psoriasis palmo-plantar- –
En la psoriasis palmo-plantar el GPS recomienda tratamiento tópico con corticoides de potencia muy alta/alta y, como alternativa, análogos de la vitamina D y cura oclusiva.
La psoriasis palmo-plantar puede ser otra localización de difícil tratamiento, para la que se dispone de poca evidencia de calidad89,125,174,249,250.
En un ECA abierto, 20 pacientes con psoriasis palmo-plantar recibieron tratamiento con pomada de mometasona, una vez al día hasta la remisión y durante un máximo de 4 semanas; otros 20 pacientes siguieron la misma pauta, pero en combinación con un nuevo emoliente249. Todos los pacientes mostraron mejoría, con reducción significativa de la gravedad (eritema, descamación e infiltración) y superficie afectada. La duración de la terapia corticoidea fue similar entre los grupos, pero la mejoría en la descamación, la superficie afectada y los síntomas subjetivos fue significativamente superior en el grupo del nuevo emoliente249.
El clobetasol en combinación libre con alquitrán o con fototerapia (PUVA) produjo una reducción del PASI significativa en un ECA con pacientes con este tipo de psoriasis. En las palmas esta reducción de PASI fue mayor con la combinación de corticoide y PUVA y en plantas con la corticoide y alquitrán. La combinación corticoide-alquitrán no provocó acontecimientos adversos relevantes, mientras que con el PUVA tópico se observó fototoxicidad en el 22% de los casos125.
En otro pequeño ECA se comparó el tratamiento tópico durante 12 semanas de clobetasol frente a tazaroteno, ambos en crema250. Casi el 53% de los pacientes con tazaroteno tuvieron un blanqueamiento completo de la piel, así como el 61,5% con clobetasol tópico. No hubo diferencias estadísticamente significativas entre grupos, ni problemas importantes en cuanto a la seguridad de los tratamientos250.
Un total de 29 pacientes con psoriasis palmo-plantar fueron analizados en un ECA que comparó la eficacia y seguridad de la cura oclusiva con calcipotriol pomada, 2 veces por semana vs. el tratamiento no oclusivo 2 veces al día, durante 6 semanas174. Ambas pautas fueron igualmente eficaces con mejoría de los síntomas y signos de la enfermedad, y sin problemas de seguridad relevantes174.
Finalmente, en un ECA 39 pacientes con psoriasis palmo-plantar fueron aleatorizados a recibir tratamiento con pomada de alquitrán vs. de ácido salicílico durante 8 semanas que se dejaban mantenían toda la noche con guantes y calcetines89. Se observó mejoría en los síntomas y signos de la psoriasis palmo-plantar en el 75,5% de los pacientes del grupo alquitrán vs. el 45,5% de los del grupo ácido salicílico (p < 0,050). No hubo acontecimientos adversos de interés en ninguno de los grupos89.
Psoriasis pustulosa- –
En pacientes con psoriasis pustulosa el GPS recomienda el uso de corticoides tópicos de potencia muy alta/alta, considerando el tratamiento tópico como coadyuvante, al igual que en la psoriasis eritrodérmica.
La evidencia actual sobre eficacia y seguridad del tratamiento tópico en psoriasis pustulosa es escasa. Un pequeño ECA cruzado puso de manifiesto la eficacia de clobetasol tópico en cura oclusiva durante 12 días175. Los resultados de otro pequeño ECA sugieren que la cura oclusiva con crema de triamcinolona cada 3 días podría ser eficaz176.
Psoriasis eritrodérmica- –
Al igual que la psoriasis pustulosa, el tratamiento tópico en la psoriasis eritrodérmica es fundamentalmente coadyuvante y los corticoides tópicos de potencia muy alta/alta son los más recomendados por el GPS.
La evidencia actual sobre la eficacia y seguridad del tratamiento tópico en este tipo de pacientes es bastante limitada. Un ECA doble-ciego, placebo-control, mostró que la vaselina de calcitriol puede mejorar las lesiones68.
Adherencia y preferencias de los pacientesLa adherencia a los tratamientos tópicos es capital ya que se estima que entre el 30-40% de las aplicaciones no se realizan y entre el 8-88% de los pacientes pueden ser no adherentes, lo que influye considerablemente en la eficacia de los tratamientos9-11. La falta de adherencia es aún mayor en tratamientos prolongados, considerándose las 8 semanas como el punto crítico9.
Diferentes RSL han analizado los factores asociados a falta de adherencia9-11 (tabla 8), algunos no modificables, como la edad del paciente o la duración de la enfermedad, pero otros susceptibles de modificación (tabla 9). Por otro lado, las causas más importantes de falta de adherencia, según los pacientes, son la falta de eficacia, el tiempo de aplicación, y las inadecuadas características cosméticas de los medicamentos tópicos (conveniencia)9.
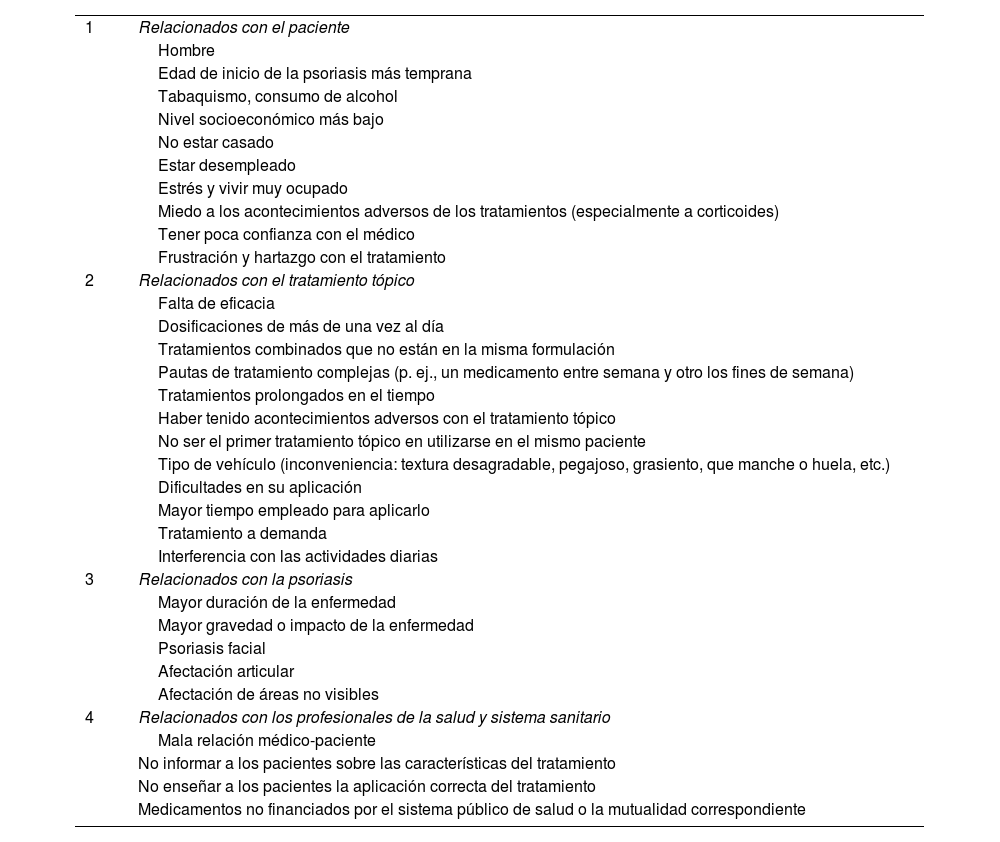
Factores asociados a la mala adherencia a los tratamientos tópicos en la psoriasis
| 1 | Relacionados con el paciente |
| Hombre | |
| Edad de inicio de la psoriasis más temprana | |
| Tabaquismo, consumo de alcohol | |
| Nivel socioeconómico más bajo | |
| No estar casado | |
| Estar desempleado | |
| Estrés y vivir muy ocupado | |
| Miedo a los acontecimientos adversos de los tratamientos (especialmente a corticoides) | |
| Tener poca confianza con el médico | |
| Frustración y hartazgo con el tratamiento | |
| 2 | Relacionados con el tratamiento tópico |
| Falta de eficacia | |
| Dosificaciones de más de una vez al día | |
| Tratamientos combinados que no están en la misma formulación | |
| Pautas de tratamiento complejas (p. ej., un medicamento entre semana y otro los fines de semana) | |
| Tratamientos prolongados en el tiempo | |
| Haber tenido acontecimientos adversos con el tratamiento tópico | |
| No ser el primer tratamiento tópico en utilizarse en el mismo paciente | |
| Tipo de vehículo (inconveniencia: textura desagradable, pegajoso, grasiento, que manche o huela, etc.) | |
| Dificultades en su aplicación | |
| Mayor tiempo empleado para aplicarlo | |
| Tratamiento a demanda | |
| Interferencia con las actividades diarias | |
| 3 | Relacionados con la psoriasis |
| Mayor duración de la enfermedad | |
| Mayor gravedad o impacto de la enfermedad | |
| Psoriasis facial | |
| Afectación articular | |
| Afectación de áreas no visibles | |
| 4 | Relacionados con los profesionales de la salud y sistema sanitario |
| Mala relación médico-paciente | |
| No informar a los pacientes sobre las características del tratamiento | |
| No enseñar a los pacientes la aplicación correcta del tratamiento | |
| Medicamentos no financiados por el sistema público de salud o la mutualidad correspondiente |
Estrategias para mejorar la adherencia a los tratamientos tópicos en la psoriasis
| 1 | Toma de decisiones compartida con el paciente teniendo en cuenta sus preferencias (selección de vehículo, rapidez de acción del tratamiento, etc.) |
| 2 | Gestión realista de las expectativas (eficacia, tiempo hasta efecto, etc.) |
| 3 | Información al paciente sobre el tratamiento (objetivos, características, importancia de seguir la pauta dada) |
| 4 | Selección de un vehículo adaptado a la localización de las lesiones y a las características y preferencias del paciente |
| 5 | Entrenamiento específico sobre el modo de aplicación de los tratamientos tópicos |
| 6 | Fomentar la implicación del paciente en el tratamiento |
| 7 | Tranquilizar al paciente en relación con los acontecimientos adversos de los tratamientos tópicos (en general poco frecuentes y de carácter leve, especialmente cuando se siguen las indicaciones adecuadas) |
| 8 | Fomentar el rol de la enfermería especializada |
| 9 | Monitorización estrecha de pacientes en los que se sospecha mala adherencia |
| 10 | Uso de material educativo en formato papel y e-Health (móvil, vídeos, webs, etc.) |
En este sentido, el GPS subraya la importancia de seleccionar un tratamiento tópico que, no solo se ajuste a la gravedad/impacto de la psoriasis, sino que también se adapte a las características y preferencias del paciente (tipo de fármaco, pauta y vehículo).
El tipo de vehículo (base o excipiente) puede ser determinante en la adherencia y satisfacción al tratamiento tópico. La elección de uno concreto puede ser fundamental para una adherencia óptima. El escaso interés de los profesionales sobre la composición y nomenclatura de las formulaciones galénicas tópicas también puede impactar negativamente en la adherencia251.
En la tabla 10 se ofrece una visión general de las ventajas, desventajas y áreas de aplicación sugeridas para cada formulación galénica de los tratamientos tópico251,252. En el material suplementario se describen con más detalle.
Visión general de las ventajas, desventajas y áreas de aplicación sugeridas de las distintas formulaciones galénicas para el tratamiento tópico de la psoriasis
| Vehículo | Ventajas | Desventajas | Áreas sugeridas de aplicación |
|---|---|---|---|
| Pomada | Aumenta la hidratación y temperatura de la piel253 | Textura grasosa, por lo que es menos atractiva cosméticamente254La preparación es difícil de lavar255No es fácil de extender256 | Palmas y plantas255Piel con vello corto o escaso255Zonas más secas del cuerpo, comoel tronco y las extremidades255 |
| Crema | Propiedades hidratantes y emolientes256Más untable y menos graso que las pomadas256 | Menos hidratante que las pomadas256 | Piel seca y exudativaespecialmente si se trata de serosas256Zonas de flexión y genitales257Todas las partes del cuerpo257 |
| Loción | Proporcionan un efecto de enfriamiento a medida que la fase acuosa se evapora258Fácil de aplicar en las zonas con pelo258Se extiende rápidamente258 | Menos hidratante que las pomadas o las cremas258 | Dermatosis exudativas258Zonas con pelo258 |
| Solución | Se extiende fácilmente por varias zonas del cuerpo258-Muy fácil de producir 258 | Difícil aplicación258No provoca la protección cutánea de los emolientes258Proporciona menos hidratación256Productos basados en alcohol pueden causar picor, sequedad o irritación cutánea256 | Zonas con pelo, incluido el cuero cabelludo258Zonas no pilosas258 |
| Hidrogel | Se seca como una película no oclusivaCosméticamente elegante258Fácil de aplicar y lavar, especialmente en las zonas con pelo258No graso 258Proporciona una sensación de frescor259 | No es un vehículo oclusivo o emoliente256La transpiración elimina el gel258No tiene efectos oclusivos y la piel está poco hidratada256El gel aceitoso puede ser difícil de lavar de las zonas con pelo, como el cuero cabelludo | Zonas con pelo255, como el cuero cabelludo257Zonas grasas, como la cara255 |
| Espuma hidroalcohólica | No contienen fragancias, conservante formaldehído ni otros conservantes no formaldehído260Baja densidad y fácil de aplicar y extender en la superficie de la piel256Mayor absorción cutánea256Elegancia cosmética de bajo residuo258 | Dependiendo de la base del excipiente, puede provocar escozor o ardor en la piel excoriada258Sin efectos oclusivos y con poca hidratación de la piel256 | Zonas pilosas del cuerpo, como el cuero cabelludo255Zonas grasas, como la cara255Zonas no pilosas258Zonas inflamadas o sensibles, ya que la aplicación requiere una mínima fuerza mecánica de corte para para dispersar el medicamento256 |
| Espuma grasa sobresaturada | Fácil aplicación, y extensión en la superficie de la piel261Usualmente sin conservantesElevada absorción cutánea y biodisponibilidad debido a la sobresaturación de principios activos261HidratanteEfecto oclusivoCosméticamente aceptable261 | Puede producir reacciones locales en la piel (como dermatitis de contacto) o irritación de los ojos y membranas mucosas261 | Todas las zonas del cuerpo, excepto pliegues, genitales y cara261Zonas pilosas del cuerpo, como el cuero cabelludo261 |
Igualmente, el GPS considera esencial informar al paciente sobre todos los aspectos del tratamiento, desde sus objetivos, características (eficacia, rapidez del efecto, gestión del riesgo, etc.), e importancia de cumplir la pauta prescrita y realizar correctamente las aplicaciones, para conseguir una mayor adherencia terapéutica.
Finalmente, el GPS subraya la necesidad de evaluar periódicamente la adherencia a los tratamientos tópicos mediante preguntas directas, o cuestionarios específicos como el Questionnaire for Adherence with Topical Treatments in Psoriasis (QATOP)262.
El programa TTPO se diseñó para mejorar la adherencia y optimización del tratamiento tópico en la psoriasis e incluye 5 acciones159: 1) lista de comprobación para las visitas con instrucciones sobre la conversación cara a cara entre el dermatólogo y el paciente; 2) lista de comprobación para las visitas entre enfermería y el paciente; 3) material educativo para el paciente; 4) servicio de atención telefónica/correo electrónico para los pacientes, y 5) recordatorios de tratamiento, con contacto de la enfermería con el paciente. En este estudio se utilizó la combinación fija de dipropionato de betametasona y calcipotriol en gel hasta 64 semanas. En comparación con el cuidado habitual, a las 8 semanas, la tasa de respuesta (aclaramiento total o casi según el PGA) fue significativamente mayor en el grupo TTPO (36,3% vs. 31,3%; p = 0,026), diferencias que se mantuvieron de la semana 8 a la 64. Por el contrario, no se observaron diferencias entre grupos en otras variables como el BSA, la valoración del paciente, o el DLQI159. Los pacientes evaluaron el programa con el Topical Therapy Adherence Questionnaire (TTAQ) observándose una influencia positiva en distintos factores relacionados con la adherencia.
ConclusionesLos medicamentos tópicos son un elemento fundamental en el tratamiento del paciente con psoriasis. En los últimos años se han producido avances que hacen que el papel de estos tratamientos deba ser reevaluado, y aunque la evidencia publicada sobre los mismos es extraordinariamente amplia, la calidad de esta es muy variable. Esto hace también necesaria una reflexión por parte de los expertos para posicionar de la manera más eficaz y segura esta modalidad terapéutica.
En este documento hemos generado un nuevo marco para optimizar el uso de los tratamientos tópicos basados en la mejor evidencia disponible y la experiencia de los expertos del GPS.
FinanciaciónEste proyecto estuvo financiado por la Academia Española de Dermatología y Venereología (AEDV).
Declaración de autoríaMiquel Ribera, Esteban Dauden, Antonio Sahuquillo-Torralba, Lourdes Rodríguez-Fernández, Pablo De La Cueva, José Manuel Carrascos han participado en la concepción y el diseño del estudio, el análisis y la interpretación de los datos, en la redacción del borrador del artículo y en la revisión crítica.
Conflicto de interesesMiquel Ribera recibió honorarios de consultoría de Abbvie, Almirall, Amgen, Boehringer Ingelheim, Bristol Myers Squibb, Gebro Pharma. Janssen, LEO Pharma, Eli Lilly, Novartis, Pierre-Fabre, SKB, UCB; pago u honorarios por conferencias, presentaciones, redacción de manuscritos o eventos educativos de Abbvie, Almirall, Amgen, Boehringer Ingelheim, Bristol Myers Squibb, Gebro Pharma, Janssen, LEO Pharma, Eli Lilly, Novartis, Pierre-Fabre, Pfizer, Sandoz, SKB, UCB; apoyo para asistir a reuniones y/o viajar de AbbVie, Almirall, Janssen, LEO Pharma, Eli Lilly, Novartis y UCB.
Esteban Dauden recibió: pago u honorarios por conferencias, presentaciones, redacción de manuscritos o eventos educativos de Almirall, Janssen-Cilag, Leo-Pharma, Novartis, Lilly, UCB, Boehringer-Ingelheim; apoyo para asistir a reuniones y/o viajes de UCB, Lilly, Janssen, LEO Pharma; participación en comités asesores para Abbvie, Almirall, Janssen-Cilag, Novartis, Lilly, UCB, Brystol-Myers y Boehringer-Ingelheim.
Antonio Sahuquillo-Torralba recibió: subvenciones o tuvo contratos de Novartis, UCB, Almirall, Leo Pharma, BMS, Janssen, Abbvie, Boehringer-Ingelheim; regalías o licencias de Novartis, UCB, Almirall, Leo Pharma, BMS, Janssen, Abbvie, Boehringer-Ingelheim; honorarios de consultoría de Novartis, UCB, Almirall, Leo Pharma, BMS, Janssen, Abbvie, Boehringer-Ingelheim; pago u honorarios por conferencias, presentaciones, redacción de manuscritos o eventos educativos de Novartis, UCB, Almirall, Leo de Novartis, UCB, Almirall, Leo Pharma, BMS, Janssen, Abbvie, Boehringer-Ingelheim; apoyo para asistir a reuniones y/o viajar de Novartis, UCB, Leo Pharma, Janssen, Abbvie y participación en comités asesores de Novartis, UCB, Almirall, Leo Pharma, BMS, Janssen, Abbvie y Boehringer-Ingelheim.
Lourdes Rodríguez-Fernandez recibió: honorarios de consultoría de Abbvie, Almirall, Amgen, Boehringer, Celgene, Janssen., LEO Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi, UCB; pago u honorarios para conferencias, presentaciones, manuscritos eventos literarios o educativos de Abbvie, Almirall, Amgen, Boehringer, Celgene, Janssen., LEO Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi, UCB; apoyo para la asistencia a reuniones y/o viajes de Abbvie, Almirall, Amgen, Boehringer, Celgene, Janssen., LEO Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi, UCB; participación en comités asesores de Abbvie, Almirall, Amgen, Boehringer, Celgene, Janssen., LEO Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi y UCB.
Pablo de la Cueva recibió: honorarios de consultoría de Abbvie, Almiral, Amgen, Boehringer, Celgene, Janssen, Leo Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi, UCB; pago u honorarios por conferencias, presentaciones, redacción de manuscritos o eventos educativos de Abbvie Almiral, Amgen, Boehringer, Celgene, Janssen, Leo Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi y UCB.
Jose Manuel Carrascosa recibió: subvenciones o contratos de Janssen, Novartis y Almirall; honorarios de consultoría de,Abbvie, Novartis, Leo Farmacéutica, Sanofi, Janssen, UCB, BI, Lilly, Almirall; pago u honorarios por conferencias, presentaciones, redacción de manuscritos o eventos educativos de Abbvie, Novartis, Leo Pharma, Sanofi, Janssen, UCB, BI, Lilly y Almirall.