INTRODUCCION
El pénfigo vulgar es una enfermedad autoinmune caracterizada por ampollas intraepidérmicas inducidas por autoanticuerpos contra la matriz intercelular. El tratamiento de esta enfermedad, potencialmente mortal, incluye corticoides y otros inmunosupresores. Rituximab (Mabthera®, Roche, Suiza) es un anticuerpo monoclonal quimérico murino-humano anti-CD20 que induce depleción de células B. El CD20 es un antígeno expresado en la superficie de las células pre-B, células B inmaduras, células B maduras y células plasmáticas inmaduras, que participa en la activación y proliferación de células B 1. El antígeno CD20 está ausente en la superficie de los plasmocitos. Se ha observado in vitro que la unión de rituximab a CD20 produce citotoxicidad mediada por el complemento, inhibición de la proliferación de células B e inducción de la apoptosis 2. El rituximab se utiliza en neoplasias malignas de células B y en enfermedades autoinmunes mediadas por anticuerpos como la púrpura trombocitopénica idiopática, anemia hemolítica urémica, lupus eritematoso sistémico, miastenia grave, síndrome de Sjögren y aplasia pura de células rojas 3. La utilidad de rituximab en el pénfigo se describió inicialmente en pacientes con un pénfigo paraneoplásico asociado a linfoma no hodgkiniano folicular 4-6. Parece que el efecto del rituximab se debe a la depleción de células B autorreactivas. La depleción de células B ocurre rápidamente, y su número no empieza a recuperarse hasta los 6-9 meses. A pesar de que el número de células B se reduce drásticamente tras el uso de rituximab, las concentraciones de IgG sérica son normales 7. Esto se debe a que las células plasmáticas son CD20 negativas y capaces de producir autoanticuerpos durante periodos de tiempo prolongado, incluso durante años, debido a las células plasmáticas de vida larga 8. Comunicamos un caso de pénfigo vulgar tratado con rituximab y revisamos la eficacia y seguridad de los casos publicados.
DESCRIPCION DEL CASO
Un hombre de 64 años, en un caso ya publicado 9, fue referido a nuestro hospital con ampollas y erosiones que afectaban a más del 45 % de la superficie corporal total, junto con estomatitis erosiva grave. Una biopsia de piel mostraba acantolisis y ampollas suprabasales. En el estudio microscópico de inmunofluorescencia directa se evidenciaba depósito intercelular de IgG. Los autoanticuerpos circulantes contra la sustancia intercelular estaban presentes a un título de 1:640, lo que confirmó el diagnóstico de pénfigo vulgar. El paciente requirió tratamiento sistémico con corticoides, micofenolato mofetilo, ciclosporina, azatioprina, ciclofosfamida (con o sin gammaglobulinas), metotrexato, talidomida y plasmaféresis. Sin embargo no se logró un control satisfactorio de la enfermedad, de modo que se administró infliximab en dosis de 5 mg/kg las semanas 0, 2, 6 y posteriormente cada 8 semanas 9. El paciente experimentó una mejoría espectacular, y en la semana 22 logró un aclaramiento total, aunque aparecieron nuevas lesiones tras la decimotercera infusión (fig. 1). Se suspendieron las infusiones de infliximab y en abril de 2004 se inició tratamiento con deflazacort 45 mg/kg/día y rituximab (375 mg/m 2) en intervalos semanales durante 5 semanas. Después de 3 semanas de la primera dosis las erosiones estaban epitelizando y no aparecían nuevas lesiones. El paciente se mantuvo libre de lesiones (fig. 2) hasta 7 meses después de la quinta dosis, cuando aparecieron nuevas lesiones ampollosas. En febrero de 2005 se repitió una nueva tanda de 5 dosis de rituximab en intervalos semanales. En la actualidad el paciente se encuentra libre de lesiones y la dosis de corticoides se ha reducido progresivamente hasta suspenderlos. Los títulos de anticuerpos antisustancia intercelular son indetectables, con recuento de células B y concentraciones séricas de IgG normales. El paciente no ha experimentado complicaciones infusionales o infecciosas que pudieran atribuirse a rituximab.
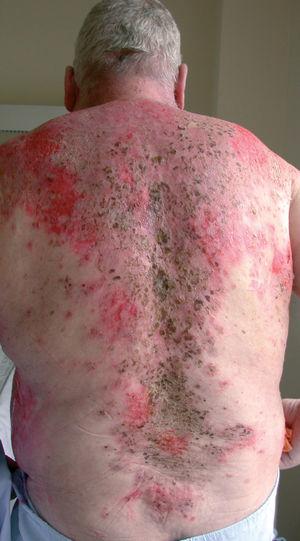
Fig. 1.--Extensas lesiones costrosas y exudativas pinceladas con eosina antes del tratamiento con rituximab.
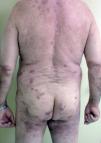
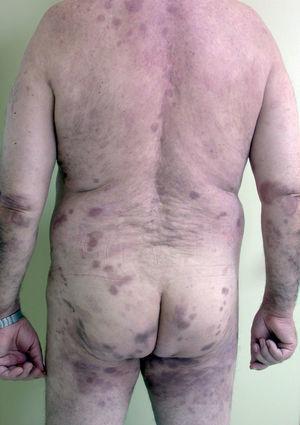
Fig. 2.--Piel completamente epitelizada con hiperpigmentación residual, sin lesiones activas de pénfigo vulgar a las 8 semanas de iniciar el tratamiento con rituximab.
DISCUSION
Describimos un caso de pénfigo vulgar grave, refractario a tratamiento inmunosupresor incluso en dosis altas y en combinación. La respuesta inicial a infliximab fue excelente, aunque no se mantuvo posiblemente a causa de anticuerpos antiquiméricos 10. Con el uso de rituximab se logró una respuesta completa que duró 7 meses tras la primera tanda de infusiones. Tras la segunda tanda se logró nuevamente un efecto completo que permitió suspender la administración de corticoides adyuvantes.
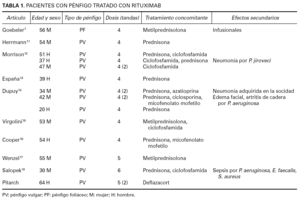
Revisamos todos los casos de pénfigo tratados con rituximab publicados hasta la fecha 7,11-19. Excluimos los casos de pénfigo paraneoplásico asociado a linfoma no hodgkiniano folicular tratados con rituximab porque se desconoce si la respuesta se debe a una acción específica sobre el pénfigo o si se produce al tratar el linfoma asociado. Se han comunicado 12 casos de pénfigo vulgar y un caso de pénfigo foliáceo 7 con rituximab (tabla 1). Todos los pacientes habían sido tratados previamente con una amplia variedad de inmunosupresores, incluyendo corticoides (terapia continua y pulsada), azatioprina, ciclosporina, ciclofosfamida, micofenolato mofetilo, metotrexato, inmunoglobulinas intravenosas, minociclina, dapsona, sales de oro, fotoféresis extracorpórea y plasmaféresis. La dosis administrada fue de 375 mg/m 2/semana. En todos los casos el uso de rituximab se asoció inicialmente con otros fármacos inmunosupresores. En todos los casos la dosis y/o la cantidad de inmunosupresores fue menor tras el uso de rituximab respecto a los requeridos antes de su administración. Entre los pacientes que solamente requirieron una tanda de rituximab la respuesta se mantuvo durante un tiempo de observación que varió desde los 3 meses hasta los 18 meses (media 7,7 meses). Se obtuvo una mejoría tanto en las lesiones cutáneas como en las mucosas. La respuesta pudo observarse desde la segunda semana de iniciar el tratamiento. El tiempo hasta conseguir la respuesta máxima varió desde las 2 semanas tras la última infusión hasta los 3 meses.
En 10 pacientes se observó una reducción del título de anticuerpos de pénfigo vulgar. En un paciente se produjo un aumento del título de anticuerpos a pesar de la mejoría clínica 16. El número de células B circulantes se redujo de forma drástica en los 6 pacientes en que se determinaron.
La actividad de la enfermedad se correlaciona con las concentraciones de autoanticuerpos de pénfigo vulgar y con el recuento de células B periféricas. De acuerdo con el mecanismo de acción de rituximab, las recidivas ocurrirán meses después de la infusión, coincidiendo con un aumento del título de autoanticuerpos y una recuperación del número de células B 14. La actividad de las células plasmáticas depende de los linfocitos T CD4+, de modo que la combinación de rituximab y de otros fármacos para suprimir la función de las células T intentaría bloquear las respuestas humoral y celular implicadas en la enfermedad 17. La buena respuesta observada en el tratamiento combinado de rituximab con corticoides y/o otros fármacos inmunosupresores apoya esta hipótesis. Se han demostrado efectos sinérgicos antiproliferativos con la combinación de dexametasona y rituximab en líneas de células B de linfoma no hodgkiniano 18. Entre los casos publicados se observó el empeoramiento de la enfermedad en un paciente cuando se redujo la dosis de prednisona 14, aunque en la mayoría de los pacientes la dosis de los fármacos inmunosupresores, incluyendo corticoides, se pudo reducir notablemente e incluso suspender. Es difícil afirmar cuál es la mejor combinación de fármacos adyuvantes debido a la gran variedad de regímenes empleados. El uso de corticoides, solos o en combinación con otros inmunosupresores, ha mostrado ser una opción eficaz.
Los efectos adversos observados con más frecuencia son aquéllos relacionados con la infusión, que se pueden evitar gracias a la premedicación con paracetamol y antihistamínico. Los efectos adversos más importantes por su gravedad son las infecciones. Un paciente murió debido una neumonía por Pneumocystis jiroveci12. Otra paciente desarrolló sepsis por Pseudomonas aeruginosa, Enterococcus faecalis y Staphylococcus aureus18. También se ha descrito asociación con neumonía adquirida en la comunidad y recidiva de artritis de cadera por P. aeruginosa 14. El desarrollo de infecciones graves pocos meses después de la infusión de rituximab podría estar relacionado con la depleción de células B producidas por el fármaco. De todas maneras las células plasmáticas no expresan CD20, de modo que las concentraciones séricas de inmunoglobulinas se mantienen a pesar de la reducción de las células B circulantes. Parece que las complicaciones infecciosas en pacientes que reciben rituximab podrían ser más frecuentes en pacientes con enfermedades autoinmunes que en aquéllos con neoplasias de células B, posiblemente debido a los antecedentes de inmunosupresión farmacológica prolongada.
El caso aquí comunicado, así como los revisados, apoyan la utilidad de rituximab en casos graves de pénfigo vulgar y foliáceo. Este tratamiento debe reservarse para pacientes que no hayan respondido previamente a otros tratamientos, ya que se dispone de menor experiencia en su uso y presenta un riesgo no desdeñable de complicaciones infecciosas graves.
Declaración de conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Gerard Pitarch. Servicio de Dermatología.
Hospital General Universitario de Valencia.
Avda. Tres Cruces, s/n. 46014. Valencia. España.
gerardpitarch@hotmail.com
Recibido el 11 de julio de 2005.
Aceptado el 21 de octubre de 2005.