La necrólisis epidérmica tóxica es la reacción secundaria a medicamentos más grave dentro del espectro de las reacciones mucocutáneas. El tratamiento multidisciplinario es clave para disminuir la mortalidad de los pacientes, además de la suspensión del fármaco causal. Existen pocos estudios de tratamientos farmacológicos en pacientes con necrólisis epidérmica tóxica en Latinoamérica que combinen el uso de esteroides sistémicos e inmunoglobulina intravenosa (IgIV). Describimos 6 casos de pacientes con necrólisis epidérmica tóxica tratados con esteroides sistémicos e IgIV en un hospital de referencia dermatológica en Ciudad de México. Ningún paciente falleció ni presentó complicaciones a corto y mediano plazo de seguimiento. En la mayoría de los casos se empleó una dosis de IgIV de 1g/kg por 3-5 días y 1g de metilprednisolona por 3-5 días. El tiempo de ingreso hospitalario fue de 14,8 días. La combinación de esteroides sistémicos e IgIv parece ser una opción segura en pacientes con necrólisis epidérmica tóxica.
Toxic epidermal necrolysis is the most serious mucocutaneous adverse drug reaction. Multidisciplinary treatment and withdrawal of the causative drug are key to reducing mortality. Few studies have analyzed the use of systemic corticosteroids and intravenous immunoglobulins (IVIG) in patients with toxic epidermal necrolysis in Latin America. We describe our experience with 6 cases treated at a dermatology referral hospital in Mexico City. None of the patients died or developed complications in the short or medium term. The most widely used regimen was a combination of IVIG 1 g/kg for 3 to 5 days and methylprednisolone 1 g for 3 to 5 days. Mean hospital stay was 14.8 days. The combined use of systemic corticosteroids and IVIG seems to be a safe treatment option for patients with toxic epidermal necrolysis.
La necrólisis epidérmica tóxica (NET) es la reacción secundaria a medicamentos más grave dentro del espectro de las reacciones mucocutáneas. Es una enfermedad rara, con una incidencia de 2 a 13 casos por millón de habitantes1-3. Los principales fármacos asociados son los antiepilépticos aromáticos (carbamazepina, fenitoína, fenobarbital), algunos antibióticos (sulfametoxazol, β-lactámicos, quinolonas), el alopurinol y los antirretrovirales (abacavir, nevirapina)5.
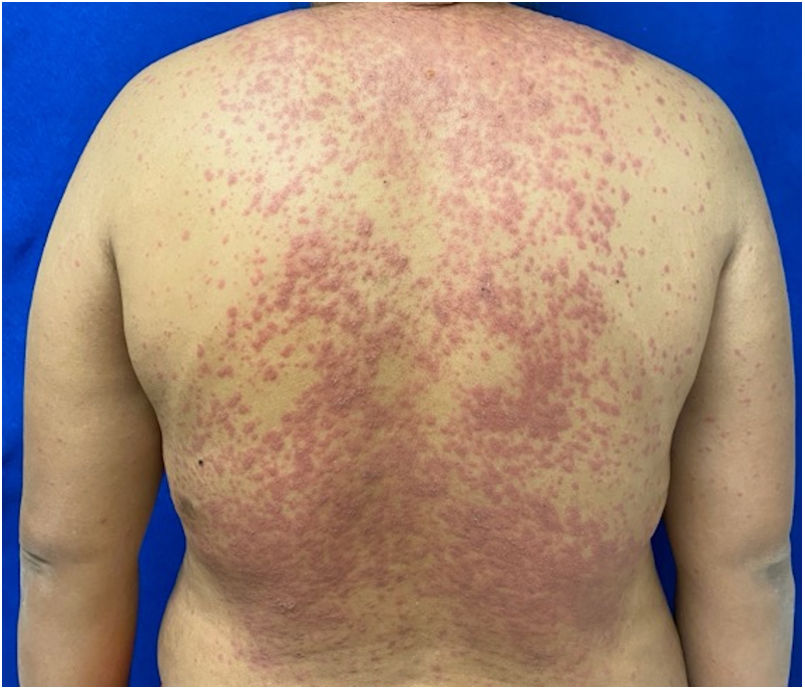
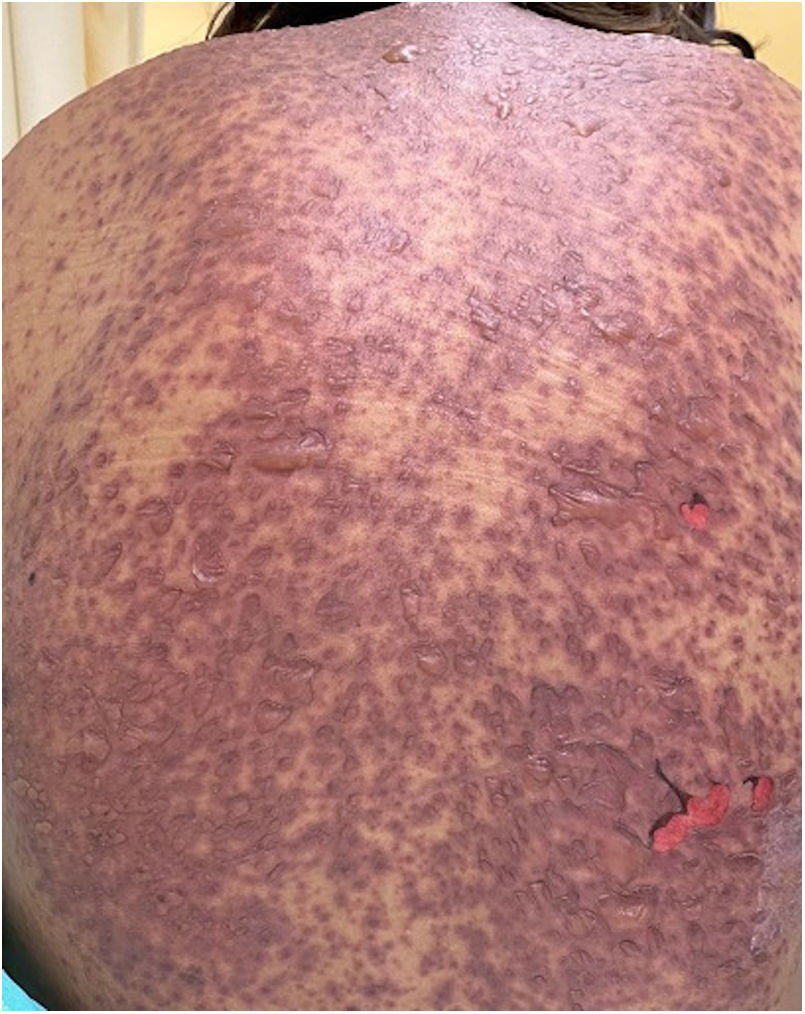
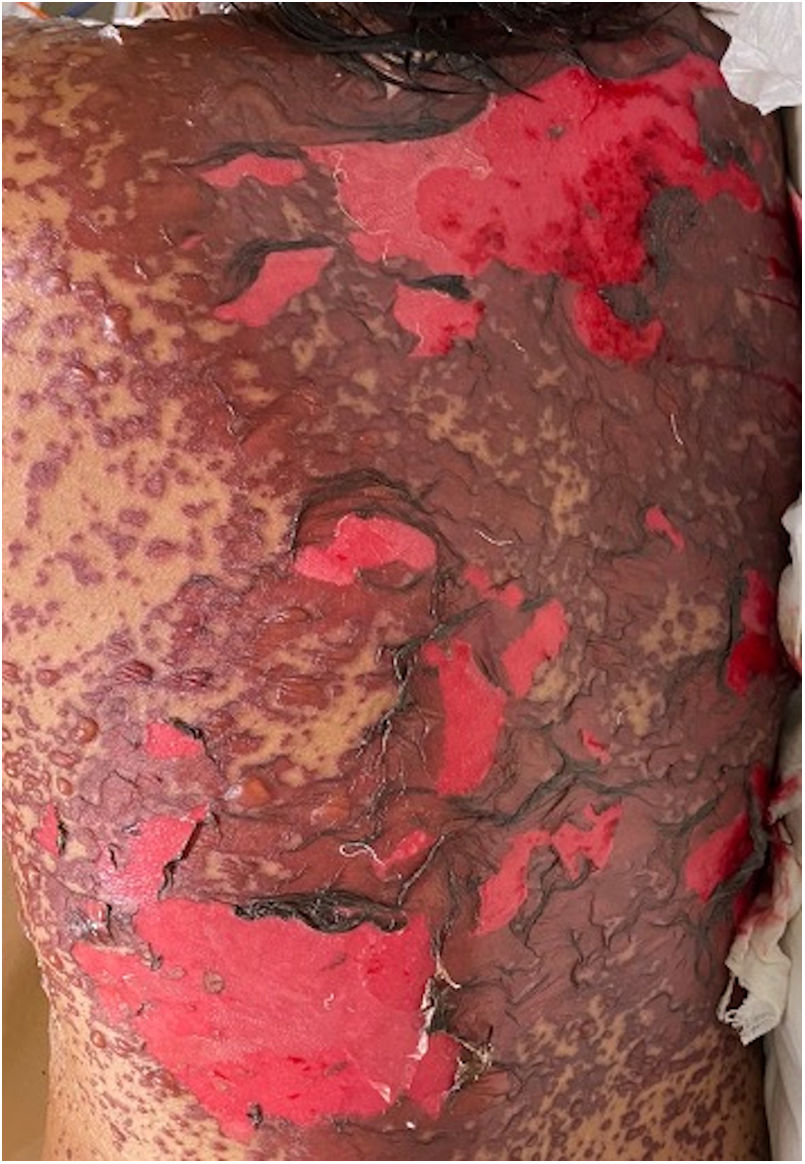
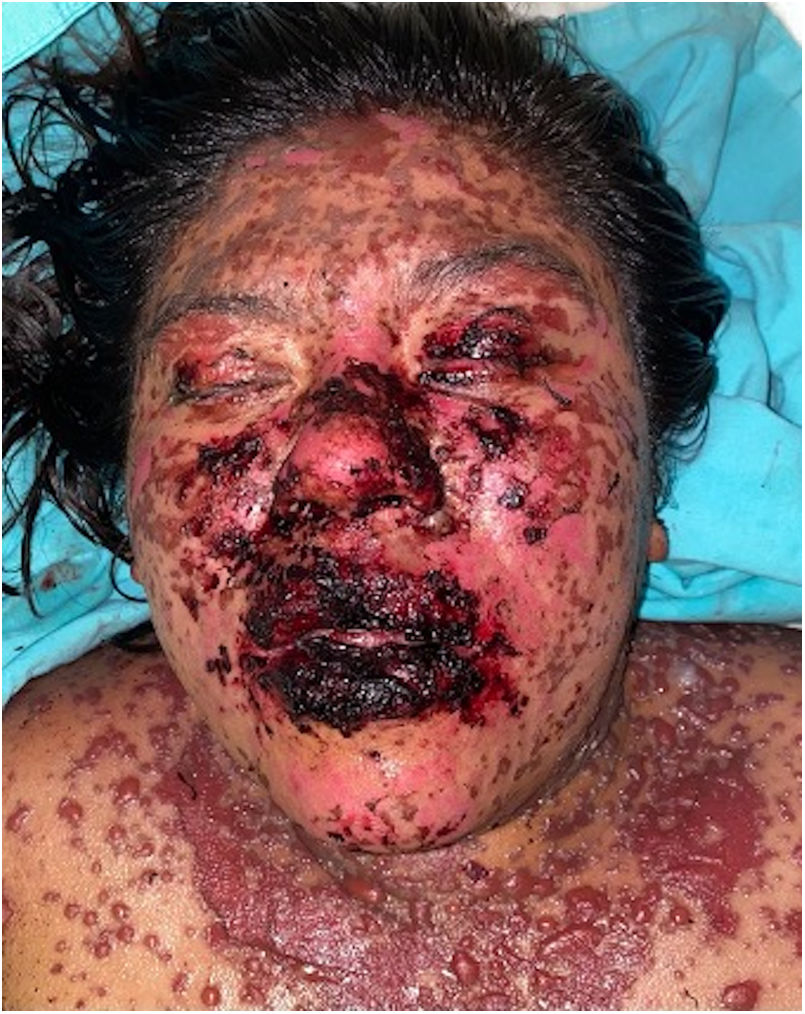
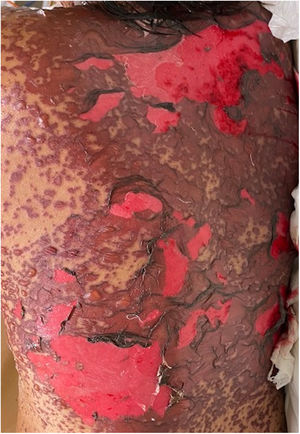
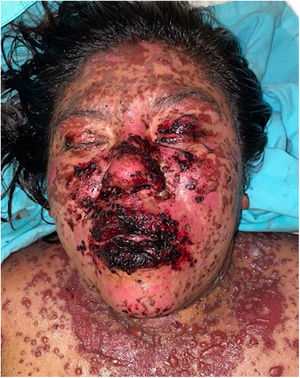
Se caracteriza por la formación de ampollas flácidas, con el subsecuente desprendimiento de la epidermis en más del 30% de la superficie corporal y la afectación de las mucosas. La mortalidad de la NET es alta (alrededor del 25-30%) y la principal causa de muerte es la sepsis4. La suspensión inmediata del medicamento causal es esencial, además de un abordaje multidisciplinar en una unidad hospitalaria de cuidados intensivos.
El efecto de los tratamientos sistémicos que han sido empleados para tratar esta entidad se basa en la supresión y la limitación de la respuesta inflamatoria e incluyen: glucocorticoides, ciclosporina, inmunoglobulina humana (IgIV) y anticuerpos monoclonales contra el factor de necrosis tumoral (TNF) alfa. No hay una recomendación universal para el tratamiento sistémico que disminuya la mortalidad, debido a la descripción de resultados heterogéneos e incluso contradictorios, probablemente como consecuencia de la variedad de esquemas de tratamiento evaluados.
Describimos 6casos de pacientes con NET ingresados en un hospital de referencia dermatológica en Ciudad de México tratados con esteroides sistémicos o IgIV entre julio del 2019 y febrero del 2021. Todos los pacientes otorgaron consentimiento informado.
Caso clínicos y métodoSe incluyeron los casos diagnosticados como NET en la División de Dermatología del Hospital General Dr. Manuel Gea González. En todos los casos, además de los datos clínicos, el diagnóstico fue confirmado histopatológicamente con una evidencia de dermatitis vacuolar de interfase con una necrosis epidérmica total y un infiltrado inflamatorio mínimo.
En la tabla 1 se resumen las características clínicas presentadas por los pacientes, así como los fármacos causales y sus días de estancia intrahospitalaria.
Características clínicas de los pacientes con NET
| Caso | Sexo (H/M) /edad (años) | Comorbilidades | Fármaco causal | Superficie corporal afectada (%) | Afección de mucosas | Puntuación SCORTEN al día 1 y día 3 | Días de estancia intrahospitalaria |
|---|---|---|---|---|---|---|---|
| 1 | M/86 | Hipertensión arterial | No determinado | 34 | Oral | 2/3 | 12 |
| 2 | M/28 | Migraña | Carbamazepina | 37 | OralConjuntivalUrogenital | 2/2 | 25 |
| 3 | M/31 | Enfermedad indiferenciada de tejido conectivo con predominio de artralgias y nefropatía membranosa primaria anti-PLA2R negativa | Sulfasalazina | 33 | OralConjuntival | 2/3 | 18 |
| 4 | H/41 | Cuadro de podagra 13 días antes de dermatosis | Alopurinol | 32 | Oral | 2/3 | 12 |
| 5 | H/32 | Infección por virus de inmunodeficiencia humana carga viral indetectable CD4>200 cels | No determinado | 45 | Oral | 2/2 | 12 |
| 6 | M/26 | Coriorretinitis bilateral, infección congénita por Toxoplasma gondii | Sulfametoxazol | 37 | Oral | 1/1 | 10 |
H: hombre; M: mujer.
Los 6 pacientes se curaron. A 5de ellos se les administró IgIV y los 6recibieron esteroides sistémicos. No presentaron complicaciones a corto y mediano plazo de seguimiento. En el primero y en el penúltimo de los pacientes no fue posible identificar el agente farmacológico causal, dado que habían recibido más de 10medicamentos en las últimas 12semanas y no se pudo establecer una causalidad directa con la aparición de la dermatosis. Dos de nuestros pacientes presentaron afectación conjuntival y una de ellas requirió el uso de conformadores oculares para evitar la formación de sinequias. No fue necesario utilizar ningún tratamiento adicional. En la tabla 2 se resume el tratamiento en los 6pacientes, así como la dosis y tipo de esteroide empleado.
Tratamiento farmacológico empleado en pacientes con NET
| Número de caso | Dosis de IgIV (g/kg) | Dosis total IgIV (g) | Días de infusión IgIV | Días en iniciar tratamientoa | Dosis y tipo de esteroide (g o mg) | Días de administración de esteroide | Días para cese de nuevas lesiones |
|---|---|---|---|---|---|---|---|
| 1 | — | — | — | 4 | Hidrocortisona 200mg día 1, 400mg día 2 y 50mg de metilprednisolona en dosis (reducción en 9 días) | 12 | 3 |
| 2 | 1 g/kg | 60 g | 5 | 4 | Metilprednisolona 1g al día 3 días y después hidrocortisona 100mg cada 8 horas 4 días | 7 | 3 |
| 3 | 1 g/kg | 80g | 5 | 10 | 1g de metilprednisolona 3 días y 125mg prednisona 4 días | 7 | 3 |
| 4 | 1 g/kg | 80g | 3 | 3 | 1g metilprednisolona 3 días y 80mg prednisona 4 días reducción de dosis | 7 | 5 |
| 5 | 1?g/kg | 60 g | 5 | 2 | 1g metilprednisolona 5 días y 60mg prednisona 4 días dosis reducción | 7 | 3 |
| 6 | 1?g/kg | 70 g | 3 | 2 | 500mg metilprednisolona 3días y 60mg 7 días reducción de dosis | 10 | 3 |
IgIV: inmunoglbulina intravenosa.
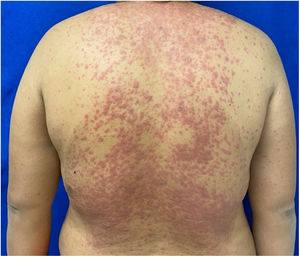
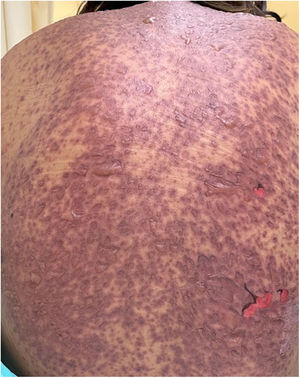
Los pacientes número 2y 3ameritaron estancia en terapia intensiva por la gravedad del cuadro y por la afección de mucosas (figs. 1-4). El máximo puntaje en la escala SCORTEN fue de 3 puntos, lo cual les confería una predicción de mortalidad del 35,3%. A pesar de que la puntuación de SCORTEN aumentó en 3 pacientes, estos se mantuvieron estables y no hubo ningún caso de muerte. Todos los pacientes recibieron cuidados generales de las heridas y manejo multidisciplinario por las áreas de medicina intensiva, urología, oftalmología y clínica del dolor. El tiempo promedio de estancia hospitalaria fue de 14,8 días.
Únicamente la primera paciente no recibió tratamiento con IgIV por el antecedente de hipertensión arterial, su edad avanzada y la enfermedad renal no estudiada al momento del cuadro clínico. El tratamiento con IgIV fue instaurado en las primeras 24 h de estancia intrahospitalaria y tuvo una duración promedio de 3 a 5 días, dependiendo de su gravedad y de la formación continua de ampollas. Además del uso de IgIV, se administró de manera concomitante esteroides sistémicos por vía intravenosa. En la mayoría de los casos, se prefirió utilizar dosis altas de metilprednisolona en bolo por la extensión de la superficie corporal y mucosa afectada. El tiempo promedio de administración de esteroides sistémicos fue inferior a 2 semanas en todos los casos.
La reepitelización de heridas ocurrió en todos los pacientes y se realizaron curas cada 48 h con el uso de apósitos no adherentes y gasas impregnadas con petrolato sólido. Para el tratamiento de la mucosa oral se emplearon colutorios con mometasona, sucralfato y clorhidrato de difenhidramina. En 3 pacientes se empleó nistatina de manera profiláctica para evitar la candidiasis oral.
DiscusiónEl tratamiento primario más importante de la NET es la suspensión inmediata del medicamento sospechoso, junto con el ingreso del paciente en una unidad de cuidados intensivos6. En el estudio de revisión multicéntrico de pacientes tratados en unidades de quemados realizado por Palmieri et al.7, se observó una reducción en la mortalidad atribuida al control de líquidos, el apoyo nutricional enteral y la reconstitución de la función de barrera de la piel7, factores clave para un pronóstico favorable. Estas son las medidas terapéuticas más importantes en los pacientes con NET.
Respecto al tratamiento sistémico farmacológico, no existe un algoritmo bien establecido. Algunas guías proponen el uso de esteroides sistémicos o IgIV, ciclosporina o anticuerpos monoclonales anti TNF-alfa. Paquet et al. demostraron que, posterior a la administración de IgIV a pacientes con NET, hay un aumento estadísticamente significativo de inmunoglobulina en la piel dañada respecto de controles sin administración de IgIV8,9. En el estudio de Prins et al., con 48 pacientes, los autores recomiendan el uso de infusiones tempranas de IgIV a altas dosis, con una dosis total de 3g/kg (1g/kg al día por 3 días consecutivos). Mencionan una supervivencia del 88% con esta posología, así como un cese en las lesiones cutáneas y mucosas en promedio a los 2,3 días (rango 1-6 días)10. En otros estudios, la mortalidad se asoció a unas dosis menores de IgIV, a un inicio tardío, a comorbilidades crónicas, a la edad avanzada y al porcentaje de superficie corporal afectada11. En un metaanálisis reciente de 19 estudios, se encontró que los adultos que recibieron unas dosis altas de IgIV tuvieron buenos resultados, sin embargo, reportan que estadísticamente la dosis utilizada no correlaciona con la mortalidad12. La terapia combinada de metilprednisolona (1,5mg/kg por día) y 2g/kg de IgIV resultó en una tasa de supervivencia más alta en casi todos los niveles de SCORTEN y en una detención temprana de la progresión en comparación con la monoterapia con corticosteroides4. En un análisis retrospectivo de 281 pacientes de Francia y Alemania inscritos en el registro nacional de reacciones adversas cutáneas graves6, 119 pacientes recibieron corticoesteroides sistémicos, incluyendo a 40 pacientes con corticoesteroides más IgIV, 35 únicamente IgIV y 87 con terapia de soporte. La tasa de mortalidad para pacientes que recibieron IgIV sola fue del 34%, con terapia de soporte fue del 25%, con corticosteroides fue del 18% y la combinación de corticoesteroides más IgIV fue de 18%6. En otro estudio retrospectivo de 55 pacientes con NET, 39 fueron tratados con IgIV (0,4g/kg por día durante 5días) más metilprednisolona (1,5mg/kg por día durante 3a 5días) y 22 pacientes solo con metilprednisolona. La tasa de mortalidad fue del 13% (5/39) entre los pacientes tratados con terapia combinada y del 23% (5/22) entre los tratados solo con corticoesteroides13.
Un estudio multicéntrico retrospectivo de los Estados Unidos que incluyó a 377 pacientes hospitalizados con SJS/NET, el standardized mortality ratio (SMR), entre los pacientes que recibieron corticoesteroides sistémicos (dosis diaria promedio de 148mg de prednisona) e IgIV (dosis media de 1g/kg por día durante 3días) fue menor que entre aquellos que recibieron monoterapia con corticoesteroides, IgIV o atención de apoyo (SMR 0,52; IC 95%: 0,21-0,79; SMR 0,72; IC 95%: 0,48-0,89; SMR 0,79; IC 95%: 0,55-0,92 y SMR 0,70; IC 95%: 0,47-0,87, respectivamente)14.
Una revisión sistemática y metaanálisis publicado en el 2020 reveló que, de 11 brazos posibles de tratamiento, la combinación de esteroides sistémicos e IgIV fue el único tratamiento con un beneficio de supervivencia significativo (0,53; IC 95%: 0,31-0,93)15.
En su revisión sistemática de la literatura y metaanálisis, Torres-Navarro et al. señalan la ciclosporina o el uso de IgIV con esteroides sistémicos con una menor asociación al riesgo de muerte comparado con el calculado por SCORTEN. Ningún tratamiento farmacológico ha significado una reducción mayor en la mortalidad en comparación con el tratamiento de soporte16.
Hasta el momento no hay un fármaco de elección y faltan estudios con evidencia científica mayor para determinar si existe o no alguna alternativa terapéutica además del tratamiento de soporte que disminuya la mortalidad de esta reacción. Dada la heterogeneidad de estudios con respecto al tiempo de inicio del tratamiento, la discordancia en dosis de tratamiento y la mejoría con el tratamiento de soporte, no se ha identificado un fármaco definitivo que sea de primera línea en los pacientes afectados.
En nuestro centro hospitalario tratamos a todos nuestros pacientes con esteroides sistémicos y de forma concomitante a 5de ellos con IgIV. Uno de los principales factores asociados a la decisión de utilizarlos fue la disponibilidad y costo, en comparación con otras terapias sistémicas descritas en la literatura. El uso de ciclosporina o anti-TNF es una opción costosa y con mayor riesgo de efectos adversos. A pesar de que los corticoesteroides representan un riesgo en cuanto al retraso en la reepitelización de heridas o inmunosupresión del paciente, su empleo por cortos periodos de tiempo y con una desescalada gradual puede ser una opción de utilidad en la detención de la cascada inflamatoria de apoptosis masiva de queratinocitos.
FinanciaciónLos autores de este articulo confirman que no se ha recibido ningún tipo de financiación o ayuda económica para la elaboración de este trabajo.
Conflicto de interesesNinguno.