Las úlceras venosas crónicas de los miembros inferiores representan un reto terapéutico importante en la práctica clínica diaria, resultando primordial la búsqueda de nuevas alternativas que mejoren la curación de estas heridas. Pese al tratamiento habitual con compresión, desbridamiento y uso de apósitos, muchas úlceras permanecen sin cicatrizar. En estas úlceras que no curan uno de los tratamientos más empleados es el trasplante de injertos cutáneos en sus diversas variantes: pinch grafts, punch grafts, injertos de piel de espesor parcial, injertos de piel de grosor total e injertos elaborados a partir de células cultivadas en laboratorio. En los últimos años numerosos estudios han destacado el importante papel del folículo piloso en el proceso de cicatrización de las heridas cutáneas. Trasladando a la práctica estos conocimientos se han utilizado folículos pilosos del cuero cabelludo en injertos tipo punch que son trasplantados al lecho de las úlceras crónicas para estimular su curación. Los resultados parecen ser mejores que el trasplante tradicional de injertos tipo punch sin pelo, lo cual proporciona nuevas líneas de tratamiento para las úlceras venosas crónicas recalcitrantes.
Chronic venous leg ulcers are a major therapeutic challenge in clinical practice, and the search for new approaches to improve wound healing is essential. Many ulcers do not heal with traditional treatment using compression, debridement, and dressings. Skin-grafts variants, such as pinch grafts, punch grafts, split- or full-thickness skin grafts, and grafts derived from cells cultured in the laboratory, are among the most widely used options in ulcers that do not heal. In recent years, numerous studies have brought to our attention the important role of the hair follicle in the healing process of cutaneous wounds. Putting knowledge into practice, hair follicles from the scalp have been used in punch-type grafts transplanted to the base of chronic ulcers to stimulate healing. Results appear to be better than those with traditional hairless punch grafts, opening new lines of treatment for recalcitrant chronic venous ulcers.
Las úlceras venosas crónicas en los miembros inferiores representan un problema médico crónico, frecuente e invalidante, que repercute de manera importante en la calidad de vida del paciente. El tratamiento estándar de las úlceras venosas se basa en el uso de apósitos adecuados junto con una terapia compresiva eficaz1–3. Sin embargo, pese a este hasta un 20% de úlceras venosas permanecerán sin cicatrizar tras 50 semanas de compresión adecuada4. Para aquellos pacientes que no responden a los tratamientos convencionales existen otras opciones terapéuticas, tales como la compresión neumática intermitente5, los fármacos (pentoxifilina6–8, tretinoína9, timolol10, fraccio¿n flavonoica purificada y micronizada11, heparina12,13, doxiciclina14, Aspirina®15,16), el plasma rico en plaquetas auto¿logo17,18, el tratamiento con oxígeno hiperbárico19, la terapia electromagnética20 y la terapia de presión negativa21. Respecto al tratamiento quirúrgico las opciones disponibles incluyen la cirugía del sistema venoso3,22–25 y el uso de injertos cutáneos1.
Injertos de piel en úlceras crónicasLos injertos de piel se pueden clasificar en autoinjertos, aloinjertos o xenoinjertos. Los injertos también pueden clasificarse en aquellos que están constituidos por fragmentos de piel, por capas de células cultivadas en el laboratorio o por apósitos que incorporan células de la piel1,26.
Los autoinjertos se obtienen del mismo paciente. Se han utilizado injertos tipo pellizco (pinch grafts), injertos obtenidos con punch (punch grafts)27–29, injertos de piel de espesor parcial, injertos de piel de grosor total e injertos elaborados a partir del cultivo de células del propio paciente en un laboratorio, como por ejemplo los injertos de queratinocitos cultivados. Los aloinjertos se obtienen de piel o células de otra persona, cultivadas y preparadas en el laboratorio (queratinocitos cultivados, fibroblastos epidérmicos cultivados)30,31. Los xenoinjertos se obtienen de un animal, siendo el más frecuente el cerdo, por su similitud con la piel humana.
En algunos estudios se han referido porcentajes de curación tras la realización de los injertos cutáneos del 50%3,32,33. Debido a la facilidad de acceso, la zona donante de los injertos siempre ha sido el muslo, la nalga o la espalda28,29. Sin embargo, el concepto tradicional de injertos de piel glútea o abdominal en el tratamiento de las úlceras crónicas se ha visto modificado en los últimos años gracias a la publicación de múltiples estudios que avalan la conexión existente entre el folículo piloso, las células madre y la curación de las heridas34–44. Como consecuencia, nuevos trabajos han utilizado el injerto de folículo piloso obtenido de cuero cabelludo como una nueva opción de tratamiento dentro del arsenal terapéutico de las úlceras crónicas45–47.
Por otro lado, la zona donante del injerto ideal debe reunir además una serie de propiedades como son un cuidado postoperatorio sencillo, un bajo riesgo de infección, una cicatrización de la herida rápida y una mínima cicatriz residual. La localización que cumple todas estas características es el cuero cabelludo48.
Función del folículo piloso en la curación de las heridasEs un hecho demostrado que las zonas de piel con pelo cicatrizan más rápidamente que la piel glabra49–51. Por ejemplo, zonas de piel que han recibido radioterapia52 en las que se han destruido las estructuras anexiales como los folículos pilosos o las glándulas ecrinas53 cicatrizan con mucha dificultad.
La demostración más importante realizada hasta la fecha de que los folículos pilosos desempeñan un papel central en la curación de la heridas sigue siendo el trabajo publicado por Bishop en 1945. Este investigador realizó heridas cutáneas a diferentes profundidades en su propio brazo y biopsias secuenciales, con el fin de estudiar meticulosamente el proceso de curación49. Observó que la curación de la piel comienza no solo a partir de los bordes de la herida, sino alrededor de los folículos remanentes. Demostró también que no solo la reepitelización, sino también el tejido de granulación regenerado se comienza a formar a partir del tejido conjuntivo perifolicular, otorgando al folículo piloso un papel clave en el inicio del proceso de curación de las heridas49.
Okuda en 1939 realizó estudios histológicos sobre biopsias tomadas en diferentes momentos evolutivos tras la realización de injertos de pelo, describiendo la proliferación de células de tejido conectivo proveniente de los folículos pilosos implantados en el seno del tejido conectivo de la zona receptora54.
También se conoce que el folículo piloso representa el principal reservorio de células madre cutáneas55–57. Así, en respuesta a una herida cutánea, células madre epiteliales localizadas en la zona bulge del folículo proliferan y emigran a la superficie contribuyendo a la reepitelización de la nueva epidermis50. De igual modo, las células madre mesenquimales localizadas en la vaina perifolicular (dermal sheath) contribuyen a la regeneración del tejido dérmico58–60. El cuero cabelludo, por su gran densidad de folículos pilosos en fase anágena, y por la consiguiente gran densidad de células madre epiteliales y mesenquimales, sería teóricamente la zona donante ideal para trasplantar folículos, con el objetivo de estimular la curación de heridas.
Existen numerosos casos clínicos publicados que respaldan la contribución del folículo piloso en la curación de las heridas35,38,39,59,61,62. La mayor parte son casos clínicos aislados de pacientes con quemaduras o heridas quirúrgicas tratadas con una combinación de apósitos de dermis artificial más trasplante de folículos pilosos63–65. Navsaria et al.64 publicaron el caso de un paciente con una quemadura extensa y profunda en el cuero cabelludo, en el que consiguieron una cicatrización completa de la herida mediante un trasplante de folículos pilosos sobre una dermis artificial (Integra®, Integra LifeSciences Corporation, Plainsboro, N.J.). De forma similar Narushima et al.63 publicaron los casos de 2 pacientes con defectos quirúrgicos en el cuero cabelludo que fueron cubiertos con dermis artificial (PELNAC, Smith & Nephew KK, Japan) para posteriormente realizar el trasplante de unidades foliculares sobre ella, con el fin de obtener crecimiento de cabello y con ello un resultado más estético. Zakine et al.65 publicaron una serie de 15 pacientes con quemaduras agudas de tercer grado que fueron tratadas con injertos de dermis de cuero cabelludo, mostrando la eficacia de este tipo de injertos en la cicatrización, así como la excelente capacidad regeneradora de las zonas donantes de cuero cabelludo.
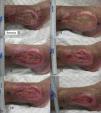
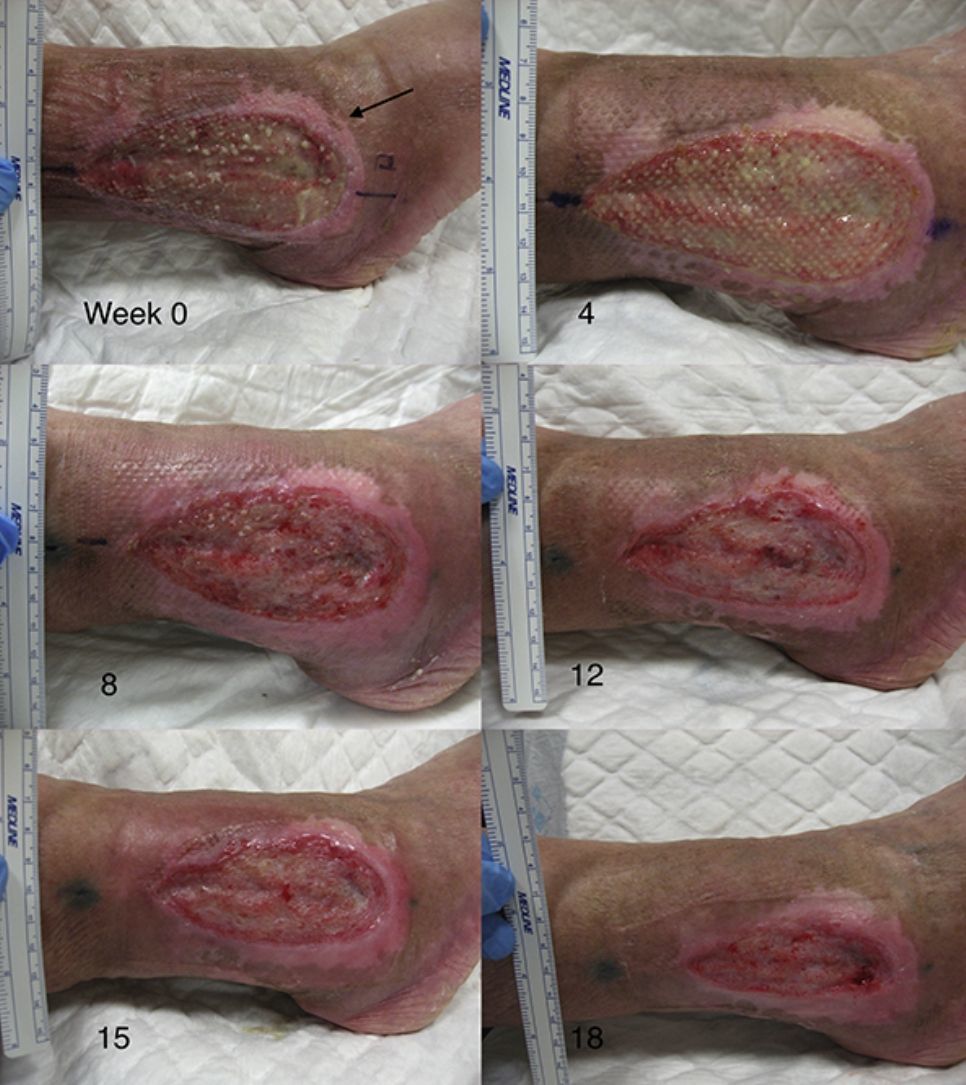
Trasplante de folículos pilosos mediante injertos punch en úlceras crónicas recalcitrantes: su aplicación en la práctica clínicaEn cuanto al trasplante de injertos tipo punch de folículos pilosos en las úlceras crónicas en las piernas, el primer trabajo para estudiar su viabilidad y seguridad clínica en pacientes fue publicado por Jiménez et al.45 en 2012. Fueron tratados 10 pacientes con úlceras crónicas recalcitrantes (10,5 años de duración media) en los miembros inferiores de etiología venosa, mixta y por presión, con un tamaño medio de 36,8 cm2. En cada úlcera se asignó aleatoriamente un área experimental y un área control, ambas de 4 cm2. Ambos grupos recibieron los mismos cuidados de la úlcera (limpieza y apósitos vaselinados), mientras solo en el área experimental se implantaron los injertos punch de cuero cabelludo conteniendo folículos pilosos terminales. A modo similar a como se realiza el trasplante quirúrgico en la alopecia androgenética, se extrajeron punches de 2mm de diámetro de la zona occipital del cuero cabelludo, los cuales fueron trasplantados de forma inmediata en el seno de la úlcera del propio paciente. Tras 18 semanas de seguimiento se observó una reducción del área experimental del 27,1% comparada con el 6,5% en el área control (p=0,046) (fig. 1). Los signos clínicos también mejoraron en 7 de los 10 pacientes, con aparición de tejido de granulación, reactivación del borde de la herida y disminución del exudado.
Úlcera venosa en la que se indican los 2 cuadrantes utilizados para el estudio. El cuadrante superior correspondió al área experimental que recibió los injertos punch de folículos pilosos de cuero cabelludo (área experimental) y el inferior fue el área control que no recibió ningún trasplante (área control).
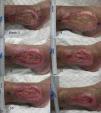
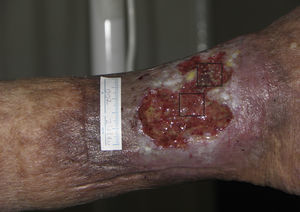
Tras este ensayo clínico piloto, nuestro grupo de trabajo realizó otro estudio clínico en úlceras venosas crónicas comparando punches de piel del cuero cabelludo con folículos terminales versus punches de piel de zonas sin pelo terminal visible66. Se incluyeron un total de 12 pacientes con úlceras crónicas venosas en los miembros inferiores durante 18 semanas, con un tamaño medio inicial de 23,34 cm2 y un tiempo de evolución medio de 6,04 años. En cada paciente se trató una sola úlcera que fue dividida en 2 partes de igual superficie, una mitad que recibiría los injertos punch de cuero cabelludo y la otra mitad los injertos punch de piel sin pelo (de la región abdominal). Al finalizar el estudio el porcentaje de reducción del área de la úlcera que se trasplantó con punches de cuero cabelludo fue de un 75,15%, mientras en el grupo trasplantado con punches sin pelo visible fue de un 33,7% (p=0,002) (fig. 2)66. La conclusión de este estudio fue la demostración de que los injertos punch de folículos pilosos de cuero cabelludo estimulan en mayor grado la curación de la úlcera que los injertos punch de piel sin pelo, con lo cual se confirma esta técnica de trasplante de folículos pilosos como una alternativa terapéutica eficaz en las úlceras venosas crónicas que no curan con tratamiento convencional.
Una posible explicación teórica de la mejor curación de las úlceras introduciendo folículos terminales sería el mayor aporte de células madre, con gran capacidad proliferativa, tanto epiteliales y mesenquimales, contenidas en los folículos terminales en anágeno (aproximadamente el 85% de los folículos en el cuero cabelludo se encuentran en anágeno67). De todos los tipos de injertos descritos anteriormente (pinch, punch, laminares), el más adecuado para este fin sería el injerto tipo punch de cuero cabelludo, ya que de esta manera se conseguiría trasplantar el folículo piloso completo, aportando células del dermal sheath de la porción inferior del folículo, cuya capacidad de diferenciación a miofibroblastos ayudaría a crear un nuevo tejido de granulación59,68.
A partir de estos trabajos han comenzado a publicarse otros estudios clínicos similares de trasplante de folículos pilosos en heridas cutáneas con buenos resultados47,69. Liu et al.47 realizaron un estudio con un total de 14 pacientes en los que trasplantaron unidades foliculares en úlceras quirúrgicas o traumáticas que no respondían al trasplante tradicional de injertos de piel, observando una reepitelización completa en todos los casos. Sin embargo, en este estudio no existió grupo control ni fue un estudio aleatorizado, por lo que resulta difícil comparar resultados. Fox et al.69 presentaron un paciente con una úlcera venosa crónica de la pierna resistente a tratamiento conservador en la que trasplantaron punches de cuero cabelludo con folículos pilosos terminales en una zona, e injertos de punch sin pelo terminal en otra zona de igual superficie. Se observó una reducción del área total de la úlcera del 56% y del 73% a las 4 y 6 semanas del trasplante respectivamente, sobre todo a expensas de la zona que recibió los injertos punch de cuero cabelludo. Yang et al. compararon los resultados obtenidos en 40 pacientes con úlceras crónicas tratados con trasplantes de folículo piloso o con injertos de piel de espesor parcial, observando no solo que los injertos de folículos pilosos estimulan la curación de las úlceras, sino que las cicatrices de los casos trasplantados con folículos pilosos eran de una mejor calidad (piel menos contraída y más elástica) y tenían mejor aspecto estético que las cicatrices de los casos trasplantados con injertos de piel parcial70.
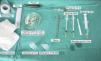
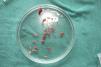
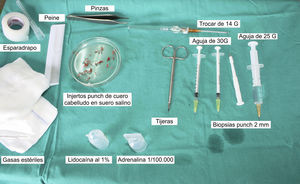
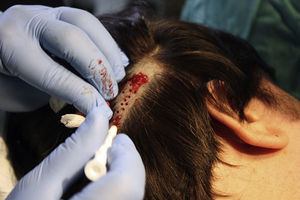
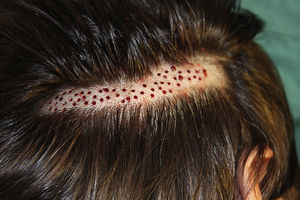
Técnica quirúrgica utilizada en el trasplante de folículos pilosos en úlceras crónicasLa técnica quirúrgica no precisa ser realizada en quirófano estéril, siendo un procedimiento mínimamente invasivo, seguro y de bajo coste, especialmente cuando lo comparamos con las técnicas de cirugía plástica convencional o de ingeniería tisular (figu. 3). En primer lugar, tras rasurar y anestesiar la zona donante, se extraen los injertos con un punch circular de biopsia de diámetro aproximado de 2mm (fig. 4), aunque el tamaño puede variar a juicio del cirujano. El motivo de utilizar estos punches tan pequeños es que las heridas remanentes curan en 5-6 días por segunda intención, sin necesidad de dar puntos de sutura y dejando solo una cicatriz puntiforme totalmente inapreciable e invisible para el paciente (fig. 5), lo que resulta importante desde el punto de vista estético. Las posibilidades de infección son muy reducidas al ser un tejido muy vascularizado.
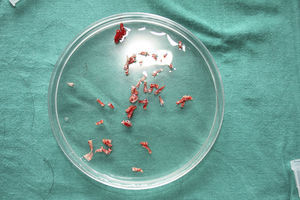
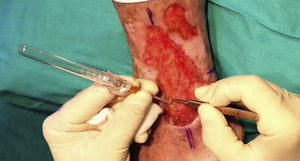
Tras su extracción, los injertos son introducidos en un recipiente estéril con suero salino hasta su implantación, que se lleva a cabo a los pocos minutos (fig. 6). Con el fin de disminuir el dolor asociado a las infiltraciones del anestésico en la periferia de la úlcera, una hora antes del procedimiento se podría aplicar una crema anestésica en oclusión sobre la superficie de esta. Los injertos punch se insertan en el interior del tejido de las úlceras realizando una mínima incisión de tamaño acorde las dimensiones del injerto (1,5mm de diámetro por 3-4mm de profundidad con un trocar de 14G). La inserción del injerto se realiza, una por una, con pinzas de punta muy fina (jeweler forceps o pinzas de joyero) (fig. 7). La densidad de injertos trasplantados al seno de las úlceras es de aproximadamente 5 injertos/cm2, al ser esta la densidad mínima que consideramos adecuada para garantizar la regeneración del tejido45, aunque esta densidad puede variar según cada cirujano. Tras finalizar el trasplante la úlcera tratada se cubre durante 4 días con un apósito vaselinado y vendaje de compresión terapéutica. Se recomienda al paciente reposo relativo durante 3-4 días, pero sin necesidad de inmovilización. En las primeras curas es importarte retirar los apósitos de forma lenta, y tras humedecerlos con suero fisiológico durante unos minutos previamente con el fin de evitar las adherencias al tejido.
En los trabajos publicados por nuestro grupo hemos observado que aproximadamente a las 18 semanas tras el trasplante se observa la mayor estimulación de la cicatrización de la úlcera. Finalmente resulta interesante destacar que, a pesar de que los injertos implantados en las úlceras contienen numerosos folículos terminales, los pelos que salen en las úlceras una vez cicatrizadas son más bien escasos en número (fig. 8). Este hecho también ha sido destacado por otros autores47,70. La explicación posible de este fenómeno es que el microambiente de la úlcera estimula las células foliculares a diferenciarse más en la dirección de la curación de la herida y no tanto en la fabricación del tallo piloso. Esta explicación concuerda con una sugerente teoría propuesta ya hace años por Jahoda et al.59, quienes plantearon que la prioridad evolutiva del folículo piloso humano es la curación de las heridas cutáneas y no la producción del tallo piloso, y que la maquinaria celular del folículo piloso, en función de factores microambientales de la piel, debe tomar partido entre producir un tallo piloso o participar en la curación de las heridas.
ConclusionesLos resultados obtenidos en nuestro estudio demuestran que el trasplante de injertos punch de folículos pilosos de cuero cabelludo estimula más la curación de las úlceras venosas crónicas que el trasplante de injertos punch de piel sin pelo. El trasplante de folículos pilosos parece ser una alternativa terapéutica eficaz en las úlceras venosas crónicas que no curan con tratamiento convencional. La realización de futuros ensayos clínicos será necesaria para evaluar el perfil de paciente y las características de las úlceras que se pueden beneficiar en mayor medida de este tipo de injertos, así como su uso en úlceras crónicas de otras etiologías.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.