Los agentes vesicantes constituyen un grupo de agentes químicos de guerra cuyo principal representante es la iperita, también conocida como gas mostaza. Las ampollas que aparecían en los intoxicados por iperita en combate durante la Primera Guerra Mundial hicieron que a todos los agentes incluidos en este grupo se les denomine hoy en día agentes «vesicantes». Sus efectos se producen fundamentalmente por la acción local de la forma líquida o del vapor sobre la piel, los ojos y el tracto respiratorio. Sin embargo, la gran capacidad de absorción de la forma líquida a través de la piel o de la forma de vapor tras la inhalación puede dar lugar a efectos sistémicos importantes. Desde nuestra experiencia y tras una revisión de la literatura médica, en el presente trabajo se analizan estos efectos, el tratamiento de las intoxicaciones y las secuelas a largo plazo.
Vesicants are a group of chemicals used in warfare. The most representative agent is yperite, also known as mustard gas. The blisters that appeared on those exposed to yperite during combat in the First World War are responsible for the current name—vesicants—for this group of chemicals. Their affects are produced mainly through localized action of liquid or vapor forms on the skin, eyes, and respiratory tract. However, the high absorption of the liquid form through the skin or the vapor form on inhalation may cause substantial systemic effects. Here we analyze these effects, treatment of intoxication, and long-term sequelae, drawing on our experience and a review of the literature.
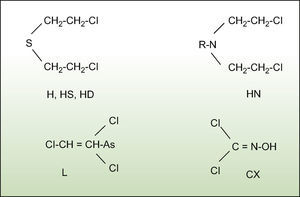
El nacimiento de la guerra química moderna se produjo durante la Primera Guerra Mundial, cuando sustancias químicas que se utilizaban de forma habitual en la industria química, como el cloro o el fosgeno, se emplearon con fines tácticos. Los buenos resultados de estos ataques llevaron a que tanto los alemanes como los países aliados pusiesen en marcha programas de investigación y desarrollo de armas químicas. Se buscaban sustancias químicas cuyas propiedades fisicoquímicas y toxicológicas fuesen las más adecuadas para utilizar en combate. De esta manera nacieron los denominados agentes vesicantes de guerra, un grupo de armas químicas que incluye las mostazas de azufre, las mostazas de nitrógeno, las lewisitas (L) y la oxima de fosgeno (CX).
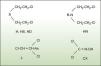
Los agentes vesicantes más importantes —debido a que distintos países los han empleado en conflictos bélicos y los han almacenado en cantidades importantes— son las mostazas de azufre, especialmente el sulfuro de bis (2-cloroetilo), conocido coloquialmente como iperita o gas mostaza (fig. 1). La iperita se sintetizó por primera vez entre 1820 y 1860, y Guthrie1 y Niemann2 describieron sus propiedades vesicantes en 1860. En 1886, Meyer sintetizó una iperita de mayor pureza mediante la reacción de tiodiglicol y tricloruro de fósforo3. Pero no fue hasta la Primera Guerra Mundial cuando Lommel y Steinkopf desarrollaron el proceso de Meyer para producirla a gran escala y utilizaron cloruro de tionilo (la iperita así sintetizada se conocía como Lost, acrónimo hecho con los apellidos de los 2 científicos alemanes)4. Curiosamente, el Reino Unido también había estudiado el posible uso de la iperita como arma unos 15 meses antes de que los alemanes la utilizasen por primera vez el 12 de julio de 19175. Este primer ataque tuvo lugar en Ypres, de ahí la denominación “iperita”. Los primeros afectados describían un olor que les recordaba al ajo o a la mostaza, de ahí que también se le denomine gas mostaza. A pesar de que esta característica organoléptica se suele citar con mucha frecuencia, la experiencia de los intoxicados de la guerra Irán-Iraq muestra que es muy subjetiva y que, incluso, puede variar con la pureza de la sustancia6. De hecho, la iperita suele denominarse como H o HS (del alemán Hun Stoffe) para referirse a la que se obtiene por el procedimiento de Levinstein, que contiene un 20–30% de impurezas, mientras que la denominación de HD (la D hace referencia a “destilada”) se refiere a una iperita de mayor pureza. Otra denominación frecuente en la Primera Guerra Mundial fue “cruz amarilla”, ya que era la forma que tenían los alemanes para marcar los proyectiles que contenían el agente7. Las llamativas lesiones que provocaba y la eficacia de sus ataques hicieron que durante la Primera Guerra Mundial se le llegase a denominar como “el rey de los gases”8.
Según algunos autores, el motivo por el que no se utilizaron armas químicas en la Segunda Guerra Mundial fue el rechazo de Hitler a emplearlas, al haber tenido una irritación ocular intensa tras un ataque del Reino Unido con iperita en la Primera Guerra Mundial9. Si bien no se han descrito casos de uso de iperita durante la Segunda Guerra Mundial, el ataque de la aviación alemana en el puerto italiano de Bari el 2 de diciembre de 1943 afectó al buque norteamericano USS John Harvey, que llevaba unas 2.000 bombas cargadas con 45kg de iperita cada una, lo que provocó su dispersión que afectó a más de 1.000 personas10.
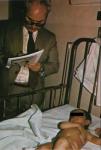
Se han descrito otros casos de utilización de iperita: España en la guerra del Rif en la década de 192011; Italia en Etiopía en 1935–1936, que fue quizá el primer ataque con un agente químico en sistemas de aerosolización en aeronaves12; desde 1938, Japón contra China13, y probablemente Egipto en la Guerra Civil yemení a mediados de la década de 196014. Más recientemente, las tropas iraquíes utilizaron la iperita en la guerra Irán-Iraq, donde las armas químicas causaron más de 45.000 bajas, civiles y militares, aunque esta cifra varía en función de las fuentes15. Desde mayo de 1983 hasta agosto de 1988 se realizaron 12 misiones de investigación de la Organización de las Naciones Unidas que demostraron la utilización de iperita por parte del ejercito iraquí (fig. 2)16.
Al final de la Segunda Guerra Mundial, gran cantidad del armamento químico de los alemanes y de las propias tropas aliadas se vertió al mar, sobre todo en el mar del Norte y en el mar Báltico, por lo que no es raro que se den casos de intoxicación por iperita en pescadores que faenan actualmente en estas aguas17. Algo parecido ocurre con el armamento químico que quedó abandonado y no controlado en lo que fue el teatro de operaciones europeo de la Primera y de la Segunda Guerra Mundial. Se siguen encontrando antiguas armas químicas que en ocasiones han dado lugar a casos de intoxicación en la población civil18,19. Asimismo, se han dado casos de intoxicación en centros de almacenamiento y destrucción de armas químicas20.
A pesar de que la iperita es el principal representante de las mostazas de azufre, existen otras moléculas con actividad vesicante. De hecho, la Convención para la prohibición de Armas Químicas (CAQ) incluye 9 mostazas azufradas a las que se les están realizando inspecciones de verificación21. La CAQ es un tratado internacional de no-proliferación que prohíbe el desarrollo, la producción, el almacenamiento, la transferencia y el empleo de armas químicas. Es, además, un tratado de desarme, ya que impone a los Estados Partes que posean armas químicas e instalaciones para producirlas, que procedan a su destrucción. La CAQ entró en vigor en 1997 y según lo establecido en su Artículo VIII se creó la Organización para la Prohibición de Armas Químicas, con sede en La Haya, organismo responsable de velar por el cumplimiento de las disposiciones de la convención.
Durante la década de 1930, las modificaciones en la estructura de las mostazas de azufre llevaron al descubrimiento de las mostazas de nitrógeno, con unas propiedades muy parecidas a las de sus análogas azufradas (fig. 1)22. Hasta hoy no se han descrito casos de utilización de este grupo de agentes vesicantes. Los principales representantes de las mostazas de nitrógeno son la bis (2-cloroetil) etilamina, la bis (2-cloroetil) metilamina y la tris (2-cloroetil) amina, todas ellas recogidas en las listas de sustancias sujetas a inspecciones de verificación de la CAQ21. La bis (2-cloroetil) metilamina es la más conocida, pero no por su consideración de arma química, sino por su uso en el tratamiento del cáncer.
La 2-clorovinildicloroarsina o L (fig. 1) se sintetizó en 1903, pero adquirió su nombre cuando en 1918 el equipo dirigido por el capitán Lewis del Servicio de Guerra Química del Ejército de EE. UU. la redescubrió como arma química23,24. Ese mismo año se llegó a enviar un cargamento con 150 toneladas rumbo a Europa, pero el fin de la guerra hizo que el buque arrojase este cargamento al mar25,26. No hay evidencia de su uso en combate, aunque en algunas publicaciones se cita una posible utilización de Japón contra China a partir de 193913. El principal problema de la L como arma es que se hidroliza rápidamente, por lo que se inactivaría en condiciones de elevada humedad en el ambiente27. En la antigua Unión Soviética se llegó a producir una mezcla de iperita y L, denominada HL. La iperita, al tener un punto de fusión de 14,4°C, no se podría utilizar en condiciones de baja temperatura, mientras que la mezcla HL, con un punto de fusión por debajo de 0°C, no presentaría este problema. Al igual que ocurre con la iperita, no son raros los casos de intoxicación por L en personas que entran en contacto con armamento abandonado y no controlado, sobre todo en Japón y China19,28. La lista de sustancias sujetas a inspecciones de verificación de la CAQ incluye otras 2 moléculas en el grupo de las L: la bis (2-clorovinil) cloroarsina (L2) y la tris (2-clorovinil) arsina (L3)21.
Algunas publicaciones también incluyen dentro de los agentes vesicantes a la CX (fig. 1), ya que se cree que la antigua Unión Soviética pudo haberla producido como arma. Sin embargo, esta sustancia no viene recogida en las listas de sustancias sometidas a inspecciones de verificación de la CAQ21.
A pesar de que el principal representante de las mostazas es conocido como “gas” mostaza, la realidad es que, tanto las mostazas de azufre como las de nitrógeno y las L, son líquidos a temperatura ambiente (tabla 1)29. Las mostazas, a diferencia de la L, se consideran agentes persistentes debido a su volatilidad relativamente baja que les permite permanecer en la zona en la que se emplean durante períodos de tiempo más o menos prolongados. La CX, por el contrario, es un sólido cristalino con una elevada volatilidad.
Propiedades fisicoquímicas que afectan la persistencia de los principales agentes vesicantes29
| Agente | Punto de fusión (°C) | Presión de vapor (mmHg, 25°C) | Volatilidad (mg/m3, 25°C) |
| HD | 14,45 | 0,11 | 910 |
| HN3 | −3,7 | 0,011 | 121 |
| L | −1,2 | 0,35 | 3.900 |
| HL | −25,4 | 0,361 | 3.900 |
| CX | 35–40 | 11,2 | >20.000 |
CX: oxima de fosgeno; HD: iperita destilada; HL: mezcla de iperita y lewisita; HN3: tris (2-cloroetil) amina; L: lewisita.
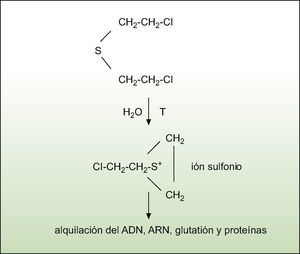
Aunque la iperita se utilizó por primera vez en 1917, todavía no se conoce bien su mecanismo de acción, si bien hay distintas hipótesis. Las mostazas de azufre o de nitrógeno tienen una reacción de ciclación intramolecular que da lugar a iones sulfonio o imonio, respectivamente (fig. 3)30. Se ha visto que esta reacción intramolecular está favorecida por la presencia de agua y por un aumento de la temperatura31, de ahí que las zonas más húmedas del cuerpo sean las más susceptibles. Los iones sulfonio e imonio son potentes agentes alquilantes del ácido desoxirribonucleico (ADN), ácido ribonucleico, glutatión y proteínas, entre otros. La alquilación del ADN da lugar a entrecruzamientos y rotura de las cadenas, y se activan polimerasas como la poli (difosfato de adenosina-ribosa) polimerasa, que produce una depleción de su sustrato, el dinucleótido de nicotinamida y de adenina, y una inhibición de la síntesis de trifosfato de adenosina, que provoca la muerte de la célula32–34. Éste es el motivo por el que las células con mayor velocidad de división son las más afectadas por las mostazas31. Se ha observado que la iperita parece tener una afinidad especial por el N-7 de la guanina35. Los iones sulfonio e imonio también alquilan moléculas nucleofílicas como las enzimas que contienen grupos sulfidrilo y que están encargadas de regular la homeostasis del calcio en la célula36. Esto provocará un aumento de la concentración intracelular de calcio, que altera los microfilamentos responsables de la integridad de la célula y activa endonucleasas, proteasas y fosfolipasas, que finalmente provocan apoptosis31. Además, las mostazas interaccionan con el glutatión y aumentan los radicales libres que, por peroxidación de los lípidos de membrana, alteran la integridad y funcionamiento de la membrana celular31,37. Algunos trabajos plantean que el estrés oxidativo por especies reactivas de oxígeno tiene un papel relevante en el mecanismo de acción toxicológico de la iperita38,39. Finalmente, las mostazas estimulan la producción de citoquinas, e inducen reacciones inmunológicas y lesiones tisulares31.
Se desconoce el mecanismo exacto por el que la L produce su acción citotóxica, pero su principal acción parece ser a nivel mitocondrial sobre el ácido lipoico de la piruvato deshidrogenasa: impide la formación de acetil-coenzima A a partir de piruvato40–42. En cuanto a la CX, se desconoce su mecanismo de acción.
Clínica y fisiopatologíaLa información disponible sobre la clínica y los efectos de los agentes vesicantes se refiere sobre todo a la iperita y proviene fundamentalmente de la experiencia de la Primera Guerra Mundial y de la guerra Irán-Iraq. Por este motivo, la experiencia reciente en países occidentales en la atención a estos pacientes es más bien escasa, salvo algunas excepciones. En la década de 1980, durante la guerra Irán-Iraq, Irán envió a más de 200 afectados por iperita a hospitales europeos, incluido el Hospital Militar Central Gómez Ulla (hoy Hospital Central de la Defensa Gómez Ulla) en Madrid. En el año 1986, este hospital recibió 20 víctimas iperitadas iraníes: 16 hombres (militares y civiles) y 4 mujeres, 2 de ellas niñas. Posteriormente, en 1987, recibió una docena más de víctimas, en su mayoría personal sanitario al que se evacuó de un hospital atacado con armas químicas.
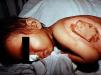
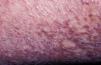
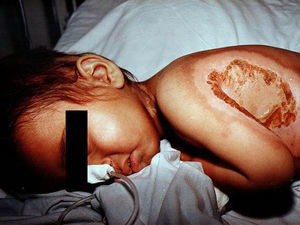
Tras la exposición a la iperita hay un período de latencia asintomático hasta que aparecen los primeros síntomas y signos de la intoxicación, lo que dificulta tanto el diagnóstico diferencial como el triage (clasificación de afectados) por parte del personal sanitario. Este período de latencia es de 2–48h, en función de la dosis o Ct (producto de la concentración del agente y el tiempo de exposición), la temperatura, la humedad y la parte del cuerpo expuesta. Las zonas más sensibles son aquéllas de menor espesor y mayor humedad, de ahí que las partes más afectadas sean el tracto respiratorio, los ojos y, en la piel, la axila (fig. 4), el cuello, el pliegue del codo, la ingle, los genitales y el perineo43–45. Por lo tanto, los efectos locales afectan principalmente a la piel, al tracto respiratorio y a los ojos, aunque se puede producir una lesión directa del tracto gastrointestinal por ingestión del agente (por ejemplo, al consumir alimentos contaminados).
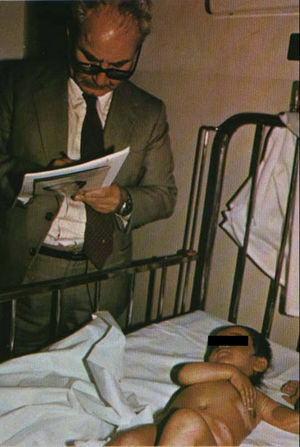
Las zonas más húmedas del cuerpo, como la axila, son las más sensibles a la acción de la iperita. La niña de la imagen tenía un año de edad cuando experimentó los efectos tóxicos de la iperita en el ataque iraquí al pueblo de Aloot (Irán) en 1987. Hoy tiene graves secuelas que afectan su sistema respiratorio, piel y ojos. Además, tiene importantes problemas psicológicos relacionados con estas lesiones. Cortesía del Dr. Shahriar Khateri.
La iperita se absorbe a través de la piel, los ojos, por inhalación e, incluso, a través del tracto gastrointestinal si es ingerida46. Tanto en forma líquida como en forma de vapor, la elevada lipofilia de la iperita hace que la piel sea una buena vía de entrada, y aumenta la absorción al aumentar la temperatura. Una vez absorbida, los efectos sistémicos afectan sobre todo a la médula ósea, el tracto gastrointestinal y el sistema nervioso central. También se ha observado que una vez absorbida, y dada su naturaleza lipofílica, la iperita se acumula en tejidos grasos y en el sistema nervioso central47. La muerte en las primeras 24h tras la exposición suele deberse a la insuficiencia respiratoria aguda, consecuencia de la obstrucción del árbol bronquial por seudomembranas y laringoespasmo20. La muerte a partir del tercer día suele deberse a la neumonía bacteriana favorecida por la depresión de la médula ósea directa que induce el agente. En la Primera Guerra Mundial, la mortalidad en los afectados por iperita fue del 2–3%47–49 y en la guerra Irán-Iraq fue del 3–4%46. En el incidente de Bari la mortalidad fue del 13–14%, pero muchas muertes se debieron a los efectos mecánicos y térmicos de la munición convencional, y no a los efectos tóxicos de la iperita10. De hecho, aunque los agentes vesicantes se solían clasificar como agentes químicos de guerra letales, su acción es principalmente incapacitante.
Las mostazas de nitrógeno tienen efectos similares a los de las mostazas de azufre, pero sus efectos sobre el sistema nervioso central son más graves y en estudios in vivo en modelos animales se observa que la administración intravenosa da lugar a convulsiones50. La L también presenta una buena absorción a través de la piel y las mucosas29. La principal diferencia con respecto a las mostazas es que no existe un período de latencia, y produce dolor e irritación de forma inmediata. Aunque sus efectos están menos estudiados que los de las motazas, distintos estudios in vivo en modelos animales y casos de exposición accidental en el hombre muestran unos efectos muy parecidos7,51.
PielLos niveles a partir de los que se producen los primeros síntomas y signos de intoxicación en la piel son de 100–300mgmin/m3 para la iperita en forma de vapor y de 10–20μg/cm2 para la iperita líquida52–55. Se ha observado que 20μg/cm2 de iperita líquida son suficientes para producir ampollas en la piel, mientras que sólo se necesitan 4μg/cm2 de iperita en forma de vapor para producir el mismo efecto54,56. El motivo es que la iperita en forma líquida, al entrar en contacto con la piel, se absorbe en un 10–20% por su elevada lipofilia, pero el 80–90% restante se volatiliza31,57. Del 10–20% que atraviesa la piel un 10% se fija a macromoléculas, mientras que un 90% pasa a la circulación sistémica57,58. La rápida absorción se refleja en que 30min después del contacto ya no se detecta iperita sin metabolizar en la piel47. En nuestra experiencia en el Hospital Gómez Ulla los análisis de las muestras obtenidas de suero, orina y del agua procedente del primer lavado que se hizo de los heridos no indicaron presencia de iperita ni de otro tipo de agente químico de guerra.
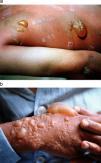
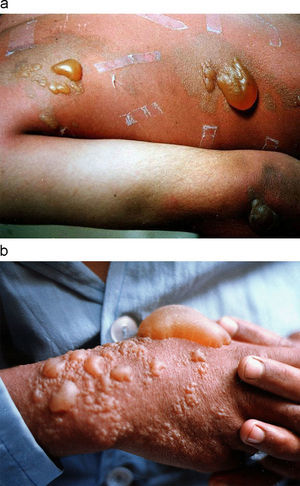
El eritema aparece a las 2–48h después de la exposición y, posteriormente, aparecen ampollas en las zonas eritematosas. Inicialmente pueden aparecer pequeñas ampollas en la periferia de la zona eritematosa, en forma de “collar de perlas”, que van uniéndose entre sí para formar ampollas de mayor tamaño (fig. 5)59. En lesiones graves, sobre todo por exposición al agente en forma líquida, se produce necrosis y son más susceptibles a infecciones secundarias, que complican la evolución de la lesión. Como se ha comentado, dada la gran reactividad de las mostazas, se ha observado que el líquido de las ampollas no contiene agente activo, por lo que no hay riesgo de intoxicación por contacto60–63. La posterior aparición de ampollas en zonas con eritema no se debe al contacto con la iperita presente en las ampollas, sino a la fricción de la piel que da lugar al signo de Nikolsky45.
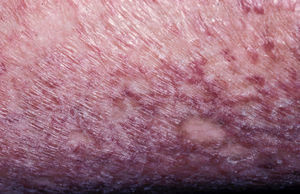
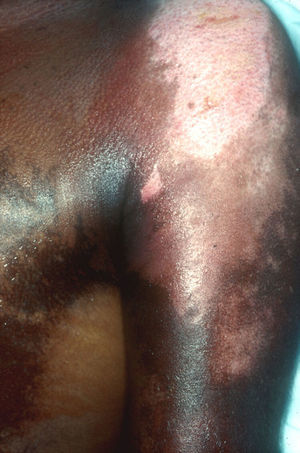
La reepitelización es lenta debido a las alquilaciones del ADN, que impiden que las células epidérmicas proliferen a una velocidad normal62, y se completa aproximadamente a los 10–15 días, con escasas cicatrices. En nuestro caso, solamente un paciente presentó cicatrices hipertróficas en los miembros inferiores (fig. 6). Sin embargo, la mayoría de los pacientes presentó una hiperpigmentación residual intensa, de inicio folicular y extensión gradual en mancha de aceite (fig. 7). La pigmentación se hace más evidente en los pliegues: cuello, axilas, ingles y región genital.
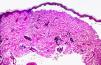
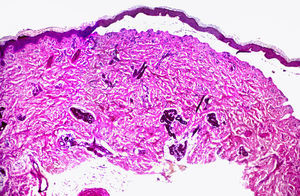
Desde el punto de vista anatomopatológico, en las lesiones más recientes pueden observarse ampollas subepidérmicas con degeneración de la capa basal (fig. 8). Las ampollas se forman entre la epidermis y la dermis, al alterarse los hemidesmosomas que unen la membrana basal con los queratinocitos de la epidermis45; muestran un escaso contenido en células inflamatorias, y la zona PAS (tinción con ácido peryódico de Schiff) positiva de la membrana basal se sitúa en el suelo de la ampolla. En otros casos, el techo de la ampolla se muestra completamente necrótico. En lesiones más evolucionadas, el despegamiento de la ampolla puede situarse intraepidérmicamente, por regeneración del epitelio. En ese momento puede mostrar dilatación de los capilares e infiltrado inflamatorio mononuclear. En la fase de hiperpigmentación se observa una gran acumulación de melanina en todos los estratos de la epidermis, incluso en el estrato córneo. Además, se pueden observar numerosos melanófagos con gruesos gránulos de melanina en la parte superior de la dermis.
En la guerra Irán-Iraq, las tropas iraquíes no se limitaron a atacar unidades militares, sino que atacaron también a la población civil. Uno de los ataques más importantes se produjo el 28 de junio de 1987 en la ciudad iraní de Sardasht, donde 4 bombas de 250kg de iperita provocaron unos 4.500 afectados, en su mayoría civiles. La experiencia que obtuvieron de estos ataques los médicos iraníes indica que los niños son más susceptibles que los adultos a los efectos de la iperita en la piel y que la evolución de las lesiones es mucho más rápida64.
A diferencia de las mostazas, el contacto directo con la L produce de forma inmediata irritación y dolor en la zona de contacto. La L se absorbe más rápidamente que la iperita a través de la piel (3–5min)7,27,62. Las lesiones cutáneas por L se caracterizan por la aparición inicial de una pequeña ampolla en el centro del área eritematosa que se expande para englobar toda el área afectada. Además, la reepitelización de las lesiones por L es más rápida y las alteraciones de la pigmentación de la piel son más raras que en las intoxicaciones por iperita65. En el líquido de las ampollas producidas por L sí se ha observado la presencia del agente activo, así como la de productos de su oxidación que tienen acción vesicante62,65. La CX también produce una irritación muy intensa e inmediata en contacto con la piel, pero la aparición de ampollas es rara62.
Tracto respiratorioLa intoxicación aguda por iperita se caracteriza por ronquera y tos productiva59,66–68. En casos graves puede producirse edema pulmonar no cardiogénico, que fue el motivo del fallecimiento de un paciente a las 48h de su ingreso en nuestro hospital. Inicialmente, se produce una lesión de la mucosa y, posteriormente, de la capa muscular del árbol bronquial. Estas lesiones pueden dar lugar a seudomembranas desde las partes proximales de las vías respiratorias hasta las partes distales, con la consiguiente obstrucción69.
No hay información directa de los efectos de la L en el tracto respiratorio del hombre, pero se intuye que debe producir una irritación intensa al entrar en contacto con el vapor27. Los capilares pulmonares parecen ser muy susceptibles a la acción de la L, de manera que si la piel entra en contacto con el agente hay riesgo de hemoconcentración e hipotensión (“shock por L”), pero no sólo por una alteración de la permeabilidad de los capilares a nivel local, sino porque al pasar a la circulación sistémica la L llega a los pulmones y afecta a los capilares pulmonares, con riesgo de producir edema pulmonar27.
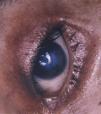
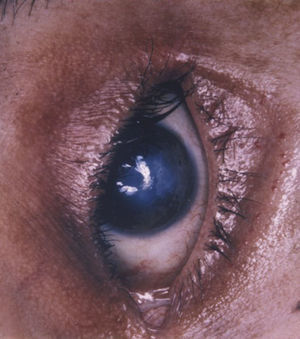
OjosLos ojos son muy sensibles a los agentes vesicantes en forma de vapor. De hecho, el período de latencia hasta que aparecen los primeros síntomas o signos clínicos oculares es menor que en la piel70,71. La iperita penetra en la córnea más rápidamente que en la piel72. Una exposición a 50mgmin/m3 produce los primeros efectos oculares y una exposición a 200mgmin/m3 provoca la total incapacitación del individuo con una irritación muy intensa y ceguera temporal debida al edema palpebral65. La irritación ocular inicial progresa hacia una conjuntivitis con fotofobia, blefaroespasmo, dolor y lesión corneal59. La pérdida de visión permanente es rara, excepto en casos graves de lesiones por altas concentraciones o por contacto directo con el agente en forma líquida, que puede producir ulceración corneal. En 2 de los pacientes tratados en el Hospital Gómez Ulla, las úlceras corneales evolucionaron hacia opacidades graves que precisaron trasplante de córnea45 (fig. 9). En algunos casos también se produce miosis por la actividad colinérgica de la iperita, que puede dificultar el diagnóstico diferencial con los agentes neurotóxicos de guerra por parte del personal sanitario62. De hecho, las mostazas de azufre y de nitrógeno y, en menor grado, la L, son capaces de inhibir la acetilcolinesterasa73,74.
No hay información directa sobre los efectos oculares de la L y de la CX en el hombre. En estudios in vivo en conejos se observa que la L produce rápidamente edema palpebral y miosis75.
Efectos sistémicosMédula óseaEl principal efecto sistémico de las mostazas es la depleción general de todos los elementos de la médula ósea, de ahí que muchas veces se haga referencia a esta acción como un efecto “radiomimético”72. Los granulocitos y megacariocitos parecen ser los más susceptibles a la acción de la iperita. En los primeros 3 días puede producirse leucocitosis, seguida de una leucocitopenia a los 7–10 días después de la exposición. En los pacientes iraníes afectados por iperita en la guerra Irán-Iraq llegaron a describirse situaciones de menos de 200leucocitostotales/μl59,76. El desarrollo de una leucocitopenia o de una anemia aplásica graves son indicadores de una mala evolución clínica7,59.
Tracto gastrointestinalLa mucosa gastrointestinal es muy sensible a las mostazas, no sólo por un efecto local por ingestión, sino por un efecto sistémico tras la inhalación o el contacto con la piel. Los síntomas más frecuentes incluyen náuseas, vómitos, dolor, diarrea y postración72.
Sistema nervioso centralLa experiencia de la Primera Guerra Mundial y de la guerra Irán-Iraq indica que la inhalación de concentraciones altas de iperita puede dar lugar a convulsiones, seguidas de una fase depresiva en la que el sujeto está apático77.
TratamientoInicialmente, es fundamental llevar a cabo una descontaminación del afectado una vez retirado de la zona de exposición. El fin de la descontaminación es finalizar el contacto entre el agente y el individuo y evitar que se produzca una contaminación secundaria del personal que entra en contacto con el afectado, incluido el personal sanitario. La rápida absorción de la iperita y la L a través de la piel hace necesario que la descontaminación se realice en menos de 30 o 5min, respectivamente7,27,47,62. De hecho, el Regimiento de Defensa NBQ del Ejército de Tierra hace referencia a la “media hora de oro”, para recalcar la importancia de realizar una rápida evacuación y descontaminación del personal afectado.
El escaso tiempo de reacción para realizar la descontaminación ha llevado a que el Ejército de EE. UU. incluya en el material complementario individual de defensa química de los combatientes la pomada SERPACWA (Skin Exposure Reduction Paste Against Chemical Warfare Agents) que impide el paso de agente líquido, pero no de vapor. Esta pomada está pensada para que el combatiente se la aplique en las zonas más sensibles a la iperita.
A pesar de que la descontaminación utilizando únicamente agua dio buenos resultados a las tropas iraníes en la guerra Irán-Iraq78, la baja hidrosolubilidad de los agentes vesicantes implica que mediante este sistema existe un alto riesgo de que el agente se extienda por una mayor superficie corporal, lo que extiende los efectos locales y favorece la aparición de efectos sistémicos. Lo mejor es utilizar previamente un material absorbente, como tierra de Fuller, y a continuación lavar con abundante agua o con una solución de hipoclorito sódico al 0,5%79,80. Sobre los ojos está indicada la utilización inmediata de abundante agua o de suero fisiológico.
AntídotosActualmente no existen antídotos frente a las intoxicaciones por mostazas pero se están investigando distintos barredores con actividad nucleofílica, como el tiosulfato sódico, la N-acetil-cisteína o la amifostina, barredores que oxiden la iperita a su metabolito sulfóxido, que no es tóxico (pero sin metabolizarlo a su metabolito sulfona, que sí es tóxico), inhibidores de polimerasas, y moduladores del calcio47,61,81,82.
En el caso de la L se dispone de un antídoto, el 2,3-dimercaptopropanol, conocido como dimercaprol o BAL (British Anti-Lewisite). El dimercaprol forma un complejo hidrosoluble con el arsénico que se elimina en la orina83. El dimercaprol se puede presentar en distintas formas farmacéuticas: pomada oftálmica, pomada dermatológica o en ampollas para su administración por vía intramuscular29,83. Las pomadas presentan el inconveniente de tener una baja estabilidad y de que su aplicación debe realizarse inmediatamente tras el contacto con el agente, de ahí que en la práctica su eficacia sea baja. La administración de dimercaprol por vía intramuscular presenta cierta eficacia para contrarrestar los efectos sistémicos, pero es muy dolorosa y tiene efectos adversos importantes, como hipertensión arterial, taquicardia, náuseas, vómitos, dolor de cabeza y sensación de quemazón en la boca, los labios y la garganta24,83. El ácido meso-2,3-dimercaptosuccínico y el ácido 2,3-dimercapto-1-propanosulfónico son otras alternativas al dimercaprol.
Tratamiento sintomático y de soporteAl no disponerse de tratamiento antidótico específico para las intoxicaciones por mostazas, el objetivo del tratamiento es aliviar los síntomas, evitar las infecciones y estimular la reepitelización y la cicatrización49,59. La experiencia con los afectados por iperita en la guerra Irán-Iraq indica que el resultado final y el proceso de curación de las lesiones cutáneas por iperita dependen más de la gravedad inicial de la lesión (dosis o Ct a la que se expone el individuo) que del tratamiento aplicado. Dado que el origen de las lesiones cutáneas por agentes vesicantes es distinto de las de origen térmico, la regla de los 9 de Wallace o la figura de Lund-Browder son poco eficaces para determinar la gravedad inicial y establecer la fluidoterapia. La deshidratación observada en los pacientes iraníes que durante la guerra Irán-Iraq se trasladaron a distintos hospitales de Europa fue debida a las malas condiciones higienicosanitarias durante la evacuación, y no a un efecto directo de la iperita. Aun así, se debe mantener el estado metabólico adecuado y reemplazar la pérdida de fluidos y electrolitos, teniendo en cuenta que esta pérdida de fluidos no es tan grave como la que se produce en casos de quemaduras térmicas.
La principal complicación de las lesiones cutáneas es la aparición de infecciones. No existe consenso entre los distintos autores en si se deben o no romper las ampollas y en la forma óptima de tratamiento (vendajes o no; húmedos o secos)59. Sin embargo, la doctrina del Ejército de EE. UU. y la experiencia de los profesionales sanitarios en Irán recomiendan romperlas (excepto las pequeñas, de menos de 2cm) de forma controlada y, posteriormente, colocar vendajes con antisépticos locales46,62. Las víctimas tratadas en el Hospital Gómez Ulla evolucionaron favorablemente con lavados antisépticos y con la aplicación de una crema de sulfadiazina argéntica al 1%, de amplio uso entonces en el tratamiento de quemados. Cabe resaltar que en estudios in vivo con modelos animales, tanto con iperita como con L, se han obtenido buenos resultados en la regeneración epitelial con dermoabrasión y láser49,84,85.
En las lesiones oculares, los analgésicos locales pueden aumentar el daño de la córnea por lo que se debe recurrir a analgésicos sistémicos29. Los pacientes con lesiones de córnea deben recibir midriáticos para prevenir adherencias entre el iris y la córnea. En caso de acumulación de secreciones se debe irrigar con suero fisiológico estéril y, para impedir que los párpados se peguen, puede aplicarse petrolato estéril (Vaselina®).
Aunque no se ha probado su eficacia, en la última guerra de Iraq, el Ejército de EE.UU. disponía de factor estimulante de colonias de granulocitos en la cadena logística de abastecimiento de recursos sanitarios para tratar la posible leucocitopenia en caso de producirse intoxicados por mostazas46,86.
Efectos a largo plazoEn 236 veteranos iraníes de la guerra Irán-Iraq se observó que, entre 2 y 28 meses después de la exposición, las principales secuelas afectaban al sistema respiratorio (78%), al sistema nervioso central (45%), a la piel (41%) y a los ojos (36%)66. En un estudio posterior en 34.000 iraníes que habían estado expuestos a la iperita 13–20 años atrás se vio que las principales complicaciones se producían en el sistema respiratorio (42,5%), ojos (39,3%) y piel (24,5%)87. Un estudio más reciente de 40 veteranos iraníes que presentaron cuadros de intoxicación aguda por iperita 16–20 años atrás, muestra efectos sobre todo en el tracto respiratorio (95%), el sistema nervioso periférico (77,5%), la piel (75%) y los ojos (65%)88.
PielEl efecto a largo plazo más característico en la piel son los cambios en la pigmentación, con la aparición tanto de áreas hipopigmentadas debido a la destrucción de melanocitos, como de áreas hiperpigmentadas y piel seca49,61,66,88–90.
Tracto respiratorioEn los afectados iraníes las principales complicaciones a largo plazo aparecen a los pocos meses o, incluso, varios años después de la exposición, e incluyen bronquitis crónica, asma, estrechamiento de las vías aéreas superiores, bronquiectasia y fibrosis pulmonar66,91,92. Ghanei et al93 indican que la exposición a la iperita, incluso subclínica (concentraciones tan bajas que no producirían síntomas de intoxicación aguda durante la exposición), puede producir bronquiolitis obliterante.
OjosEn los afectados iraníes de la guerra Irán-Iraq se han observado efectos crónicos y tardíos de la iperita que se caracterizan por lesiones en la superficie ocular y en la córnea, que dan lugar a irritación ocular y a un deterioro progresivo de la visión. Javadi et al94 y Solberg et al71 plantean una posible causa inmunológica.
OtrosEn trabajadores de instalaciones de producción de iperita y personal que trabajó en el desmantelamiento de estas instalaciones se ha observado un aumento significativo de la incidencia de cáncer que afecta, sobre todo, al tracto respiratorio77,95–103. Sin embargo, en el caso de exposiciones aisladas a la iperita, normalmente en combate, los estudios epidemiológicos no muestran un aumento significativo de procesos neoplásicos con respecto a los grupos control77,99,104,105. En un estudio reciente, Emadi et al90 indican que el número de casos de cáncer cutáneo relacionado con la exposición aguda y crónica a la iperita es bajo, aunque consideran que su aparición no resulta extraña por el mecanismo de acción de ésta. Aun así, los autores plantean que no está claro si estos casos de cáncer cutáneo están relacionados con la acción de la iperita sobre el ADN o con la presencia de cicatrices o úlceras crónicas. La actividad alquilante de la iperita y su capacidad “radiomimética” podrían ser las causantes de la especial clínica poiquilodérmica observada, con límites mal definidos, alteraciones de la pigmentación, atrofia reticular y, ocasionalmente, angiomas eruptivos y telangiectasias, que asimismo resultan diferentes de las secuelas por quemaduras. Por otro lado, el hecho de que los carcinomas observados se localicen sobre úlceras crónicas y cicatrices de antiguas lesiones provocadas por la iperita, no parece diferir de lo esperado en secuelas por otros tipos de heridas antiguas. Sin embargo, la mayor frecuencia de carcinoma basocelular sobre carcinoma espinocelular es justo lo inverso a lo habitual en estos casos.
En un estudio de 2004 de Ghanei et al106 no se observaron efectos sobre la fertilidad de los afectados iraníes. Finalmente, tanto en los afectados por iperita en la Primera Guerra Mundial como en los afectados en la guerra Irán-Iraq se ve una elevada incidencia de trastorno por estrés postraumático7,66.
ConclusionesA pesar de haberse desarrollado como armas en la Primera Guerra Mundial, los mecanismos de acción específicos de los agentes vesicantes de guerra todavía no se han dilucidado totalmente. Quizá esto se debe a que, al ser potentes agentes alquilantes de macromoléculas, inducen múltiples procesos que en su conjunto son los causantes de la clínica y los efectos fisiopatológicos observados. Los efectos locales se producen fundamentalmente en la piel, el tracto respiratorio y los ojos. Sin embargo, al ser sustancias lipófilas presentan una buena absorción, que da lugar a efectos sistémicos importantes, sobre todo en la médula ósea, el tracto gastrointestinal y el sistema nervioso central. Debido al mecanismo de acción inespecífico de estos agentes no se dispone, hasta hoy, de antídotos para el tratamiento de las intoxicaciones. La excepción es el dimercaprol, con cierta eficacia para minimizar los efectos sistémicos de la L.
Los agentes vesicantes se pueden considerar agentes incapacitantes, tal y como demuestra la baja mortalidad observada en los conflictos armados en los que se han utilizado y, sobre todo, cuando se comparan con otros agentes químicos de guerra. Un elevado número de incapacitados por estos agentes puede provocar serios problemas al enemigo ya que, al contrario que las víctimas mortales, requieren descontaminación, evacuación y tratamiento sanitario.
No debemos minusvalorar la importante alteración de la calidad de vida de los pacientes con secuelas por iperita, en gran parte debida a la sintomatología de tipo dermatitis atópica. Tampoco debemos descartar las posibilidades de cancerización propias de cicatrices antiguas, sobre todo por la importancia de evitar factores sobreañadidos, como la exposición solar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores desean agradecer a los doctores Manuel Domínguez Carmona, Benedicto Hernández Moro, Luis Requena y Shahriar Khateri su generosa dedicación y colaboración en la elaboración de este trabajo.