El parche biosintético de colágeno porcino de tipoI se está utilizando en el cierre de úlceras y heridas quirúrgicas oncológicas que curan por segunda intención.
ObjetivoConocer los factores que se asocian al tiempo de cicatrización de este tipo de heridas.
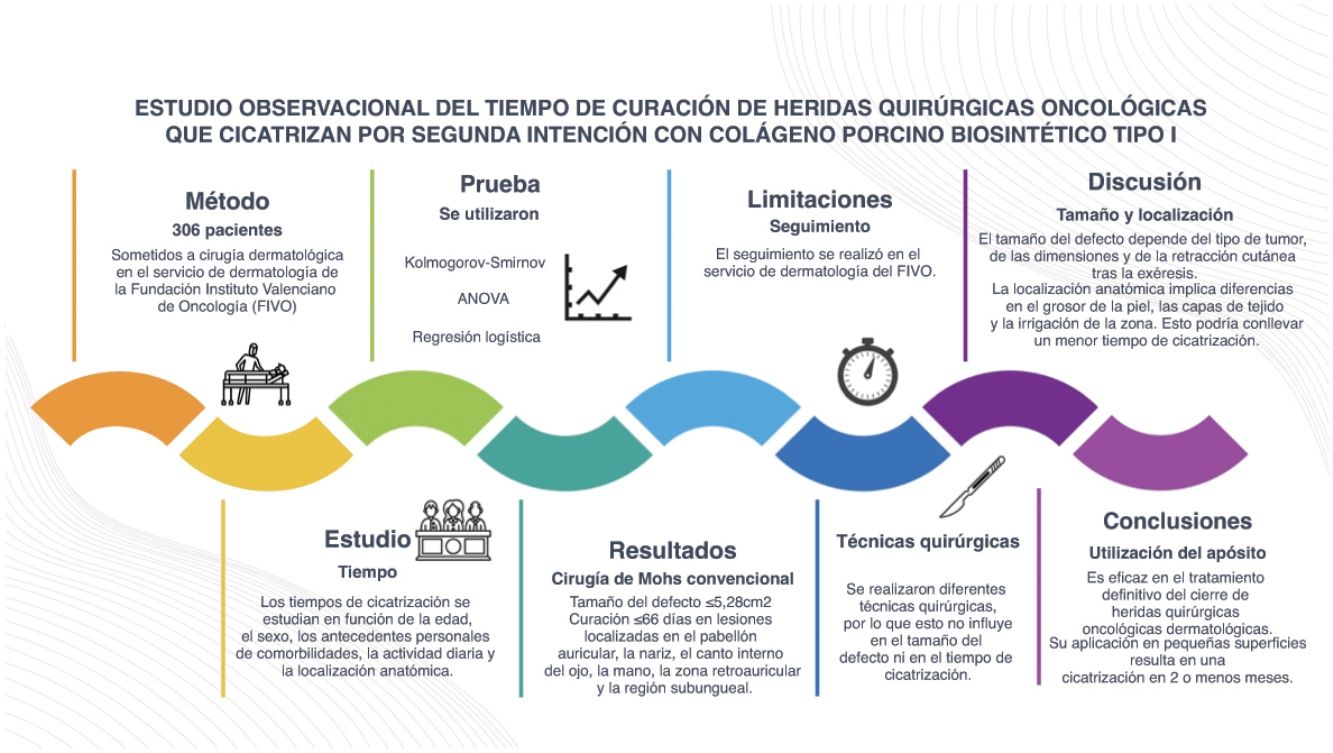
MétodoSe diseñó un estudio observacional retrospectivo de los pacientes tratados con cirugía dermatológica oncológica en el Servicio de Dermatología de la Fundación Instituto Valenciano de Oncología. Se estudió el tiempo de cicatrización en función de la edad, el sexo, los antecedentes personales de comorbilidades, la medicación habitual, la localización anatómica, el tipo de cirugía realizado y el tamaño final del defecto, con la prueba ANOVA y modelos de regresión logística.
ResultadosSe incluyeron 306 pacientes, con una mediana de edad de 73años y un 62,4% de hombres. Las lesiones localizadas en el pabellón auricular, la nariz, el canto interno del ojo, la mano, el área retroauricular y la subungueal, así como la cirugía de Mohs y un tamaño del defecto quirúrgico menor o igual a 5,28cm2 se asociaron a un tiempo de cicatrización menor o igual a 66días.
LimitacionesEl diseño del estudio fue retrospectivo y de una única institución.
ConclusiónEl uso del apósito biosintético de colágeno porcino de tipo I para el tratamiento definitivo del cierre de las heridas quirúrgicas dermatológicas oncológicas parece especialmente adecuado para defectos pequeños y localizados en el canto interno del ojo, la mano, el pabellón auricular, la nariz, la frente, el área retroauricular o la subungueal.
Biosynthetic porcine type I collagen dressing is useful to close ulcers and secondary intention healing of surgical cancer wounds.
ObjectiveTo identify factors associated with the healing time of such wounds.
MethodsWe conducted a retrospective observational study of patients on oncological dermatological surgery in a cancer center. Healing time was studied based on age, sex, personal history of comorbidities, usual medication, anatomical location, type of surgery performed and size of the defect. Statistical analysis was performed using the ANOVA test and logistic regression.
ResultsA total of 306 patients were included with a median age of 73 years (62.4%, men). The statistically significantly characteristics associated with a healing time≤66 days were location—auricle, nose, inner canthus, hand, retroauricular region and nail bed—use of the Mohs technique and defect sizes≤5.28cm2.
LimitationsThis is a retrospective study from a single center.
ConclusionThe use of biosynthetic porcine type I collagen dressings for the definitive closure of dermatological surgical cancer wounds seems particularly suitable for small defects of the inner canthus of the eye, hand, auricle, nose, forehead, retroauricular region, and nail bed.
La cicatrización por segunda intención se utiliza en el cierre de los defectos cutáneos tras la cirugía oncológica. Esta técnica ofrece algunas ventajas clínicas, sobre todo en aquellas zonas en las que existe un alto riesgo de recidiva y en las que el cierre por segunda intención puede ser preferible al cierre con un colgajo o injerto, ya que facilita el seguimiento y la detección precoz de la recidiva tumoral1. De hecho, hacer un colgajo, en algunas ocasiones, podría enmascarar una recidiva tumoral. Además, aunque los injertos proporcionan una resolución más rápida del defecto y permiten una mejor evaluación de la zona quirúrgica para la detección de recidivas, requieren dejar una cicatriz adicional en la zona donante y, además, necesitan un mayor tiempo quirúrgico en comparación con la colocación de un apósito biosintético2,3.
El cierre por segunda intención requiere un tiempo prolongado de cicatrización, lo que puede causar molestias al paciente y un resultado estético deficiente4,5. Además, las situaciones que afectan el flujo sanguíneo, como es el caso de la edad avanzada o la diabetes, también pueden ralentizar la cicatrización. Por ejemplo, la diabetes afecta a la función normal de los fibroblastos y las células epidérmicas, perjudica la angiogénesis y la neovascularización e influye en la respuesta inmunitaria, lo que puede, a su vez, dificultar el proceso de cicatrización6. En otras enfermedades crónicas en las que se requiere el tratamiento con anticoagulantes orales, como es el caso de la cardiopatía coronaria y la enfermedad vascular periférica, también se observará un retraso de la cicatrización7.
El apósito de colágeno porcino de tipo I se utilizó por primera vez en 1979 para tratar quemaduras y las zonas donantes. Esta membrana biosintética semipermeable está diseñada para sustituir temporalmente las funciones de la epidermis hasta que las heridas se reepitelicen8. Consta de 2 capas: una malla de nailon no biodegradable (cuyo revestimiento exterior impide la pérdida de agua y la colonización bacteriana) y una segunda capa de silicona unida a la malla de nailon mediante colágeno porcino de tipo I. Este apósito favorece la formación de tejido de granulación y la cicatrización. Además, favorece la formación de tejido de granulación en el lecho de la herida quirúrgica. Su flexibilidad le permite adaptarse a cualquier parte de la superficie corporal, incluso en zonas difíciles, incluidas las irregulares, como la cara. Así mismo puede fijarse a la superficie de la piel con grapas, sutura o adhesivos9-13. También tiene la ventaja de ser transparente, lo que permite una inspección más fácil del lecho de la herida y la detección precoz de complicaciones.
Su uso se ha extendido a la cobertura de defectos tras la cirugía dermatológica oncológica, principalmente, como cobertura temporal para favorecer la granulación del lecho y asegurar una mejor nutrición del injerto, que será colocado en un segundo acto quirúrgico. Así mismo, se utilizará para acelerar el cierre definitivo del defecto quirúrgico mediante una cicatrización por segunda intención.
Los beneficios que aporta al tratamiento de las quemaduras están ampliamente demostrados. Entre otros, reduce el tiempo de cicatrización, la duración de la estancia, el dolor y la necesidad de analgésicos14-16. Sin embargo, estos efectos no han sido bien estudiados en el contexto de las heridas secundarias a la cirugía oncológica cutánea.
El objetivo de nuestro estudio fue determinar el tiempo medio de cicatrización de las heridas quirúrgicas oncológicas y dermatológicas cerradas mediante una cicatrización por segunda intención utilizando un apósito biosintético de colágeno porcino de tipo I e identificar los factores asociados a un tiempo de cicatrización más corto.
Pacientes y métodosSe realizó un estudio observacional retrospectivo, incluyendo pacientes intervenidos concirugía dermatológica oncológica en el Servicio de Dermatología del Instituto Valenciano de Oncología (IVO) (Valencia, España) desde mayo del 2008 hasta octubre del 2018. Los pacientes fueron elegibles siempre que tuvisen un cierre quirúrgico de heridas por segunda intención utilizando un apósito biosintético de colágeno porcino tipo I. En el anexo de datos complementarios se ha incluido un vídeo que ilustra el procedimiento rutinario utilizado para la aplicación del apósito. La selección del método de cierre se dejó a discreción del cirujano en función del riesgo de recidiva tumoral y del estado general del paciente. No obstante, la decisión final se tomó junto con el paciente, con quien se discutieron previamente las posibles opciones de cierre.
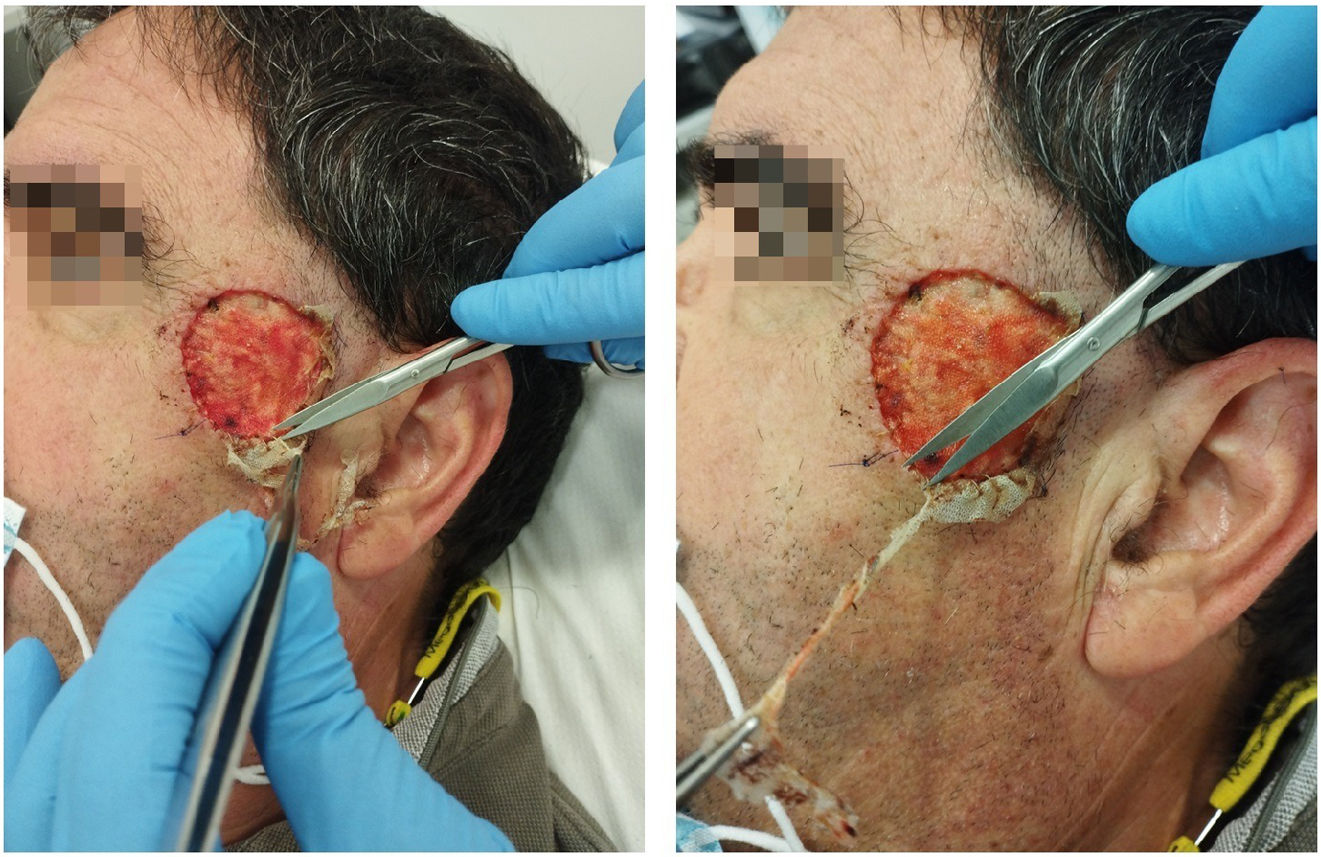
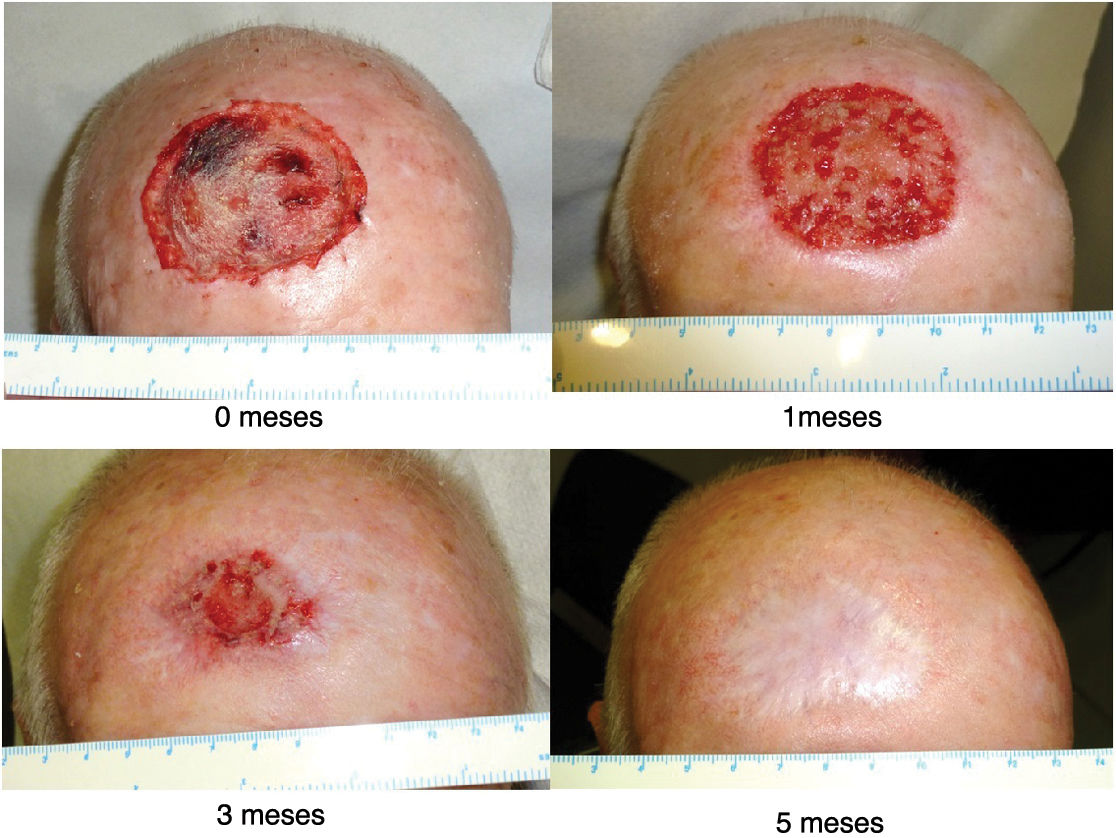
El manejo del apósito por la Unidad de Cuidado de Heridas consiste en evaluar el estado de estas. Dadas las medidas de asepsia adoptadas durante la colocación del apósito biosintético Biobrane®, normalmente se tratará de heridas limpias sin signos de infección. Se procederá a lavar las heridas con suero fisiológico, luego se recortarán los bordes sobrantes del Biobrane® (para favorecer la reepitelización desde los bordes de la herida) como se muestra en la figura 1 y, por último, se aplicará un apósito secundario, que puede variar en función de la cantidad del exudado de la herida, del estado de la piel perilesional, de la frecuencia de los cambios de apósito, de las preferencias del paciente y de la relación coste-eficacia. Posteriormente se tomarán imágenes y se medirá el tamaño del defecto. En la figura 2 se ilustra la progresión de la herida del cuero cabelludo desde el postoperatorio inmediato hasta la cicatrización completa.
Los datos de los pacientes se obtuvieron del registro de la Unidad de Cuidados de Heridas del Servicio de Dermatología del IVO. Todos los casos fueron recogidos prospectivamente, incluyendo la realización de iconografía pre- y postoperatoria. Los pacientes en los que no se completó el seguimiento postoperatorio en la mencionada unidad fueron excluidos del estudio. Todos los pacientes firmaron el consentimiento informado correspondiente y el estudio fue aprobado por el Comité Ético de Investigación del IVO (registro n° 002-19).
La variable dependiente del estudio fue el tiempo de cicatrización, definido como el número de días transcurridos entre la intervención quirúrgica y el cierre completo de la herida. Este tiempo se evaluó como variable continua y se crearon 2 categorías basadas en la mediana del tiempo de curación de la población del estudio: ≤66 y >66 días. Según la opinión del equipo de investigación, este punto de corte de casi 2 meses se consideró aceptable para identificar los casos en los que el tiempo de cicatrización por segunda intención era razonable.
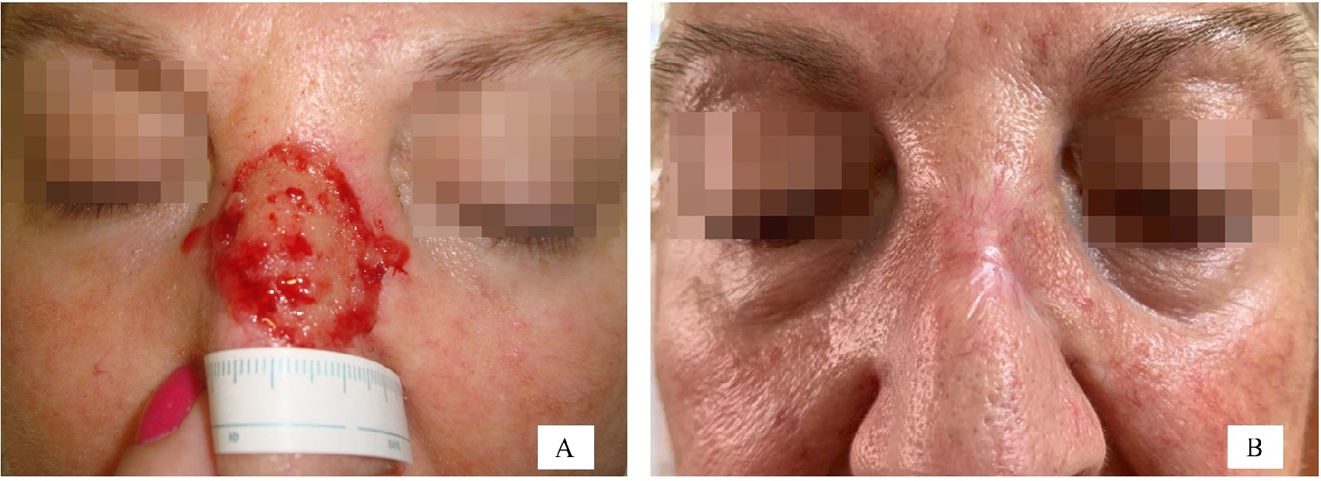
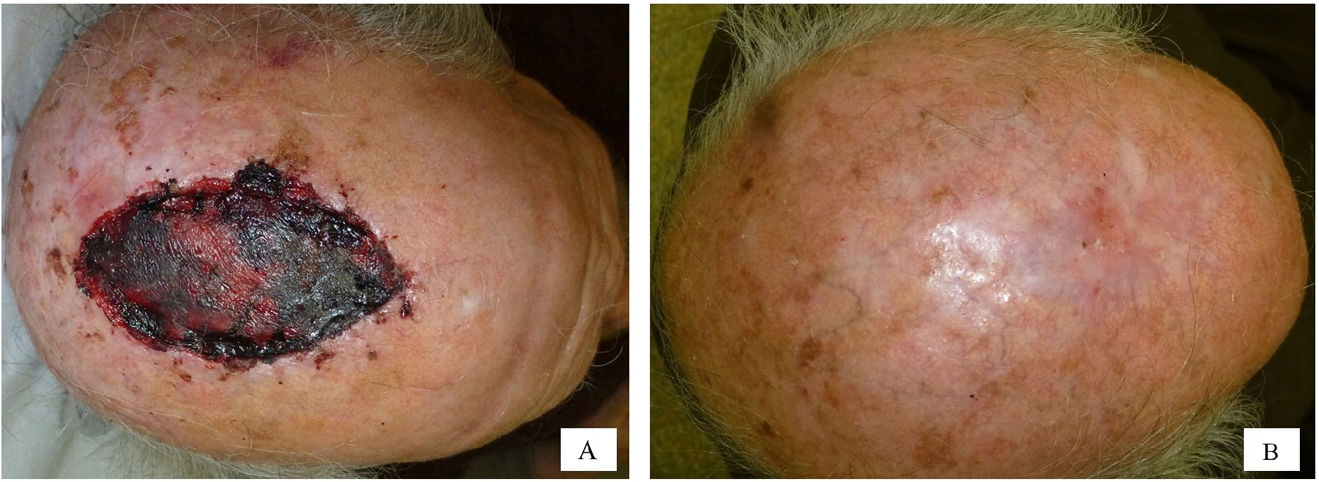
Se recogieron las siguientes variables: la edad categorizada en cuartiles (≤62 años, 63-73 años, 74-80 años y >80 años), el sexo, la presencia o ausencia de enfermedades crónicas (hipertensión arterial o diabetes), el uso o no de fármacos anticoagulantes y la localización anatómica del defecto quirúrgico. Se incluyeron un total de 21 localizaciones diferentes y, a continuación, se clasificaron en 2 grupos en función de los resultados de un análisis de correspondencia (Anexo A). El grupo n.° 1 incluía el pie, la sien, el cuero cabelludo, la mejilla, la pierna, la frente y la región preauricular. El grupo n.° 2 incluía el pabellón auricular, la nariz, el canto interno del ojo, la mano, la región retroauricular y el lecho ungueal. Las figuras 3 y 4 ilustran ejemplos de heridas en 2 localizaciones diferentes (nariz y cuero cabelludo) con las correspondientes imágenes pre- y postoperatorias. También se registró el tipo de cirugía según 2 modalidades (cirugía convencional o cirugía de Mohs en diferido y cirugía de Mohs convencional) y el tamaño del defecto quirúrgico. Para el análisis de esta última variable, se consideró que los defectos tenían forma elíptica y el área se calculó midiendo el diámetro mayor y menor del defecto. Así, se definieron 2 categorías en función de si el área del defecto quirúrgico era ≤5,28m2 o >5,28cm2. Se calculó un punto de corte de 5,28cm2 mediante el método de árbol de clasificación y regresión (Anexo A). Este punto de corte permitió discriminar entre un tiempo de cicatrización≤66 y >66 días.
La normalidad de la distribución de la variable continua tiempo de curación se evaluó mediante la prueba de Shapiro-Wilks. Se utilizó la prueba ANOVA para comparar las medias entre grupos. Las asociaciones entre el tiempo de curación y las características estudiadas se determinaron mediante modelos de regresión logística univariantes y multivariantes. Se calcularon la oddsratio (OR), los intervalos de confianza (IC) del 95% y los valores p asociados. Se consideró significación estadística para valores p<0,05. Para las pruebas estadísticas, se utilizó IBM SPSS versión 23 (IBM SPSS, Inc.; Chicago, EE. UU.).
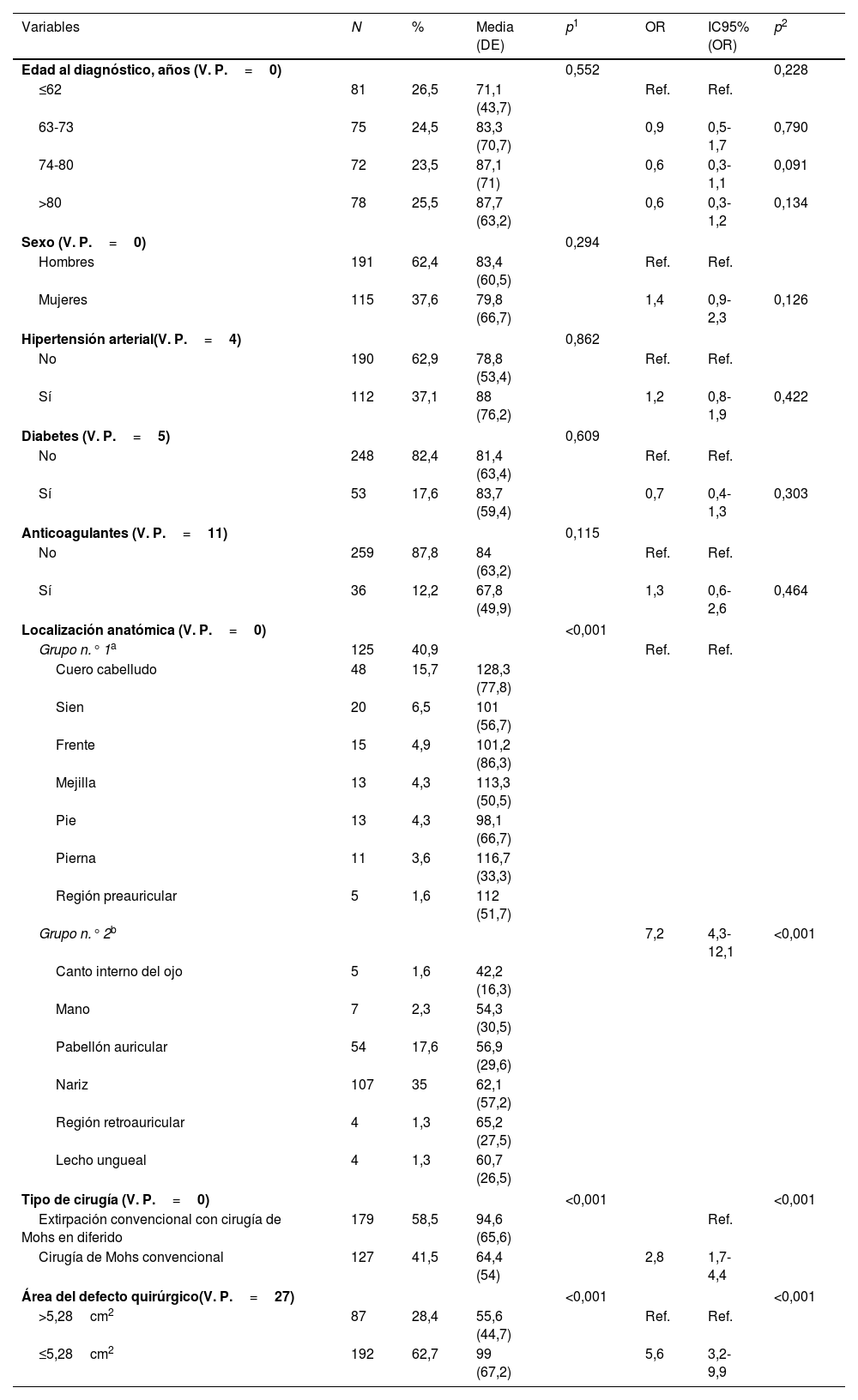
ResultadosDe un total de 495 pacientes, 306 cumplieron los criterios de selección (Anexo A fig. A). En la tabla 1 se ilustra el número de pacientes y su porcentaje en función de los valores de cada variable estudiada. En conclusión, la mediana de la edad fue de 73 años (IQR: 62-80 años; 62,4%, hombres). Respecto a las comorbilidades, el 37,1% presentaba hipertensión, el 17,6% diabetes y el 12,2% tomaba anticoagulantes. En cuanto a la localización, el 40,9% tenía el defecto en el grupo n.° 1 (el cuero cabelludo, la sien, la frente, la mejilla, el pie, la pierna o la región preauricular) y el 59,1% en el grupo n.° 2 (el canto interno del ojo, la mano, el pabellón auricular, la nariz, la frente, la región retroauricular y el lecho ungueal). La cirugía de Mohs convencional se realizó en el 41,5% de los pacientes, mientras que la cirugía convencional o la cirugía de Mohs diferida se realizó en el 58,5% de los pacientes. En el 28,4% de los casos el tamaño del defecto fue ≤5,28cm2 y en el 62,7% fue >5,28cm2.
Estudio de las variables asociadas al tiempo de curación≤66 días: análisis descriptivo y resultados de la comparación de medias mediante la prueba ANOVA
| Variables | N | % | Media (DE) | p1 | OR | IC95% (OR) | p2 |
|---|---|---|---|---|---|---|---|
| Edad al diagnóstico, años (V. P.=0) | 0,552 | 0,228 | |||||
| ≤62 | 81 | 26,5 | 71,1 (43,7) | Ref. | Ref. | ||
| 63-73 | 75 | 24,5 | 83,3 (70,7) | 0,9 | 0,5-1,7 | 0,790 | |
| 74-80 | 72 | 23,5 | 87,1 (71) | 0,6 | 0,3-1,1 | 0,091 | |
| >80 | 78 | 25,5 | 87,7 (63,2) | 0,6 | 0,3-1,2 | 0,134 | |
| Sexo (V. P.=0) | 0,294 | ||||||
| Hombres | 191 | 62,4 | 83,4 (60,5) | Ref. | Ref. | ||
| Mujeres | 115 | 37,6 | 79,8 (66,7) | 1,4 | 0,9-2,3 | 0,126 | |
| Hipertensión arterial(V. P.=4) | 0,862 | ||||||
| No | 190 | 62,9 | 78,8 (53,4) | Ref. | Ref. | ||
| Sí | 112 | 37,1 | 88 (76,2) | 1,2 | 0,8-1,9 | 0,422 | |
| Diabetes (V. P.=5) | 0,609 | ||||||
| No | 248 | 82,4 | 81,4 (63,4) | Ref. | Ref. | ||
| Sí | 53 | 17,6 | 83,7 (59,4) | 0,7 | 0,4-1,3 | 0,303 | |
| Anticoagulantes (V. P.=11) | 0,115 | ||||||
| No | 259 | 87,8 | 84 (63,2) | Ref. | Ref. | ||
| Sí | 36 | 12,2 | 67,8 (49,9) | 1,3 | 0,6-2,6 | 0,464 | |
| Localización anatómica (V. P.=0) | <0,001 | ||||||
| Grupo n.° 1a | 125 | 40,9 | Ref. | Ref. | |||
| Cuero cabelludo | 48 | 15,7 | 128,3 (77,8) | ||||
| Sien | 20 | 6,5 | 101 (56,7) | ||||
| Frente | 15 | 4,9 | 101,2 (86,3) | ||||
| Mejilla | 13 | 4,3 | 113,3 (50,5) | ||||
| Pie | 13 | 4,3 | 98,1 (66,7) | ||||
| Pierna | 11 | 3,6 | 116,7 (33,3) | ||||
| Región preauricular | 5 | 1,6 | 112 (51,7) | ||||
| Grupo n.° 2b | 7,2 | 4,3-12,1 | <0,001 | ||||
| Canto interno del ojo | 5 | 1,6 | 42,2 (16,3) | ||||
| Mano | 7 | 2,3 | 54,3 (30,5) | ||||
| Pabellón auricular | 54 | 17,6 | 56,9 (29,6) | ||||
| Nariz | 107 | 35 | 62,1 (57,2) | ||||
| Región retroauricular | 4 | 1,3 | 65,2 (27,5) | ||||
| Lecho ungueal | 4 | 1,3 | 60,7 (26,5) | ||||
| Tipo de cirugía (V. P.=0) | <0,001 | <0,001 | |||||
| Extirpación convencional con cirugía de Mohs en diferido | 179 | 58,5 | 94,6 (65,6) | Ref. | |||
| Cirugía de Mohs convencional | 127 | 41,5 | 64,4 (54) | 2,8 | 1,7-4,4 | ||
| Área del defecto quirúrgico(V. P.=27) | <0,001 | <0,001 | |||||
| >5,28cm2 | 87 | 28,4 | 55,6 (44,7) | Ref. | Ref. | ||
| ≤5,28cm2 | 192 | 62,7 | 99 (67,2) | 5,6 | 3,2-9,9 | ||
Regresión logística bivariante. Análisis descriptivo de las variables y resultados de la comparación de medias mediante la prueba no paramétrica U de Mann-Whitney. ANOVA. Análisis de las variables asociadas al tiempo de curación≤66 días. Regresión logística bivariante.
IC: intervalo de confianza; OR: odds ratio; V.P.: valores perdidos; Ref.: categoría de referencia.
Las características epidemiológicas y clínicas asociadas con el tiempo de curación y la comparación de medias mediante la prueba ANOVA se muestran en la tabla 1. Las variables asociadas a un tiempo de cicatrización≤66 días fueron: el tamaño del defecto≤5,28cm2, la cirugía de Mohs convencional y la localización en el grupo n.° 2. No se hallaron diferencias en el tiempo de cicatrización en función de la edad, el sexo ni la presencia de comorbilidades, como la hipertensión, la diabetes y el tratamiento con anticoagulantes orales (tabla 1).
Aunque no era un objetivo de este estudio, se registró el número de complicaciones asociadas al uso de los apósitos biosintéticos de colágeno porcino de tipo I. Se observaron 15 casos de hipergranulación (4,9%), 175 casos de integración del apósito en el tejido (57,2%), 13 desprendimientos (4,2%), un seroma (0,3%) y 6 infecciones (2%), en las que se aislaron Cloceleritorebacter, Bacteroides eggrthii y Pseudomonas. Además, 2 casos requirieron ser reevaluados por el Servicio de Cirugía Plástica (0,7%). En uno de estos pacientes el defecto se localizaba en la nariz y requirió ser intervenido por cirugía plástica para una remodelación con injerto de cartílago debido a la retracción del colgajo nasolabial, que elevaba los bordes de las alas nasales. El otro paciente tenía el defecto localizado en la mejilla y necesitó una nueva cirugía por presentar una complicación funcional (ectropión del párpado inferior).
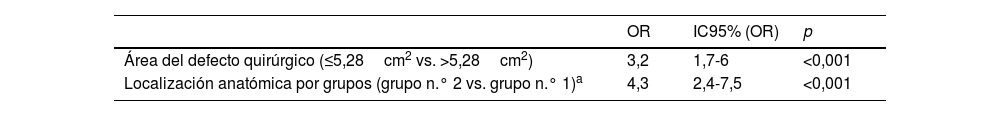
Tras el análisis multivariante, tanto el tamaño del defecto≤5,28cm2 como la localización del defecto en el grupo n.° 2 siguieron estando asociados a un menor tiempo de cicatrización (tabla 2).
Análisis multivariante de las variables asociadas al tiempo de curación≤66 días
| OR | IC95% (OR) | p | |
|---|---|---|---|
| Área del defecto quirúrgico (≤5,28cm2 vs. >5,28cm2) | 3,2 | 1,7-6 | <0,001 |
| Localización anatómica por grupos (grupo n.° 2 vs. grupo n.° 1)a | 4,3 | 2,4-7,5 | <0,001 |
Localización:
Grupo n.° 1 corresponde a localizaciones en la pierna, el cuero cabelludo, la mejilla, la sien, el pie, la frente y la región preauricular. El grupo n.° 2 corresponde a localizaciones en la pierna, la nariz, el canto interno del ojo, la mano, la zona retroauricular y el lecho ungueal.
IC: intervalo de confianza; OR: odds ratio.
La extirpación de algunos tumores cutáneos deja defectos cuya reconstrucción supone un reto quirúrgico debido a su tamaño, localización y riesgo de recidiva, lo que hace cuestionable su reconstrucción con un colgajo. En este estudio hemos demostrado que el uso de un apósito biosintético de colágeno porcino de tipo I ayuda a conseguir un tiempo de cicatrización relativamente corto, sobre todo en defectos pequeños localizados en determinadas regiones anatómicas.
El tamaño final del defecto en la cirugía dermatooncológica depende del tipo de tumor, de sus dimensiones y de la retracción de la piel tras la extirpación del tumor. Encontramos, al igual que en otros estudios y como era de esperar, que un defecto quirúrgico pequeño (considerado como tal si su área era ≤5,28cm2), se asociaba a un tiempo de cicatrización menor4. En estos casos, el uso de un apósito biosintético de colágeno porcino de tipo I permitió un tiempo de cicatrización<66 días en el 41,6% de los casos.
La localización anatómica da lugar a diferencias en la vascularización, el grosor y las capas de tejido (la piel, el tejido celular subcutáneo, la aponeurosis, el pericondrio, el cartílago, el periostio o el hueso)17. Estas diferencias parecen ser cruciales para una cicatrización adecuada en <66 días, especialmente cuando los defectos se incluyeron dentro del grupo n.° 2, ya que carecen de una capa gruesa de tejido celular subcutáneo. En estas localizaciones, el tejido de granulación aparece rápidamente con la ayuda del apósito biosintético de colágeno porcino de tipo I. Además, la piel de estas zonas no experimenta una retracción significativa tras la extirpación del tumor, por lo que el defecto final depende sobre todo del tipo y el tamaño del tumor. Por otro lado, como estas localizaciones anatómicas son evidentes, los tumores suelen diagnosticarse antes y son de menor tamaño. En particular, la piel de la frente puede tener una capa ligeramente más gruesa de tejido celular subcutáneo y puede estar sujeta a cierta retracción. Sin embargo, otras características inherentes a este lugar, como el patrón de vascularización diferenciado, la visibilidad de la zona o la posible exposición del periostio, también son importantes para conferir una cicatrización más rápida17. Por otro lado, el pabellón auricular, la nariz (en la parte inferior) y la región retroauricular tienen soporte cartilaginoso. La mayor presencia de colágeno pericondrial en estas localizaciones anatómicas da lugar a una cicatrización más rápida y eficaz.
Otros autores han descrito la eficacia del apósito biosintético en el tratamiento de las heridas quirúrgicas asociadas a la exposición de estructuras importantes y han destacado el papel del apósito en la protección de estructuras vasculares y anastomosis antes del cierre definitivo. Sin embargo, no se ha descrito el tiempo de cicatrización necesario para el cierre11. Dos estudios anteriores mostraron que este apósito parecía ser eficaz en el tratamiento de defectos del cuero cabelludo>5cm2 en los que también se realizó la resección del periostio. Sin embargo, se informó que este tipo de herida quirúrgica tardaba más en cicatrizar (entre 95 y 135 días, con una media de 115 días)1,2.
En el presente estudio, las características clínicas de los pacientes, como la edad avanzada, el diagnóstico de hipertensión, de diabetes o el uso de anticoagulantes orales, no influyeron en el tiempo de cicatrización. El componente biológico del apósito podría promover la neovascularización y la formación de tejido de granulación fino en el lecho de las heridas incluso poco vascularizadas8. Este hallazgo relevante requiere más estudios, ya que señala que el apósito podría ser una buena alternativa para todos los pacientes, independientemente de sus comorbilidades.
Algunos estudios en pacientes quemados tratados con apósitos biosintéticos han demostrado que el uso de estos apósitos dentro de las primeras 12h tras la lesión reduce de forma significativa el tiempo de reepitelización13-17. En la cirugía oncológica cutánea, este apósito se aplica de inmediato después de la cirugía, independientemente de la localización del defecto.
Además, el lecho limpio de la herida quirúrgica favorece una adherencia óptima, lo que podría explicar los buenos resultados obtenidos en nuestro estudio, que coinciden con los hallazgos de otros autores16.
Por otro lado, se ha demostrado que el apósito biosintético de colágeno porcino de tipo I es seguro, ya que presenta una baja tasa de complicaciones. La integración del apósito fue la única complicación observada en un porcentaje relativamente elevado de pacientes. Sin embargo, esto podría deberse a que, en las heridas quirúrgicas dermatológicas tras la extirpación de tumores cutáneos, se dejó colocado el apósito más tiempo del recomendado por el fabricante para lograr una cicatrización completa o un lecho de la herida óptimo para recibir el injerto.
El fabricante recomienda retirar el apósito a los 7-14 días. El precio de una sábana Biobrane® de 10cm×10cm es de 70 euros. Dado que el apósito es reutilizable, el coste aproximado de la pieza utilizada para los cubrir defectos inferiores a 5,28cm2 es inferior a 10 euros.
La principal limitación de este estudio es el diseño retrospectivo en pacientes de un único centro.
En conclusión, el apósito biosintético de colágeno porcino de tipo I es una herramienta sencilla, barata y eficaz en el tratamiento definitivo de tumores cutáneos, ya que se utilizará en el cierre quirúrgico de las heridas gracias a una cicatrización por segunda intención. Su uso parece especialmente útil en defectos pequeños o en algunas localizaciones, como en el canto interno del ojo, la mano, el pabellón auricular, la nariz, la frente, la región retroauricular o el lecho subungueal, donde el tiempo de cicatrización es de casi ≤2 meses.
FinanciaciónEsta investigación no ha recibido ayudas específicas de organismos del sector público, del sector comercial ni de entidades sin ánimo de lucro.
Conflicto de interesesNinguno.