La mpox humana es una infección zoonótica causada por un ortopoxvirus, con un curso indolente que se resuelve normalmente en el plazo de 2 a 4semanas. El 23 de julio de 2022, la Organización Mundial de la Salud (OMS) declaró la infección por el virus de la viruela una emergencia de carácter internacional1-3. En el brote actual de 2022, muchos casos se produjeron en hombres que habían tenido sexo con hombres, y fueron diagnosticados a menudo de manera concomitante con otras infecciones de transmisión sexual (ITS)3-6.
Varón de 58años, con antecedentes clínicos de enfermedad de Gaucher, enfermedad de Parkinson, trasplante renal y terapia inmunosupresora triple (tacrolimus, micofenolato y prednisona), e infección por VIH con terapia de lamivudina/dolutegravir con carga viral indetectable y células CD4+>1.000/ml. El paciente acudió a la unidad de urgencias en julio de 2022 tras cinco días de odinofagia, fiebre y lesiones mucocutáneas diseminadas. Reportó contacto sexual con inserción oral siete días previos al inicio de los síntomas con una pareja no habitual.
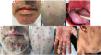
La exploración física reveló la presencia de múltiples vesículas-pústulas en rostro, brazos, piernas y tronco (fig. 1A,B), lesiones ulceradas en la cavidad oral con lesión necrótica en la amígdala palatina derecha, desplazamiento uvular (fig. 1C) y gran conglomerado doloroso de ganglios en la región cervical derecha.
Imágenes clínicas de las lesiones cutáneas por mpox: pseudopústulas confluyentes con centro necrótico deprimido y eritema perilesional que afecta al rostro (A) y tronco (B) el primer día de la hospitalización. Lesiones ulceradas en la cavidad oral y lesión necrótica en la amígdala palatina derecha con desplazamiento uvular (C). Empeoramiento de las lesiones cutáneas el cuarto día de hospitalización: incremento del número y tamaño de las pseudopústulas confluyentes con incremento del centro necrótico en rostro (E), tronco (F), palmas (E) y cuello (G).
En el contexto del brote de 2022, se sospechó inicialmente infección por mpox, que se confirmó en el diagnóstico. El material aislado de las pústulas fue positivo para mpox mediante PCR. El cribado de otras ITS resultó negativo.
El paciente había sido aparentemente bien vacunado contra el virus de la viruela en su juventud. Fue ingresado en la unidad de enfermedades infecciosas, iniciándose tratamiento con andamoxicilina/clavulánico. La tomografía computarizada de cuello reveló la presencia de múltiples linfadenopatías bilaterales que causaron una reducción del calibre de la vía aérea.
El segundo día empeoró la condición general del paciente al presentarse fiebre, seguida de incremento rápido del número y tamaño de las lesiones cutáneas (fig. 1D-G).
En dicho momento se consideró necesario administrar terapia antiviral, seleccionándose un régimen de 14días de 600mg/12h de tecovirimat inhibidor de la proteína Vp37 de ortopoxvirus, que se administró oralmente. Se contraindicaron los fármacos disponibles alternativos (cidofovir y brincidofovir) debido a las comorbilidades del paciente. Tecovirimat fue suministrado individualmente por la Agencia Española de Medicamentos y Productos sanitarios, dado el contexto global del brote. Tratándose de un inductor de citocromo, la Unidad de Farmacia recomendó el cambio de terapia del paciente: se reguló la dosis de tacrolimus a 4mg/12h con seguimiento estrecho de los niveles, se discontinuó micofenolato y se incrementó la dosis de metilprednisolona a 10mg/día. El paciente mostró un curso clínico lento, aunque favorable, que permitió el alta hospitalaria el sexto día de la terapia con tecovirimat. Transcurridas dos semanas de la finalización de la terapia, se restauró la terapia inmunosupresora basal.
Muchas personas que contraen infección por mpox se recuperan en el curso de pocas semanas sin ningún tratamiento específico. Las complicaciones más frecuentes son infección cutánea bacteriana y cicatrices6. También se han reportado casos de complicaciones graves, tales como encefalitis, sepsis, neumonía, compresión de la vía aérea por grandes ganglios cervicales, conjuntivitis, queratitis y miocarditis6,7.
Cerca del 1 al 13% de los pacientes requieren hospitalización8, situándose la prevalencia de enfermedad fatal entre el 0 y el 11%2. Las personas con gran riesgo de enfermedad grave son los niños, mujeres embarazadas, individuos inmunodeprimidos, personas mayores con múltiples parejas sexuales y personas de zonas endémicas2-4.
Siguiendo las pautas de la OMS, nuestro paciente cumplió los criterios de infección por mpox grave o complicada, ya que pertenecía a grupos de población de alto riesgo debido a su condición inmunosupresora. Además, mostró signos y síntomas clínicos de severidad: linfadenopatía cervical y una puntuación de gravedad de la lesión cutánea (100-250 lesiones). En tales casos, la OMS recomienda aislamiento, hospitalización, terapia sintomática y uso de antivirales u otras terapias específicas, siempre que estuvieran indicadas y disponibles9.
Los fármacos oralmente biodisponibles que han sido aprobados son brincidofovir (FDA) y tecovirimat (EMA). Sin embargo, no se ha estudiado aún su eficacia en humanos en ensayos clínicos aleatorizados, habiéndose reportado poco su uso10.
La vacuna contra la viruela confiere protección cruzada contra la infección por mpox con una eficacia del 85%. Fue autorizada por vez primera en julio de 2022 y está disponible para profilaxis previa a la exposición de las personas con prácticas sexuales de alto riesgo, profesionales sanitarios y profilaxis posterior a la exposición tras contactos estrechos de alto riesgo para la enfermedad grave8. Sin embargo, se carece de datos sobre la eficacia de la vacuna en individuos inmunocomprometidos4. De estar contraindicada la vacuna contra la viruela, es beneficiosa la dosis intravenosa profiláctica de inmunoglobulina anti-viruela4.
La mpox se ha propagado rápidamente entre los humanos. Aunque muchos de los casos son leves y no requieren hospitalización, algunos pacientes tienen riesgo de enfermedad grave. Son necesarios más estudios para definir los factores de riesgo de gravedad, hospitalización y mortalidad para identificar aquellos que se beneficiarán de una terapia antiviral temprana. Actualmente, diversos países han implementado ya estrategias tales como seguimiento de contacto, asesoramiento sanitario y campañas de vacunación para controlar la propagación de este brote.
Conflicto de interesesNinguno.