Para el diagnóstico y manejo de las alopecias se utilizan técnicas invasivas, como biopsias de cuero cabelludo, y no invasivas, como tricoscopia, pero esta no siempre proporciona suficiente información sobre el estado de la enfermedad. En la actualidad, disponemos de nuevos métodos diagnósticos no invasivos para complementar los hallazgos clínicos y tricoscópicos de pacientes con alopecia. Estos son la ecografía de alta frecuencia (EAF) y ultraalta frecuencia (EUAF), la microscopia confocal de reflectancia (MCR) y la tomografía de coherencia óptica (TCO), que son capaces de identificar estructuras bajo la superficie del cuero cabelludo, manteniendo la capacidad de monitorizar los tallos pilosos. En esta revisión se describen las características reportadas con cada técnica para los distintos tipos de alopecias (cicatriciales y no cicatriciales), con el objetivo de identificar parámetros que contribuyan a aclarar nuevos hallazgos fisiopatológicos, sumar información al examen tricoscópico y mejorar los procesos de diagnóstico y seguimiento.
Although invasive techniques such as scalp biopsies and non-invasive techniques such as trichoscopy are commonly used for the diagnosis and management of alopecia, the latter does not always provide enough information on the state of the disease. Currently, we have new non-invasive diagnostic methods to complement the clinical and trichoscopic findings of patients with alopecia; these are high-frequency ultrasound (HFU), ultra-high-frequency ultrasound (UHFU), reflectance confocal microscopy (RCM) and optical coherence tomography (OCT), which are capable of identifying structures under the surface of the scalp, while maintaining the ability to monitor hair shafts.
This review describes the main features reported with each technique for the different types of alopecia —scarring and non-scarring— with the aim of identifying those parameters that may contribute to clarifying new pathophysiological findings, while adding information to the trichoscopic examination and improving diagnostic processes and monitoring.
La aproximación diagnóstica de los distintos tipos de alopecias se basa principalmente en la historia clínica, examen físico, tricoscopia y estudio histopatológico. La búsqueda de nuevos métodos diagnósticos, especialmente no invasivos, es cada vez más relevante, ya que aportan información para el diagnóstico diferencial, contribuyen en decisiones terapéuticas y reducen la necesidad de biopsias1-4. En los últimos años hay cada vez más interés en técnicas como la ecografía de alta frecuencia (EAF), la microscopia confocal de reflectancia (MCR) y la tomografía de coherencia óptica (TCO), ya que han mostrado utilidad en su diagnóstico y seguimiento. En esta revisión se describe la principal evidencia recopilada con relación al uso de estas técnicas en tricología, tanto en alopecias no cicatriciales como cicatriciales.
Respecto a la metodología, se realizó una búsqueda electrónica para recopilar publicaciones sobre el uso de EAF, MCR y TCO en evaluación, diagnóstico y seguimiento en tricología. La revisión se hizo hasta marzo de 2024 en la base de datos electrónica de PubMed utilizando los términos de búsqueda «ecografía de alta frecuencia», «microscopia confocal de reflectancia», «tomografía de coherencia óptica», «alopecia» y «pelo».
EcografíaLa EAF es una técnica muy utilizada en dermatología. Se basa en la emisión de pulsos ultrasónicos de alta frecuencia (>15MHz) desde un transductor sobre la piel, que registra su regreso (fenómeno de eco) en la unidad de procesamiento. La frecuencia mínima recomendada para el estudio de estructuras cutáneas varía entre 15 y 20MHz1, con profundidades de entre 6 y 10mm. A aquellos dispositivos que emiten ondas superiores a 50MHz se les denomina de ultraalta frecuencia (EUAF) y pueden llegar actualmente hasta los 70MHz5. La diferencia entre ambas es la resolución axial espacial, que es más alta en la EUAF y alcanza los 30μm. Además, a través del modo Doppler color se puede detectar y medir la velocidad del flujo sanguíneo.
En el ámbito de la tricología, se describe ecográficamente a los folículos pilosos normales como bandas hipoecogénicas oblicuas en la dermis que, en fase anágena, se localizan en la dermis profunda o incluso en la hipodermis superior, mientras que en fase telógena se restringen a la dermis superior (fig. 1). En el cuero cabelludo los tallos pilosos se informan como estructuras hiperecogénicas predominantemente trilaminares con un complejo cutícula-corteza externo y una médula interna2,6. Al comparar la EAF con tricoscopia, se ha reportado que el número de unidades foliculares no difiere de forma significativa y solo su ancho es mayor con las mediciones ecográficas7. En la EUAF se observan los tractos pilosos en el interior de los folículos antes de emerger a la superficie2,5.
En la alopecia androgénica (AGA) se ha descrito hipoecogenicidad de los folículos pilosos involucrados, hallazgo cuya fisiopatología sigue sin estar clara y que podría atribuirse a inflamación8. En un estudio prospectivo de 33 pacientes con AGA y 10 controles sanos9 se encontró en AGA folículos menos profundos en la dermis y un reemplazo del patrón normal predominantemente trilaminar de los tallos pilosos por uno bilaminar y áreas de ausencia de folículos pilosos.
En la alopecia areata (AA) se han identificado signos como folículos pilosos vacíos e hiperecogenicidad perifolicular en el subcutáneo8 que podrían facilitar la evaluación directa de la gravedad de la enfermedad y así ayudar a diseñar estrategias terapéuticas. A su vez, son interesantes los hallazgos reportados recientemente por Mikiel et al.10, quienes caracterizan las imágenes ecográficas de 25 pacientes con AA y sus fases, de 10 con AGA y de 12 con dermatitis seborreica, correlacionando los hallazgos con tricoscopia (tabla 1). En AA activa se describieron folículos claros y ensanchados similares a gotas de agua, la fase inactiva se caracterizó por una menor cantidad de folículos sin bordes definidos y en la fase de recrecimiento se encontraron folículos de diferentes anchos, alargados y con partes distales ensanchadas. Tanto el ancho como la ecogenicidad de los folículos en AA, con independencia del estadio de la enfermedad, fue significativamente mayor. En los casos de AGA, el ancho de los folículos fue el más pequeño de todos los grupos estudiados.
Hallazgos ecográficos de estructuras foliculares (EF) comparadas con tricoscopia en cada grupo estudiado
| Grupo | Hallazgos ecográficos | Hallazgos tricoscópicos |
|---|---|---|
| AA fase activa | En forma de gotaZonas distales en dermis inferior | Puntos negrosPelos en signo de exclamaciónPelos rotosPuntos amarillos |
| AA fase inactiva | Sin forma distintiva, disminución del númeroZonas distales más anchas y en dermis inferior | Puntos amarillosPelos vellosos |
| AA fase recrecimiento | Diversidad en el anchoZonas distales en diferentes niveles de la piel, también penetran en capa subdérmica | Pelos verticales en recrecimientoPelos en cola de cerdoPelos vellososPelos terminales con o sin pigmento |
| AGA | Diversidad en el tamaño y más anchosZonas distales en diferentes niveles de la dermisTallos pilosos bilaminares | Puntos amarillosPelos vellososDiversidad ancho tallos pilososMayor número de unidades foliculares con tallo único |
| DS | Zonas distales más anchas que penetran en capas subdérmicas | Áreas amarillentasEscamas blancas y amarillasVasos arborizantes finos |
| Control (individuos sanos) | Bandas oblicuas elongadas, que penetran en capa subdérmica | Unidades foliculares regulares con 2 a 3 tallos |
AA: alopecia areata; AGA: alopecia androgénica; DS: dermatitis seborreica.
Las primeras publicaciones que utilizaron EAF en la evaluación de alopecias cicatriciales mostraron que la inflamación dérmica aparece hipoecogénica y la subcutánea, hiperecogénica y, al Doppler, las zonas afectadas son hipovasculares2,4,9,11. Sin embargo, también se ha reportado mayor vascularización en las áreas cicatriciales usando técnicas de imagen microvascular e incluso mayor grosor y rigidez con elastografía de ondas de corte12.
Recientemente se evaluó la EAF como método diagnóstico en 8 pacientes con liquen plano pilaris (LPP), 11 con lupus eritematoso discoide (LED), 14 con alopecia fibrosante frontal (AFF) y 11 voluntarios sanos13. La forma activa de enfermedad en todos los grupos se caracterizó por estructuras foliculares con morfología y parámetros diferentes de los observados en el grupo control; las formas inactivas se caracterizaron por una reducción significativa del número de folículos (tabla 2). La ecogenicidad de la piel y de las estructuras foliculares fue significativamente mayor que en los voluntarios sanos, lo que es probable que se deba al proceso de fibrosis subyacente. Cabe destacar que la ausencia de aperturas foliculares en la tricoscopia muchas veces no se correlacionó con la falta total de estructuras foliculares en las imágenes ecográficas. Todos estos hallazgos señalan que la EAF permite una evaluación más precisa del momento en que se completa el proceso de cicatrización.
Características ecográficas de estructuras foliculares y hallazgos tricoscópicos en alopecias cicatriciales
| Grupo | Hallazgos ecográficos | Hallazgos tricoscópicos |
|---|---|---|
| LPP en fase activa | Estructuras foliculares en forma de cigarro | Descamación perifolicularVasos elongados lineales |
| LPP en fase inactiva | Disminución de estructuras folicularesBorde dérmico o subdérmico en forma de sierra | Ausencia de aperturas folicularesPuntos blancosÁreas blanco-lechosas desestructuradas |
| AFF fase activa | Estructuras foliculares en forma de cigarro | Eritema y descamación perifolicularVasos arborizantes |
| AFF fase inactiva | Estructuras foliculares únicasBorde dérmico o subdérmico en forma de sierra | Ausencia de aperturas folicularesSigno del pelo solitarioÁreas blancas desestructuradas |
| LED fase activa | Duplicación focal de ecos de entradaEstructuras foliculares más anchasBandas hipoecogénicas desestructuradas en dermis | Puntos amarillos grandesVasos arborizantes gruesosPuntos rojos |
| LED fase inactiva | Disminución de estructuras folicularesSin patrón específicoBorde dérmico o subdérmico borroso | Áreas blancas desestructuradasVasos arborizantes delgados |
AFF: alopecia fibrosante frontal; LED: lupus eritematoso discoide; LPP: liquen plano pilaris.
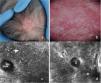
Por su parte, con EUAF en AFF se han descrito hallazgos como hipoecogenicidad perifolicular en dermis media, ambigüedad distal de folículos pilosos y bandas hiperecogénicas onduladas en el tejido celular subcutáneo (fig. 2). Los 2primeros también se observaron en LPP y en la histopatología se correspondieron con fibrosis perifolicular e inflamación en promontorio y con folículos inflamados o destruidos en istmo o infundíbulo, respectivamente. A su vez, las bandas hiperecogénicas en subcutáneo se correspondieron con tabiques fibrosos distribuidos de forma lineal en hipodermis8. Otro estudio ecográfico en 99 mujeres con AFF y 40 controles demostró mayor diámetro vascular y mayor flujo en el área de la línea de implantación capilar en comparación con la zona de banda alopécica y grupo control, lo que puede explicarse tanto por inflamación activa en la línea frontal como por fibrosis en la banda alopécica. Además, el diámetro de los vasos fue significativamente mayor en la zona del cuero cabelludo sano de pacientes con AFF que en el grupo control, lo que se explicaría por inflamación subclínica y podría ser predictor de progresión futura14.
Ecografía de alopecia frontal fibrosante. A) Pérdida de folículos pilosos (*) y de tejido adiposo subcutáneo. Pérdida de la definición del límite dermohipodérmico (flecha oblicua), aumento de ecogenicidad subcutánea (o) y estructuras laminillares prominentes subcutáneas (flecha horizontal). B) Doppler color de la misma región demuestra aumento de la vascularización dérmica.
La celulitis disecante presenta hallazgos ecográficos similares a la hidradenitis supurativa e incluyen dilatación de folículos pilosos, pseudoquistes (<1cm), colecciones hipoecogénicas (≥1cm), túneles que transcurren a través de la dermis y subcutáneo y pueden presentar grados variables de fibrosis y, al Doppler color, grados variables de hipervascularización dermohipodérmica en la periferia de las lesiones15.
Microscopia confocal de reflectanciaLa MCR es una técnica óptica basada en la emisión de láser de baja potencia, que es reflejado por las estructuras en función de sus diferentes índices de refracción. Se obtienen imágenes en diferentes planos focales que permiten un análisis tridimensional y la visualización de los contornos celulares, como en la histopatología. Su ventaja es la alta resolución axial y su principal limitación es su baja penetración, ya que solo alcanza profundidades de 250-350μm, visualizando únicamente hasta la dermis reticular superficial16,17. Gracias a la posibilidad de observar cambios microscópicos detallados, la MCR también se está utilizando en tricología y se puede considerar un paso intermedio entre la tricoscopia y la histología. Con MCR los folículos pilosos normales se han descrito como estructuras de diferentes tamaños en un patrón ordenado, con células basales pequeñas ovoides o poligonales y centrales más grandes y planas3.
Alopecia no cicatricialRudnicka et al.3 publicaron una pequeña serie de casos en la que se utilizó MCR para caracterizar algunas enfermedades del cabello. La estructura del tallo piloso presentó la misma apariencia en controles sanos, AA y AGA, sin embargo, en este último se observó heterogeneidad en el grosor de los tallos.
Se han reportado criterios de MCR para el diagnóstico de alopecias no cicatriciales tales como papilas dérmicas delimitadas, tallos pilosos miniaturizados y queratinización folicular (fig. 3). Estos hallazgos fueron publicados en un estudio retrospectivo del 201618, en el que se establecieron varios parámetros descriptivos de las alopecias cicatriciales (28 con LPP y 9 con LED) y no cicatriciales (30 con AGA y 19 con AA) y se identificaron características estadísticamente significativas para ambos tipos de alopecia (tabla 3). Si bien no se identificaron características distintivas significativas para AGA comparada con AA, en AA se encontraron células inflamatorias en epidermis superior y alrededor de estructuras anexiales en varios pacientes, lo que se explicaría por su origen autoinmune.
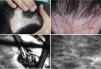
A) Placa eritematodescamativa en vértex. B) Dermatoscopia: se observa eritema difuso, tapones foliculares así como vasos arboriformes finos. C) MCR epidérmico: se observan células de morfología dendrítica de distribución peri e interfolicular (
). D) MCR en la UDE: se observa tapón folicular (*), infiltrado inflamatorio conformado por células de morfología redonda () así como vasos dilatados (o).Hallazgos en MCR distintivos asociados a diagnóstico de alopecia y su respectiva histopatología
| Grupo | Hallazgos en MCR | Correspondencia con histopatología |
|---|---|---|
| Alopecia no cicatricial | 1. Papila dérmica bien delimitada2. Miniaturización de tallos pilosos3. Queratinización folicular | 1. Unión dermoepidérmica íntegra y pigmentada2. Miniaturización folicular3. Material queratósico en los ostium foliculares |
| Alopecia cicatricial | 1. Infiltración inflamatoria en epidermis, perianexial y dermis superior2. Degeneración de fibras dérmicas y perianexiales | 1. Infiltración de células inflamatorias en epidermis, estructuras anexiales y dermis superior2. Fibras de colágeno con esclerosis difusa en dermis y localizada alrededor de estructuras anexiales |
En tiña capitis se han descrito estructuras hiperreflectantes homogéneas redondeadas de 5 a 10μm en la zona proximal del tallo piloso, correspondientes a conidias que, en condiciones in vivo, se observaron compactas, mientras que ex vivo, fueron más dispersas19,20.
Por su parte, en la alopecia inducida por quimioterapia también se han encontrado hallazgos distintivos. En un estudio observacional prospectivo de 16 mujeres con cáncer de mama se describieron características confocales y tricoscópicas propias de las fases evolutivas de la alopecia inducida por quimioterapia21.
Alopecia cicatricialCon MCR se han descrito células inflamatorias en dermis, epidermis y alrededor de estructuras anexiales, lo cual concuerda con la patogenia inflamatoria o autoinmune de las alopecias cicatriciales. A su vez, se han identificado 3características altamente específicas: células inflamatorias en epidermis, ausencia de miniaturización y ausencia de queratinización folicular18. De hecho, uno de los criterios principales que permite discriminar entre alopecias cicatriciales y no cicatriciales es la inflamación activa en epitelio anexial o unión dermoepidérmica, con el consiguiente oscurecimiento de las papilas dérmicas y ausencia de su borde normal. Otro criterio importante es la esclerosis dérmica, caracterizada por fibras aumentadas y engrosadas dispuestas de forma radial alrededor del folículo. Si bien estos hallazgos son propios de alopecias cicatriciales, se han descrito en algunos casos de alopecia no cicatricial crónica, como en fase tardía de AGA, lo que se atribuye al daño solar grave y a inflamación crónica18,22.
Respecto a LPP y AFF, hay un estudio específico del 202023 en el que se evaluaron 10 pacientes con LPP y 2 con AFF y se describieron células inflamatorias en epidermis próxima al infundíbulo anexial en casi la mitad de los casos, hallazgo consistente con la histopatología de estadios tempranos18,23. En lesiones de larga duración se observaron vasos sanguíneos dilatados, aumento de fibras dérmicas gruesas mal definidas y fibrosis perifolicular extensa (fig. 4).
A) Placa alopécica cicatricial en área interparietal. B) Tricoscopia: eritema, hiperqueratosis perifolicular y tufting folicular. C) MCR: hiperqueratosis infundibular con material blanquecino que rellena el infundíbulo del folículo piloso y rodea el tallo piloso D) En la dermis se observa un aumento del número de fibras dérmicas, mal definidas y gruesas.
En LPP y LED también se han descrito características que han mostrado correlación con la histopatología. Hay predominio de infiltrado inflamatorio en epidermis y cambios de interfase difusos en LPP, focales en LED con compromiso de la unión dermoepidérmica y localizados exclusivamente en la capa basal del epitelio anexial en LPP con compromiso folicular prominente. Estos hallazgos se describieron en un estudio de 7 pacientes con diagnóstico histológico previo de LPP y LED24.
En particular para casos de LED, el proceso diagnóstico puede ser difícil, por lo que el uso de MCR es prometedor. Un estudio observacional de 12 pacientes con LED encontró que la dermatitis de interfase y la dilatación infundibular fueron las características que presentaron mayor nivel de concordancia con la histopatología25. A su vez, el análisis confocal asociado a 3hallazgos tricoscópicos logró mejorar la concordancia con la histopatología.
También hay reportes en morfea y foliculitis decalvante. En una paciente con diagnóstico de morfea en golpe de sable, la MCR mostró marcadas áreas hiperreflectantes con atrofia grave de glándulas ecrinas, desaparición de glándulas sebáceas y algunos folículos de pequeño tamaño26, lo que contribuyó en el diagnóstico de etapas tempranas (con predominio de infiltrado linfocítico) y tardías (con esclerosis más prominentes). Con relación a la foliculitis decalvante, la MCR en 14 pacientes identificó estructuras tubulares muy reflectantes, estructuras brillantes redondas u ovaladas rodeadas de un borde regular e hiperqueratosis interfolicular, correspondientes en tricoscopia con pelos en penacho, pústulas y escamas o costras, respectivamente27,28.
Tomografía de coherencia ópticaLa TCO es una técnica de imagen que emplea luz de banda ancha en el infrarrojo cercano para detectar fotones retrodispersados a diferentes profundidades y, con ello, crea cortes transversales de alta resolución. Su uso se ha extendido en dermatología, ya que permite visualizar cambios celulares y morfológicos hasta 2-3mm de profundidad29. En tricología se ha incorporado recientemente como herramienta diagnóstica. Muestra el cuero cabelludo como una superficie brillante y los tallos pilosos como lúmenes oscuros y huecos dentro de los cuales hay anillos brillantes y reflectantes4. Su ventaja es la alta resolución, similar a la de la EUAF, y su principal limitación es la baja penetración, ya que no permite observar el tejido celular subcutáneo completo.
Alopecias no cicatricialesPara determinar la morfología y vitalidad del pelo con TCO, se utilizan 2parámetros que permiten realizar comparaciones y análisis en los estudios: sección transversal (ST) y factor de forma (FF), este último determinado por la relación de los diámetros máximo y mínimo del cabello. La variación en la ST en voluntarios sanos ha reportado ser <3%, mientras que el FF correspondiente varía en ≤4%30 y se ha observado que empeoran en pacientes en tratamiento con quimioterapia31 y con AA32.
El examen de 20 pelos de zonas frontal y occipital, ex vivo, en mujeres con cáncer de mama que recibieron tamoxifeno (17) versus quimioterapia (17) mostró que el diámetro medio después de quimioterapia fue 15% más bajo y la ST fue significativamente menor que en los pelos obtenidos antes del tratamiento; el FF no varió para el área frontal, pero sí para el área occipital. En las pacientes tratadas con tamoxifeno no se observaron cambios en ST ni en FF.
García Bartels et al.32 publicaron cambios morfológicos detectados con TCO en 9 pacientes con AA. La ST en los parches alopécicos fue significativamente menor en comparación con las áreas no afectadas, sin embargo, el FF no mostró diferencias significativas. Estos resultados indican que las anomalías estructurales de los tallos se encuentran solo en lesiones activas de AA. Otra publicación monitorizó la evolución de 2 pacientes con AA en parches y uno con AA universal tratados con 3sesiones de plasma rico en plaquetas33. Encontraron aumento de la longitud y cantidad de folículos en AA en parches y ningún cambio significativo en el paciente con AA universal. Otro estudio sobre AA detectó que 22 de 30 escaneos de la unión dermoepidérmica tenían más folículos que en la superficie4, lo que indica presencia de pelos en crecimiento en AA que no son visibles en la superficie.
Alopecias cicatricialesEn una publicación reciente se propone un atlas de las características tomográficas obtenidas de la evaluación en 6 sujetos sanos, 12 con alopecia cicatricial y 14 con alopecia no cicatricial34. Destacan los hallazgos de aumento del grosor epidérmico y disminución del recuento de folículos en el grupo de alopecia cicatricial, comparado con los grupos de alopecia no cicatricial y control. Si bien se analizan pocos pacientes, este estudio entrega un valioso conjunto de imágenes potencialmente útiles para el seguimiento y manejo de las alopecias, incluidas las cicatriciales (tabla 4).
Principales hallazgos con TCO en los grupos estudiados
| Grupo | Características tomográficas |
|---|---|
| Control | Estructuras tubulares cilíndricas largas con absorción uniforme de la luz que proyecta sombras bien formadasTodos los pelos tienen un diámetro similarLa unión dermoepidérmica se identifica fácilmente |
| Alopecia no cicatricial | AGA: muchos pelos vellosos, la unión dermoepidérmica se identifica fácilmente y epidermis sin alteracionesAA parcheada: aperturas foliculares con pelos terminales y algunos vellosos, la unión dermoepidérmica es fácilmente visible y el grosor de la epidermis es menorAA universal: aperturas foliculares sin pelos, la superficie del cuero cabelludo es reflectante, pero la unión dermoepidérmica es fácilmente identificable y el grosor epidérmico es menor |
| Alopecia cicatricial | AFF: muchos pelos individuales, ningún pelo velloso y grandes áreas sin aperturas foliculares. La unión dermoepidérmica está claramente delimitada y la epidermis, engrosadaLPP: grandes áreas de fibrosis, muchos pelos terminales solitarios, epidermis engrosada y unión dermoepidérmica disminuida |
En AFF se ha empleado TCO para mostrar que el grosor epidérmico es mayor en la línea de implantación capilar y menor en la banda alopécica cicatricial35. Estos hallazgos se explican por la presencia de infiltrado inflamatorio y edema en zonas de actividad y de atrofia en las áreas cicatriciales, respectivamente. Además, a medida que las zonas inflamadas progresan a cicatriciales, el flujo vascular del plexo superficial disminuye de forma progresiva y el flujo más profundo aumenta, lo que ocurriría por obliteración de los vasos superficiales en etapa cicatricial con redistribución de flujo hacia los más profundos.
ConclusionesSi bien el método de referencia en la evaluación de las enfermedades del cabello es el análisis histológico, constituye una modalidad invasiva y no siempre representativa del proceso global. A su vez, la tricoscopia proporciona una imagen ampliada de la superficie, tallos pilosos y orificios foliculares, pero los folículos subyacentes son inaccesibles. Por lo tanto, estas nuevas herramientas diagnósticas no invasivas aportan mayor información y complementan los métodos tradicionales, al evaluar estructuras más profundas, e incluso permiten analizarlas durante y después de implementar un tratamiento. Sin embargo, existen aún varias dificultades para adoptar el uso de todas estas técnicas en tricología, tales como coste elevados, curva de aprendizaje para el dermatólogo, dificultad propia de la zona anatómica, estudios con número pequeño de pacientes y ausencia de comparación de las imágenes histopatológicas y tricoscópicas. Adicionalmente, se deben tener en cuenta las ventajas y limitaciones de cada técnica para aprovechar de forma adecuada la información anatómica que provee cada modalidad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.