Sr. Director:
El sarcoma de Kaposi clásico (SKC) es una neoproliferación vascular típica de extremidades inferiores de pacientes ancianos. Se asocia al virus herpes 8 (VH8), aunque la alta prevalencia en países mediterráneos sugiere que otros factores ambientales son relevantes en su etiopatogenia.
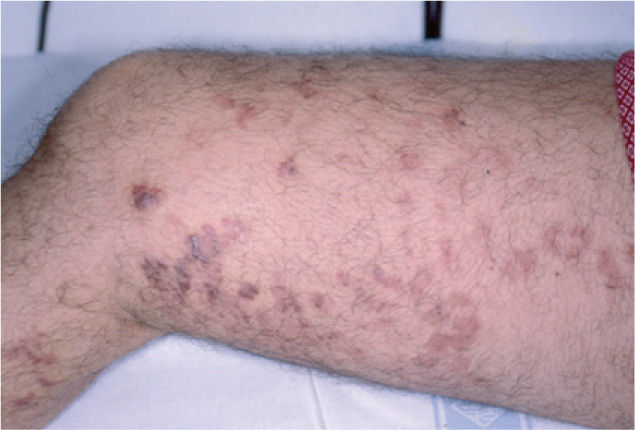
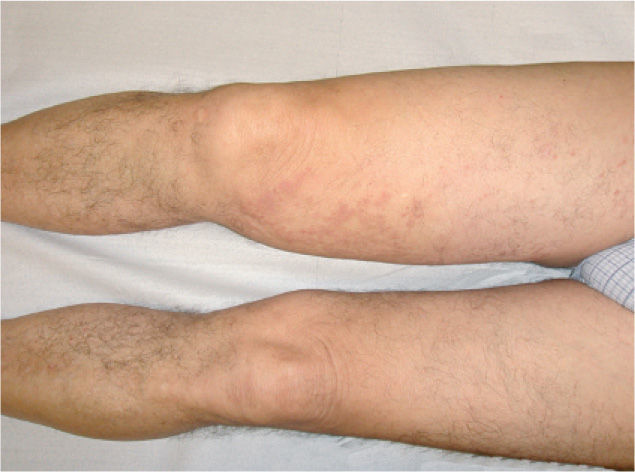
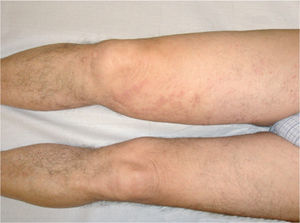
Presentamos el caso de un varón de 59 años con placas y nódulos violáceos asintomáticos de un año de evolución en la extremidad inferior derecha (fig. 1). Se observa linfedema en la misma, que está presente desde la práctica de un cateterismo arterial femoral seis años antes, a raíz de un sangrado intestinal. El estudio histopatológico lesional muestra proliferación vascular de células fusiformes con hematíes disecando los haces de colágeno, compatible con sarcoma de Kaposi (SK). El estudio inmunohistoquímico resultó positivo para el VH8. La angiorresonancia con contraste no muestra anomalías vasculares ni fístulas arteriovenosas en las extremidades inferiores. Se administraron diez ciclos de doxorrubicina liposomal de 20 mg/m2/tres semanas, y se obtuvo la remisión clínica completa (fig. 2).
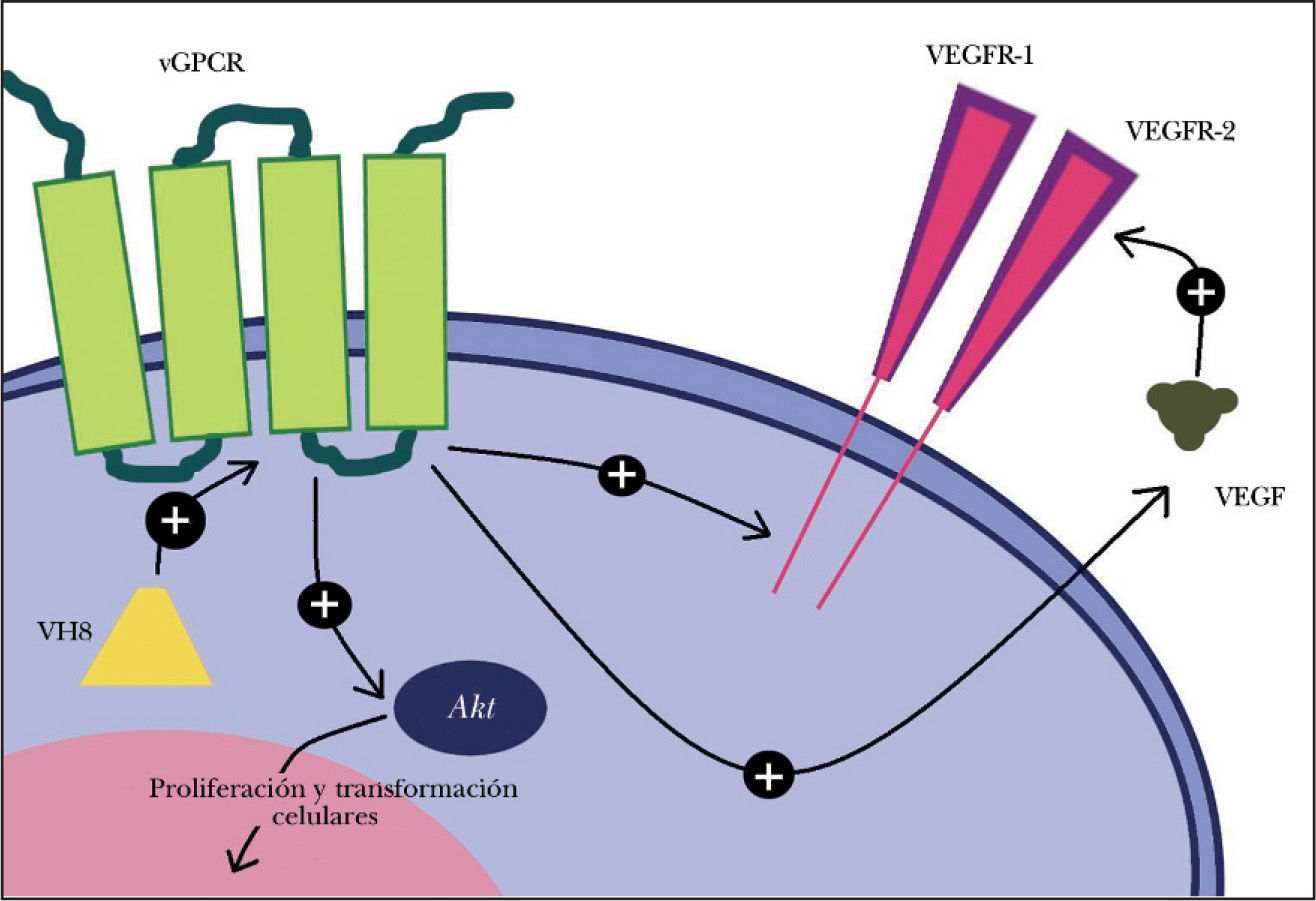
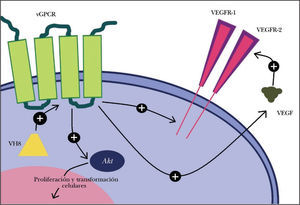
La variante clásica del SK se caracteriza por pápulas o nódulos violáceos en la parte distal de los miembros de varones de edad avanzada, con un curso indolente. Parece que el VH8 es un factor necesario para su aparición: independientemente de la variante tumoral, más del 95 % de las células neoplásicas están infectadas por este virus1. Se encarga de codificar proteínas homólogas a oncoproteínas humanas que modifican el ciclo y la proliferación celulares, la apoptosis, la angiogénesis y la respuesta inmune mediada por linfocitos T helper1. Las oncoproteínas víricas son promotoras tumorales inductoras de la síntesis de moléculas angiogénicas como el receptor acoplado a la proteína G viral (vGPCR)1,2, el factor de crecimiento del endotelio vascular (VEGF)2,3 y de la expresión del receptor KDR2. El vGPCR es un receptor de citoquinas humano «pirateado» que promueve la aparición del SK: regula la proliferación y transformación celulares a través de la molécula Akt, y de factores angiogénicos como el VEGF y sus receptores tipo 1 y 22. El vGPCR dispara la proliferación endotelial vía intracelular y/o autocrina, e induce el desarrollo tumoral en células próximas por contacto directo o secreción paracrina2 (fig. 3). La pérdida del control de la proliferación celular y la alteración de la respuesta inmunitaria y de las vías de las citoquinas promoverían el SK. En la etiopatogenia y agresividad del SKC también participan otros factores como las alteraciones inmunitarias1, los trastornos del drenaje linfático4,5, la oncogénesis vascular6 y la proteína tat del virus de la inmunodeficiencia humana (VIH)1.
Mecanismos moleculares de acción del virus herpes 8 (VH8) en la transformación celular y en la secreción de factores y receptores angiogénicos. VEGFR-1: receptor 1 del factor de crecimiento del endotelio vascular; VEGFR-2: receptor 2 del factor de crecimiento del endotelio vascular; vGPCR: receptor acoplado a la proteína G viral.
En el caso presentado, la localización tumoral limitada al linfedema sugiere una relación etiológica con el trastorno circulatorio. La angiorresonancia descartó fístulas arteriovenosas secundarias al cateterismo que pudieran explicar la aparición de lesiones similares al SK (pseudo-SK, síndrome de Bluefarb-Stewart). La ausencia de alteraciones vasculares, el aspecto histológico de las lesiones, la positividad inmunohistoquímica para VH8 y la negatividad de la serología del VIH apoyan el diagnóstico de SKC.
El linfedema es frecuente antes o durante la aparición del SK1,4,5,7,8, y podría tratarse de una lesión precoz en el espectro del SK8. El estudio linfográfico de casos de SKC revela anomalías estructurales y funcionales del drenaje concordantes con las del estasis linfático primario o secundario4. El estasis linfático ocasiona disfunción inmunitaria local7 celular -tráfico de linfocitos y células de Langerhans-5,9 y estimula la linfangiogénesis7 y la angiogénesis7,9, que favorecen neoplasias vasculares benignas y malignas7. Se han descrito casos de SK en zonas de linfedema5,8, trombosis venosas3, cateterismos complicados6, venopunciones10, abscesos10 y traumatismos10. Los estímulos físicos aumentarían la secreción de factores de crecimiento vasculares (factor de crecimiento fibroblástico básico) y mediadores inflamatorios (interleucinas 1 beta, 6 y factor de necrosis tumoral alfa) que favorecen la proliferación vascular y la adquisición de características de las células fusiformes del SK en el endotelio normal1,6.
Un drenaje vascular anormal facilitaría la secreción autocrina del VEGF y su receptor (KDR)3, promoviendo la proliferación de células endoteliales infectadas por el VH8. Tanto en las trombosis como en el linfedema se ha descrito un aumento del VEGF3 que estimula la angiogénesis.
La aparición de SK sobre zonas con trastornos circulatorios y linfáticos sin fístulas arteriovenosas apoya el papel etiopatogénico de las alteraciones inmunitarias locales y de la secreción de factores de crecimiento vasculares como el VEGF. Sobre este y otros agentes angiogénicos actúan las oncoproteínas víricas, cuyo rol es cada vez más destacado en la génesis del SK. El fenómeno de Koebner y la secreción secundaria de moléculas angiogénicas podrían explicar la aparición de SK en zonas traumatizadas por pruebas invasivas. En pacientes más susceptibles al SK, como los infectados por el VIH, las maniobras invasivas suponen un riesgo para la aparición de esta neoplasia. En conclusión, parece que el estasis linfático, a través de mecanismos físicos, inmunológicos y por secreción de agentes angiogénicos, puede conducir a la aparición de neoplasias vasculares como el SKC.