El ruxolitinib es un inhibidor JAK1 y 2 que fue aprobado en 2011 para su uso en mielofibrosis (MF), en 2014 para la policitemia vera (PV) y en 2019 para la enfermedad de injerto contra huésped (EICH)1,2. Desde los primeros ensayos clínicos con ruxolitinib, se observó un posible incremento de la incidencia de cáncer cutáneo no melanoma (CCNM)2,3. Es importante señalar que este fármaco se utiliza en unos pacientes que presentan un riesgo incrementado respecto a la población general de desarrollar CCNM, debido a sus neoplasias hematológicas y tratamientos previos (por ejemplo, hidroxiurea)4. Además de este incremento en la incidencia, se han comunicado casos de carcinoma de células escamosas (CCE), excepcionalmente agresivos, en pacientes tratados con ruxolitinib5–7.
Se describen tres hombres que desarrollaron un CCE de alto riesgo durante el tratamiento con ruxolitinib administrado por patologías hematológicas. En la tabla 1 se recogen las características clínicas y demográficas de los pacientes. El paciente 1 y el paciente 3 fallecieron debido a la progresión de su neoplasia cutánea, localizada inicialmente en ambos pacientes en el pabellón auricular (fig. 1 y 2). El paciente 2 falleció poco después de la intervención inicial por un problema médico no relacionado, pero es significativa la presencia de factores tumorales de mal pronóstico, como la invasión perineural o la infiltración de los cartílagos nasales (fig. 2).
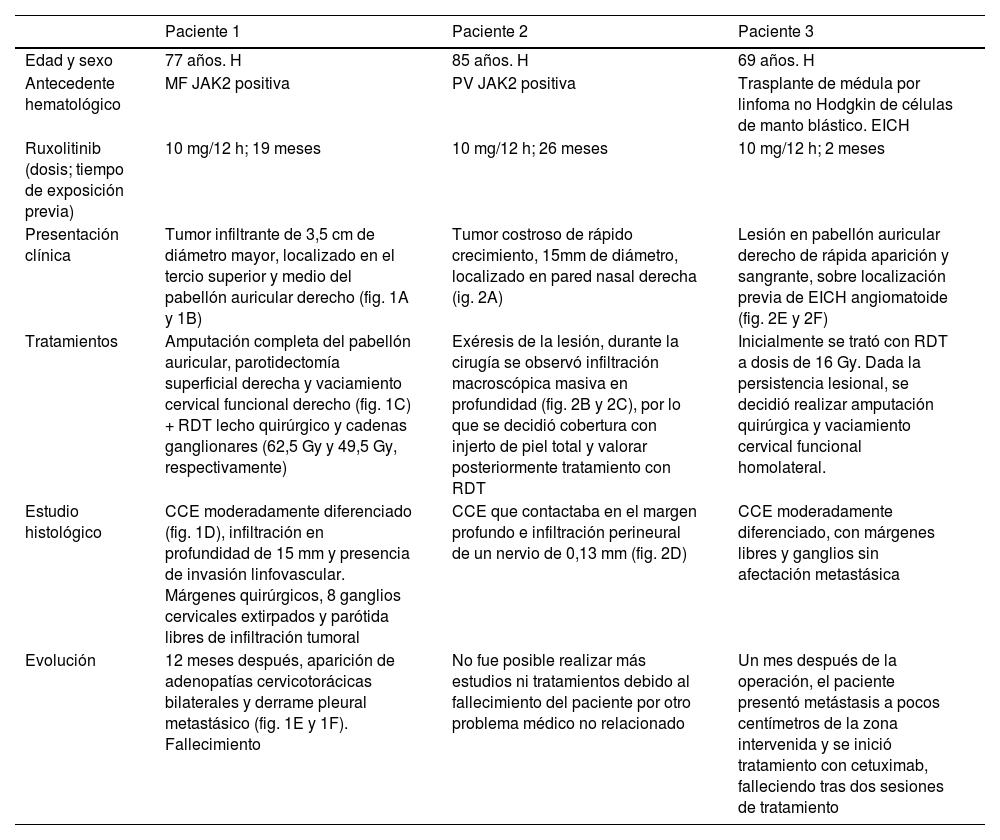
Principales características de los pacientes que desarrollaron CCE de alto riesgo mientras recibían ruxolitinib
| Paciente 1 | Paciente 2 | Paciente 3 | |
|---|---|---|---|
| Edad y sexo | 77 años. H | 85 años. H | 69 años. H |
| Antecedente hematológico | MF JAK2 positiva | PV JAK2 positiva | Trasplante de médula por linfoma no Hodgkin de células de manto blástico. EICH |
| Ruxolitinib (dosis; tiempo de exposición previa) | 10 mg/12 h; 19 meses | 10 mg/12 h; 26 meses | 10 mg/12 h; 2 meses |
| Presentación clínica | Tumor infiltrante de 3,5 cm de diámetro mayor, localizado en el tercio superior y medio del pabellón auricular derecho (fig. 1A y 1B) | Tumor costroso de rápido crecimiento, 15mm de diámetro, localizado en pared nasal derecha (ig. 2A) | Lesión en pabellón auricular derecho de rápida aparición y sangrante, sobre localización previa de EICH angiomatoide (fig. 2E y 2F) |
| Tratamientos | Amputación completa del pabellón auricular, parotidectomía superficial derecha y vaciamiento cervical funcional derecho (fig. 1C) + RDT lecho quirúrgico y cadenas ganglionares (62,5 Gy y 49,5 Gy, respectivamente) | Exéresis de la lesión, durante la cirugía se observó infiltración macroscópica masiva en profundidad (fig. 2B y 2C), por lo que se decidió cobertura con injerto de piel total y valorar posteriormente tratamiento con RDT | Inicialmente se trató con RDT a dosis de 16 Gy. Dada la persistencia lesional, se decidió realizar amputación quirúrgica y vaciamiento cervical funcional homolateral. |
| Estudio histológico | CCE moderadamente diferenciado (fig. 1D), infiltración en profundidad de 15 mm y presencia de invasión linfovascular. Márgenes quirúrgicos, 8 ganglios cervicales extirpados y parótida libres de infiltración tumoral | CCE que contactaba en el margen profundo e infiltración perineural de un nervio de 0,13 mm (fig. 2D) | CCE moderadamente diferenciado, con márgenes libres y ganglios sin afectación metastásica |
| Evolución | 12 meses después, aparición de adenopatías cervicotorácicas bilaterales y derrame pleural metastásico (fig. 1E y 1F). Fallecimiento | No fue posible realizar más estudios ni tratamientos debido al fallecimiento del paciente por otro problema médico no relacionado | Un mes después de la operación, el paciente presentó metástasis a pocos centímetros de la zona intervenida y se inició tratamiento con cetuximab, falleciendo tras dos sesiones de tratamiento |
H: hombre; RDT: radioterapia; CCE: carcinoma de células escamosas: MF: mielofibrosis; PV: policitemia vera; EICH: enfermedad injerto contra huésped.
Imágenes pertenecientes al paciente 1. A y B) Aspecto clínico del CCE afectando al tercio superior y medio del pabellón auricular derecho. C) vaciamiento cervical funcional. En la imagen se distinguen la vena yugular externa, parótida y nervio facial. D) Hematoxilina y eosina, 200x. Tumor queratinizante moderadamente diferenciado formando remolinos córneos. E) Tomografía computarizada (TC) con contraste, corte coronal, en círculo adenopatías supraclaviculares derechas; en asterisco derrame pleural. F) TC con contraste, corte transversal, asterisco señala derrame pleural.
A) Paciente 2, tumor escamocostroso en pared nasal. B y C) Aspecto intraoperatorio en el que se sospecha infiltración en profundidad de los cartílagos nasales. D) Hematoxilina y eosina, 200x, tumor presentando infiltración perineural. E y F) Paciente 3, gran tumor carnoso, con sangrado espontáneo afectando a la práctica totalidad del pabellón auricular.
El ruxolitinib es uno de los fármacos más utilizados en el tratamiento de los pacientes con síndromes mieloproliferativos y de aquellos con un EICH refractario a corticoides, porque es uno de los pocos tratamientos que ha demostrado mejorar la supervivencia global (en MF y PV) y libre de enfermedad (en EICH)2,3,8. En la valoración a cinco años del ensayo clínico COMFORT-II, que llevó a la aprobación de la indicación en el tratamiento de la MF, se observó una incidencia de CCNM en los pacientes que recibían ruxolitinib de 17,1% (25 de 146) frente a 2,7% (2 de 73) en el grupo control que recibía la mejor terapia disponible3. Sin embargo, tras ajustar por exposición (pacientes/año) esta diferencia no alcanzó la significación estadística.
Recientemente se han publicado los datos de práctica clínica correspondientes a la cohorte más amplia hasta la fecha, compuesta por 188 pacientes que recibieron ruxolitinib por MF o PV y controles ajustados por edad, sexo, raza, tiempo desde el diagnóstico y tratamientos previos, incluyendo hidroxiurea1. En este estudio se encontró una hazard ratio (HR) para el desarrollo de CCE en pacientes que recibían ruxolitinib de 3,2 (intervalo de confianza [IC] de 95%, 1,5-7). En los pacientes que no presentaban mutación en JAK2, este riesgo se incrementaba hasta una HR de 7,4 (IC 95%, 2,5-21,6)1. Los autores hipotetizaron que esta diferencia podría justificarse porque la ausencia de mutación en JAK2 pudo condicionar una inhibición más intensa del ruxolitinib de los linfocitos tisulares responsables de evitar el desarrollo de neoplasias cutáneas1. Contrariamente a lo esperado, no se encontraron diferencias significativas en el desarrollo de CCE en los pacientes que recibieron hidroxiurea respecto a los que no lo recibieron (HR 1,1). Sin embargo, haber recibido tratamiento con ciclosporina, azatioprina o corticoides sistémicos durante más de dos semanas sí que se relacionó con un riesgo incrementado de CCE. La mayoría de los CCE aparecieron entre el primer y el segundo año tras el inicio del ruxolitinib, mediana 66,5 semanas (rango 11-245).
En cuanto al EICH, todavía no existen datos a largo plazo en estos pacientes sobre el desarrollo de neoplasias cutáneas en pacientes que reciben ruxolitinib8. El paciente 3 es el primero que hemos podido encontrar en la literatura publicada de CCE en un paciente con EICH tratado con ruxolitinib. Dada su evolución fatal, parece conveniente estar alerta sobre la posible aparición de CCE agresivos en este grupo de pacientes.
Sobre el uso tópico de ruxolitinib, hasta la fecha no se han comunicado casos de CCE en pacientes recibiendo este tratamiento de forma tópica9. Además, en una revisión de la farmacocinética del ruxolitinib en crema para dermatitis atópica, en la que se incluyeron 1.139 pacientes provenientes de ensayos clínicos, no se encontraron concentraciones en sangre capaces de tener un efecto sistémico o cambios hematológicos10. Todo ello hace muy probable que el perfil de seguridad de la presentación tópica sea muy distinto al del fármaco sistémico.
Como conclusión, recomendamos el seguimiento dermatológico de los pacientes que reciben tratamiento con ruxolitinib por problemas hematológicos, recomendación que está actualmente incluida en la ficha técnica del fármaco1. Se debe estar alerta ante la evolución agresiva y letal que pueden presentar estos pacientes. Futuros estudios poscomercialización, con seguimientos más largos que los recogidos en los ensayos clínicos, podrán arrojar más luz sobre el riesgo en los pacientes con EICH y el tratamiento con ruxolitinib.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.