Las queratosis actínicas (QA) son lesiones crónicas y recurrentes precancerosas, inducidas principalmente por la exposición solar prolongada, y que se encuentran comúnmente en áreas expuestas al sol, como la cara, el cuello, las manos, los antebrazos y las pantorrillas. Las QA son muy frecuentes, afectando a millones de personas en todo el mundo, y presentan un riesgo significativo de transformarse en carcinomas escamosos invasivos.
ObjetivoEsta revisión sistemática tiene como objetivo actualizar la evidencia científica sobre el papel de los bioactivos orales, nutracéuticos o suplementos dietéticos en el tratamiento de las QA y el campo de cancerización, evaluando su perfil de seguridad y eficacia.
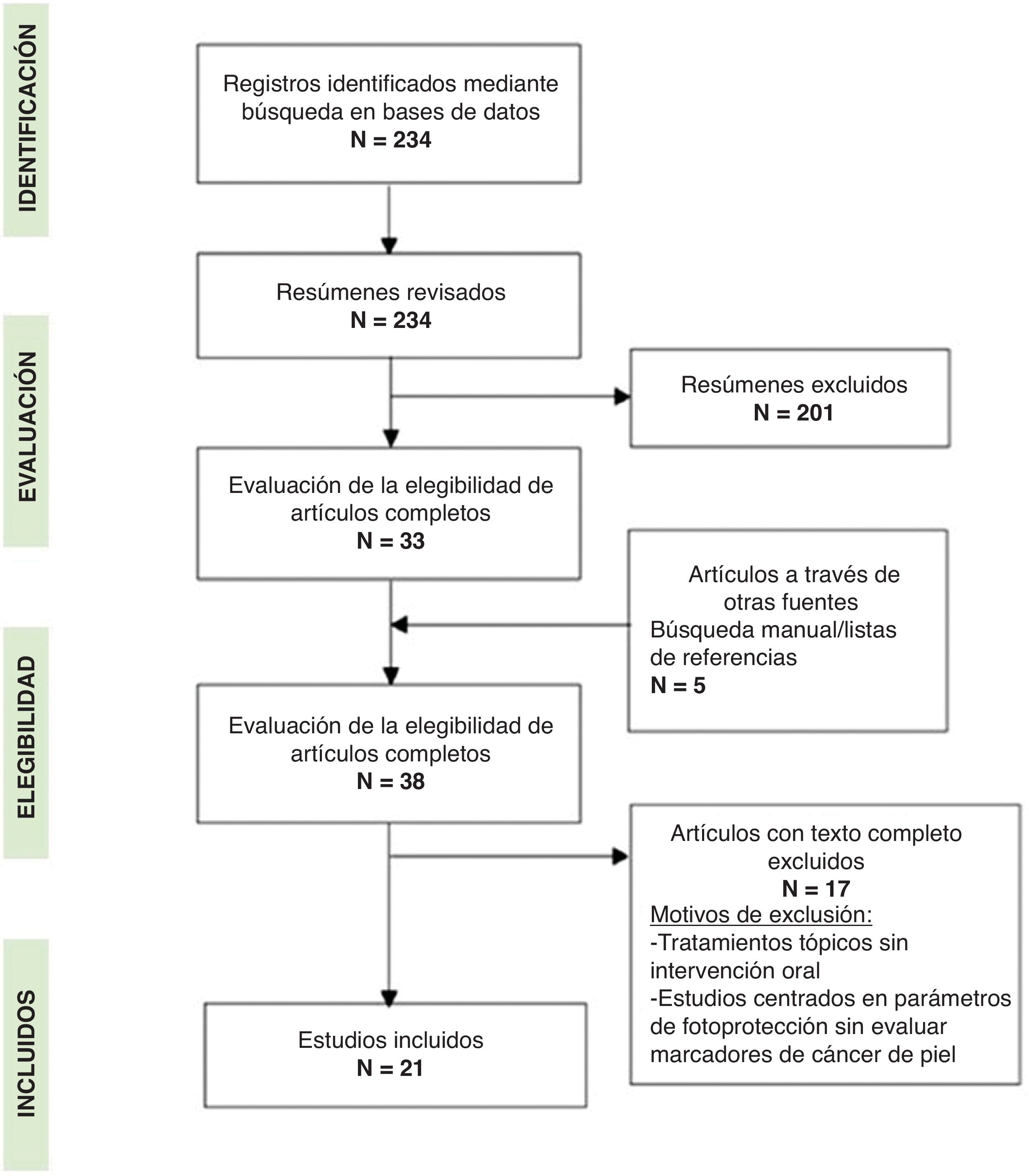
MétodosEl plan de revisión fue registrado en la base de datos PROSPERO (CRD42023485985). Siguiendo las directrices PRISMA, identificamos, seleccionamos e incluimos estudios relevantes. Se examinaron 234 artículos, revisamos exhaustivamente 38 textos completos, y finalmente se incluyeron 21 artículos publicados entre 2013 y 2023 para su análisis.
ResultadosLos estudios seleccionados se clasificaron en 3 grupos según la naturaleza química de los suplementos: polifenoles (11 estudios), vitaminas (8 estudios) y otros (2 estudios). Los estudios incluyeron investigaciones preclínicas (9 estudios) y clínicas (12 estudios). Los ensayos clínicos han demostrado la eficacia de los suplementos polifenólicos, como el extracto de Polypodium leucotomos y otros, en la mejora de la salud de la piel y la reducción del riesgo de cánceres cutáneos. Los estudios preclínicos destacaron los efectos protectores de los polifenoles contra el daño inducido por los rayos UV y la transformación neoplásica. Los estudios de suplementación con vitaminas mostraron resultados mixtos, con datos claros que indican beneficios en la reducción del riesgo de lesiones precancerosas y cánceres de piel tras el tratamiento con nicotinamida, mientras que otros no demostraron efectos protectores significativos.
ConclusionesLa revisión confirma la eficacia de los polifenoles en la prevención y el tratamiento de las QA y afecciones relacionadas con la piel. Sin embargo, el papel de las vitaminas y otros suplementos requiere más investigación debido a hallazgos inconsistentes y/o escasos. Los futuros estudios clínicos deberían centrarse en poblaciones diversas con mayor riesgo de cáncer de piel y explorar nuevos ingredientes, así como combinaciones de varios ingredientes para optimizar las aplicaciones terapéuticas.
Actinic keratoses (AKs) are chronic, recurrent precancerous lesions primarily induced by long-term sun exposure, commonly found on sun-exposed areas such as the face, neck, hands, forearms, and lower legs. AKs are prevalent, affecting millions worldwide, and pose a significant risk of transforming into invasive squamous cell carcinomas (SCCs).
ObjectiveThis systematic review aims to update the scientific evidence on the role of oral bioactives, nutraceuticals, or dietary supplements in the treatment of AKs and field cancerization, while evaluating their safety and efficacy profile.
MethodsA review plan was pre-registered in the PROSPERO database (CRD42023485985). Following the PRISMA guidelines, we identified, selected, and included relevant studies. We screened a total of 234 articles, thoroughly reviewed 38 full texts, and ultimately included 21 articles published from 2013 through 2023 for analysis.
ResultsThe selected studies were categorized into three groups based on the chemical nature of the supplements: polyphenols (11 studies), vitamins (8 studies), and others (2 studies). The studies included preclinical (9) and clinical (12) studies. Clinical trials have demonstrated the efficacy profile of polyphenolic supplements, such as Polypodium leucotomos extract (PLE) and others in improving skin health and reducing the risk of skin cancers. Preclinical studies highlighted the protective effects of polyphenols against UV-induced damage and neoplastic transformation. Vitamin supplementation studies revealed mixed results, with clear data showing benefits in reducing the risk of precancerous lesions and skin cancers after nicotinamide (NAM) treatment, while others did not demonstrate significant protective effects.
ConclusionsThe review confirms the efficacy of polyphenols in preventing and treating AKs and related skin conditions. However, the role of vitamins and other supplements requires further investigation due to inconsistent and/or scarce findings. Future clinical trials should focus on diverse populations at higher risk of skin cancer and explore new ingredients as well as combinations of various ingredients to optimize therapeutic applications.
Las queratosis actínicas (QA) son lesiones cutáneas crónicas y recurrentes inducidas principalmente por la exposición prolongada a la luz solar. Se localizan con frecuencia en zonas corporales expuestas al sol, como la cara, el cuello, el dorso de las manos, los antebrazos y la parte inferior de las piernas. Las QA surgen como proliferaciones atípicas intraepiteliales de queratinocitos y se caracterizan típicamente por lesiones planas o ligeramente elevadas con una textura áspera y escamosa. Según estimaciones recientes, 40 millones de estadounidenses desarrollan una nueva QA cada año, una tendencia que se espera que aumente en los próximos años. Además, la aparición de QA afecta a más de un tercio de los adultos mayores de 60 años en Europa, y hasta al 60% en Australia1–3. En España, la prevalencia de las QA es de aproximadamente del 28,6% de los individuos mayores de 45 años, observándose tasas más elevadas en hombres y poblaciones de mayor edad. Esta elevada prevalencia subraya la importante carga que las QA suponen para los servicios de dermatología en España4,5.
El mayor riesgo asociado a las QA reside en su potencial para evolucionar a carcinomas de células escamosas (CCE) invasivos a través de una vía diferenciada o indiferenciada6. De hecho, las QA se definen como las formas iniciales de CCE, con un riesgo variable de transformación maligna estimado entre el 0,025 y el 16% cada año7,8. Los estudios han demostrado que el riesgo de desarrollar un CCE se correlaciona positivamente con el número de QA, ya que se encontraran QA contiguas a un CCE en casi el 97% de los casos8. Además, las QA y los CCE comparten ciertas características genéticas, como mutaciones en el gen supresor de tumores p53 y NOTCH, entre otras9,10.
Por otro lado, la piel de apariencia normal y expuesta al sol que rodea a las QA también está sujeta a daño actínico acumulativo, con lesiones subclínicas, y por tanto podría presentar alteraciones moleculares similares a las de las lesiones de QA. En este sentido, el concepto de «campo de cancerización» fue introducido por primera vez por Slaughter et al.11. Actualmente, describe la presencia de células precancerosas y cancerosas en un tejido cercano a un tumor y expuesto crónicamente a un carcinógeno8,12. En el contexto de las QA, el campo de cancerización se refiere al fenómeno en el que los queratinocitos alrededor de una lesión visible parecen histológicamente normales, pero presentan alteraciones genéticas idénticas a las de la lesión. Estas zonas de la piel con un daño UV extenso son propensas a desarrollar un mayor número de QA13. Teniendo esto en cuenta, la presencia de un campo de cancerización requiere una estrategia terapéutica que no solo debe centrarse en el tratamiento de las QA clínicamente visibles, como es el caso de las terapias dirigidas a la lesión, p. ej., la crioterapia, sino también tratar las QA subclínicas para minimizar su potencial de transformación en CCE. Por lo tanto, los tratamientos dirigidos al campo de cancerización son muy recomendables para abordar el daño subclínico, reducir las tasas de recurrencia de las QA y reducir potencialmente el riesgo de CCE. Además, las opciones de tratamiento deben permitir tratar zonas extensas, salvaguardando la comodidad del paciente y logrando buenos resultados estéticos12,14–16. De hecho, varias modalidades dirigidas a tratar el campo de cancerización están aprobadas para el tratamiento de zonas dañadas por el sol con múltiples QA, incluida la terapia fotodinámica (TFD), y agentes tópicos, como el 5-fluorouracilo, el imiquimod, la tirbanibulina y el diclofenaco17–20.
En consonancia con esta estrategia, la combinación de fotoprotección tópica y fotoprotección oral también es una opción preventiva con potencial como tratamiento del campo de la piel con daño actínico grave21. Por lo tanto, dado que se sabe que los compuestos naturales obtenidos a partir de plantas o fitoconstituyentes ejercen efectos terapéuticos principalmente a través de sus propiedades antioxidantes, de eliminación de radicales libres y antiinflamatorias, puede considerarse su inclusión en los tratamientos de campo junto con los tratamientos farmacológicos estándar. En esta revisión sistemática pretendemos actualizar la evidencia científica disponible sobre el papel de los bioactivos orales o nutracéuticos o suplementos dietéticos en el tratamiento de las QA y del campo de cancerización, y evaluar el perfil de seguridad y eficacia reportado por dichos tratamientos.
MétodosSe registró previamente un plan de revisión en la base de datos PROSPERO (CRD42023485985). Este artículo se desarrolló siguiendo la guía Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA), que envuelve la identificación, la selección, la elegibilidad y la inclusión22.
Estrategia de búsquedaSe realizó una búsqueda bibliográfica exhaustiva utilizando diversas bases de datos electrónicas, incluidas, entre otras, Pubmed, Google Scholar, EMBASE, The Cochrane Library, junto con las listas de referencias de los estudios elegibles y los registros de ensayos. Se dio prioridad a Pubmed Central como referencia de la National Library of Medicine. Nuestra búsqueda se limitó a artículos publicados desde 2013 hasta 2023 (ambos años incluidos), escritos en inglés y relevantes para nuestra investigación sobre los efectos de los suplementos dietéticos orales en la salud de la piel. Los criterios de búsqueda se adaptaron a cada base de datos utilizada. La técnica de recuperación detallada se describe minuciosamente en el Tabla suplementaria S1 (datos suplementarios).
Criterios de elegibilidadLos estudios se incluyeron siguiendo los siguientes criterios:
- 1.
Tipo de estudio: Estudios clínicos realizados en seres humanos con QA diagnosticadas mediante evaluación clínica y dermatoscópica, incluida la evaluación del número, el grado y las imágenes dermatoscópicas. Estudios clínicos en los pacientes con campo de cancerización (diagnosticado mediante el número de QA, el tamaño de las QA, el esquema de clasificación clínica de Olsen, que gradúa las QA en función de su grosor y grado de hiperqueratosis, entre otros). Estudios in vitro con células cutáneas o estudios preclínicos con modelos de piel artificial. Los principales criterios de exclusión incluían: a) estudios de revisión y b) estudios in vitro desarrollados con compuestos naturales que no tuvieran evidencia clínica demostrada en la piel. Posteriormente, los trabajos aceptados debían ser revisados por pares y se debía de disponer del texto completo.
- 2.
Participantes/poblaciones objeto de estudio: Se incluyeron estudios clínicos en los que participaran adultos con edades ≥18 años. Los principales criterios de exclusión fueron: a) estudios con niños y adolescentes (menores de 18 años) y b) estudios preclínicos realizados en animales.
- 3.
Tipo de intervención: Un estudio se consideró elegible si evaluaba intervenciones para el tratamiento de las QA, incluidos métodos basados en lesiones individuales (p. ej., crioterapia) o tratamientos tópicos dirigidos a campos específicos (p. ej., TFD, diclofenaco, 5-fluorouracilo e imiquimod). Además, los tratamientos cosméticos podrían utilizarse como coadyuvantes de estas terapias. Estas intervenciones podrían diferir en cuanto a la seguridad, la eficacia y los resultados cosméticos. Por lo tanto, también podrían considerarse terapias orales con productos naturales, solos o en combinación con los tratamientos farmacológicos estándares mencionados.
Estos parámetros se indican en la tabla 1 tras la declaración PICAR (tabla 1).
Criterios de elegibilidad relativos a la población y a las áreas clínicas, intervenciones, comparadores, atributos de las CPGs y características de las recomendaciones (PICAR)
| Elemento PICAR | Criterios específicos del estudio |
|---|---|
| Población y área/s clínica/s | - Adultos (mayores de 18 años) diagnosticados de queratosis actínica.- Estudios preclínicos: Estudios in vitro con células cutáneas o estudios preclínicos en modelos cutáneos. |
| Intervenciones | - Compuestos de origen natural con evidencia clínica en la prevención del campo de cancerización y las queratosis actínicas. |
| Comparadores | No se aplica ningún comparador. |
| Características de los estudios elegibles | - Idioma: Inglés.- Años de publicación: 2013-2023.- Tipo de publicación: Estudios clínicos y preclínicos. Los trabajos publicados deben ser artículos revisados por pares con texto completo.- Región de publicación: Todas.- Ámbito clínico: Estudios que evalúen compuestos orales con evidencia clínica establecida y se centren en las vías implicadas en el desarrollo de queratosis actínicas o del campo de cancerización.- Formato: Ensayo clínico y estudio in vitro.- Propósito: Reducir las queratosis actínicas y el campo de cancerización.- Intervenciones: Tratamientos tópicos individuales basados en la lesión (p, ej., crioterapia) o dirigidos al campo (p. ej., diclofenaco, 5-fluorouracilo, imiquimod). Además, el tratamiento cosmético podría utilizarse como terapia adyuvante de estos tratamientos. Éstos podrían variar en términos de seguridad, eficacia y resultados cosméticos. Por lo tanto, solo se considerarán las terapias orales con productos naturales, también solos o en combinación con los tratamientos farmacológicos estándares citados. |
| - Ámbito de aplicación: Compuestos naturales que hayan demostrado eficacia clínica oral en la mejora de afecciones cutáneas mediante evidencia clínica o modulación sobre las vías implicadas en el desarrollo de queratosis actínicas o del campo de cancerización.- Duración del tratamiento: No aplicable.- Niveles de confianza: No aplicable.- Comparadores: En los estudios clínicos debe incluirse un placebo (grupo de pacientes que no estarán expuestos al tratamiento con el producto natural).- Modelos in vitro: Un control que no será expuesto al tratamiento con el producto natural.- Recomendaciones de localización: no aplicable. |
Dos revisores (A.R.-L. y A.Z.) seleccionaron de forma independiente los documentos para determinar su elegibilidad, examinando inicialmente los títulos y resúmenes mediante un documento de Microsoft Excel® (Microsoft®), eliminando los duplicados. Los desacuerdos se resolvieron por consenso, con la ayuda de un tercer revisor (S.G.). Una vez cumplidos los criterios de inclusión, los textos completos se importaron a Mendeley (ELSEVIER LIMITED). Posteriormente, estos textos completos fueron evaluados de forma independiente por 2 investigadores (A.R.-L. y A.Z.) según los criterios mencionados anteriormente para determinar su elegibilidad.
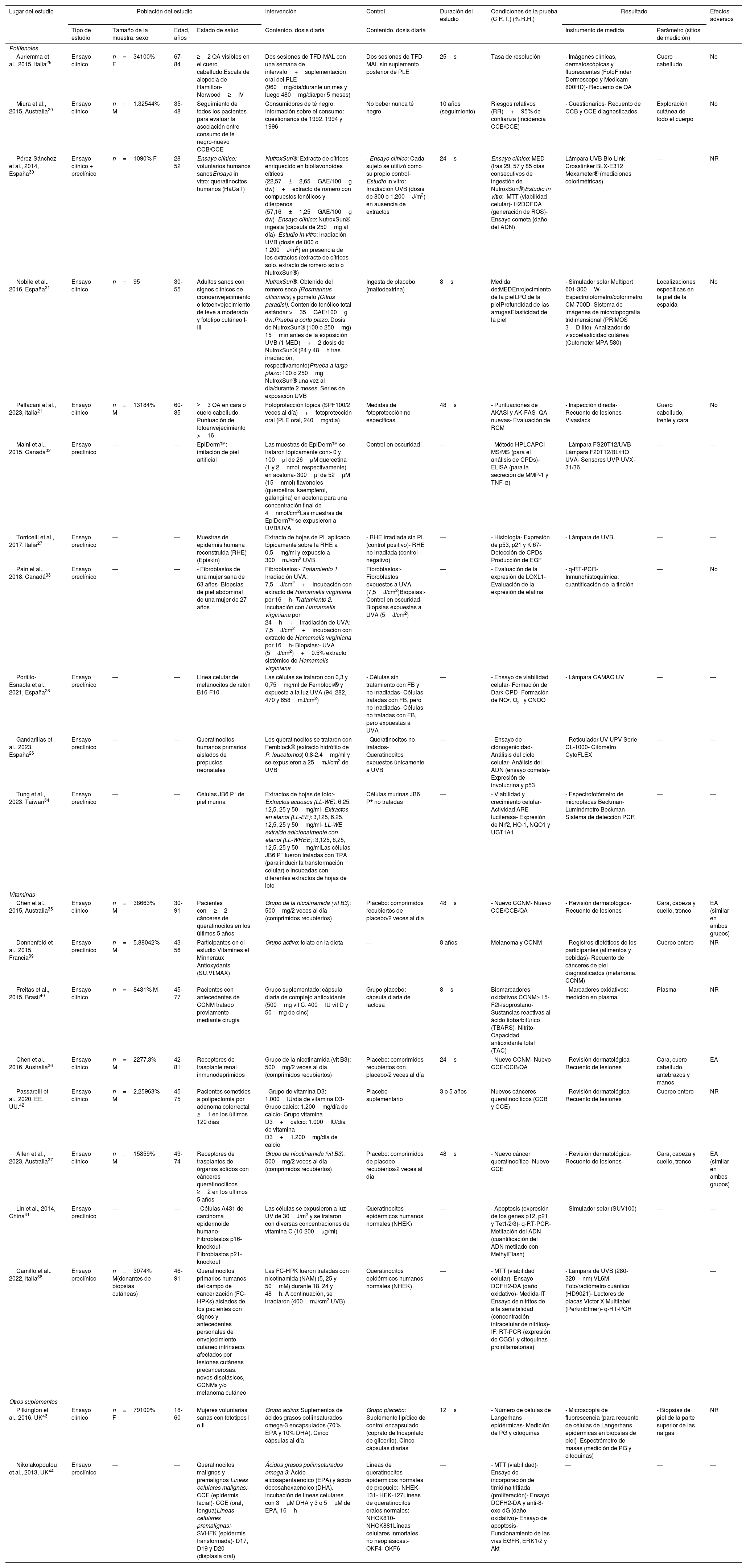
Extracción de datosSe extrajeron los datos en un formulario de extracción estandarizado mediante un documento de Microsoft Excel® (Microsoft®). Las características de cada estudio se muestran en la tabla 2, incluyendo datos específicos de la investigación como la referencia del artículo (autor principal+año de publicación+lugar del estudio); tipo de estudio (ensayo clínico o preclínico); población y características del estudio; (tamaño de la muestra, sexo; edad/años; estado de salud); intervención y control del producto natural (contenido, dosis diaria); duración del estudio; condiciones de la prueba; resultado (instrumentos y parámetros de medición) y efectos adversos.
Características y aspectos específicos de la investigación de cada estudio incluido: referencia del artículo (autor principal+año de publicación+lugar del estudio); tipo de estudio (ensayo clínico o preclínico); población y características del estudio; (tamaño de la muestra, sexo; edad/años; estado de salud); intervención y control del producto natural (contenido, dosis diaria); duración del estudio; condiciones de la prueba; resultado (instrumentos y parámetros de medida) y acontecimientos adversos
| Lugar del estudio | Población del estudio | Intervención | Control | Duración del estudio | Condiciones de la prueba (C R.T.) (% R.H.) | Resultado | Efectos adversos | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Tipo de estudio | Tamaño de la muestra, sexo | Edad, años | Estado de salud | Contenido, dosis diaria | Contenido, dosis diaria | Instrumento de medida | Parámetro (sitios de medición) | ||||
| Polifenoles | |||||||||||
| Auriemma et al., 2015, Italia25 | Ensayo clínico | n=34100% F | 67-84 | ≥2 QA visibles en el cuero cabelludo.Escala de alopecia de Hamilton-Norwood≥IV | Dos sesiones de TFD-MAL con una semana de intervalo+suplementación oral del PLE (960mg/día/durante un mes y luego 480mg/día/por 5 meses) | Dos sesiones de TFD-MAL sin suplemento posterior de PLE | 25s | Tasa de resolución | - Imágenes clínicas, dermatoscópicas y fluorescentes (FotoFinder Dermoscope y Medicam 800HD)- Recuento de QA | Cuero cabelludo | No |
| Miura et al., 2015, Australia29 | Ensayo clínico | n=1.32544% M | 35-48 | Seguimiento de todos los pacientes para evaluar la asociación entre consumo de té negro-nuevo CCB/CCE | Consumidores de té negro. Información sobre el consumo: cuestionarios de 1992, 1994 y 1996 | No beber nunca té negro | 10 años (seguimiento) | Riesgos relativos (RR)+95% de confianza (incidencia CCB/CCE) | - Cuestionarios- Recuento de CCB y CCE diagnosticados | Exploración cutánea de todo el cuerpo | No |
| Pérez-Sánchez et al., 2014, España30 | Ensayo clínico + preclínico | n=1090% F | 28-52 | Ensayo clínico: voluntarios humanos sanosEnsayo in vitro: queratinocitos humanos (HaCaT) | NutroxSun®: Extracto de cítricos enriquecido en bioflavonoides cítricos (22,57±2,65GAE/100g dw)+extracto de romero con compuestos fenólicos y diterpenos (57,16±1,25GAE/100g dw)- Ensayo clínico: NutroxSun® ingesta (cápsula de 250mg al día)- Estudio in vitro: Irradiación UVB (dosis de 800 o 1.200J/m2) en presencia de los extractos (extracto de cítricos solo, extracto de romero solo o NutroxSun®) | - Ensayo clínico: Cada sujeto se utilizó como su propio control- Estudio in vitro: Irradiación UVB (dosis de 800 o 1.200J/m2) en ausencia de extractos | 24s | Ensayo clínico: MED (tras 29, 57 y 85 días consecutivos de ingestión de NutroxSun®)Estudio in vitro:- MTT (viabilidad celular)- H2DCFDA (generación de ROS)- Ensayo cometa (daño del ADN) | Lámpara UVB Bio-Link Crosslinker BLX-E312 Mexameter® (mediciones colorimétricas) | — | NR |
| Nobile et al., 2016, España31 | Ensayo clínico | n=95 | 30-55 | Adultos sanos con signos clínicos de cronoenvejecimiento o fotoenvejecimiento de leve a moderado y fototipo cutáneo I-III | NutroxSun®: Obtenido del romero seco (Rosmarinus officinalis) y pomelo (Citrus paradisi). Contenido fenólico total estándar >35GAE/100g dw.Prueba a corto plazo: Dosis de NutroxSun® (100 o 250mg) 15min antes de la exposición UVB (1 MED)+2 dosis de NutroxSun® (24 y 48h tras irradiación, respectivamente)Prueba a largo plazo: 100 o 250mg NutroxSun® una vez al día/durante 2 meses. Series de exposición UVB | Ingesta de placebo (maltodextrina) | 8s | Medida de:MEDEnrojecimiento de la pielLPO de la pielProfundidad de las arrugasElasticidad de la piel | - Simulador solar Multiport 601-300W- Espectrofotómetro/colorímetro CM-700D- Sistema de imágenes de microtopografía tridimensional (PRIMOS 3D lite)- Analizador de viscoelasticidad cutánea (Cutometer MPA 580) | Localizaciones específicas en la piel de la espalda | No |
| Pellacani et al., 2023, Italia21 | Ensayo clínico | n=13184% M | 60-85 | ≥3 QA en cara o cuero cabelludo. Puntuación de fotoenvejecimiento >16 | Fotoprotección tópica (SPF100/2 veces al día)+fotoprotección oral (PLE oral, 240mg/día) | Medidas de fotoprotección no específicas | 48s | - Puntuaciones de AKASI y AK-FAS- QA nuevas- Evaluación de RCM | - Inspección directa- Recuento de lesiones- Vivastack | Cuero cabelludo, frente y cara | No |
| Maini et al., 2015, Canadá32 | Ensayo preclínico | — | — | EpiDerm™: imitación de piel artificial | Las muestras de EpiDerm™ se trataron tópicamente con:- 0 y 100μl de 26μM quercetina (1 y 2nmol, respectivamente) en acetona- 300μl de 52μM (15nmol) flavonoles (quercetina, kaempferol, galangina) en acetona para una concentración final de 4nmol/cm2Las muestras de EpiDerm™ se expusieron a UVB/UVA | Control en oscuridad | — | - Método HPLCAPCI MS/MS (para el análisis de CPDs)- ELISA (para la secreción de MMP-1 y TNF-α) | - Lámpara FS20T12/UVB- Lámpara F20T12/BL/HO UVA- Sensores UVP UVX-31/36 | — | — |
| Torricelli et al., 2017, Italia27 | Ensayo preclínico | — | — | Muestras de epidermis humana reconstruida (RHE) (Episkin) | Extracto de hojas de PL aplicado tópicamente sobre la RHE a 0,5mg/ml y expuesto a 300mJ/cm2 UVB | - RHE irradiada sin PL (control positivo)- RHE no irradiada (control negativo) | — | - Histología- Expresión de p53, p21 y Ki67- Detección de CPDs- Producción de EGF | - Lámpara de UVB | — | — |
| Pain et al., 2018, Canadá33 | Ensayo preclínico | — | — | - Fibroblastos de una mujer sana de 63 años- Biopsias de piel abdominal de una mujer de 27 años | Fibroblastos:- Tratamiento 1. Irradiación UVA: 7,5J/cm2+incubación con extracto de Hamamelis virginiana por 16h- Tratamiento 2. Incubación con Hamamelis virginiana por 24h+irradiación de UVA: 7,5J/cm2+incubación con extracto de Hamamelis virginiana por 16h- Biopsias:- UVA (5J/cm2)+0.5% extracto sistémico de Hamamelis virginiana | Fibroblastos:- Fibroblastos expuestos a UVA (7,5J/cm2)Biopsias:- Control en oscuridad- Biopsias expuestas a UVA (5J/cm2) | — | - Evaluación de la expresión de LOXL1- Evaluación de la expresión de elafina | - q-RT-PCR- Inmunohistoquímica: cuantificación de la tinción | — | No |
| Portillo-Esnaola et al., 2021, España28 | Ensayo preclínico | — | — | Línea celular de melanocitos de ratón B16-F10 | Las células se trataron con 0,3 y 0,75mg/ml de Fernblock® y expuesto a la luz UVA (94, 282, 470 y 658mJ/cm2) | - Células sin tratamiento con FB y no irradiadas- Células tratadas con FB, pero no irradiadas- Células no tratadas con FB, pero expuestas a UVA | — | - Ensayo de viabilidad celular- Formación de Dark-CPD- Formación de NO•, O2− y ONOO− | - Lámpara CAMAG UV | — | — |
| Gandarillas et al., 2023, España26 | Ensayo preclínico | — | — | Queratinocitos humanos primarios aislados de prepucios neonatales | Los queratinocitos se trataron con Fernblock® (extracto hidrófilo de P. leucotomos) 0,8-2,4mg/ml y se expusieron a 25mJ/cm2 de UVB | - Queratinocitos no tratados- Queratinocitos expuestos únicamente a UVB | — | - Ensayo de clonogenicidad- Análisis del ciclo celular- Análisis del ADN (ensayo cometa)- Expresión de involucrina y p53 | - Reticulador UV UPV Serie CL-1000- Citómetro CytoFLEX | — | — |
| Tung et al., 2023, Taiwan34 | Ensayo preclínico | — | — | Células JB6 P+ de piel murina | Extractos de hojas de loto:- Extractos acuosos (LL-WE): 6,25, 12,5, 25 y 50mg/ml- Extractos en etanol (LL-EE): 3,125, 6,25, 12,5, 25 y 50mg/ml- LL-WE extraído adicionalmente con etanol (LL-WREE): 3,125, 6,25, 12,5, 25 y 50mg/mlLas células JB6 P+ fueron tratadas con TPA (para inducir la transformación celular) e incubadas con diferentes extractos de hojas de loto | Células murinas JB6 P+ no tratadas | — | - Viabilidad y crecimiento celular- Actividad ARE-luciferasa- Expresión de Nrf2, HO-1, NQO1 y UGT1A1 | - Espectrofotómetro de microplacas Beckman- Luminómetro Beckman- Sistema de detección PCR | — | — |
| Vitaminas | |||||||||||
| Chen et al., 2015, Australia35 | Ensayo clínico | n=38663% M | 30-91 | Pacientes con≥2 cánceres de queratinocitos en los últimos 5 años | Grupo de la nicotinamida (vit B3): 500mg/2 veces al día (comprimidos recubiertos) | Placebo: comprimidos recubiertos de placebo/2 veces al día | 48s | - Nuevo CCNM- Nuevo CCE/CCB/QA | - Revisión dermatológica- Recuento de lesiones | Cara, cabeza y cuello, tronco | EA (similar en ambos grupos) |
| Donnenfeld et al., 2015, Francia39 | Ensayo preclínico | n=5.88042% M | 43-56 | Participantes en el estudio Vitamines et Minneraux Antioxydants (SU.VI.MAX) | Grupo activo: folato en la dieta | — | 8 años | Melanoma y CCNM | - Registros dietéticos de los participantes (alimentos y bebidas)- Recuento de cánceres de piel diagnosticados (melanoma, CCNM) | Cuerpo entero | NR |
| Freitas et al., 2015, Brasil40 | Ensayo clínico | n=8431% M | 45-77 | Pacientes con antecedentes de CCNM tratado previamente mediante cirugía | Grupo suplementado: cápsula diaria de complejo antioxidante (500mg vit C, 400IU vit D y 50mg de cinc) | Grupo placebo: cápsula diaria de lactosa | 8s | Biomarcadores oxidativos CCNM:- 15-F2t-isoprostano- Sustancias reactivas al ácido tiobarbitúrico (TBARS)- Nitrito- Capacidad antioxidante total (TAC) | - Marcadores oxidativos: medición en plasma | Plasma | NR |
| Chen et al., 2016, Australia36 | Ensayo clínico | n=2277.3% M | 42-81 | Receptores de trasplante renal inmunodeprimidos | Grupo de la nicotinamida (vit B3): 500mg/2 veces al día (comprimidos recubiertos) | Placebo: comprimidos recubiertos con placebo/2 veces al día | 24s | - Nuevo CCNM- Nuevo CCE/CCB/QA | - Revisión dermatológica- Recuento de lesiones | Cara, cuero cabelludo, antebrazos y manos | EA |
| Passarelli et al., 2020, EE. UU.42 | Ensayo clínico | n=2.25963% M | 45-75 | Pacientes sometidos a polipectomía por adenoma colorrectal ≥1 en los últimos 120 días | - Grupo de vitamina D3: 1.000IU/día de vitamina D3- Grupo calcio: 1.200mg/día de calcio- Grupo vitamina D3+calcio: 1.000IU/día de vitamina D3+1.200mg/día de calcio | Placebo suplementario | 3 o 5 años | Nuevos cánceres queratinocíticos (CCB y CCE) | - Revisión dermatológica- Recuento de lesiones | Cuerpo entero | NR |
| Allen et al., 2023, Australia37 | Ensayo clínico | n=15859% M | 49-74 | Receptores de trasplantes de órganos sólidos con cánceres queratinocíticos ≥2 en los últimos 5 años | Grupo de nicotinamida (vit B3): 500mg/2 veces al día (comprimidos recubiertos) | Placebo: comprimidos de placebo recubiertos/2 veces al día | 48s | - Nuevo cáncer queratinocítico- Nuevo CCE | - Revisión dermatológica- Recuento de lesiones | Cara, cabeza y cuello, tronco | EA (similar en ambos grupos) |
| Lin et al., 2014, China41 | Ensayo preclínico | — | — | - Células A431 de carcinoma epidermoide humano- Fibroblastos p16-knockout- Fibroblastos p21-knockout | Las células se expusieron a luz UV de 30J/m2 y se trataron con diversas concentraciones de vitamina C (10-200μg/ml) | Queratinocitos epidérmicos humanos normales (NHEK) | — | - Apoptosis (expresión de los genes p12, p21 y Tet1/2/3)- q-RT-PCR- Metilación del ADN (cuantificación del ADN metilado con MethylFlash) | - Simulador solar (SUV100) | — | — |
| Camillo et al., 2022, Italia38 | Ensayo preclínico | n=3074% M(donantes de biopsias cutáneas) | 46-91 | Queratinocitos primarios humanos del campo de cancerización (FC-HPKs) aislados de los pacientes con signos y antecedentes personales de envejecimiento cutáneo intrínseco, afectados por lesiones cutáneas precancerosas, nevos displásicos, CCNMs y/o melanoma cutáneo | Las FC-HPK fueron tratadas con nicotinamida (NAM) (5, 25 y 50mM) durante 18, 24 y 48h. A continuación, se irradiaron (400mJ/cm2 UVB) | Queratinocitos epidérmicos humanos normales (NHEK) | — | - MTT (viabilidad celular)- Ensayo DCFH2-DA (daño oxidativo)- Medida-IT Ensayo de nitritos de alta sensibilidad (concentración intracelular de nitritos)- IF, RT-PCR (expresión de OGG1 y citoquinas proinflamatorias) | - Lámpara de UVB (280-320nm) VL6M- Foto/radiómetro cuántico (HD9021)- Lectores de placas Victor X Multilabel (PerkinElmer)- q-RT-PCR | — | |
| Otros suplementos | |||||||||||
| Pilkington et al., 2016, UK43 | Ensayo clínico | n=79100% F | 18-60 | Mujeres voluntarias sanas con fototipos I o II | Grupo activo: Suplementos de ácidos grasos poliinsaturados omega-3 encapsulados (70% EPA y 10% DHA). Cinco cápsulas al día | Grupo placebo: Suplemento lipídico de control encapsulado (coprato de tricaprilato de glicerilo). Cinco cápsulas diarias | 12s | - Número de células de Langerhans epidérmicas- Medición de PG y citoquinas | - Microscopía de fluorescencia (para recuento de células de Langerhans epidérmicas en biopsias de piel)- Espectrómetro de masas (medición de PG y citoquinas) | - Biopsias de piel de la parte superior de las nalgas | NR |
| Nikolakopoulou et al., 2013, UK44 | Ensayo preclínico | — | — | Queratinocitos malignos y premalignos Líneas celulares malignas:- CCE (epidermis facial)- CCE (oral, lengua)Líneas celulares premalignas:- SVHFK (epidermis transformada)- D17, D19 y D20 (displasia oral) | Ácidos grasos poliinsaturados omega-3: Ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA). Incubación de líneas celulares con 3μM DHA y 3 o 5μM de EPA, 16h | Líneas de queratinocitos epidérmicos normales de prepucio:- NHEK-131- HEK-127Líneas de queratinocitos orales normales:- NHOK810- NHOK881Líneas celulares inmortales no neoplásicas:- OKF4- OKF6 | — | - MTT (viabilidad)- Ensayo de incorporación de timidina tritiada (proliferación)- Ensayo DCFH2-DA y anti-8-oxo-dG (daño oxidativo)- Ensayo de apoptosis- Funcionamiento de las vías EGFR, ERK1/2 y Akt | — | — | — |
El riesgo de sesgo se evaluó mediante la herramienta estándar de evaluación del riesgo de sesgo para ensayos controlados aleatorios (ECA) recomendada por la Colaboración Cochrane, con 2 revisores que realizaron el examen de forma independiente23. Esta herramienta evalúa 7 tipos de sesgo: sesgo de selección (generación de la secuencia aleatoria y ocultación de la asignación), sesgo de realización (cegamiento de los participantes y los investigadores), sesgo de detección (cegamiento de los evaluadores de resultados), sesgo de desgaste (datos de resultados incompletos), sesgo de información (información selectiva) y otros sesgos (como cambios en el estilo de vida durante el estudio, condiciones de prueba inestables y posibles conflictos de intereses). Cada estudio se clasificó según estos criterios como de riesgo de sesgo «bajo», «alto» o «poco claro». Un criterio se consideró de bajo riesgo si el estudio informaba adecuadamente de los métodos para prevenir el sesgo según las directrices Cochrane. Se asignó riesgo alto si los métodos descritos no podían eliminar el sesgo, y riesgo poco claro cuando la información era insuficiente, irrelevante o faltaba24.
ResultadosCaracterísticas de los estudiosTras el cribado de títulos y resúmenes de 234 artículos y una revisión exhaustiva del texto completo de 38 artículos, finalmente se eligieron para nuestro análisis 21 artículos publicados entre 2013 y 2023 (fig. 1). Los estudios se clasificaron en función de la naturaleza química del agente elegido para la administración de suplementos dietéticos. Por lo tanto, seleccionamos 3 categorías: administración de polifenoles (11 estudios), vitaminas y oligoelementos (8 estudios), y una tercera categoría denominada «otros», que incluye varios tipos de ingredientes (2 estudios). El tipo de estudio incluía estudios preclínicos (9 estudios) y clínicos (12 estudios) (fig. 1 y tabla 2).
Características de los pacientesEn general, nuestro análisis de revisión incluyó a 10.463 pacientes, con una edad media de 52,4 años (rango: 21-91 años). Basándonos en los artículos que proporcionaron esta información, determinamos que el 51,8% (n=5.426 mujeres de 10.493) de los participantes eran mujeres.
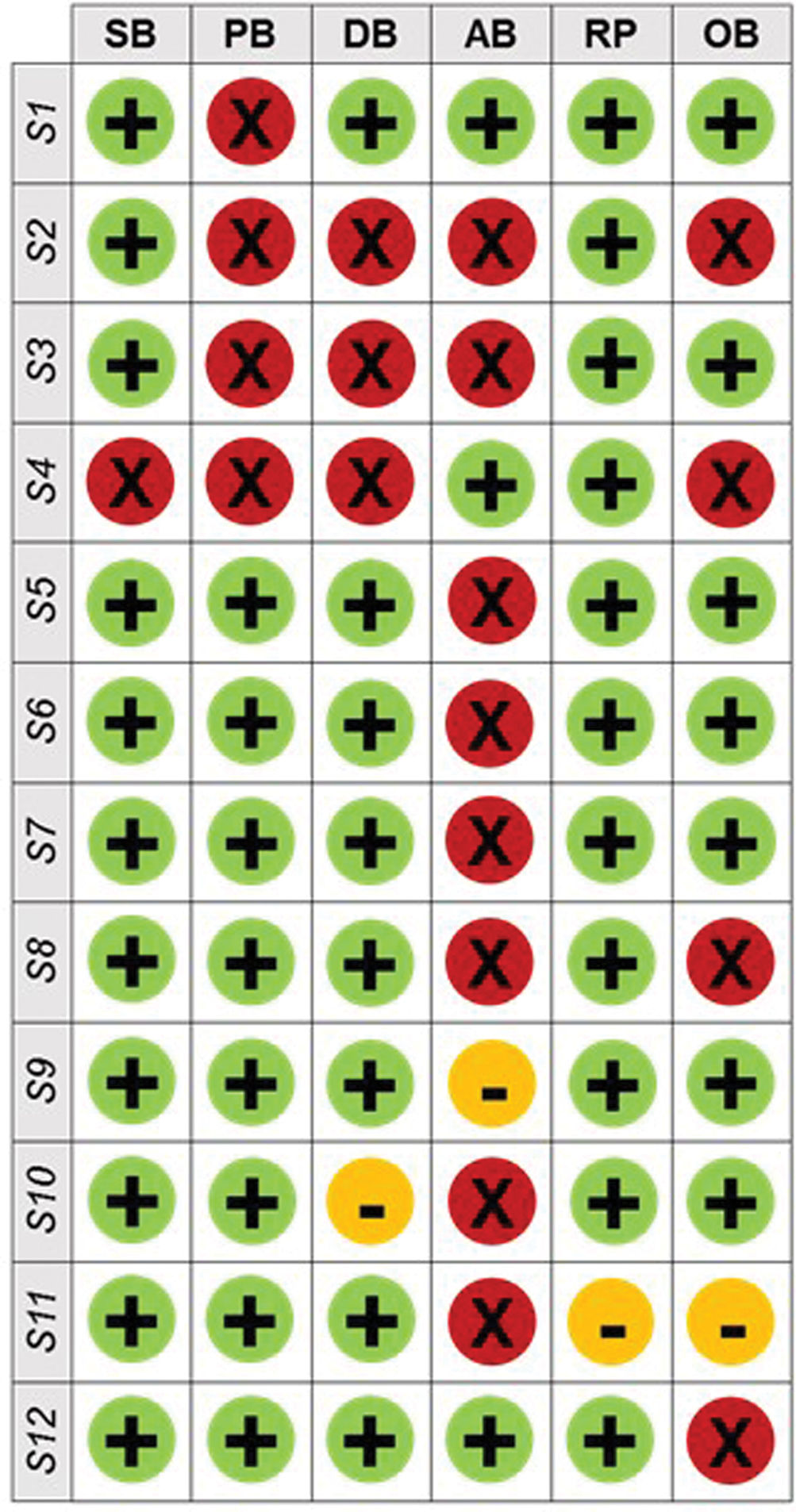
Riesgo de sesgo en los estudios de investigaciónLa valoración del riesgo de sesgo en las investigaciones seleccionadas se representó como porcentajes en la figura 2, según la evaluación de los investigadores. La mayoría de los ensayos mostraron puntos fuertes en su diseño y métodos. En consecuencia, el riesgo de sesgo fue bajo en la mayoría de los parámetros analizados: el 91,7% de los ensayos controlados aleatorizados (ECA) mencionaron adecuadamente la aleatorización, y solo un estudio se consideró de alto riesgo (8,3%). El cegamiento tanto de los sujetos como de los investigadores se implementó en 8 de los 12 estudios (66,7%) y el cegamiento de los evaluadores al analizar los resultados también se implementó en 8 de los 12 estudios (66,7%). En cuanto al aspecto de los sesgos de desgaste, la mayoría de los estudios (8/12, 66,7%) presentan un riesgo elevado, ya que muchos de ellos experimentaron el abandono de varios sujetos del estudio, principalmente debido al incumplimiento de la ingesta de suplementos orales. En todos los estudios seleccionados, el sesgo de información supuso un riesgo bajo, ya que la mayoría (11.712, 91,7%) de los estudios proporcionaron datos precisos y ninguno de ellos mostró falta de información, un factor crucial para garantizar la transparencia y la fiabilidad en la investigación clínica. Cuatro estudios (33,3%) se calificaron de alto riesgo por «otros sesgos», debido a posibles conflictos de intereses y a detalles insuficientes sobre el cumplimiento del consumo de suplementos y el mantenimiento de los hábitos de vida.
Resumen de las evaluaciones de los revisores para cada dominio de riesgo de sesgo («bias»). Riesgo de sesgo. SB: sesgo de selección; PB: sesgo de realización) DB: sesgo de detección; AB: sesgo de desgaste; RB: sesgo de información; OB: otros sesgos. Estudios: (S1) Pellacani et al., 2023; (S2) Auriemma et al., 2015; (S3) Miura et al., 2015; (S4) Pérez-Sánchez et al., 2014; (S5) Chen et al., 2015; (S6) Chen et al., 2016; (S7) Allen et al., 2023; (S8) Freitas et al., 2015; (S9) Pasarelli et al., 2014; (S10) Pilkington et al., 2016; (S11) Donnenfeld et al., 2014; (S12) Nobile et al., 2016.
Once estudios informaron sobre la administración de compuestos polifenólicos para el tratamiento de las QA, CCB y CCE y el envejecimiento actínico, así como la prevención del daño inducido por los UVB en la piel (formación de CPD, eritema, etc.). Cinco de los 11 eran ensayos clínicos y 6 estudios preclínicos.
En cuanto a los ensayos clínicos, se administró extracto de PLE, polifenoles de té negro y una combinación de polifenoles de romero y pomelo como suplementos dietéticos para la prevención de las QA, el eritema inducido por UV y la peroxidación lipídica, la mejora de los signos de fotoenvejecimiento y la reducción de la incidencia de CCB y CCE. En conjunto, estos estudios incluyeron un total de 1.595 pacientes, con una edad media de 51,7 años, que oscilaba entre los 28 y los 85 años. Los datos mostraron que el 54,4% (n=867 mujeres/1.595) de los participantes eran mujeres.
La experimentación preclínica incluyó la evaluación de PLE, flavonoles (quercetina, kaempferol y galangina) y extractos obtenidos de las hojas de Hamamelisvirginiana y loto para prevenir el daño genómico inducido por UV y la formación de DPC, inhibir el envejecimiento actínico y la progresión de las QA y suprimir la transformación neoplásica.
Fragmentos de investigaciónExtracto de Polypodium leucotomosEn un reciente ensayo clínico se analizó el efecto del PLE, administrado por vía oral en combinación con una protección solar tópica SPF100, en sujetos con fotoenvejecimiento grave e historial de al menos 3 QA. La combinación del PLE tópico y oral a una dosis diaria de 240mg produjo una mejora de los parámetros AKASI y AK-FAS y redujo el número de nuevas QA y la necesidad de intervención adicional en mayor medida que en el caso del tratamiento tópico solo21. Así pues, la combinación de fotoprotección tópica y oral con el PLE puede ayudar a prevenir la aparición de nuevas lesiones en zonas de la piel expuestas al sol21.
Además, este extracto no solo ha demostrado su eficacia en la prevención del cáncer de piel, sino también en su tratamiento. En un ensayo clínico se evaluó si el PLE podía mejorar la eficacia de la TFD en la disminución de la recurrencia de las QA25. Para ello, los pacientes con al menos 2 QA visibles en el cuero cabelludo se clasificaron en 2 grupos: uno que recibió 2 sesiones de TFD-MAL sola, y otro que recibió las mismas 2 sesiones de TFD junto con suplementos orales de PLE (dosis diarias de 480mg, comenzando una semana después de la última sesión) durante 6 meses. Los datos clínicos, dermatoscópicos y de imágenes fluorescentes mostraron que, a los 6 meses de seguimiento, la TFD más PLE oral dio lugar a una tasa de eliminación mayor que la TFD sola. Así pues, la suplementación con el PLE parece mejorar la eficacia de la TFD a largo plazo, reduciendo significativamente el número de QA25.
Un estudio reciente realizado por Gandarillas et al. con queratinocitos epidérmicos humanos primarios sugiere que el PLE tiene la capacidad de inducir la reparación del daño genómico inducido por la luz UV26. El tratamiento con el PLE promueve la expresión de H2AX y p53 -activando la maquinaria de reparación del ADN- y ralentiza la progresión de los queratinocitos a través de la transición G2/M (favoreciendo el control del punto de control G2/M). Los autores observaron que el tratamiento con el PLE prolongaba la duración de la fase de reparación del ADN en las células madre, mejorando su capacidad de regeneración. Además, el aumento de la señal de reparación del ADN debería disminuir el número de células en proceso de diferenciación tras la división celular. La diferenciación prematura de los queratinocitos es un factor del envejecimiento cutáneo. Sin embargo, las células tratadas con el PLE mostraron una mayor resistencia frente al envejecimiento, manteniendo un mayor potencial de autorrenovación y proliferación tras el tratamiento. Así pues, este refuerzo de la señalización de reparación del ADN podría prolongar la capacidad de renovación de las células madre y disminuir la proporción de células sometidas a diferenciación posmitótica26.
En relación con la importancia de evaluar el impacto del daño en el ADN, Torricelli et al. también evaluaron el papel preventivo del PLE frente al daño inducido por la radiación UV27. Su ensayo preclínico se realizó en un modelo de epidermis humana reconstruida (RHE) expuesta a UVB y demostró que el tratamiento con el PLE reduce la expresión de p53 y p21, lo que se correlaciona con la reducción de la formación de células dañadas por el sol, y previene la regulación al alza de proteínas proliferantes (EFG, Ki-67) y la formación de CPDs27. En relación con la formación de CPDs, Portillo-Esnaola et al.28 analizaron el papel de Fernblock® (FB; el extracto hidrofílico estandarizado de las hojas de PLE) en la prevención de la formación de estos fotoproductos en melanocitos murinos expuestos a UVA. Los resultados indicaron que el tratamiento con FB disminuye los niveles tanto de especies reactivas de oxígeno (ROS) como de especies reactivas de nitrógeno (RNS), reduciendo así la formación de CPDs oscuros. Tanto las propiedades antioxidantes como las de barrido mostradas por el FB hacen de este compuesto un candidato óptimo para ser incluido en las formulaciones de los protectores solares28.
Extractos de polifenoles del téUn estudio prospectivo exploró si existe una relación entre el consumo de té negro y la aparición de CCB y CCE. El estudio estimó el consumo de té negro en 1.325 voluntarios de 1992, 1994 y 1996 y registró todos los cánceres de piel diagnosticados en estos voluntarios entre 1997 y 2007. A pesar de este exhaustivo análisis, los resultados no mostraron ninguna asociación significativa entre el consumo de té negro y la incidencia de CCB o CCE. Por lo tanto, el consumo de té negro no puede considerarse parte de una estrategia preventiva para reducir el riesgo de cáncer de piel29.
Otras fuentes de polifenolesEn varios estudios se han investigado otras fuentes de polifenoles para explorar su papel en la prevención de los daños cutáneos inducidos por los rayos UV, lo que ofrece vías prometedoras para la protección de la piel y la prevención del cáncer. Pérez-Sánchez et al.30, demostraron que una combinación de romero y bioflavonoides cítricos del pomelo (NutroxSun®) aumentaba la supervivencia celular, reducía las ERO intracelulares, prevenía el daño del ADN y disminuía las aberraciones cromosómicas en queratinocitos humanos expuestos a UVB. Además, la administración oral de esta combinación a voluntarios humanos produjo un aumento significativo de la dosis mínima de eritema (MED), lo que sugiere su potencial como estrategia de fotoprotección oral30. De forma similar, el ensayo clínico realizado por Nobile et al.31 indicaron que la ingesta de la misma combinación de romero y pomelo (NutroxSun®) por parte de voluntarios con signos clínicos de fotoenvejecimiento también produjo una disminución del enrojecimiento cutáneo y de la peroxidación de los lípidos basales y un aumento de la MED, así como una disminución de la profundidad de las arrugas y un aumento de la elasticidad cutánea31. En otro estudio, Maini et al.32 revelaron la eficacia de la quercetina, el kaempferol y la galangina en la prevención de la formación de DPC inducida por RUV en piel artificial. Además, la quercetina redujo significativamente la secreción de MMP-1 y TNF-α. Estos hallazgos sugieren que estos flavonoles, tradicionalmente considerados antioxidantes, podrían servir como una herramienta prometedora para prevenir el daño del ADN asociado a la progresión de las QA32. En cuanto a la elastosis cutánea, caracterizada por la acumulación de fibras elásticas anormales en la piel, Pain et al.33 evaluaron la capacidad de un extracto de hoja de H. virginiana para contrarrestar el desequilibrio enzimático elastina/lisil oxidasa (LOXL1) y la síntesis de elafina, un marcador de agregados elastóticos, desencadenados por la exposición a la luz UV. Este desequilibrio contribuye a la acumulación de agregados de fibras de elastina no funcionales, lo que conduce al envejecimiento actínico. Para ello, midieron la expresión de LOXL1 y elafina tanto en fibroblastos humanos como en biopsias de piel humana expuestas a radiación UVA y tratadas con extracto de H. virginiana. El extracto aumentó la expresión de LOXL1 y disminuyó la síntesis de elafina, lo que produjo una disminución de los agregados y la restauración de las fibras elásticas funcionales33. Los fitoquímicos de la dieta poseen propiedades quimiopreventivas que pueden obstaculizar o retrasar el proceso de carcinogénesis. La hoja de loto, una planta medicinal tradicional rica en numerosos polifenoles, es un ejemplo notable. El extracto de hoja de loto, rico en fenoles y quercetina, mostró un fuerte potencial en la inhibición de la carcinogénesis cutánea en células JB6 P+ de piel murina. Activó la vía NRF2, potenciando enzimas antioxidantes y de desintoxicación como HO-1, NQO1 y UGT1A1, al tiempo que redujo los niveles de metilación del ADN. Esto sugiere que este extracto puede impedir la transformación neoplásica regulando la vía NRF2 y los procesos epigenéticos34.
Así pues, la exploración de los compuestos polifenólicos, realizada mediante estudios clínicos y preclínicos, revela su potencial en la prevención y el tratamiento de diversas afecciones cutáneas, como las QA, los CCB, los CCE y el envejecimiento actínico. Los ensayos clínicos han demostrado la eficacia de suplementos como el extracto de PLE para mejorar la salud de la piel y reducir el riesgo de cánceres cutáneos. Los experimentos preclínicos destacan el papel de los polifenoles en la inhibición del daño del ADN, la supresión de la transformación neoplásica y la protección contra el daño cutáneo inducido por los rayos UV. Sin embargo, no todos los polifenoles presentan efectos protectores significativos, como demuestra la falta de asociación entre el consumo de té negro y la incidencia de CCB o CCE. A pesar de ello, la investigación sobre polifenoles procedentes de fuentes como el romero, los bioflavonoides cítricos, el extracto de hoja de loto y el extracto de H. virginiana ofrece vías prometedoras para desarrollar estrategias fotoprotectoras y quimiopreventivas eficaces contra el cáncer de piel y el envejecimiento actínico.
Suplementación con vitaminas y oligoelementosOcho estudios informaron acerca de la administración de vitaminas y derivados vitamínicos para la prevención y el tratamiento de las QA, los CCB y los CCE, el melanoma, el estrés oxidativo y la apoptosis inducida por UV. De los 8 trabajos, 6 correspondían a estudios clínicos y 2 eran estudios preclínicos.
En cuanto a los ensayos clínicos, la nicotinamida (NAM, un derivado de la vitamina B3), el folato (vitamina B9), un complejo antioxidante (vitamina D+vitamina C+cinc) y la vitamina D3, se administraron como suplementos dietéticos para prevenir lesiones precancerosas (QA) y lesiones no melanocíticas (CCB y CCE) en una población de pacientes de alto riesgo que incluía pacientes receptores de trasplantes de órganos (RTO), así como melanomas. En total, en todos estos estudios participaron 8.789 pacientes, con una edad media de 52,6 años, que oscilaba entre los 30 y los 91 años. Los datos indicaron que el 50,9% (n=4.472 mujeres/8.819) de los participantes eran mujeres.
Los estudios preclínicos examinaron la capacidad de la NAM para reducir el estrés oxidativo asociado al cáncer cutáneo no melanoma (CCNM), y el papel potencial de la vitamina C para inhibir la apoptosis inducida por la RUV a través de la modulación de la metilación del ADN.
Fragmentos del estudioNicotinamida y otros derivados de la vitamina BLos estudios seleccionados proporcionan información valiosa sobre el potencial de la nicotinamida (NAM) como agente preventivo y terapéutico del cáncer de piel. En 201535, Chen et al. realizaron un ensayo clínico con 386 pacientes de alto riesgo con antecedentes médicos de al menos 2 CCNM en los 5 años anteriores. Los participantes fueron aleatorizados para recibir NAM oral (500mg) o placebo/2 veces al día durante 12 meses. La evaluación por dermatólogos reveló resultados prometedores, con una tasa un 20% inferior de CCB, un 30% inferior de nuevos CCE y un 13% inferior de nuevas QA en el grupo de NAM frente al grupo placebo35. En otro ensayo clínico, Chen et al.36 exploraron el perfil de seguridad y la eficacia de NAM en la prevención de la aparición de CCB y CCE en receptores de trasplante renal inmunodeprimidos con antecedentes de al menos 2 CCNM en los 12 meses anteriores. Los pacientes fueron aleatorizados para recibir NAM oral (500mg) o placebo y las lesiones cutáneas (QA, CCB y CCE) fueron registradas 2 veces al mes hasta los 6 meses por dermatólogos. En este estudio, se observó una reducción de los CCB y CCE (35%) y de las QA (16%) en el grupo de NAM frente al de placebo, aunque los resultados no fueron estadísticamente significativos36. En 2023, Allen et al.37, también exploraron la eficacia de la NAM en la quimioprevención del cáncer de piel en los pacientes con RTO. Se inscribieron 158 adultos que habían padecido al menos 2 cánceres de queratinocitos confirmados histológicamente en los últimos 5 años y habían sido sometidos a un trasplante de riñón, hígado, corazón o pulmón al menos 12 meses antes. Estos participantes recibieron aleatoriamente NAM oral (500mg) o placebo emparejado/2 veces al día durante 12 meses. La evaluación por dermatólogos no reveló diferencias significativas en los recuentos de CCE, CCB y QA entre el grupo de NAM y el de placebo, concluyendo que NAM oral no prevenía la aparición de nuevos cánceres de queratinocitos o QA en RTO sólidos inmunodeprimidos37. Camillo et al. en 202238, también analizaron el papel potencial de la NAM como agente quimiopreventivo desde un punto de vista preclínico. Obtuvieron biopsias de piel de 30 pacientes con lesiones cutáneas precancerosas, nevos displásicos, CCNM y/o melanoma cutáneo. A partir de estas biopsias, aislaron queratinocitos primarios humanos del campo de cancerización (FC-HPKs) para su posterior estudio. Sus hallazgos demostraron que la NAM disminuía eficazmente los niveles de ROS y la expresión de la oxoguanina glicosilasa (OGG)1 (responsable de la escisión 8-oxoG) en los FC-HPK expuestos a UVB, protegiéndolos así del estrés oxidativo y de los daños en el ADN inducidos por la irradiación UVB. Además, la NAM previno la inflamación inducida por UVB a través de la modulación de la expresión de citoquinas proinflamatorias (especialmente IL1b y TNFα). Estos resultados sugieren que la NAM podría ser una molécula útil para la quimioprevención de los CCNM y el tratamiento del campo de cancerización38.
Todos estos hallazgos contrastados sobre la NAM ponen de manifiesto la complejidad del papel de este compuesto en la prevención del cáncer de piel y subrayan la necesidad de seguir investigando para dilucidar sus mecanismos de acción y sus posibles aplicaciones terapéuticas.
Otro derivado de la vitamina B es el folato (vitamina B9). Un estudio prospectivo realizado por Donnenfeld et al.39 tenían como objetivo investigar el impacto de la ingesta de folato en la dieta sobre el riesgo de desarrollar cáncer de piel. Durante el periodo de estudio, que abarcó de 1994 a 2002, 5.880 voluntarios rellenaron un registro dietético cada 2 meses, detallando todos los alimentos y bebidas consumidos en periodos de 24h. A lo largo del ensayo, se documentaron meticulosamente todas las lesiones de cáncer de piel diagnosticadas. Al final del ensayo, se diagnosticaron 144 casos de cáncer de piel (20 melanomas, 18 CCE y 106 CCB). Sobre la base de estos resultados y de los análisis de folato eritrocitario —que se realizaron en todos los participantes a los 2 y 5 años— se concluyó que la ingesta de folato en la dieta estaba asociada a un mayor riesgo de cáncer de piel CCB. Esta asociación se observó más específicamente en las mujeres39.
Vitamina C y vitamina EFreitas et al.40, realizaron un estudio en 2 fases para investigar los efectos de una terapia antioxidante (consistente en un complejo con vitamina C, vitamina E y cinc) en el estado de estrés oxidativo de los pacientes con antecedentes médicos de CCNM. En la fase I, se analizaron las concentraciones plasmáticas de varios biomarcadores oxidativos en 60 pacientes con CCNM (previamente tratados con cirugía) y 24 voluntarios sanos. Los resultados mostraron que los pacientes con CCNM tenían niveles más altos de todos los marcadores oxidativos evaluados que los voluntarios sanos. En la fase II, los pacientes con CCNM fueron asignados aleatoriamente a recibir complejo antioxidante oral o placebo una vez al día durante 2 meses. En este caso, la evaluación de los biomarcadores de estrés tras el periodo de suplementación no reveló diferencias significativas entre los grupos. En conclusión, la terapia antioxidante basada en estas vitaminas no redujo significativamente los niveles de biomarcadores de estrés oxidativo40. Otro estudio in vitro realizado por Lin et al.41 exploraron el papel de la vitamina C en la apoptosis inducida por UV en células de un carcinoma epidermoide humano y fibroblastos p16/p21-knockout. Como mostraron los resultados, la vitamina C antagonizó eficazmente la apoptosis inducida por UV en células de cáncer de piel promoviendo la desmetilación del ADN y reactivando posteriormente la activación de los genes supresores de tumores p16 y p2141.
Vitamina D y oligoelementosEn lo que respecta a la vitamina D, Passarelli et al. examinaron en 202042, el efecto de la administración diaria de suplementos orales de vitamina D o calcio sobre el riesgo de desarrollar CCB o CCE cutáneo invasivo. Inscribieron en este ensayo clínico a un total de 2.259 pacientes diagnosticados de un adenoma colorrectal. Los participantes fueron asignados aleatoriamente a uno de estos 4 grupos: 1) 1.000UI/día de vitamina D3; 2) 1.200mg/día de carbonato cálcico; 3) vitamina D3 y carbonato cálcico y 4) placebo. El período de suplementación fue de 3 o 5 años, y durante ese período se informó de la incidencia de CCB o CCE. Los resultados indicaron que, si bien la incidencia de CCB no estaba relacionada con la suplementación administrada, la suplementación con carbonato cálcico —solo o en combinación con vitamina D— parecía reducir la incidencia de CCE, lo que sugiere el papel preventivo del calcio en el desarrollo de CCE42.
Por lo tanto, la investigación sobre la administración de suplementos vitamínicos para la prevención y el tratamiento de diversas afecciones cutáneas presenta diversos hallazgos e implicaciones. Los ensayos clínicos han explorado los beneficios potenciales de la NAM, el folato (vitamina B9), los complejos antioxidantes y la vitamina D3 en la reducción del riesgo de lesiones precancerosas, CCNM y lesiones melanocíticas. Los resultados contradictorios de estos ensayos ponen de manifiesto la complejidad del papel de dichas vitaminas en la prevención del cáncer de piel, especialmente evidente en el caso de la NAM, cuya eficacia varía según los distintos estudios. Los estudios preclínicos aclaran aún más los mecanismos subyacentes a los efectos protectores de estas vitaminas, como la capacidad de la NAM para reducir el estrés oxidativo y la inflamación y la asociación del folato con un mayor riesgo de cáncer de piel, especialmente en las mujeres. Además, la vitamina C resulta prometedora para modular la apoptosis inducida por los rayos UV y promover la desmetilación del ADN en las células del cáncer de piel. La administración de suplementos de vitamina D, en particular de carbonato cálcico, parece tener un efecto preventivo sobre la incidencia de CCE cutáneo invasivo. En general, estos resultados subrayan la importancia de seguir investigando para comprender mejor los mecanismos de acción y optimizar el potencial terapéutico de los suplementos vitamínicos en la prevención y el tratamiento del cáncer de piel.
Suplementación con otros suplementosDos estudios informaron sobre el uso de diferentes compuestos para la inhibición del crecimiento y desarrollo de los CCE y la prevención de los daños inducidos por los rayos UV en el sistema inmunitario. Uno de estos 2 estudios es un ensayo clínico y el otro un ensayo preclínico.
En cuanto al ensayo clínico, se evaluaron los ácidos grasos poliinsaturados omega-3 (Ω-3 PUFA) ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA) como suplementos dietéticos para la prevención del daño inducido por la RUV en el sistema inmunitario. En este estudio participaron 79 mujeres, con una edad media de 40,6 años, comprendida entre los 21 y los 60 años.
En un ensayo preclínico se examinó la capacidad del EPA y el DHA para inhibir el crecimiento de células obtenidas de CCE orales y faciales humanos43.
Fragmentos de estudioΩ-3 ácidos grasos poliinsaturados: ácido eicosapentaenoico y ácido docosahexaenoicoUn ensayo clínico realizado por Pilkington et al.43 evaluaron el papel protector del EPA y el DHA sobre la inmunidad mediada por células —cuya supresión es uno de los efectos de la exposición a la RUV— mediante el análisis del número de células de Langerhans (CL) y de mediadores inmunomoduladores. Para ello, 79 voluntarios sanos recibieron aleatoriamente 5 cápsulas al día que contenían un 70% de EPA y un 10% de DHA o placebo, durante 12 semanas. Además, se expusieron zonas específicas de sus nalgas a la RUV antes y después de la suplementación. El análisis de las muestras recogidas no encontró diferencias en el número de LC y mediadores inmunomoduladores entre los grupos de EPA y placebo tras la exposición a la RUV. Por lo tanto, no había pruebas de que el EPA redujera la supresión de la inmunidad cutánea por RUV mediante cambios en el número de CL epidérmicos o mediadores inmunomoduladores43. En este contexto, Nikolakopoulou et al.44 realizaron una investigación de laboratorio para evaluar cómo afectan los PUFA n-3 a la proliferación de queratinocitos premalignos y malignos de CCE faciales y orales humanos. Sus resultados indicaron que el DHA y, en particular, el EPA inhibían específicamente la proliferación de estos queratinocitos activando la vía ERK1/2 e induciendo tanto la apoptosis como la detención del ciclo celular44.
Por lo tanto, los suplementos alternativos como los PUFA omega-3 muestran potencial para reducir el daño inducido por la RUV y prevenir el crecimiento del CCE. Aunque los ensayos clínicos arrojan resultados dispares, los estudios preclínicos indican efectos prometedores de los AGPI omega-3 en la inhibición del crecimiento de queratinocitos malignos.
ConclusionesFinalmente, podemos concluir que los estudios revisados apoyan el perfil de eficacia potencial de los polifenoles en la prevención de lesiones cancerosas, particularmente debido a sus efectos protectores frente al daño del ADN y el daño inducido por los rayos UV. Sin embargo, cabe destacar las limitaciones de los estudios revisados, incluyendo el pequeño tamaño de las muestras, la variabilidad en los diseños de los estudios y el posible impacto de variables no controladas. Además, es fundamental destacar que la fotoprotección integral, que incluye el uso de fotoprotectores tópicos, orales y la adopción de hábitos fotoprotectores, sigue siendo la estrategia más recomendada para la prevención del cáncer de piel. En este contexto, futuros estudios clínicos deberían tener como objetivo investigar el impacto de los suplementos dietéticos, particularmente en poblaciones de alto riesgo y explorar diferentes combinaciones de ingredientes con variados mecanismos de acción para optimizar las aplicaciones terapéuticas.
Aprobación éticaEl protocolo del estudio se registró en PROSPERO (CRD42023485985).
Conflicto de interesesG.P ha recibido subvenciones de AbbVie, Almirall, Galderma, Leo, Lilly, Novartis, Pierre Fabre y Pfizer. K.P recibió subvenciones de Sanofi, Novartis, AbbVie y Almirall. Honorarios por consultoría de Sanofi, honorarios por conferencias y eventos educativos de Lilly, Sanofi y Sun Pharma, participación en consejos asesores de AbbVie y Almirall. Leo Pharma, Lilly, Janssen, Sanofi, Pierre Fabre, Sun Pharma, Biogen, Galderma y Philogen. P. C-P ha actuado como miembro del consejo asesor de AbbVie, Almirall, Cantabria, Galderma, Janssen, LEO Pharma, Novartis, Boehringer Ingelheim, Molteni y Sanofi, ha recibido subvenciones para charlas de Almirall, AbbVie, Novartis, LEO Pharma, Sanofi y Novartis, y ha actuado como investigador para Clinuvel, Mitsubishi, Novartis, Sanofi, Galderma, LEO Pharma, Amgen, Biogen, Pierre Fabre, Regeneron y SI Health. M.V.deG ha sido investigadora y ponente para Cantabria labs, La Roche-Posay, Beiersdorf, ISDIN, Pierre Fabre, Rilastil. Y.G ha recibido apoyo como asesor, investigador o ponente de Galderma, Almirall, Cantabria Labs, AbbVie, Lilly, Sanofi, UCB, Isdin, PfizerRoche y Roche-Posay. S.G es consultor de Cantabria Labs.
Los demás autores no declararon ningún conflicto de intereses.