La hidradenitis supurativa (HS) es una entidad inflamatoria crónica caracterizada por la aparición de múltiples nódulos, abscesos y fístulas, de predominio en regiones apocrinas. Además de su afectación dermatológica, se asocia a varias comorbilidades sistémicas. Su tratamiento es combinado: farmacológico tópico, farmacológico sistémico y quirúrgico. En cuanto a los medicamentos biológicos o de molécula pequeña, actualmente solo está aprobado adalimumab. En este artículo, se presenta una revisión narrativa de la literatura sobre fármacos biológicos o de molécula pequeña utilizados en el tratamiento de la HS. El arsenal que encontramos es numeroso, con múltiples dianas: inhibidores del factor de necrosis tumoral alfa (TNF-alfa), interleucina (IL)-17, IL-23, IL-1, inhibidores de la vía Janus quinasa (JAK) u otros fármacos en estudio. Son necesarios nuevos ensayos prospectivos y comparativos que analicen la eficacia y seguridad de estos abordajes, en una entidad con un futuro prometedor.
Hidradenitis suppurativa (HS) is a chronic inflammatory entity characterized by the appearance of multiple nodules, abscesses, and fistulas, predominantly in apocrine regions. In addition to its dermatological involvement, it is associated with multiple systemic comorbidities. Its treatment is combined: topical pharmacological, systemic pharmacological and surgical. Regarding biologic or small molecule drugs, currently only adalimumab is approved. A narrative review of the literature on biological or small molecule drugs used in the treatment of hidradenitis suppurativa is presented. The arsenal we found is large, with multiple targets: inhibitors of tumor necrosis factor alpha (TNF-alpha), interleukin (IL)-17, IL-23, IL-1, inhibitors of the janus kinase (JAK) pathway, and multiple other drugs in study. New prospective studies and comparative trials are needed to analyze the effectiveness and safety of these treatments, in an entity with a promising future.
La hidradenitis supurativa (HS), también conocida como acné inverso, es una enfermedad cutánea inflamatoria crónica y recurrente1. Se caracteriza por la aparición repetida de nódulos, abscesos y fístulas, localizados predominantemente en las regiones apocrinas, como las axilas, los pliegues submamarios y la ingle2. Uno de los principales problemas es el poco conocimiento que se tiene acerca de esta entidad, habiéndose descrito en la literatura retrasos de incluso 12 años para su diagnóstico. Lo anterior puede conducir a la aparición de lesiones cicatriciales ya establecidas, por lo que el tratamiento médico será más difícil3. Además de sus implicaciones cutáneas, es un padecimiento que se ha asociado a numerosas comorbilidades, incluyendo un mayor riesgo de anemia, enfermedad inflamatoria intestinal, psoriasis, espondiloartropatía, síndrome metabólico, ansiedad, depresión y un aumento de las tasas de suicidio4. Aunque no existen estudios multicéntricos amplios acerca de su epidemiología, la mayoría de los autores apuntan a una prevalencia estimada de 0,5-1%. La enfermedad suele comenzar en la segunda década de la vida, aunque hay casos de inicio precoz en la infancia y otros en edades más avanzadas. La HS afecta predominantemente a mujeres en una proporción de 3:1 respecto a los hombres5.
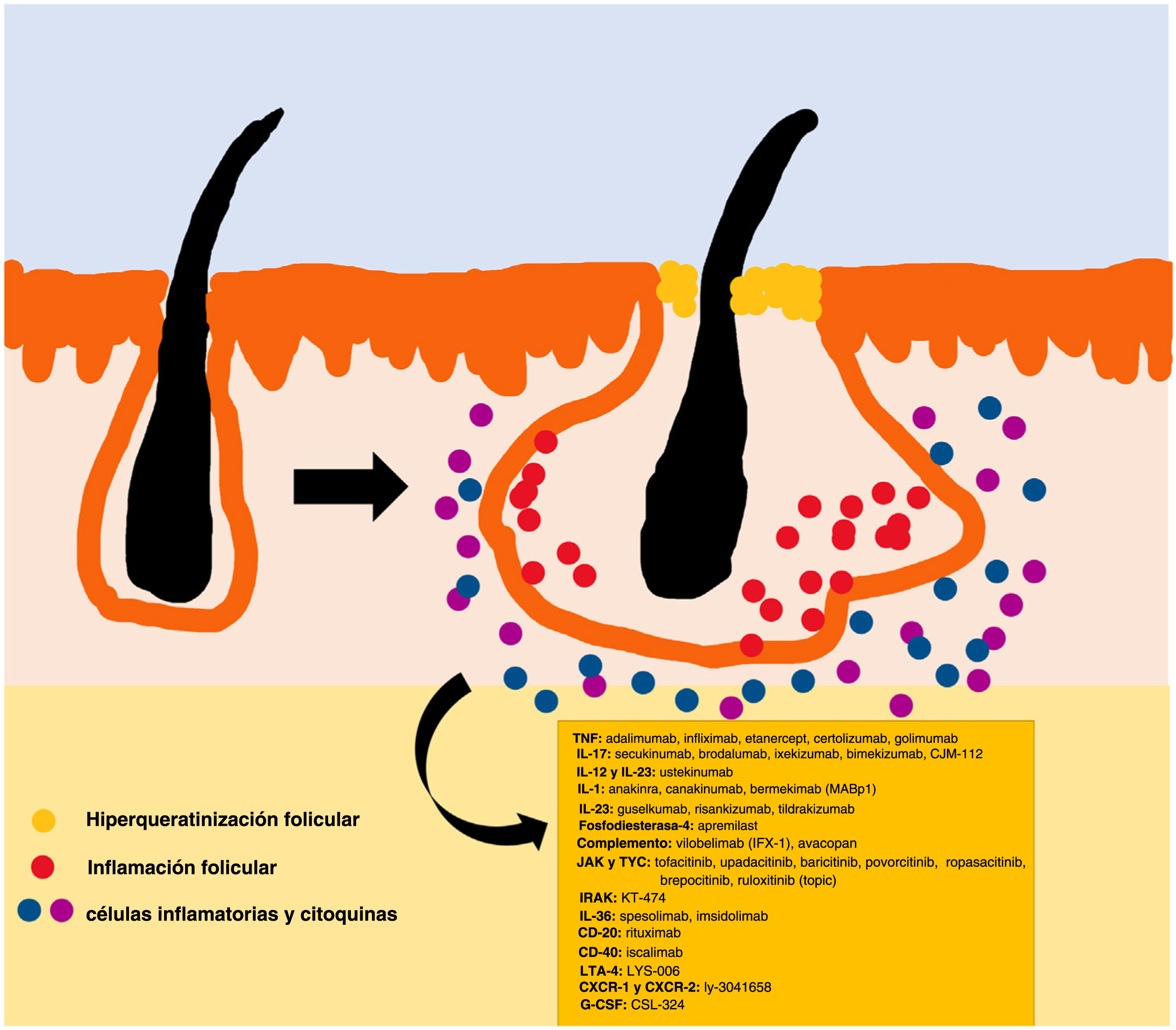
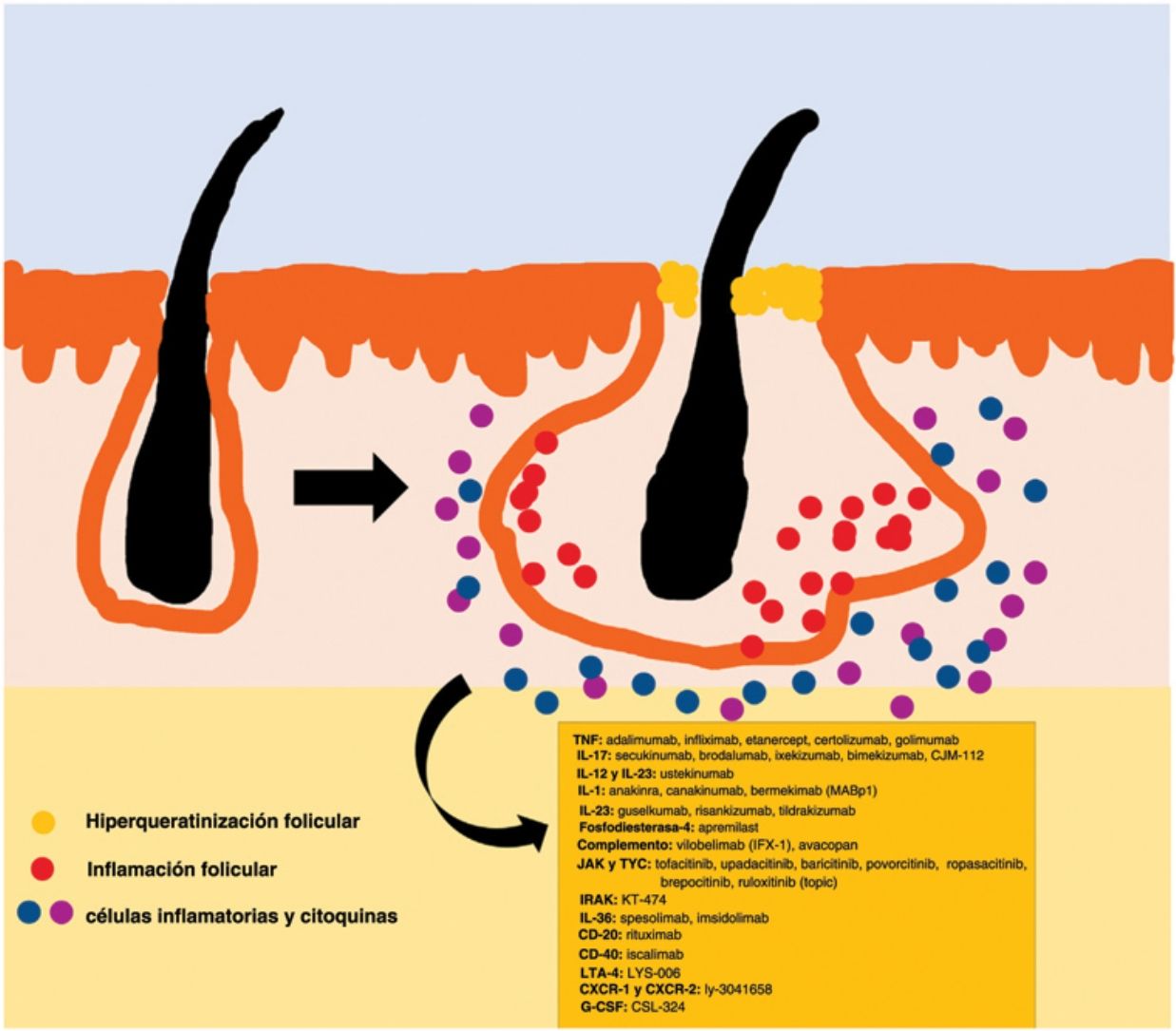
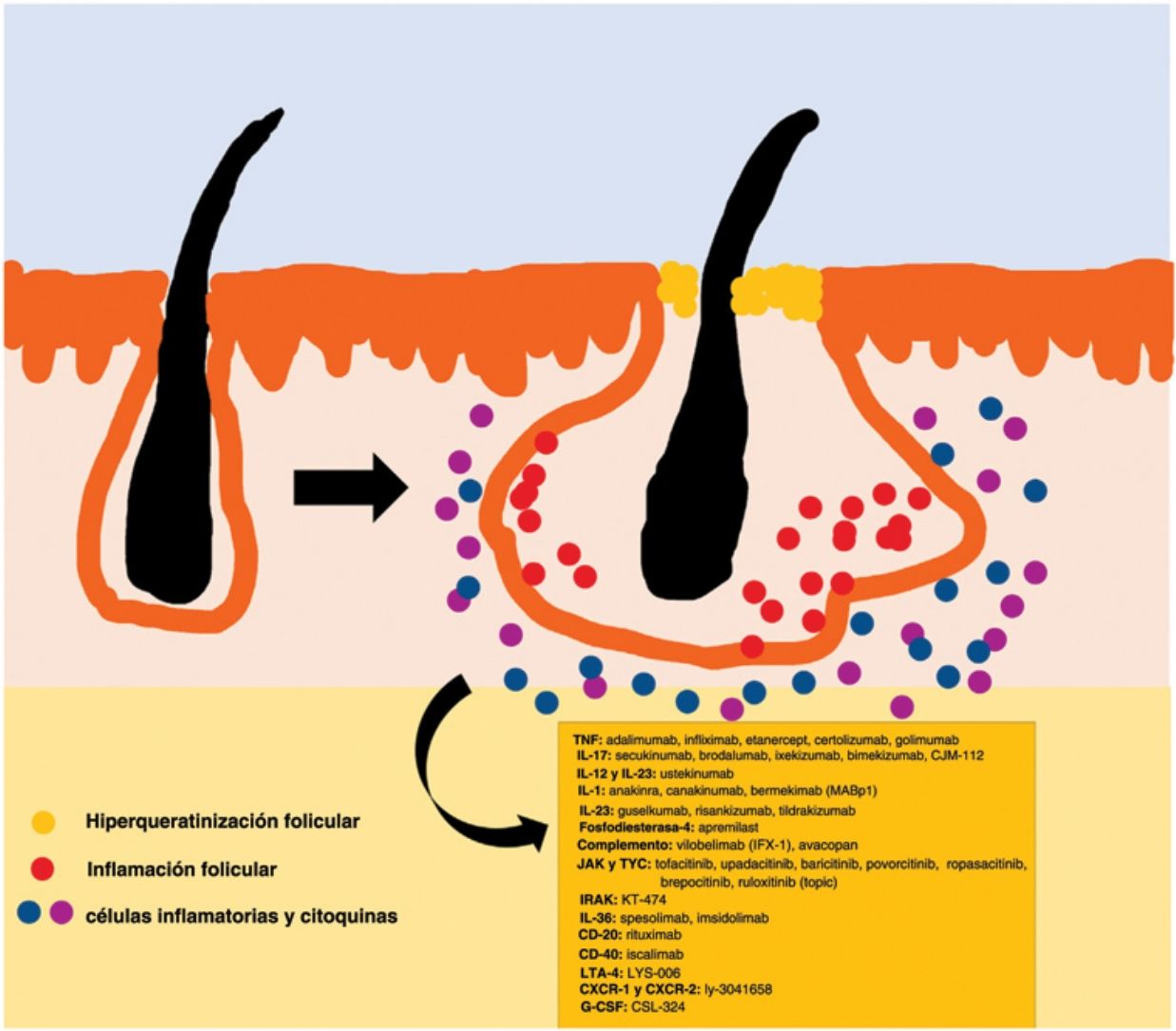
La patogenia de la HS sigue sin estar clara. Aunque la génesis de esta enfermedad no se ha dilucidado por completo, se cree que la aparición de la lesión se debe a la hiperqueratosis folicular dentro de la unidad pilosebácea-apocrina6. Se han implicado tres procesos principales en su origen: la hiperqueratosis folicular y la dilatación, la rotura folicular y una posterior respuesta inflamatoria, e inflamación crónica con cambios en la arquitectura del tejido7. Además, estudios recientes han aportado nuevos conocimientos sobre el papel de las citocinas en la patogenia de la HS, lo que ha contribuido a responder a algunas preguntas acerca del desarrollo de esta entidad6. La activación de los queratinocitos conduce a un aumento de la secreción de los péptidos antimicrobianos (p. ej., psoriasina y calgranulina) y de las citocinas inflamatorias (p. ej., la interleucina [IL]-1β, la IL-18, la IP-10 y los RANTES)7. La inflamación del epitelio folicular eleva la producción de la citoqueratina 16 en el infundíbulo y provoca la alteración e involución de las glándulas sebáceas asociadas al folículo8. Estas anomalías producen la hiperqueratinización folicular, con una dilatación retrógrada y activación endógena de la inflamación del huésped, especialmente centrada en una respuesta Th1 y Th17, modificando el microambiente folicular9,10. Tras el evento agudo primario, la inflamación crónica se mantiene por la infiltración continua de neutrófilos a través de la lipocalina-2, lo que conduce a cambios arquitectónicos permanentes típicamente en forma de fibrosis organizada11. Hasta 30-42% de los pacientes con HS tienen antecedentes familiares y varios presentarán mutaciones en alguno de los componentes del complejo de la γ-secretasa (especialmente NCSTN, PSEN1, PSENEN y POGLUT1). Este es un complejo importante implicado en la patogenia de la HS, que lleva a un deterioro de la señalización Notch 1, que altera la homeostasis de la unidad infundibular12,13. El papel de los microorganismos en la patogenia de la HS también es controvertido. Se ha encontrado un predominio de especies de Staphylococcus y bacterias anareóbicas14. En cuanto a los factores modificables involucrados en la génesis o el empeoramiento de la HS, se ha hallado una relación con el tabaquismo, considerado el factor exógeno más importante y presente hasta en 90% de los pacientes con HS15. También contribuyen otros, como el sobrepeso y la obesidad, la ropa ajustada y la fricción excesiva, ciertos fármacos como el litio, la quetiapina o el disulfiram. Además, se han descrito casos de agravamiento con la isotretinoína, por lo que su uso se reserva para personas con HS en las que predomina el acné, ya que su eficacia es controvertida en otras lesiones de HS. Este padecimiento también se ha asociado al empleo de ciertos desodorantes y a la depilación traumática16. Debido a su patogenia multifactorial y a su curso crónico, se trata de una enfermedad compleja, en la que el tratamiento debe ser individualizado y acorde a las necesidades de cada momento según la evolución de la entidad. Las pautas de terapia de la HS varían según los distintos países.
El algoritmo de manejo acordado por la Fundación Europea de Hidradenitis Supurativa (EHSF) establece que se realice una escalada de tratamiento en función de su gravedad17. La terapia antibiótica tópica se utiliza como primera línea para limitar el sobrecrecimiento bacteriano causado por una reacción inflamatoria exagerada. En los casos más graves o refractarios, se amplía el abanico terapéutico. Las terapias orales incluyen antibióticos orales o intravenosos (iv) (clindamicina, rifampicina, metronidazol, moxifloxacina, ertapenem, etc.), retinoides sistémicos, antiandrógenos sistémicos, anticonceptivos hormonales, metformina, gluconato de zinc, dapsona, metotrexato o ciclosporina. Los tratamientos intervencionistas consisten en pequeñas infiltraciones con corticoesteroides, cirugías para liberar fístulas («deroofing») o grandes colgajos o injertos para abordar los defectos mayores18–21. La HS estuvo privada del uso de tratamientos biológicos o de moléculas pequeñas hasta el año 2015, cuando la EMA) y la Administración de Alimentos y Medicamentos de los EE. UU. (FDA) aprobaron el empleo del adalimumab para la HS grave refractaria a otras terapias22,23. Con la implicación del factor de necrosis tumoral alfa (TNF-alfa) en su patogenia, se han estudiado progresivamente nuevas citocinas y dianas moleculares para la HS grave, como la IL-1, la IL-17, la IL-23, la IL-36, el complemento 5 a (C5a), el receptor C5a, la vía de la Janus quinasa (JAK) o la fosfodiesterasa 4 (FDE4)24–29. Un resumen gráfico de la fisiopatología de la HS puede encontrarse en la fig. 128. Sin embargo, a pesar de las múltiples dianas estudiadas y de los numerosos estudios prospectivos y ensayos clínicos en funcionamiento, aún no existe un algoritmo terapéutico estandarizado en aquellos pacientes con fracaso o con la contraindicación del uso de adalimumab en la HS grave. El objetivo de este trabajo es presentar una revisión narrativa actualizada de los resultados obtenidos con fármacos biológicos y de moléculas pequeñas en el tratamiento de la HS grave.
Material y métodosSe realizó una búsqueda narrativa de la literatura en Medline y Google Scholar, desde el primero de enero de 2000 hasta el primero de abril de 2023 con las palabras clave de «hidradenitis», «hidradenitis supurativa», «tratamiento sistémico», «tratamiento», «terapia», «biológicos», «moléculas pequeñas», «nuevo tratamiento», «nuevas perspectivas», «adalimumab», «infliximab», «golimumab», «etanercept», «ustekinumab», «secukinumab», «brodalumab», «ixekizumab», «bimekizumab», «guselkumab», «risankizumab», «tildrakizumab», «upadacitinib», «tofacitinib», «baricitinib», «jak», «jak inhibitor», «janus kinase». Asimismo, se efectuó una búsqueda en https://clinicaltrials.gov/, a través de la pestaña «Other terms» e incluyendo el término «hidradenitis supurativa». Se tomaron en cuenta todos los estudios, sin limitación en el número de pacientes ni en el diseño del mismo. La búsqueda se redujo a artículos en inglés y español. Se realizó una selección de los trabajos según su resumen (abstract), y se seleccionaron por su relevancia tras la lectura de los mismos. En relación con los ensayos clínicos, se recogieron los más relevantes, haciendo hincapié en los que fueran de fase 2 o superior, excepto algunos de fase 1 con un mecanismo de acción muy novedoso. El investigador principal (MMP) supervisó la búsqueda y selección de los estudios. Este proceso fue confirmado posteriormente por otro investigador (RBE).
ResultadosLos estudios más relevantes realizados o que están en curso con diversos fármacos sistémicos y de molécula pequeña para la HS grave se presentan a continuación y se resumen en la tabla 1.
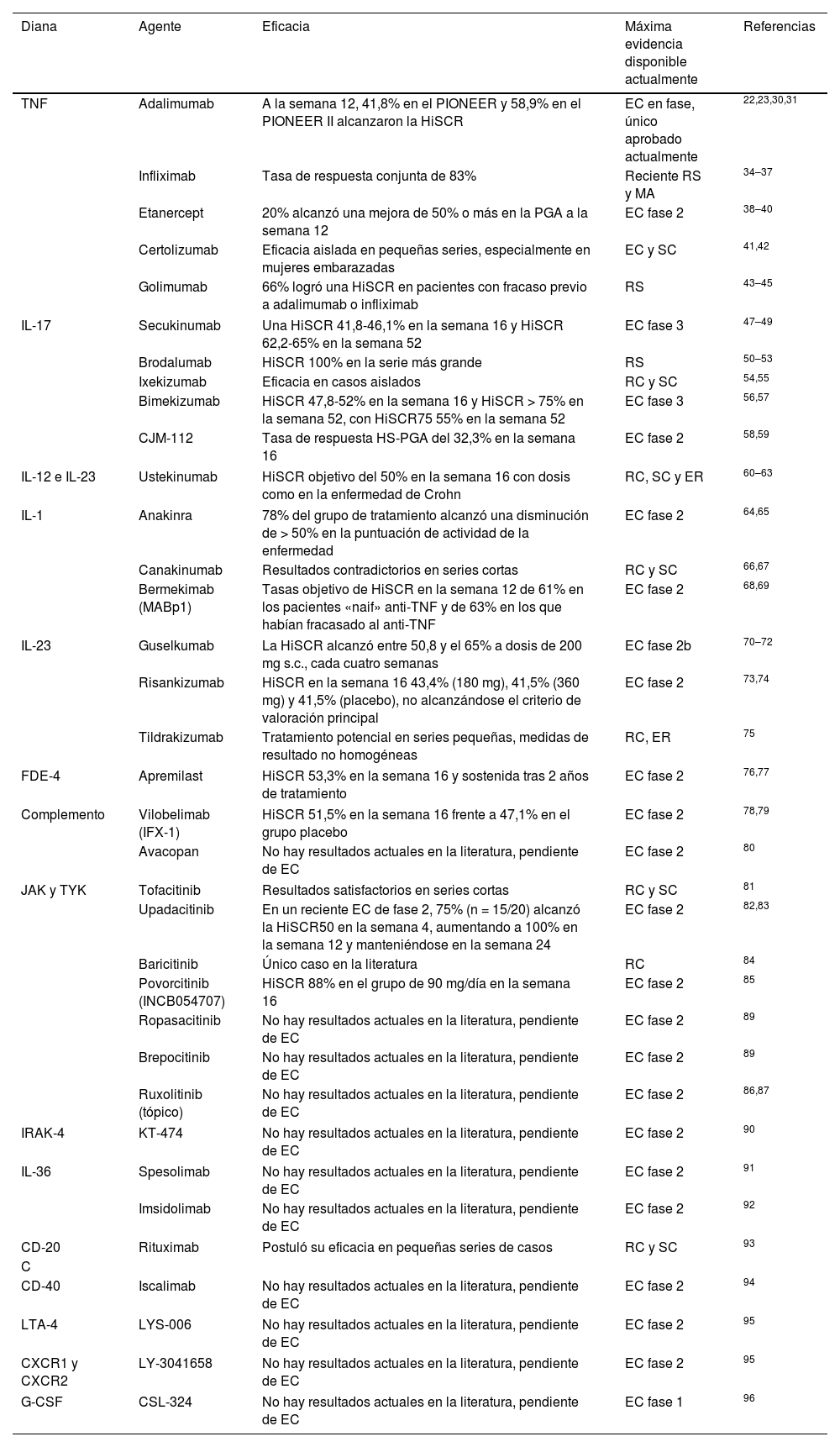
Medicamentos biológicos y de moléculas pequeñas utilizados actualmente o en fase de investigación para el tratamiento de la HS
| Diana | Agente | Eficacia | Máxima evidencia disponible actualmente | Referencias |
|---|---|---|---|---|
| TNF | Adalimumab | A la semana 12, 41,8% en el PIONEER y 58,9% en el PIONEER II alcanzaron la HiSCR | EC en fase, único aprobado actualmente | 22,23,30,31 |
| Infliximab | Tasa de respuesta conjunta de 83% | Reciente RS y MA | 34–37 | |
| Etanercept | 20% alcanzó una mejora de 50% o más en la PGA a la semana 12 | EC fase 2 | 38–40 | |
| Certolizumab | Eficacia aislada en pequeñas series, especialmente en mujeres embarazadas | EC y SC | 41,42 | |
| Golimumab | 66% logró una HiSCR en pacientes con fracaso previo a adalimumab o infliximab | RS | 43–45 | |
| IL-17 | Secukinumab | Una HiSCR 41,8-46,1% en la semana 16 y HiSCR 62,2-65% en la semana 52 | EC fase 3 | 47–49 |
| Brodalumab | HiSCR 100% en la serie más grande | RS | 50–53 | |
| Ixekizumab | Eficacia en casos aislados | RC y SC | 54,55 | |
| Bimekizumab | HiSCR 47,8-52% en la semana 16 y HiSCR > 75% en la semana 52, con HiSCR75 55% en la semana 52 | EC fase 3 | 56,57 | |
| CJM-112 | Tasa de respuesta HS-PGA del 32,3% en la semana 16 | EC fase 2 | 58,59 | |
| IL-12 e IL-23 | Ustekinumab | HiSCR objetivo del 50% en la semana 16 con dosis como en la enfermedad de Crohn | RC, SC y ER | 60–63 |
| IL-1 | Anakinra | 78% del grupo de tratamiento alcanzó una disminución de > 50% en la puntuación de actividad de la enfermedad | EC fase 2 | 64,65 |
| Canakinumab | Resultados contradictorios en series cortas | RC y SC | 66,67 | |
| Bermekimab (MABp1) | Tasas objetivo de HiSCR en la semana 12 de 61% en los pacientes «naif» anti-TNF y de 63% en los que habían fracasado al anti-TNF | EC fase 2 | 68,69 | |
| IL-23 | Guselkumab | La HiSCR alcanzó entre 50,8 y el 65% a dosis de 200 mg s.c., cada cuatro semanas | EC fase 2b | 70–72 |
| Risankizumab | HiSCR en la semana 16 43,4% (180 mg), 41,5% (360 mg) y 41,5% (placebo), no alcanzándose el criterio de valoración principal | EC fase 2 | 73,74 | |
| Tildrakizumab | Tratamiento potencial en series pequeñas, medidas de resultado no homogéneas | RC, ER | 75 | |
| FDE-4 | Apremilast | HiSCR 53,3% en la semana 16 y sostenida tras 2 años de tratamiento | EC fase 2 | 76,77 |
| Complemento | Vilobelimab (IFX-1) | HiSCR 51,5% en la semana 16 frente a 47,1% en el grupo placebo | EC fase 2 | 78,79 |
| Avacopan | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 80 | |
| JAK y TYK | Tofacitinib | Resultados satisfactorios en series cortas | RC y SC | 81 |
| Upadacitinib | En un reciente EC de fase 2, 75% (n = 15/20) alcanzó la HiSCR50 en la semana 4, aumentando a 100% en la semana 12 y manteniéndose en la semana 24 | EC fase 2 | 82,83 | |
| Baricitinib | Único caso en la literatura | RC | 84 | |
| Povorcitinib (INCB054707) | HiSCR 88% en el grupo de 90 mg/día en la semana 16 | EC fase 2 | 85 | |
| Ropasacitinib | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 89 | |
| Brepocitinib | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 89 | |
| Ruxolitinib (tópico) | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 86,87 | |
| IRAK-4 | KT-474 | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 90 |
| IL-36 | Spesolimab | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 91 |
| Imsidolimab | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 92 | |
| CD-20 | Rituximab | Postuló su eficacia en pequeñas series de casos | RC y SC | 93 |
| C | ||||
| CD-40 | Iscalimab | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 94 |
| LTA-4 | LYS-006 | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 95 |
| CXCR1 y CXCR2 | LY-3041658 | No hay resultados actuales en la literatura, pendiente de EC | EC fase 2 | 95 |
| G-CSF | CSL-324 | No hay resultados actuales en la literatura, pendiente de EC | EC fase 1 | 96 |
CD: cluster de diferenciación; CXCR 1 y 2: receptor de quimioquina tipo 1 y 2; EC: ensayo clínico; ER: estudios retrospectivos; FDE: fosfodiesterasa; G-CSF: factor estimulante de granulocito colonia; HS: hidradenitis supurativa; HiSCR: respuesta clínica en la hidradenitis supurativa, definida como una reducción de ≥ 50% en el recuento de lesiones inflamatorias (suma de abscesos y nódulos inflamatorios), sin aumento del número de abscesos o fístulas drenantes con respecto al valor inicial; IL: interleucina; JAK: janus quinasa; LTA: antagonista de leucotrienos; MA: meta-análisis; RC: reporte de caso; RS: revisión sistemática; SC: series de casos; TNF: factor de necrosis tumoral; TYK: tirosina cinasa.
Fuente: elaboración propia.
El único fármaco aprobado hasta la fecha para la HS es el adalimumab, hecho que se consolidó tras los resultados de los ensayos PIONEER I y PIONEER II, con tasas de respuesta en la semana 12 significativamente superiores para los grupos que recibieron este medicamento semanalmente que para los grupos placebo: 41,8 vs. 26,0% en el PIONEER I (p = 0,003) y 58,9 vs. 27,6% en el PIONEER II (p < 0,001) y un buen perfil de seguridad22,23,30,31. En los pacientes no respondedores o con alguna contraindicación para el adalimumab, el rango terapéutico es amplio, y no existe un algoritmo claro para su manejo. La buena respuesta inicial en algunos casos, seguida de un fracaso secundario, dió lugar a estudios en los que se analizó la intensificación del adalimumab a partir de su dosis estándar de 80 mg/14 días a 80 mg/7 días, demostrando una tasa de mejoría32,33. Además de este fármaco, se han estudiado otros agentes anti-TNF para el tratamiento de la HS. El infliximab ha demostrado su eficacia en diversos estudios34,35. Una reciente revisión sistemática y un metaanálisis reveló que la tasa de respuesta conjunta de los pacientes con HS al infliximab fue de 83% (intervalo de confianza [IC] del 95%; 0,71-0,91), con un perfil de efectos secundarios favorable36. Paralelamente a la intensificación de la dosis que algunos autores sugieren para el adalimumab, hay otros que han hallado una mayor eficacia del infliximab cuando se administra a dosis similares a las de la enfermedad inflamatoria intestinal: 7,5 mg/kg cada cuatro semanas o incluso 10 mg/kg cada cuatro semanas37. En cuanto al etanercept, en el ensayo de Giamarellos-Bourboulis et al.,38 se encontró una reducción de la carga de enfermedad a la semana 12, pero no se especificaron los valores. Posteriormente, en el estudio de Lee et al.39, solo tres de los 15 pacientes alcanzaron el resultado primario, definido como una mejoría de 50% o más en la PGA a la semana 12. Por lo tanto, no se ha logrado una evidencia suficiente de la eficacia del etanercept, así como tampoco se tiene para la recomendación de este fármaco como tratamiento de la HS grave40. Respecto al certolizumab, se han encontrado pocos artículos sobre su uso en el abordaje de la HS. La mayoría de estos, eran pequeñas series de casos, generalmente con resultados favorables, pero con la posibilidad de que esto se deba a un sesgo de publicación propio del reducido tamaño muestral. Debido a su farmacodinámica, este medicamento evita el paso placentario, lo que lo convierte en una opción atractiva en pacientes embarazadas con HS grave41,42. Por último, en relación con los agentes anti-TNF, el golimumab demostró inicialmente su utilidad en reportes y series pequeñas de casos43,44, lo que se vió reforzado con la publicación de una serie retrospectiva con 13 pacientes que fracasaron al adalimumab y tuvieron buenos resultados con el golimumab, por lo que este podría ser una opción en sujetos con fracaso al adalimumab45.
Agentes anti-IL-17La IL-17 se ha implicado en numerosos estudios en la patogénesis de la HS24. En los ensayos clínicos de fase 3 SUNSHINE y SUNRISE, el secukinumab superó el criterio de valoración primario en la semana 16, con respuestas sostenidas a la semana 52. A las 16 semanas, en el ensayo SUNSHINE, 45% de los pacientes tratados con el secukinumab 300 mg/14 días alcanzaron la respuesta clínica en la HS, definida como una reducción de ≥ 50% en el recuento de lesiones inflamatorias (suma de abscesos y nódulos inflamatorios), sin aumento del número de abscesos o fístulas drenantes con respecto al valor inicial (HiSCR), frente a 41,8% de los sujetos manejados con el secukinumab 300 mg/28 días o 33,7% en el grupo placebo. En el ensayo SUNRISE, los resultados a las 16 semanas fueron ligeramente mejores para el secukinumab 300 mg/14 días, con una respuesta HiSCR de 46,1 vs. 42,3% en los pacientes con el secukinumab 300 mg/28 días o 31,2% en el grupo placebo. Recientemente se publicaron los resultados en la semana 52, con un porcentaje de sujetos que alcanzaron la HiSCR de 56,4% con el secukinumab 300 mg/14 días y de 56,3% con el secukinumab 300 mg/28 días en el estudio SUNSHINE, mientras que el porcentaje de aquellos que lograron la HiSCR en el estudio SUNRISE fue de 65% con el secukinumab 300 mg/14 días y de 62,2% con el secukinumab 300 mg/28 días. En ambos ensayos, la tasa de efectos secundarios fue leve, siendo el más frecuente el dolor de cabeza46. Un estudio reciente retrospectivo multicéntrico de 47 pacientes con HS grave demostró que 48,9% (n = 23/47) de ellos alcanzaron una HiSCR objetiva, con acontecimientos adversos en el 6,4% (n = 3/47)47. Esta eficacia ha sido respaldada en algunos estudios recientes con periodos de observación más prolongados48. Al demostrar la disminución de la carga de la enfermedad de la HS mediante el bloqueo del receptor de IL-17A, se empezó a utilizar el brodalumab en su tratamiento49,50. Únicamente se han presentado pequeñas series de casos, la mayor de ellas con 10 pacientes a los que se les administró 210 mg en las semanas 0, 1 y 2 y posteriormente cada dos semanas. En este estudio, todos los sujetos (100%) alcanzaron el objetivo de la HiSCR, y 80% lograron un cambio de categoría IHS4 en la semana 12. El logro de la HiSCR se produjo ya en la segunda semana, con un perfil de seguridad favorable51. Recientemente, se ha propuesto la intensificación terapéutica con el brodalumab, utilizando un régimen semanal en lugar de quincenal52. En cuanto al ixekizumab, no hay estudios con evidencia suficiente para recomendar su uso en el tratamiento de la HS grave, limitándose la bibliografía a pequeños informes y series de casos53,54. Por último, en relación con esta vía, cabe destacar los resultados del bimekizumab, un inhibidor dual de la IL 17-A y 17-F, los cuales se presentaron en la Reunión Anual de la Academia Americana de Dermatología del 2023, en sus dos fases 3 (BE HEARD I y BE HEARD II), logrando mejoras estadísticamente significativas y clínicamente constantes frente al placebo, tanto en los signos como en los síntomas de la HS a la semana 16, que se mantuvieron hasta la semana 48. Esto lo posiciona como un arma terapéutica prometedora. En la semana 16 de los ensayos, 47,8% de los pacientes de BE HEARD I y 52% de los de BE HEARD II experimentaron la reducción de 50% en los abscesos cutáneos y los nódulos inflamatorios. Esto se comparó con 28,7% y 32% del placebo, respectivamente. En la semana 48, las respuestas clínicas se mantuvieron con el tratamiento continuo con el bimekizumab, ya que más de 75% de las personas alcanzaron la HiSCR50, y más de 55% lograron la HiSCR75 en la semana 48. El perfil de seguridad del bimekizumab en BE HEARD I y BE HEARD II fue coherente con el de los estudios anteriores, sin que se observaran nuevas alertas de seguridad55,56. El CJM112, otro anticuerpo monoclonal que neutraliza la IL-17 soluble y la IL-17A/F, en un estudio controlado aleatorizado de fase II, ha demostrado una tasa de respuesta a HS-PGA de 32,3% en la semana 16, frente a 12,5% en los pacientes tratados con placebo57,58.
Agentes anti-IL-12 e IL-23El ustekinumab, un inhibidor dual de la IL-12 y la IL-23 mediante el bloqueo de su subunidad p40 común, ha demostrado su eficacia en varios casos de HS59. Además, se ha postulado un aumento de la misma con la administración iv con dosis de 90 mg cada ocho o incluso seis o cuatro semanas, una dosis como la utilizada en la enfermedad de Crohn60–62, alcanzando en un estudio retrospectivo 50% (n = 7/14) de la HiSCR objetivo y con una reducción del dolor en 71,4% de los pacientes a la semana 1662.
Agentes anti-IL-1La familia de la IL-1 es un complejo que interviene en el correcto funcionamiento y regulación del sistema inmunitario innato, vinculando las respuestas inmunitarias innatas y adaptativas, y su fallo está relacionado con la psoriasis, la HS y la dermatitis atópica. El anakinra, un inhibidor de los receptores de la IL-1, ha demostrado ser eficaz en algunas series de pacientes, especialmente a dosis de 200 mg/día63. En un ensayo clínico controlado con placebo, en la semana 12 se utilizó como criterio de valoración primario una disminución de > 50% en la puntuación de actividad de la enfermedad, que logró 78% del grupo tratado y 30% del grupo placebo. Sin embargo, estos resultados no se han verificado posteriormente en ensayos más amplios y, además, se han notificado recaídas tempranas y frecuentes64. El canakinumab, un anticuerpo monoclonal anti-IL-1β, aporta datos controvertidos en la HS, con pequeñas series con resultados positivos65 y otras con resultados negativos66. El bermekimab (también denominado MABp1), un anticuerpo inhibidor específico de la IL-1α, ha mostrado en un ensayo clínico reciente de fase II rangos de objetivos de la HiSCR en la semana 12 de 61% en pacientes «naif» a anti-TNF y de 63% en los que habían fracasado a los anti-TNF67. Actualmente, se están reclutando sujetos para un nuevo ensayo aleatorizado de fase II (NCT04988308) con este fármaco68.
Agentes anti-IL-23En cuanto a los agentes anti-IL-23, estos han revelado ser eficaces en algunas series de casos69. En un estudio de fase IIb, doble ciego y controlado con placebo (NOVA-trial, NCT03628924) en el que se comparó el guselkumab a una dosis de 200 mg/4 semanas por vía subcutánea en las semanas 0, 4, 8 y 12 vs. 1.200 mg por vía iv en las semanas 0, 4 y 8 seguidos de 200 mg por vía subcutánea vs. placebo, se observó que la HiSCR se alcanzó en la semana 16 en 50,8% de los pacientes tratados con la administración subcutánea vs. 45% de los intravenosos70. Un reciente ensayo multicéntrico de fase IIa con el guselkumab a 200 mg s.c., cada cuatro semanas durante 16 semanas muestra que 65% (n = 13/20) alcanzaron la HiSCR también con una disminución significativa de la mediana de la puntuación IHS4 (8,5-5,0, p = 0,002) y de la mediana del recuento de AN (6,5-4,0, p = 0,002)71. El risankizumab había exhibido su posible uso terapéutico en la HS en pequeñas series de casos72. Sin embargo, el ensayo aleatorizado publicado recientemente con 243 pacientes (risankizumab 180 mg, n = 80; risankizumab 360 mg, n = 81; placebo, n = 82) demostró que la HiSCR se alcanzó en 46,8% de los sujetos con risankizumab 180 mg, 43,4% con risankizumab 360 mg, y 41,5% con placebo a la semana 16, no logrando el criterio de valoración primario, por lo que el estudio se dio por finalizado anticipadamente73. Los datos con el tildrakizumab son escasos. La serie más amplia con nueve pacientes mostró su potencial uso terapéutico en la HS74.
Agentes anti-FDE-4El apremilast, un inhibidor oral de la FDE-4, demostró su eficacia en un ensayo 3:1 a una dosis de 30 mg/12 h en comparación con el placebo, alcanzando 53,3% del objetivo de la HiSCR vs. 0% en el grupo placebo75. Estas respuestas se confirmaron en el seguimiento a dos años76. Estos resultados han sido apoyados por otras series pequeñas pero, hasta el momento, carecemos de estudios prospectivos comparativos con más evidencias que apoyen su uso generalizado.
Inhibidores del complementoSe ha demostrado la implicación de la vía del complemento en la patogénesis de la HS. El vilobelimab (IFX-1), un anticuerpo monoclonal anti-C5a, mostró tasas de HiSCR diana de 75% en un ensayo abierto77. Posteriormente, en un ensayo de fase 2 (NCT03487276) se ha revelado una HiSCR de 51,5% a una dosis de 800 mg iv cada cuatro semanas, aunque la respuesta con placebo fue de 47,1%78. El avacopan, otro inhibidor oral de C5a ya utilizado en las vasculitis ANCA + y en el síndrome urémico hemolítico atípico, está siendo evaluado en un ensayo (NCT03852472) frente a placebo, pero los resultados aún no se han publicado79.
Vía JAK/STATCon un uso cada vez mayor en la dermatología, se ha descrito un papel clave de la señalización de estrés y la activación de la JAK/transductor de señales y activador de la transcripción 1 (STAT1) en la progresión de la HS, lo que convierte a esta vía en una posible diana terapéutica. El tofacitinib se ha descrito como un tratamiento satisfactorio de la HS en casos aislados80. En un estudio reciente de cohortes retrospectivo de vida real, el upadacitinib demostró que 75% (n = 15/20) de los individuos alcanzaron la HiSCR50 en la cuarta semana, aumentando al 100% en la semana 12 y manteniéndose los resultados prometedores en la semana 2481. Existe un ensayo clínico de fase 2 en curso que evalúa el upadacitinib en la HS (NCT04430855)82. Solo se ha descrito en la literatura un caso de tratamiento de la HS con el baricitinib83. El INCB054707 (povorcitinib) es un nuevo inhibidor de JAK-1 que se está evaluando en tres ensayos clínicos (NCT03569371, NCT03607487 y NCT04476043). En el NCT03607487, se demostraron mayores tasas de respuesta en el grupo de 90 mg/día (HiSCR 88%) frente al placebo (HiSCR 57%), aunque la tasa de efectos adversos fue sustancial, presentando hasta un tercio de los pacientes efectos adversos de grado 3 o 484. Últimamente, también se ha postulado su utilidad tópica con el ruxolitinib85, como ya se ha establecido en otras entidades como el vitíligo o la alopecia areata. Su eficacia se está probando en dos ensayos clínicos, uno de ellos en fase de reclutamiento y otro en curso, empleando el ruxolitinib tópico al 1,5%86.
Otras dianasExisten numerosas dianas nuevas que se están evaluando para el tratamiento de la HS87,88. El IRAK-4 es un regulador inmunitario múltiple, principalmente del sistema inmunitario innato. El KT-474, un inhibidor de IRAK-4, se está evaluando para el manejo de la HS en un ensayo de fase 1 (NCT04772885), así como en uno de fase 2 (NCT04092452), un ensayo con tres fármacos anticinasa que también incluye el ropasacitinib (PF-06826647), un inhibidor de la tirosina cinasa 2 (TYK2), y el brepocitinib (PF-06700841) un inhibidor dual del TYK2/JAK189. No hemos encontrado ningún estudio que evalúe el tocilizumab u otro fármaco anti-IL-6 en el tratamiento de la HS. La IL-36 se ha implicado en la patogénesis de enfermedades autoinflamatorias, autoinmunes e infecciosas. Su elevación en la HS podría representar una nueva diana terapéutica para el spesolimab y el imsidolimab, dos anticuerpos monoclonales anti-IL-36 empleados en la psoriasis pustulosa generalizada. Ambos fármacos están siendo calificados en dos ensayos clínicos de fase 2 (NCT04762277 spesolimab90 y NCT04856930 imsidolimab91). El rituximab, un agente monoclonal anti-CD-20, se postula como posible arma terapéutica, habiéndose establecido su eficacia en cinco casos descritos en la literatura92. El iscalimab (CFZ533) es un anticuerpo monoclonal que bloquea la vía CD-40, y se está estudiando en el tratamiento de la HS en un ensayo de fase II (NCT03827798)93. El LYS 006, un inhibidor oral de la leucotrieno A4 hidrolasa (LTA4), se está valorando en un ensayo de fase II para el tratamiento de la HS (NCT03827798)93. El LY 3041658, un anticuerpo monoclonal que bloquea las quimiocinas que se unen a los receptores CXCR1 y CXCR2, también se está analizando en un ensayo de fase 2 (NCT04493502)94. Por último, el CSL 324 es un anticuerpo anti-factor estimulante de granulocito colonia (G-CSF) de fase 1 para el tratamiento de la HS y la pustulosis palmoplantar (NCT03972280)95.
DiscusiónEl reconocimiento y tratamiento precoz de la HS es esencial para evitar su progresión a una fase crónica, con presencia de tractos fistulosos organizados que en ocasiones son refractarios a todo tipo de tratamiento médico y que requieren uno quirúrgico que en ocasiones es mutilante96 (fig. 2). Sumado a la enfermedad y su gravedad, sus múltiples comorbilidades, y la mayor tasa de desempleo entre quienes la padecen hacen que este impacto sea aún más severo, afectando a todos los aspectos de la calidad de vida97. El manejo preciso de esta patología requiere un abordaje multifactorial, comenzando por la educación del paciente, insistiendo en la abolición de los factores desencadenantes y precipitantes, especialmente el tabaco y la obesidad. En la mayoría de los casos, el tratamiento tópico o pequeños ciclos de antibióticos orales controlan satisfactoriamente la enfermedad. Además, en nuestra experiencia, la realización de intervenciones quirúrgicas en forma de drenaje o desbridamiento ayuda a resolver clínicamente las lesiones. Sin embargo, en aquellos pacientes que no responden a estas medidas, es necesario el uso de fármacos biológicos o de moléculas pequeñas, destacando el adalimumab como el único aprobado actualmente por las principales agencias reguladoras de medicamentos. Cuando el adalimumab fracasa, o está contraindicado, encontramos un vacío en la literatura, tratándose de pacientes complejos, cuyo manejo presenta una gran variabilidad entre los centros, utilizando diferentes dianas, incluyendo fármacos anti-IL-17, IL-23, IL-1, inhibidores de la vía JAK o FDE-4 u otras numerosas dianas en estudio86,87. La literatura proporciona resultados imprecisos para las distintas dianas. Los recientes resultados favorables obtenidos para el secukinumab46,47 y el bimekizumab55,56 en ensayos clínicos de fase 3 sugieren que podrían ser los próximos fármacos en ser aprobados por la FDA y la EMA para el tratamiento de la HS grave. De esta forma, la IL-17 se situaría como la siguiente diana tras el fracaso de los anti-TNF. Serán necesarios estudios comparativos entre ambas alternativas. Otras opciones con resultados destacables, aunque en ensayos de menor nivel y por tanto lejos de su aprobación, son el infliximab34–37 (especialmente a dosis altas de 10 mg/kg/4 semanas37) y el ustekinumab59 (sobre todo con la primera administración iv y con dosis de la enfermedad inflamatoria intestinal60–62). También son prometedores los resultados obtenidos por el apremilast75,76, a pesar de que su ensayo cuenta con un número reducido de pacientes o, en relación con dianas más novedosas, los inhibidores de la JAK quinasa, en particular el upadacitinib81,82 y el povorcitinib84. En este sentido, también cabe destacar la posibilidad de emplear un tratamiento tópico de moléculas pequeñas con el ruxolitinib85, estudio que aún está en curso86. Este abanico de terapias es el fiel reflejo de la multifactorialidad de la enfermedad y pone de manifiesto la necesidad de nuevos ensayos clínicos y de estudios prospectivos que permitan clarificar el horizonte terapéutico de la HS grave con fracaso o contraindicación al adalimumab. El futuro terapéutico de la HS es prometedor.
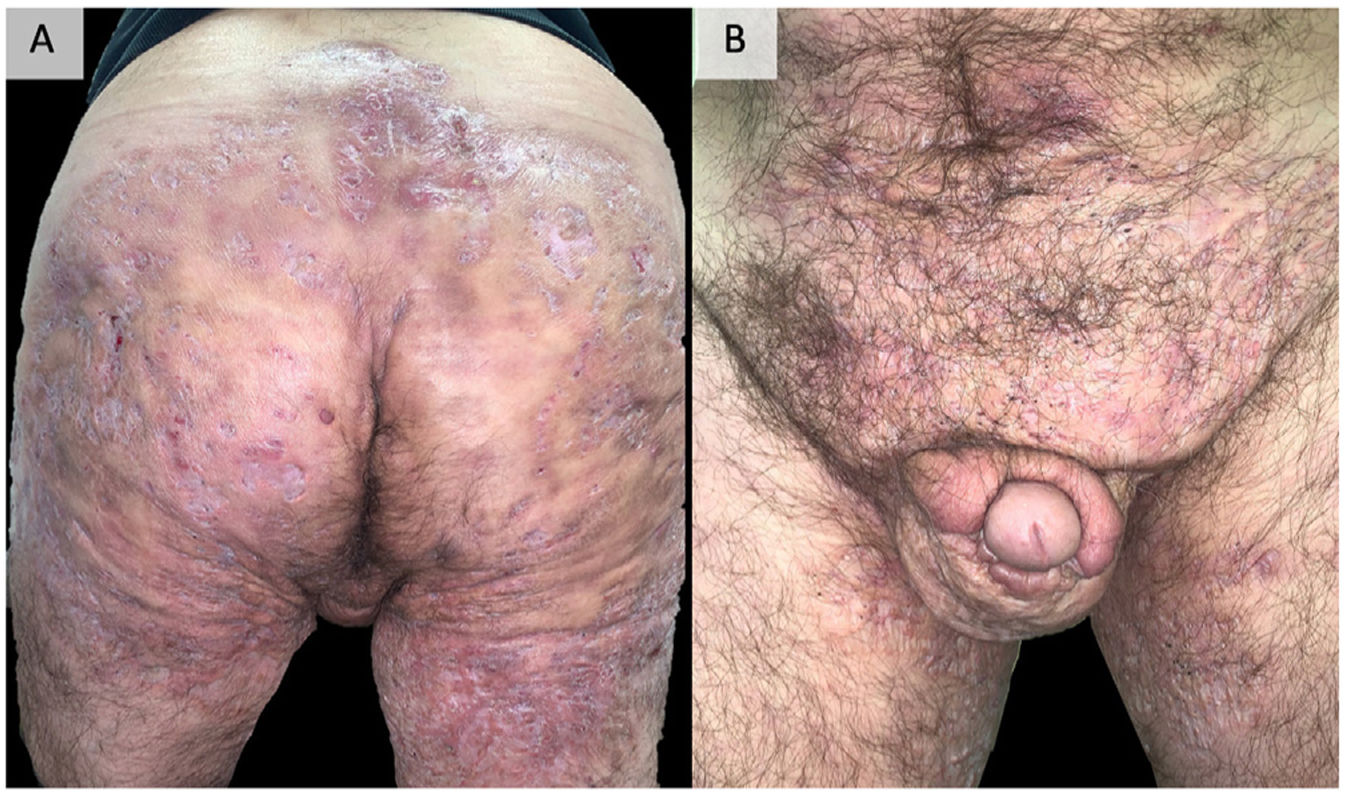
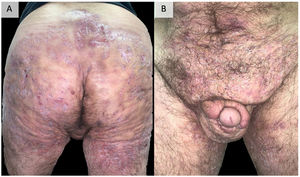
Ejemplo de hidradenitis supurativa extremadamente grave. Varón de 48 años con HS de más de 20 años de evolución, refractaria a múltiples tratamientos, incluidos adalimumab a dosis altas, infliximab y ustekinumab. Actualmente, en tratamiento con bimekizumab.
Fotografías tomadas y publicadas con el consentimiento verbal y escrito del paciente. HS: hidradenitis supurativa.
El presente trabajo está limitado por ser narrativo y no una revisión sistemática de la literatura o un metaanálisis de los principales estudios. Además, a excepción de los fármacos más utilizados, el resto del arsenal terapéutico aquí presentado se basa a menudo en pequeñas series de casos o en ensayos clínicos en fases muy preliminares.
ConclusionesLa HS es una enfermedad multifactorial muy compleja, cuyo abordaje requiere una combinación de tratamiento médico tópico, sistémico y quirúrgico. Actualmente, el único fármaco biológico o de molécula pequeña aprobado es el adalimumab. En pacientes con fracaso o contraindicación para este agente, existen numerosas opciones terapéuticas que abarcan diversas dianas, la mayoría de ellas citocinas proinflamatorias. Se necesitan nuevos estudios prospectivos y ensayos comparativos para dilucidar un algoritmo terapéutico estandarizado para los sujetos con HS grave.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.