El sarcoma de células claras (SCC) es una neoplasia maligna de tejidos blandos infrecuente. La existencia de características fenotípicas celulares similares a las del melanoma hacen necesario un diagnóstico diferencial, sobre todo en lesiones metastásicas melanocíticas de origen desconocido1.
Por otro lado, los pecomas son unos tumores mesenquimales constituidos por células epiteliodes con una localización cutánea infrecuente y con unas características inmunohistoquímicas similares a las del SCC2.
Se presenta el caso de una mujer de 45 años intervenida por dolor y parestesias en el territorio del nervio mediano de la mano derecha, compatible con un síndrome del túnel carpiano, confirmado con estudio electromiográfico.
Se realizó liberación del túnel del carpo y estudio anatomopatológico del ligamento de dicha región.
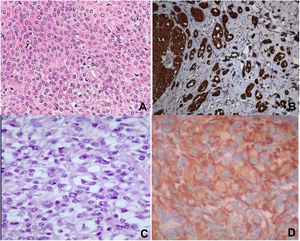
El estudio anatomopatológico informó de una proliferación fusocelular constituida por unas células dispuestas de forma desordenada que infiltraban el tejido conjuntivo y las estructuras nerviosas con 10 mitosis por 10 campo de gran aumento (CGA). La inmunotinción fue positiva para HMB-45, S-100 y vimentina, focalmente positiva para colágeno IV y FXIIIA y negativa para actina muscular específica, citoqueratina, enolasa neuronal específica, CD34 y CD68 (figs. 1A y B).
La identificación de la reordenación genética EWS-ATF1 confirmó la translocación cromosómica t(12;22)(q13;q12), lo que confirmó el diagnóstico de SCC. Se realizó la biopsia selectiva del ganglio centinela sin evidencia de enfermedad maligna y se administró tratamiento adyuvante con dacarbazina. Se objetivó progresión de la enfermedad por metástasis óseas en ambos hombros y múltiples vértebras, por lo que se administró segunda tanda de quimioterápicos con platino, etopósido y radioterapia, que tampoco fueron efectivas. Apareció progresión pulmonar, la paciente pasó a cuidados paliativos y falleció 12 meses después de la cirugía.
Otro caso es el de una mujer de 32 años, remitida por un nódulo azul negruzco con aspecto ulcerativo que había duplicado su tamaño en 2meses en la región lumbar izquierda y que presentaba, además, múltiples adenopatías inguinales izquierdas con biopsia previa sugestiva de melanoma. Ante sospecha de melanoma metastásico, se decidió ampliar los márgenes quirúrgicos y hacer linfadenectomía inguinal izquierda por la sospecha de metástasis ganglionares locorregionales.
El estudio anatomopatológico informó de una infiltración de la piel y de partes blandas por un tumor maligno de células fusiformes y epitelioides perivasculares y metástasis en 2de 8ganglios linfáticos. La inmunotinción fue positiva para HMB-45, melan-A y vimentina, focalmente positiva para S-100 y CD68 y negativa para actina, α-1-antitripsina, CD117,CD34,CD99, CKAE1/AE13,p53, desmina y sinaptofisina (figs. 1 C y D).
Ante estos hallazgos, se planteó el diagnóstico diferencial entre un SCC y un pecoma. La negatividad en el reordenamiento de EWS-ATF1 descartó el diagnóstico de SCC, por lo que finalmente fue diagnosticada de pecoma.
Se realizó tratamiento con 4 ciclos de quimioterapia (ifosfamida/adriamicina). En la TC de control se objetivó progresión tumoral pulmonar. Se instauró tratamiento quimioterápico paliativo con dacabacina en monoterapia y, tras una nueva progresión tumoral, se administró sunitinib 50. A pesar de dicho tratamiento, la paciente presentó un aumento de los nódulos pulmonares, así como nódulos metastásicos pericárdicos, retroperitoneales y mediastínicos, que produjeron un deterioro progresivo del estado general. La paciente falleció 11 meses después de la cirugía.
El SCC es una entidad clinicopatológica que se presenta frecuentemente en los tejidos blandos de las extremidades de adultos jóvenes con una localización cercana a los tendones y el tejido aponeurótico1. Representa el 1% de los sarcomas de partes blandas1.
Los SCC presentan un pronóstico desfavorable con un alto porcentaje de recidiva (21-69%)3 y porcentajes de supervivencia a los 5 años de 47-67% y a los 10 años del 33-36%3. Las variables de mal pronóstico son un tamaño tumoral mayor de 5cm, la presencia de necrosis tumoral, una resección quirúrgica completa, un índice mitótico elevado (mayor de 2 mitosis por 10 campos de gran aumento), la profundidad, la clasificación TNM, la presencia de metástasis y de recidiva local3,4.
El diagnóstico diferencial del SCC incluye tanto neoplasias epiteliales como mesenquimales variadas, aunque es de enorme dificultad determinarlo con una metástasis de un melanoma oculto y con el pecoma5. La identificación exacta de la entidad evita un tratamiento erróneo y permite establecer el pronóstico de la enfermedad (tablas 1 y 2).
Características inmunohistoquímicas y alteración cromosómica t(12;22)(q13;q129, en las piezas de resección descritas
| Caso 1 | Caso 2 | |
|---|---|---|
| HMB-45 | + | + |
| S-100 | + | + |
| Melan-A | + | + |
| Vimentina | + | + |
| Actina de músculo liso | − | − |
| Desmina | − | − |
| Citoqueratina (AE1/AE3) | − | − |
| CD34 | − | − |
| CD68 | − | − |
| Antígeno de membrana epitelial | − | − |
| t(12;22)(q13;q12) | + | − |
Diagnóstico diferencial de sarcoma de células claras con relación a melanoma y pecoma, de acuerdo con las características inmunohistoquímicas y alteraciones cromosómicas
| Sarcoma células claras | Melanoma | Pecoma | |
|---|---|---|---|
| S100 | + | + | ± |
| HMB-45 | + | + | + |
| MelanA | + | + | ± |
| MITF | + | + | + |
| Actina músculo liso | (+focal ocasional) | − | ± |
| Antigeno membrana epitelial | + | − | ± |
| Desmina | (+focal ocasional) | − | ± |
| Vimentina | + | + | + |
| T(12;22)(q13;q12) | + | − | − |
| Mutación BRAF | − | + | − |
| CD10 | − | + | +(cutáneo) |
Con relación al melanoma, el SCC se caracteriza por un crecimiento fusocelular o con nidos de células claras, pálidas, con unas características fenotípicas similares a las del melanoma maligno y que incluye la presencia de melanina, melanosomas, inmunotinción de S-100 y marcadores asociados al melanoma como HMB-45, melan-A y MITF1, como ocurrió en nuestra primera enferma.
La alteración genética t(12;22)(q13;q12), que permite la fusión genética EWS-ATF1, es la anomalía cromosómica que permitió diferenciar el SCC y el melanoma1,5. Los SCC que se localizan en el tracto gastrointestinal presentan una variante en la fusión del gen EWSR1-CREB11,5 mientras que las alteraciones genéticas más frecuentes del melanoma son las mutaciones en el gen BRAF (preferentemente en V600) y en el gen NRAS6.
El pecoma es un tumor mesenquimal formado por células epitelioides perivasculares (que pueden incluso infiltrar el músculo liso), expresa marcadores melanocíticos y puede tener un comportamiento variable, desde benignidad hasta alta malignidad2, como en nuestro segundo caso. Presenta un fenotipo histológico e inmunohistoquímico similar al SCC, aunque el pecoma cutáneo suelen expresar CD10, lo cual es muy útil para su diagnóstico diferencial7. La inmunotinción negativa de actina de músculo liso y desmina permite distinguir estas entidades, así como identificar la translocación cromosómica t(12;22)(q13;q12)2, como en nuestro segundo caso, donde sirvió para descartar el diagnóstico de SCC. Se han descrito alteraciones genéticas que afectan a la activación del complejo mTORC, por lo que podría tratarse con sirólimus (inhibor de mTORC)8.
El tratamiento del SCC consiste en la extirpación radical del tumor y no existen datos que justifiquen una terapia adyuvante generalizada9.
La radioterapia se usa en pacientes con márgenes afectos10. La quimioterapia puede ser beneficiosa en pacientes con enfermedad metastásica10.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.