El prurito es el síntoma principal en múltiples enfermedades dermatológicas y sistémicas. La dermatitis atópica, la psoriasis, la dermatitis de contacto, la urticaria, el liquen simple crónico, la micosis fungoides, las cicatrices, las enfermedades autoinmunes, la enfermedad renal o hepática crónica, entre otras, asocian prurito que puede requerir un manejo terapéutico distinto. Aunque los antihistamínicos parecen ser la primera línea de tratamiento, en realidad su papel queda limitado a la urticaria y reacciones por fármacos, ya que los mecanismos fisiopatológicos de cada una de las entidades tratadas a lo largo de este manuscrito serán distintas. En estos últimos años han aparecido nuevas moléculas para el tratamiento del prurito, con perfiles de eficacia y seguridad muy atractivos para su uso en práctica clínica. Sin duda, es un momento crucial para el desarrollo de la dermatología en el campo del prurito, y una oportunidad para ser más exigentes con los objetivos a alcanzar en estos pacientes.
Pruritus is the main symptom of many dermatologic and systemic diseases. Atopic dermatitis, psoriasis, contact dermatitis, urticaria, lichen simplex chronicus, mycosis fungoides, scars, autoimmune diseases, kidney or liver diseases among others are all associated with itch that may require different approaches to management. Although antihistamines seem to be the first line of therapy, in reality their role is limited to urticaria and drug-induced reactions. In fact, the pathophysiologic mechanisms of each of the conditions covered in this review will differ. Recent years have seen the emergence of new drugs whose efficacy and safety profiles are very attractive for the management of pruritus in clinical practice. Clearly we are at a critical moment in dermatology, in which we have the chance to be more ambitious in our goals when treating patients with pruritus.
Los tratamientos biológicos dirigidos frente a las citoquinas de la vía Th2 como la IL-4, IL-13 o la IL-31, los agonistas/antagonistas de los opioides, los antagonistas del receptor de la NK-1, los GABAérgicos como pregabalina o gabapentina, los inhibidores de la JAK1 como upadacitinib, abrocitinib y baricitinib, los anti-IL-17 como el ixekizumab, la fototerapia o los inmunosupresores clásicos como la ciclosporina, forman parte del arsenal terapéutico disponible actualmente. A continuación se detallarán los tratamientos recomendados según la enfermedad de origen.
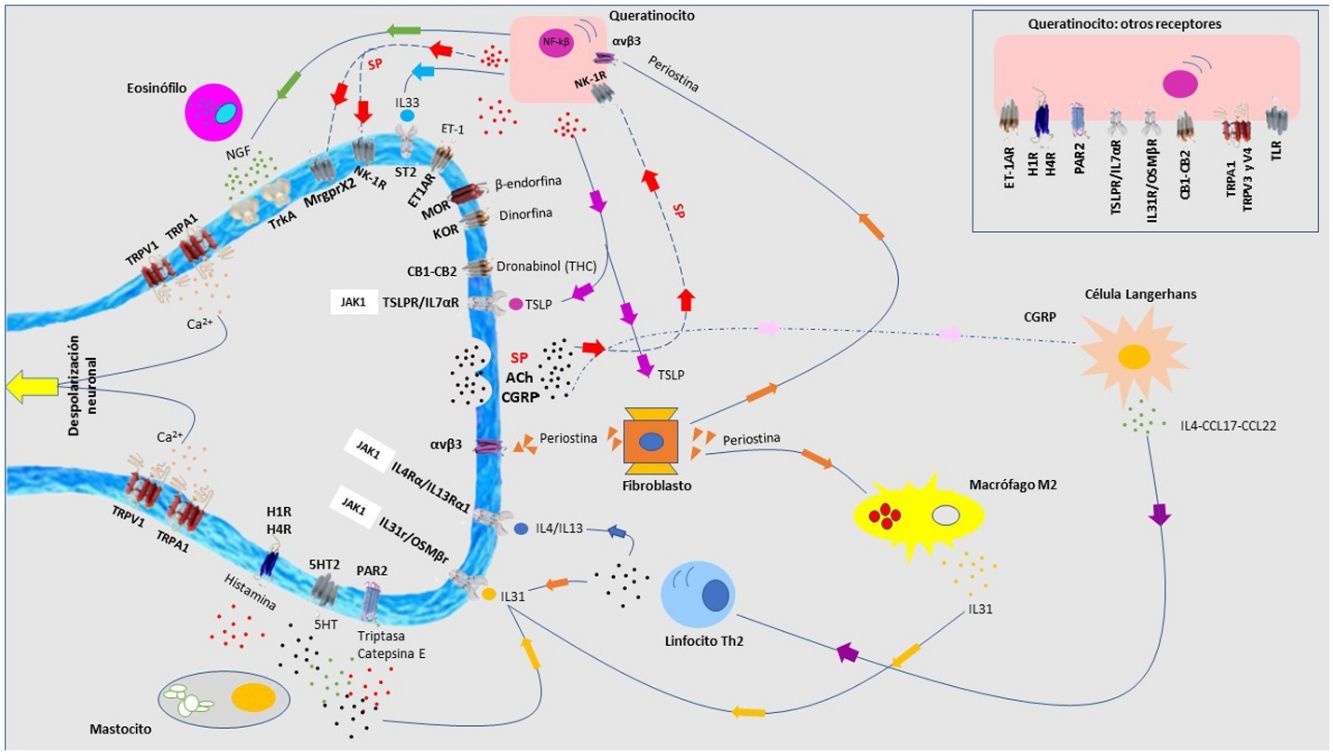
Dermatitis atópicaEl prurito forma parte de los criterios diagnósticos de la dermatitis atópica (DA). Entre el 87-100% de los pacientes lo sufren1. Es principalmente no histaminérgico. Citoquinas como la IL-4, IL-13, IL-31 y el TSLP son mediadores pruritógenos importantes en la DA2. La señalización intracelular es principalmente por JAK13, aunque los receptores cannabinoides CB1 y CB2, o los receptores opioides KOR también se han identificado. Los antagonistas NK-1 mejoran el prurito sin mejorar el eczema. Existe una sobreexpresión de PAR24 y de TRPV35. El TRPV3 aumenta la expresión de SERPIN E1 (adipoquina del queratinocito), predominantemente en piel seca, inducida por la liberación de polipéptido natriurético b (PPNB) en las terminaciones nerviosas. El péptido relacionado con el gen de la calcitonina (CGRP) y la sustancia P (SP) también están sobreexpresados.
Los péptidos antimicrobianos participan en la neuropoyesis cutánea. Catelicidina LL-37 aumenta la expresión de semaforina A, y las β-defensinas inhiben la producción de factores de crecimiento como el NGF o artemina6. También inducen la secreción de citoquinas pruritógenas como IL-4, IL-13 o IL-31. Este ambiente neuroinflamatorio, la hiperinervación cutánea y la excitación desproporcionada de las terminaciones nerviosas da lugar a la sensibilización al prurito en pacientes con DA, marcada por una hiperactividad en el tálamo, la corteza prefrontal y cingulada7,8.
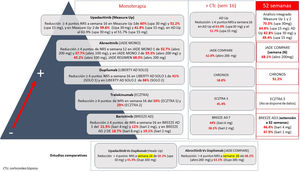
Resulta complicado comparar los resultados respecto a la mejora del prurito en los distintos ensayos clínicos publicados para el tratamiento de la DA con nuevas moléculas, que encontrará detallado en la figura 1. Upadacitinib oral muestra mejores resultados tanto en monoterapia, en combinación con corticoides, como a 52 semanas. Existen datos de dupilumab a 4 años, con una mejoría en NRS≥4 puntos respecto al basal en el 69% de los pacientes9, y con tralokinumab a 3 años (datos no publicados) en un 58% de los pacientes. Lebrikizumab, no incluido por no estar comercializado, muestra una reducción de NRS≥4 puntos a 16 semanas en el 70% de los pacientes10. Considerar el tratamiento del prurito en pacientes con DA todavía puede considerarse una necesidad no cubierta, donde la combinación con antagonistas de NK-1R, GABAérgicos, e incluso derivados opioides pueden romper el ciclo de picor-rascado y alcanzar un NRS de 0-1.
Dermatitis de contacto alérgicaLa chemoquina CXCL10, inducida por la secreción de INFγ, se ha relacionado con el prurito de la DAC11. IL-31 y TSLP también actúan como pruritógenos. Se ha detectado una sobreexpresión de MrgprX2. Los alérgenos son capaces de inducir respuestas inflamatorias distintas12. Las fragancias estimulan la vía inflamatoria de tipo 2, mientras que el níquel o las isotiazolinonas la vía de tipo 1. Esto plantea la posibilidad del tratamiento dirigido con moléculas como dupilumab, por ejemplo.
Prurito por reacciones a fármacosEn torno al 5% de los casos de prurito tienen origen farmacológico. Puede ser por metabolitos pruritógenos, fotodermatosis, hepatotoxicidad o xerosis. En la tabla 1 encontrará una lista de los principales fármacos inductores de prurito13.
Principales fármacos relacionados con la inducción del prurito
| Antibióticos | Penicilina G, amoxicilina, ampicilina, cefotaxima, ceftazidima, eritromicina, ciprofloxacina, vancomicina, clindamicina, tetraciclinas, minociclina, metronidazol, rifampicina, trimetoprima/ sulfametoxazol, antifúngicos, antipalúdicos (cloroquina, hidroxicloroquina, mepacrina) |
| Cardiovasculares | Amlodipino, diltiazem, verapamilo, clonidina, metildopa, amiodarona, captopril, enalapril, lisinopril, candesartán, irbesartán, flecainida |
| Hipolipemiantes | Clofibrato, fenofibrato, fluvastatina, pravastatina, lovastatina, simvastatina |
| Hipoglucemiantes | Metformina, gliclazida, tolbutamida, glimepiride |
| Uricosúricos | Alopurinol, colchicina, probenecid, tiopronin |
| Neurolépticos, antiepilépticos y antipsicóticos | Amitriptilina, citalopram, fluoxetina, paroxetina, sertralina, carbamazepina, fenitoína, topiramato, clorpromazina, fenotiazina, risperidona, haloperidol, clorpromazina |
| Opioides y analgésicos | Morfina, codeína, fentanilo, oxicodona, tramadol, aspirina, celecoxib, diclofenaco, ketoprofeno, naproxeno, piroxicam |
| Inmunosupresores | Metotrexate, ciclosporina, ciclofosfamida, micofenolato de mofetilo, tacrolimus, talidomida |
| Hormonas | Danazol, estrógenos, progesterona, testosterona, corticoides, tamoxifeno, clomifeno, anticonceptivos orales |
| Terapias oncológicas y biológicas | 5-Fluoracilo, clorambucilo, gemcitabina, nilotinib, vemurafenib, paclitaxel, tamoxifeno, temsirolimus, ipilimumab, cetuximab, erlotinib, rituximab, panitumumab, gefitinib, adalimumab, infliximab |
| Miscelánea | Enoxaparina, hidroxietil almidón (HES), contraste yodado, pentoxifilina, ticlopidina, interleucina-2, antitiroideos |
Prurito principalmente histaminérgico donde mastocitos y basófilos orquestan el proceso. Recientemente la IL-414 y el CGRP han sido reconocidos como mediadores pruritógenos en urticaria. Actualmente en desarrollo nuevas dianas como Mrgpr15, tirosin kinasa de Bruton (BTK)16 o tirosin kinasa del bazo (SYK)17, parece ser prometedoras. Dupilumab ha mostrado resultados significativos para esta entidad18, así como biológicos que actúan contra la IL-519.
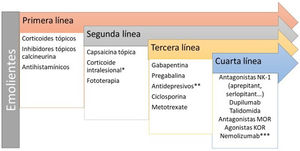
Liquen simple crónicoLa expresión de neuronas GRPR+ y de TRPV1 y TRPA1 está aumentado. Se ha planteado una neuropatía de fibra pequeña secundaria a una expresión disminuida de NGF20. El rascado crónico induce la liberación de pruritógenos por el queratinocito secundario al daño directo sobre la barrera epidérmica. El infiltrado inflamatorio es predominantemente de tipo 2. La IL-31 es la citoquina responsable de la cronicidad del prurito. Los tratamientos recomendados están en la figura 2.
PsoriasisEl 60-90% de los pacientes refieren prurito21. Existe una sobreexpresión de SP, TSLP e IL-3122, frente a una expresión disminuida de KOR/dinorfina y NPY. El CGRP participa en la inducción del prurito en las terminaciones nerviosas. Las neuronas del ganglio de la raíz dorsal expresan receptores para IL-1723. Hasta el 70% de los pacientes tratados con ixekizumab mostró una reducción del prurito24. Bimekizumab obtiene un 32,2% a la semana 16 y un 60% a la semana 48 de puntuación de prurito 0 registrado mediante la escala P-SIM25. La IL-22 parece activar neuronas GPRP+ y potenciar la señal pruritógena. Aquellos pacientes con prurito refractario pueden beneficiarse de antagonistas del receptor Nk-1 o derivados opioides.
Micosis fungoides/síndrome de Sezary (SS)Hasta el 88% de los pacientes refieren prurito26. Considerado un factor de peor pronóstico, es más frecuente en variantes como la foliculotropa27 y en estadios avanzados de la enfermedad. La IL-31 y la SP son los principales pruritógenos. En el SS se han detectado niveles elevados de IL-4, IL-2 e INFγ28. Se ha descrito cierta polarización hacia Th2, lo que podría justificar la eosinofilia (factor de peor pronóstico)29. Sin embargo, pacientes tratados con dupilumab han mostrado un empeoramiento de la enfermedad30. Otros mediadores implicados son PAR2, neuronas GRPR+ o el disbalance opioide MOR/KOR31. Aprepitant32 ha mostrado resultados significativos en la reducción del prurito (posología 125-80-80mg/cada 2 semanas). Mirtazapina, GABAérgicos, derivados opioides o talidomida deben considerarse como adyuvante al tratamiento de base.
Prurito en cicatrices/queloidesMediante transcriptomica se ha demostrado un microambiente inflamatorio neurogénico, con predominio de linfocitos Th2 y mastocitos. El NGF y la SP están sobreexpresados, así como niveles elevados de IL4Rα, triptasa y periostina33. La desviación de macrófagos hacia M2 potencia la respuesta inflamatoria de tipo 2, estimulando la secreción de TGF-β por el fibroblasto, que a su vez induce la liberación de IL-31. Las pruebas de provocación termosensoriales han demostrado una alteración de las fibras C. Existe una reducción de la densidad de fibras nerviosas intraepidérmicas. Tanto la fototerapia34 como dupilumab35 disminuyen significativamente el prurito. En la tabla 2 encontrará los distintos tratamientos.
Tratamientos disponibles para el prurito en cicatrices queloideas
| Tratamiento | Efecto/diana terapéutica |
|---|---|
| Corticoides intralesionales (acetónido triamcinolona) | Vasoconstricción, aumenta la actividad de colagenasa, actividad antimitótica de fibroblastos, reduce la expresión de IL-31 y de IL-13 |
| Crioterapia | Necrosis tisular por congelación |
| Toxina botulínica A | Inhibe la expresión del factor de crecimiento tejido conectivo, reduce los niveles de la sustancia P |
| Gabapentina | Agonista interneuronas inhibitorias centrales, disminuye el prurito de tipo neuropático |
| Terapia oxígeno hiperbárico | Reduce el ambiente inflamatorio, vasodilatador, disminuye la expresión de TRPV1 |
| Láser de luz pulsada | Inhibe la expresión del factor de crecimiento del tejido conectivo |
| 5-Fluoracilo | Inhibe la proliferación celular e induce la apoptosis de los fibroblastos |
| Parches de silicona | Aumenta la hidratación epidérmica (disminuye la actividad fibroblástica) |
IL-13: interleucina-13; IL-31: interleucina-31; TRPV1: receptor de potencial transitorio V1.
Hasta el 57% de los pacientes con enfermedades del tejido conectivo sufren prurito, secundario a la liberación de pruritógenos o inducido/agravado por la ingesta de fármacos como los antipalúdicos o los antagonistas del calcio.
- A.
Dermatomiositis (DM): Hasta el 90% de los pacientes sufren prurito36, principalmente en áreas fotoexpuestas. La intensidad del prurito se correlaciona con la gravedad de la DM. No existen diferencias entre la forma clásica y la amiopática. Aparece de forma premonitoria, durante la enfermedad o paraneoplásico. La IL-31 se ha identificado como pruritógeno37. La reducción de las fibras nerviosas intraepidérmicas sin cambios en las fibras peptidérgicas sugirieren una posible neuropatía de pequeña fibra38.
- B.
Esclerosis sistémica: El 62,3% refieren prurito39, de características neuropáticas, principalmente en cabeza, tronco y brazos. Estos pacientes asocian mayor afectación cutánea, gastrointestinal, y/o pulmonar. La cronicidad del prurito se ha relacionado con la positividad a los anticuerpos anti-centrómero40. Existe una regeneración de fibras C y un aumento de la población neuronal.
- C.
Lupus eritematoso cutáneo: El 76,8% experimentan prurito, la mitad de intensidad moderada-grave41. El cuero cabelludo es la localización más frecuente. Se ha detectado una disminución del número de fibras pequeñas y una disminución de las fibras nerviosas intraepidérmicas42. La fotosensibilidad y el uso de antipalúdicos son factores desencadenantes. Estos pacientes muestran niveles elevados de IL-3143.
- D.
Morfea: Entre el 46-52,2% presentan prurito44, más prevalente en adultos que en niños. La mejoría con fototerapia UVA1 sugiere una inflamación neurógena mediada por citoquinas.
- E.
Síndrome de Sjögren: Hasta el 38,3-41,6% asocian prurito45, sobre todo la forma primaria. Es la segunda manifestación cutánea más frecuente después de la xerosis. Se ha descrito una neuropatía de fibra pequeña46. El prurito paraneoplásico debería considerarse por el riesgo de linfomas y cáncer de tiroides47.
Los tratamientos recomendados para el prurito en estos pacientes como adyuvante al tratamiento de base son apremilast, gabapentina, pregabalina, naltrexona o talidomida. Los inhibidores JAK orales y tópicos parecen ser prometedores.
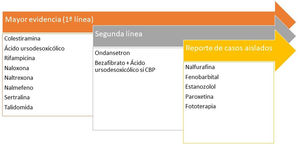
Prurito y enfermedad renal crónicaEl prurito de intensidad moderada-grave se presenta en el 38,2% de los pacientes hemodializados48, aumentando la mortalidad hasta en un 17%49. Existen 4 teorías que lo justificarían50: depósito de la toxina, neuropatía periférica, disregulación inmune y disbalance opioide. Recientemente se ha sugerido el p-cresilsulfato y el indoxilsulfato como d2os toxinas urémicas que pueden estar implicadas tanto en el prurito como con consecuencias cardiovasculares51. En la figura 352,53,54 encontrará los tratamientos recomendados.
Tratamientos recomendados para el prurito en la enfermedad renal. *A pesar de que los paneles de expertos siguen recomendando ondansetrón en segunda línea, la última revisión Cochrane concluye que no es un fármaco eficaz en el tratamiento del prurito urémico54.
Prurito de localización palmoplantar, aunque puede ser generalizado. La cirrosis biliar primaria o colangitis esclerosante primaria muestran niveles elevados de autotaxina55, enzima que metaboliza la lisofosfatidilcolina en ácido lisofosfatídico capaz de activar TRPV4. Naltrexona ha demostrado ser eficaz en el prurito urémico56. La vía pruritógena más relevante es la unión de los ácidos biliares a MrgprX457. La rifampicina disminuye la actividad de la autotaxina58. En la figura 4 encontrará los tratamientos recomendados.
Prurito y embarazoEntre el 18-40% de las embarazadas experimentaran prurito en algún momento de la gestación59. A continuación, se resumen las más relevantes60. En la tabla 3 encontrará los tratamientos recomendados:
- A.
Erupción atópica del embarazo: Es la más frecuente. El 20% tienen antecedentes de DA. Predomina la inflamación de tipo 2. Suele comenzar en el segundo/tercer trimestre. Dos formas principales de presentación: forma eczematosa localizada en cara, cuello, preesternal y flexural; y la forma tipo prurigo en superficies de extensión y en tronco. Existe riesgo de complicaciones infecciosas como el eczema herpeticum. No existe riesgo fetal.
- B.
Erupción polimorfa del embarazo: Cuadro autolimitado de pápulas y placas urticariales pruriginosas. Suele comenzar en el tercer trimestre o posparto inmediato. Las lesiones eczematosas se localizan en el abdomen (sobre estrías si existen) y región periumbilical, sin ampollas. Puede confundirse con un estadio inicial de penfigoide gestationis. No existe riesgo fetal.
- C.
Penfigoide gestationis: Enfermedad infrecuente autolimitada con autoanticuerpos IgG frente a la proteína BP180. La recurrencia en embarazos sucesivos es del 30-50% de los casos, de inicio más precoz y grave. Pápulas y placas urticariales polimorfas en la región periumbilical, abdomen y extremidades. Puede afectar a mucosas. La biopsia con IFD muestra un depósito lineal de IgG y C3 en la unión dermoepidérmica. Mediante ELISA pueden detectarse los anticuerpos (E: 94-98%; S: 86-97%). Es considerado un embarazo de alto riesgo. Existe riesgo fetal.
- D.
Colestasis intrahepática: Afecta al 0,3-5,6% de las mujeres embarazadas. Las sales biliares son el principal pruritógeno. Aparece en el segundo/tercer trimestre por activación del receptor MrgprX4. Determinar los niveles de ácidos biliares en sangre materna son clave para el diagnóstico. Si la concentración de sales biliares en sangre es >100mmol/l y la gestación ha cumplido las 37 se puede plantear la inducción del parto. Existe riesgo fetal.
- E.
Dermatosis agravadas durante el embarazo: dermatitis atópica, psoriasis, dermatomiositis, urticaria, liquen plano, mastocitosis.
Tratamientos recomendados para las distintas dermatosis gestacionales que cursan con prurito
| Dermatosis gestacional | Primera línea | Segunda línea | Tercera línea |
|---|---|---|---|
| Erupción atópica del embarazo | EmolientesCorticoide tópico media potencia(Corticoides oralesa si brote grave) | Cetirizina, loratadina, levocetirizina (categoría B FDA)Fototerapiab | Ciclosporina (categoría C FDA)Azatioprina (categoría C FDA)Dupilumab (datos de RWE)c |
| Erupción polimorfa del embarazo | EmolientesCetirizina, loratadina, desloratadinaCorticoide tópico de media potencia | Corticoide oral (prednisona) | |
| Penfigoide gestationis | EmolientesCorticoide tópico alta potenciaCetirizina, loratadina, desloratadina | Corticoide oral (prednisona)Tacrolimus tópico (no más de 5g al día) | Azatioprina (categoría C FDA)Dapsona (categoría C FDA)dInmunoglobulinas intravenosasOmalizumab (categoría B FDA)DupilumabcRituximabe |
| Colestasis intrahepática del embarazo | Ácido ursodesoxicólico oral | Rifampicina (categoría C FDA) |
Glucocorticoides orales 0,5-2mg/kg/día con especial cuidado en el primer trimestre. Uso en pruritos incoercibles durante un periodo breve de tiempo. Se ha relacionado con hendidura palatina y con bajo peso al nacer. Aumenta el riesgo de diabetes gestacional, preeclampsia y parto prematuro con rotura prematura de membranas.
Durante el tratamiento con fototerapia es necesario suplementar ácido fólico 0,8mg/día porque con este tratamiento disminuyen los niveles de ácido fólico en sangre. Se recomienda fotoprotección facial para evitar melasma.
La experiencia actual es de práctica clínica real, y aunque actualmente los datos sugieren que dupilumab es un fármaco seguro durante la gestación, los expertos recomiendan una valoración de riesgo beneficio individualizada en cada paciente.
Prurito que aparece antes o durante el proceso tumoral, pero que no es consecuencia ni del infiltrado por células tumorales ni por el tratamiento administrado61. Desaparece tras remisión del tumor, y reaparece si hay recurrencia. Trastornos oncológicos hematológicos y gastrointestinales son los más frecuentes. Hasta el 5,9% de los casos es generalizado. El 30% de los pacientes con linfoma de Hodgkin, el 40% con trombocitosis esencial, el 15-50% de los no-Hodgkin y de policitemia vera (con el prurito acuagénico característico62, más intenso en portadores de la mutación de JAK2 V617F) asocian prurito. En la tabla 4 encontrará los distintos tratamientos recomendados.
Tratamientos recomendados para el tratamiento del prurito paraneoplásico. Téngase en cuenta las precauciones para seleccionar correctamente el perfil de paciente
| Fármaco | Posología | Precauciones principales |
|---|---|---|
| Hidroxicina | 25-50mg/noche | Insuficiencia hepática, insuficiencia renal, riesgo de convulsiones, riesgo de arritmia y prolongación de QT. Evitar ingesta de alcohol |
| Paroxetina | 5-20mg/día | Evitar con linezolid e IMAO (síndrome serotoninérgico), interacción con tamoxifeno, glaucoma, epilepsia inestable |
| Fluvoxamina | 25-100mg/día | Evitar con linezolid e IMAO (síndrome serotoninérgico), glaucoma, epilepsia inestable, prolongación QT, interacción con clopidogrel |
| Sertralina | 25-50mg/día | Evitar con pimozida y con IMAO, epilepsia inestable, riesgo de sangrado, insuficiencia hepática, insuficiencia renal |
| Amitriptilina | 25-100mg/noche | Infarto cardiaco reciente, evitar con IMAO, insuficiencia hepática grave, arritmia cardiaca, hipotensión, retención urinaria, hipertiroidismo |
| Doxepina | 50mg/noche | Estreñimiento, xerostomía, retención urinaria, arritmias, glaucoma, ictericia colestásica, hipertiroidismo |
| Mirtazapina | 15mg/noche | Evitar con IMAO, riesgo agranulocitosis, epilepsia inestable, insuficiencia hepática, insuficiencia renal, elevación de glucemia, enfermedades cardiacas, toxicodermia grave, evitar ingesta de alcohol |
| Gabapentina | 300-600mg/8h (máximo 3.600mg/día) | DRESS, pancreatitis aguda, epilepsia inestable, control si administración concomitante de opioides |
| Pregabalina | 75-600mg/día (dividido en 3 dosis) | Toxicodermia grave, mareo, somnolencia, visión borrosa, insuficiencia cardiaca congestiva, control si administración concomitante de opioides. Evitar consumo de alcohol |
| Talidomida | 50-200mg/día | Neuropatía periférica, teratogénico, fenómenos tromboembólicos, hipotiroidismo, toxicodermias graves, herpes zoster, leucoencefalopatía multifocal progresiva |
| Naloxona | 0,8-2mg/intravenoso | Dependencia física, náuseas, hipotensión, hipertensión, taquicardia, edema de pulmón |
| Naltrexona | 50-100mg/día | Insuficiencia hepática, dependencia física, evitar con talidomida, hidroxicina, doxepina, amitriptilina |
| Aprepitant | 125-80-80mg en ciclos cada 1 o 2 semanas | Interacciones farmacológicas (CYP3A4), hipo, estreñimiento, cefalea |
DRESS: Drug Reaction with Eosinophilia and Systemic Symptoms; IMAO: inhibidores de la monoaminooxidasa.
El infiltrado de linfocitos T, mastocitos y eosinófilos en la histopatología confirman un ambiente inflamatorio de tipo 2, donde citoquinas como la IL-4 y la IL-31 parecen jugar un papel importante, así como la IL-17 y la IL-2263. Se ha detectado la sobreexpresión de neuronas peptidérgicas SP+ y CGRP+. Existe una hiperinervación en la dermis y una reducción de la densidad de fibras nerviosas en la epidermis secundario al disbalance entre factores de crecimiento neuronal y de factores de repulsión64. Aunque no se ha incluido a los inhibidores JAK en la figura 5, recientemente se ha publicado un caso con buena respuesta a baricitinib65. Las terapias dirigidas frente a IL-31 han demostrado ser eficaces66. Nemolizumab es un anticuerpo monoclonal afín al receptor α de la IL-3167. La DA y el prurigo nodular son el principal foco terapéutico. Los resultados de la fase 3 para DA mostraron una reducción del 42,8% (combinado con corticoides tópicos) en la puntuación de prurito a las 16 semanas respecto a la basal (el placebo mostró una reducción del 20%)68. Los resultados de la fase 2 en prurigo nodular mostraron una reducción del 53% en semana 4 (frente al 20,2% en grupo placebo)69. Vixarelimab (KPL-716)70 es un anticuerpo monoclonal afín al OSMRβ de administración subcutánea que actualmente está activo (sin reclutamiento) en un ensayo en fase 2 para prurigo nodular.
Prurito y penfigoide ampollosoPredominio de un ambiente inflamatorio de tipo 2, cuya intensidad del prurito se correlaciona con el deposito dérmico de periostina, infiltrado de eosinófilos, basófilos y de linfocitos Th2. La IL-4 y la IL-31 actúan como pruritógenos. Dupilumab ha demostrado ser eficaz en esta dermatosis71.
Prurito anogenitalPuede ser una manifestación tanto de una dermatosis local como de una enfermedad sistémica72. En las formas agudas son más frecuentes en infecciones y dermatitis de contacto, mientras que las crónicas son psicógenas, neoplásicas, o dermatosis inflamatorias crónicas. Una anamnesis detalla y la realización de pruebas complementarias dirigidas son clave para un correcto enfoque terapéutico. La zona requiere cuidados especiales como baños de asiento, evitar el papel higiénico, secado de la zona sin fricción intensa, evitar las toallitas húmedas y otros desinfectantes, uñas cortas, evitar café, chocolate, cítricos, refrescos y alimentos ricos en lácteos, y el uso pomadas de óxido de cinc 10-20% varias veces al día.
El tratamiento de la causa, la aplicación de corticoides tópicos, ITC, antifúngicos, anestésicos locales como lidocaína, e incluso capsaicina al 0,006% tópica son algunas de las recomendaciones. El uso de ISRS (sertralina, paroxetina, fluoxetina), amitriptilina, doxepina, mirtazapina, o la inyección de azul de metileno al 0,5-1% se reservan para casos refractarios73. La fisioterapia del suelo pélvico es una opción interesante para prurito genital femenino idiopático.
Cuidados básicos (generales) del paciente con prurito- -
Evitar el tabaco, alcohol, cafeína y otros estimulantes, picantes y el estrés.
- -
Ducha mejor que baño, con agua tibia y durante un máximo de 10 min.
- -
Ducha con jabones sin detergentes (syndet), aceites de ducha, o crema lavante. Evitar el uso de productos perfumados y de sustancias irritantes como el sodium lauril sulfato. Así mismo, preferiblemente utilizar jabones de pH neutro.
- -
Cremas emolientes o bálsamos hipoalergénicos, libres de fragancias y evitando conservantes de elevado poder de sensibilización como las isotiazolinonas. Pueden contener como ingredientes sustancias calmantes (ver más adelante).
- -
Ropa suave y holgada de algodón, evitar materiales sintéticos y ajustados.
Loción de mentol al 1% 3-4 veces al día (actúa a través de TRPM874). A partir de 2 años de edad:
- -
Anestésicos tópicos. Aplicación en áreas localizadas no muy extensas por riesgo de efectos sistémicos. Hay que tener cuidado con la sensibilización a estos productos.
- -
Polidocanol al 2-10% es un surfactante no iónico utilizado en escleroterapia con propiedades hidratantes y anestésicas.
- -
Formula magistral de lidocaína al 2,5-5% + amitriptilina al 5% + ketamina al 5-10% crema75 transdérmica o/w. Aplicar 3 veces/día, nunca más del 30% de la superficie corporal.
- -
Pramoxina al 1% loción, crema, espuma, geles. Aplicar 3-4 veces al día.
- -
Lidocaína al 2-5%. Aplicar 2-4 veces al día. Cuidado con la metahemoglobinemia si se aplica dosis altas de Emla® (lidocaína + procaína) en pacientes jóvenes.
Antihistamínicos tópicos. No se recomiendan en niños:
- -
Difenhidramina al 1-2%, 3-4 veces al día. La fotosensibilidad y la urticaria por sensibilización son los efectos adversos más frecuentes.
- -
Doxepina al 5% crema 4 veces al día, separadas al menos 3-4h entre aplicación. Riesgo de dermatitis de contacto, efectos anticolinérgicos o sensación local de quemazón/picazón. No debe aplicarse más del 10% de la superficie corporal.
Antiinflamatorios tópicos y capsaicina:
- -
Corticoides tópicos. Pueden combinarse con curas húmedas o infiltrarse (ácetonido triamcinolona) en lesiones gruesas. Los de potencia muy alta asocian mayor riesgo de estrías y supresión del eje hipofiso-suprarrenal.
- -
Inhibidores tópicos de la calcineurina (ITC). Tacrolimus y pimecrolimus. Se aplican 2 veces al día. Asocian prurito o sensación de quemazón local durante las primeras aplicaciones, que puede disminuir con la administración de aspirina 500mg inicialmente y evitar el consumo de alcohol durante el tratamiento.
- -
Capsaicina al 0.025% crema76. La aplicación repetida (3-4 veces al día; se tolera mejor si se aplica Emla® 30 o 60min antes) induce la activación del TRPV1 con la posterior depleción de SP, desensibilizando las fibras nerviosas. Indicado en prurito neuropático (notalgia parestésica, prurito braquiorradial, purito neurálgico post-herpético). También en prurito acuagénico, urémico o prurigo nodular.
Fármacos afines a H1R cuyo mecanismo es competitivo con la histamina. Son recomendados como primera línea en la mayoría de situaciones. Cetirizina y rupatadina inhiben la acción de PAF77, cetirizina y desloratadina disminuyen la secreción de IL-4 e IL-1378, fexofenadina inhibe la liberación de triptasa, o la ebastina la inhibición de la vía inflamatoria mediada por los linfocitos Th279.
FototerapiaTanto UVB-BE (311nm) como UVA1 (340-400nm) son considerados de segunda línea en múltiples dermatosis que asocian prurito. UVA1 disminuye los niveles de IL-4 e IL-13 y de IL-17 e IL-2380. La exposición repetida a dosis suberitematógenas tanto de UVA1 como de UVB-BE disminuyen la concentración de IL-31, mientras que dosis altas muestran el efecto contrario, sobre todo con UVB. Se ha demostrado una reducción de la degranulación de mastocitos dependiente de IgE y la disminución de la migración de las células de Langerhans a la epidermis. Otro de los hallazgos en la disminución de la expresión de MOR y el aumento de dinorfina con la fototerapia. La fototerapia ejerce un papel neuromodulador disminuyendo la liberación de NGF y aumentando la semaforina A, esto da lugar a una disminución de la densidad de fibras nerviosas intraepiteliales81. Con lámparas excimer también se disminuye la densidad de fibras nerviosas intraepiteliales.
Derivados opioidesLos antagonistas del receptor mu (MOR) y los agonistas de kappa (KOR) han demostrado ser de gran utilidad por su papel regulador central del prurito. En la tabla 582-90 encontrarán detalladamente información sobre esta útil herramienta antipruriginosa.
Opioides, mecanismo de acción y usos en prurito
| Mecanismo de acción | Fármaco | Vía de administración | Indicación en ficha técnica | Usos fuera de indicación en prurito |
|---|---|---|---|---|
| Agonistas KOR | Difelikefalina39 | Parenteral | Prurito urémico en pacientes con hemodiálisis | |
| Nalfurafina40 | Parenteral | Colestásico y prurito de origen hepático | ||
| Nalmefeno41 | Comprimidos | Reducción del consumo de alcohol | Colestásico | |
| Agonista KOR/antagonista MOR | Nalbufina42 | Parenteral | Dolor | Prurito urémico en pacientes con hemodiálisisPrurigo nodular46 |
| Butorfanol43 | Parenteral/intranasal | Dolor | Prurito intratableColestásico | |
| Antagonista MOR/antagonista KOR | Naloxona44 | Parenteral | Reversión efectos secundarios de los opioides o intoxicación | Inducido por fármacosPrurito braquiorradialColestásico |
| Naltrexona45 | Comprimidos | Alcoholismo, deshabituación opiácea | Inducido por fármacosColestásicoHaley-HaleyLiquen plano pilarPsoriasisDarier |
Resultados publicados para prurito urémico, colestático o paraneoplásico. El efecto máximo se alcanza a las 4-6 semanas. Los efectos secundarios limitan su uso, sobre todo para los ISRS y mirtazapina. En prurito neuropático son menos eficaces que pregabalina o gabapentina. El análisis de 35 estudios detalló los siguientes resultados (tabla 6)91:
Principales antidepresivos utilizados para el tratamiento del prurito
| Fármaco | Dosis | Usos en práctica clínica |
|---|---|---|
| Fluoxetina (ISRS) | 20mg/día | Prurito acuagénico |
| Fluvoxamina | 25-100mg/día | Prurito crónico en pacientes con DA, linfomas, paraneoplásico, pacientes psiquiátricos |
| Paroxetina | 20mg/día | Prurito de origen desconocido, prurito psicógeno, paraneoplásico |
| Sertralina | 75-100mg/día | Prurito urémico y prurito colestásico |
| Amitriptilina | 25mg/día | Prurito braquiorradial, liquen amiloidosis, prurito urémico, notalgia parestésica, prurito post-ICTUS, micosis fungoides, VIH |
| Doxepina | 10-20mg/día | Prurito urémico, prurito de origen desconocido |
| Nortriptilina | 75mg/día | Prurito vulvar de origen desconocido |
| Mirtazapina | 15-30mg/día (por la noche) | Prurito somatomorfo, de origen desconocido, paraneoplásico, prurito nocturno de origen desconocido |
DA: dermatitis atópica; ISRS: nhibidores selectivos de la recaptación de serotonina; VIH: virus de la inmunodeficiencia humana.
Más información y publicaciones en casos de prurigo nodular refractario92. Dosis de talidomida de 50-300mg/día, con dosis media es del 100mg/día, seguido de fototerapia UVB-BE. Buen perfil en paciente oncológico y con VIH. Principales inconvenientes la teratogenicidad y la neuropatía. Lenalidomida es una opción interesante dada la bajada de precio y la menor tasa de neuropatía.
Apremilast/difamilast/roflumilastApremilast está indicado en psoriasis, artritis psoriásica y enfermedad de Behçet. Tanto en DA como en prurito de origen desconocido no mostró resultados significativos93. Difamilast pomada está en desarrollo para la DA94. El uso de roflumilast oral fuera de ficha técnica ha sido publicado para eczema numular95 o hidrosadenitis supurativa96. Roflumilast crema está en desarrollo para la psoriasis97.
AntineurálgicosLos análogos del ácido gamma aminobutírico, gabapentina y pregabalina, son recomendados para el prurito de tipo neuropático como el braquiorradial, el prurito colestásico y urémico, o el prurito de origen desconocido98. Disminuye la liberación de SP o CGRP 99, y aumenta la capacidad inhibitoria de las interneuronas GABA+. Se une a la proteína α2δ de los canales de calcio dependientes de voltaje. La dosis de gabapentina es de 300mg/cada 8h (dosis máxima 3.600mg/día) y de pregabalina 75mg/día e incrementar hasta 225mg/día según tolerancia (dosis máxima 300). Se debe realizar una desescalada de dosis previa a la retirada del fármaco.
Inmunosupresores clásicosUso ampliamente extendido en dermatología como ahorradores de corticoides100 o bien en monoterapia. Es necesario conocer bien las peculiaridades de cada uno de ellos101:
- A.
Ciclosporina. Indicación en ficha técnica para DA a partir de 16 años a dosis de 3-5mg/kg/día repartidas en 2-3 dosis. Inhibe el infiltrado linfocitario, eosinófilos y mastocitos, inhibe la expresión de NK1-R y de IL-31R, inhibe la secreción de IL-31, e inhibe la elongación de las fibras nerviosas intraepidérmicas102. Por su mecanismo de acción, el prurito neuroinflamatorio es considerado el que mejor respuesta presenta. Hasta un 78% de los pacientes tratados refieren disminución del prurito103.
- B.
Metotrexato. Indicación en ficha técnica para psoriasis. La dosis media utilizada es de 15mg/semanal. Su mecanismo antiinflamatorio lo posiciona para el tratamiento del prurito neuroinflamatorio, incluso a dosis bajas. Ha demostrado buenos resultados en casos de POD en edad avanzada104 y en el prurigo nodular105.
- C.
Azatioprina. No tiene en ficha técnica ninguna indicación en dermatología. Ha demostrado reducción del picor significativa en pacientes con prurito de difícil manejo106 y en cirrosis biliar primaria.
- D.
Micofenolato mofetilo. Profármaco del ácido micofenólico que inhibe la inosina-5’-monofosfato deshidrogenasa y disminuye la proliferación de linfocitos T y B que puede ser de utilidad en pacientes con prurito neuroinflamatorio como en la DA107 o enfermedades autoinmunes.
Aprepitant108 es el que más utilizado ha sido y el que más publicaciones tiene. Se dispensa en blíster de 3 comprimidos (125-80-80mg). No está definida la posología, ya que hay publicaciones con ciclos de 3 comprimidos/cada 1 o 2 semanas, u 80mg/día. Aunque con resultados controvertidos, las mejores respuestas se han observado en prurito paraneoplásico109 o secundario a fármacos oncológicos110. Serlopitant111 parece superior a aprepitant. La dosis de 5mg para prurigo nodular ha mostrado reducciones significativas de prurito comparado con placebo. Los resultados del estudio EPIONE en 2021 no mostraron resultados significativos en DA con tradipitant112, motivo por el que actualmente está en estudio para trastornos gastrointestinales.
AntibióticosDoxiciclina y minociclina. Asocia un efecto antipruriginoso y neuroprotector por regulación de la población de células microglía en la asta posterior intramedular113. La doxiciclina inhibe PAR2 implicada en la mediación del prurito.
Eritromicina y azitromicina. Han demostrado ser eficaces en el prurito asociado a formas atípicas de pitiriasis rosada114 o pitiriasis liquenoide crónica115. El efecto inmunomodulador se atribuye a la interacción con fosfolípidos y con los factores de transcripción AP-1, NFκB y citoquinas proinflamatorias.
Antagonistas del receptor de la serotonina 5-HT3Ondansetrón, topisetrón y granisetrón han sido utilizado de forma anecdótica con resultados contradictorios. Salvo en enfermedad renal crónica y prurito colestásico, en el resto no se recomiendan.
ConclusionesRomper el ciclo de picor-rascado puede ser un reto terapéutico, donde la clave del éxito será seleccionar correctamente el tratamiento en cada paciente.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.