La aplicación del plasma rico en plaquetas ha experimentado un notable auge en los últimos años en una amplia variedad de enfermedades y situaciones clínicas. Su empleo en dermatología va más allá de su asociación con el envejecimiento facial. En la literatura se pueden encontrar series de casos y estudios controlados que muestran buenos resultados en aplicaciones diversas, como las úlceras cutáneas y, más recientemente, la alopecia. Sin embargo, estas indicaciones no están reconocidas en la ficha técnica en el momento actual, a falta de poder demostrar sus beneficios reales con mayor evidencia científica. Ante la expansión en el uso de esta técnica resulta fundamental el conocimiento de sus fundamentos biológicos y la evaluación de la calidad y de los resultados de los trabajos que estudian su aplicación en diferentes enfermedades cutáneas.
In recent years, the use of platelet-rich plasma has increased notably in a range of diseases and settings. Uses of these products now go beyond skin rejuvenation therapy in patients with facial ageing. Good outcomes for other dermatological indications such as skin ulcers and, more recently, alopecia have been reported in case series and controlled studies. However, these indications are not currently included in the labeling given that stronger scientific evidence is required to support their real benefits. With the increased use of these products, dermatologists need to become familiar with the underlying biological principles and able to critically assess the quality and outcomes of the studies of these products in different skin diseases.
A pesar de que la primera asociación del plasma rico en plaquetas (PRP) se realiza con la medicina estética, predominantemente el envejecimiento facial, y se muestre como una técnica aparentemente novedosa, se trata de un tratamiento empleado desde hace años en múltiples áreas de la medicina. Desde una perspectiva histórica, en la década de los años 80 del pasado siglo comenzó a aplicarse el PRP en medicina regenerativa, al descubrirse la liberación de moléculas bioactivas con acción en tejidos dañados como las úlceras cutáneas1. Una década más tarde se comenzó a utilizar en cirugía maxilofacial, aprovechando el potencial de adherencia y hemostasia de la fibrina2. La observación clínica permitió el descubrimiento de la función estimuladora de la proliferación celular y antiinflamatoria del PRP3.
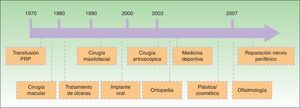
Desde la descripción por el Dr. Anituaen en 1999 de un método ambulatorio de obtención de PRP para su aplicación en implantología2 se han desarrollado diversas técnicas y sus aplicaciones se han multiplicado. Presentamos un eje temporal que recoge las diferentes aplicaciones (fig. 1). Existen al menos 16 sistemas de obtención de PRP comercializados en el momento actual.
Secuencia temporal de la aplicación del plasma rico en plaquetas en diferentes campos de la medicina3.
Esta aparente difusión contrasta con la escasa evidencia científica que avale las diferentes aplicaciones sugeridas. En la mayoría de estudios que se encuentran en la literatura se muestran los beneficios, en muchos casos muy llamativos, de la aplicación de PRP. Sin embargo, existen pocos ensayos clínicos de calidad que permitan establecer la magnitud de sus efectos. Además, ante la variabilidad metodológica existente hay poco consenso, lo que explica la ausencia de estandarización del empleo del PRP y, por tanto, la dificultad para generar evidencia científica fácilmente reproducible. En este contexto, la Agencia Española del Medicamento y Productos Sanitarios emitió un informe en mayo de 2013 con el objetivo de establecer el marco de uso del PRP en España, las obligaciones de sus fabricantes y la información que deben recibir los pacientes a quienes se les aplique. En este documento se reconoce el PRP como medicamento de uso humano4.
El objetivo de esta revisión es, en primer lugar, explicar el mecanismo de acción atribuido al PRP en la regeneración tisular y, en un segundo lugar, resumir la evidencia científica disponible en el momento actual para las diferentes indicaciones propuestas.
Las plaquetas en la regeneración tisularAdemás de su conocido papel en la hemostasia, las plaquetas desempeñan funciones esenciales en la regeneración de los tejidos. Seguidamente a la producción del daño tisular y vascular las plaquetas se activan y se agregan, circunstancia de la función hemostática que condiciona la secreción de proteínas y de otras moléculas biológicamente activas, que activarán cascadas de segundos mensajeros involucradas en el proceso de curación tisular. El fundamento teórico del beneficio biológico del PRP se basa en que, con una concentración superior a la fisiológica de plaquetas y proteínas plasmáticas se podría acelerar el proceso de reparación. Además, el reforzamiento de la malla de fibrina permitiría mantener la viabilidad de la liberación mantenida de las moléculas bioactivas5–8.
Definición de plasma rico en plaquetasNo hay consenso sobre la definición de PRP. Algunos investigadores han sugerido que por PRP se debería entender la fracción con concentración en plaquetas de 3 a 5 veces superior al nivel normal. Sin embargo, la definición más defendida en el momento actual es la que lo caracteriza como un volumen de plasma autólogo que contiene una concentración de plaquetas superior al nivel basal (150.000-350.000/μl)8.
En función del sistema utilizado variarán las concentraciones de plaquetas, leucocitos y factores de crecimiento del preparado. Consecuentemente, la nomenclatura PRP engloba las diferentes fracciones que se pueden obtener en función del método empleado: preparado rico en factores de crecimiento (PRGF), plasma rico en plaquetas y factores de crecimiento (PRPGF), plasma rico en plaquetas (PRP), plasma pobre en plaquetas (PPP), plasma rico en plaquetas y rico en leucocitos (LR-PRP), rico en plaquetas y pobre en leucocitos (LP-PRP).
Moléculas bioactivas del plasma rico en plaquetasAdemás de los conocidos factores de crecimiento, el PRP contiene otras moléculas bioactivas con papel importante en la cicatrización tisular. Entre ellas destaca el factor de crecimiento derivado de las plaquetas (PDGF), el factor de crecimiento transformante (TGF), el factor plaquetario 4 (PF4), la interleuquina (IL)-1, el factor angiogénico derivado de las plaquetas (PDAF), el factor de crecimiento endotelial (VEGF), el factor de crecimiento epidérmico (EGF), el factor de crecimiento endotelial derivado de las plaquetas (PDEGF), el factor de crecimiento de células epiteliales (ECGF) y el factor de crecimiento insulina-like (IGF). Estas moléculas, entre otras, promueven diferentes funciones importantes en el ambiente local de regeneración, como son la proliferación, la migración y diferenciación celulares y la angiogénesis. Es complicado delimitar las funciones específicas de cada factor, ya que muchos se solapan (tabla 1).
Clasificación y funciones de las moléculas bioactivas presentes en el plasma rico en plaquetas
| Categoría | Proteínas | Función |
|---|---|---|
| Proteínas adhesivas | Factor Von Willebrand, fibrinógeno, fibronectina, vitronectina, laminina-8 | Interacción celular, hemostasia, composición de la matriz extracelular |
| Factores de coagulación y proteínas asociadas | Factor V/Va, multimerina, proteína S, quininógeno de alto peso molecular, antitrombina iii, inhibidor de la vía del factor tisular | Producción de trombina y su regulación |
| Factores fibrinolíticos y proteínas asociadas | Plasminógeno, alfa 2 antiplasmina, glucoproteína rica en histidina, alfa 2 macroglobulina | Producción de plasmina y remodelado vascular |
| Proteasas y anti-proteasas | Inhibidores de metaloproteasas 1-4 (TIMP 1-4), metaloproteasas 1, 2, 4, 9, inhibidor C1, alfa 1 antitripsina | Angiogénesis, modelado vascular, regulación de la coagulación |
| Factores de crecimiento | PDGF, TGF-beta 1 y 2, EGF, IGF-1, VEGF, bFGF, HGF, BMP-2, 4, 6, CTGF | Quimiotaxis, proliferación celular y diferenciación, angiogénesis |
| Quimioquinas, citoquinas y otros | IL8, FasL, endostatinas, osteonectina, sialoproteína ósea | Regulación de la angiogénesis, modelado vascular, interacciones celulares, formación ósea |
| Proteínas antimicrobianas | Trombocidinas | Propiedades bactericidas y fungicidas |
| Glucoproteínas de membrana | La mayoría de los constituyentes de la membrana plasmática | Agregación y adhesión de plaquetas, endocitosis proteica, inflamación, generación de trombina, interacciones entre plaquetas y leucocitos |
| Otros | Sulfato de condroitina 4, albúmina, inmunoglobulinas, semaforina | Promueven angiogénesis, la regeneración cartilaginosa, la producción de fibrina y la adhesión plaquetaria |
Fuente: Anitua et al.7.
Además, se ha demostrado la actividad antibacteriana de estos preparados, que se ha asociado tanto con determinadas proteínas plaquetarias como con la acción leucocitaria en los concentrados de PRP que contienen glóbulos blancos.
Otro componente esencial del PRP son las proteínas que actúan a nivel de la adhesión celular (fibrina, fibronectina y vitronectina), que proporcionan el soporte estructural necesario para la migración celular y para la proliferación y crecimiento tridimensional de los tejidos sobre los que actúa. Por lo tanto, el PRP tiene efectos no solo directamente sobre las células diana para los factores de crecimiento, sino también como matriz extracelular para la estimulación de la reparación y/o regeneración del tejido de un modo global5–8.
Procedimiento de obtención del plasma rico en plaquetasPara la obtención del PRP se siguen los siguientes pasos, que varían en función de la técnica empleada. El método puede ser abierto o cerrado gracias al empleo de kits desechables. En primer lugar, mediante venopunción, se extrae la sangre del paciente en tubos estériles con citrato como anticoagulante. Posteriormente, se procede al centrifugado de los tubos en una centrifugadora convencional. El tiempo, la velocidad y el número de veces que se centrifuga dependen del método empleado. Para evitar la fragmentación de las plaquetas y la consiguiente liberación precoz de las proteínas secretadas, con compromiso de su bioactividad, se recomiendan velocidades de centrifugación bajas.
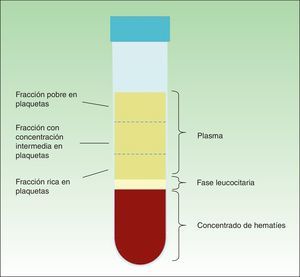
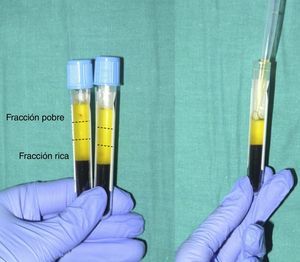
Cuando se centrifuga la sangre anticoagulada se forman 3 capas determinadas por el gradiente de densidad: la capa inferior, compuesta por glóbulos rojos; la capa media, compuesta por glóbulos blancos y plaquetas; y la capa superior, compuesta por plasma. La fase plasmática, a su vez, puede subdividirse en 3 fracciones en función de la cantidad de plaquetas presentes, que de superior a inferior son: una fracción pobre en plaquetas, la fracción intermedia con una concentración media de plaquetas y la fracción rica en plaquetas (fig. 2). Esta división de la fase plasmática no es detectable a simple vista, por lo que se establece como 1/3 superior, inferior y medio del volumen obtenido. Mediante pipeteado se procede a la separación de cada fracción en diferentes tubos estériles (fig. 3). La calidad del producto obtenido dependerá de la práctica y experiencia del personal que realice el pipeteado. Para conseguir la degranulación plaquetaria y la consiguiente liberación de los factores de crecimiento y de otras moléculas bioactivas ha de procederse a la activación de la fracción inferior de la fase plasmática. La fase rica en plaquetas se puede activar con diferentes métodos, siendo los más empleados el cloruro cálcico y la trombina9,10. En función del modo de aplicación deseado, inyectado o en gel, la mezcla activada se inyectará en los siguientes 10min o se esperará hasta la consecución de la gelificación, para lo que se precisa normalmente el calentamiento o la adición de polímeros bioactivos.
Se han realizado diferentes ensayos in vitro para establecer el contenido celular y molecular de los diferentes sistemas comerciales. Entre los resultados obtenidos destaca la importante variabilidad interindividual y la ausencia de proporcionalidad entre la concentración de plaquetas y la cantidad de factores de crecimiento obtenida con los diferentes métodos11. La repercusión clínica de las diferencias encontradas todavía no se ha determinado.
Seguridad de la aplicación de plasma rico en plaquetasDada su naturaleza autóloga el PRP es un producto seguro, que carece por definición del riesgo potencial de transmisión de enfermedades implícito en el uso de material sanguíneo de donantes. Los sistemas que emplean trombina bovina como activador están desapareciendo para evitar el desarrollo de coagulopatías o hipersensibilidad secundarias. Con respecto al potencial oncogénico del PRP que han sugerido algunos autores, no hay evidencia disponible que lo apoye12. Los factores de crecimiento, tras su unión a receptores de membrana, activan cascadas de señalización intracelular que promueven una expresión génica normal, regulada por diferentes mecanismos de control. Además, hasta el momento actual no se ha demostrado un efecto sistémico de los factores de crecimiento liberados tras la aplicación local de PRP.
En relación con las condiciones de obtención la AEMPS ha establecido unas garantías mínimas de calidad que han de ser cumplidas por los facultativos prescriptores. Se considera de obligado cumplimiento el control de la esterilidad, la trazabilidad del producto y el seguimiento de los pacientes. En el caso de los métodos de obtención de PRP de forma manual con «técnica abierta» se deberá solicitar una inspección a la autoridad competente para que valore la adecuación de las instalaciones y de la calidad de la producción. En el caso de emplear una «técnica cerrada» el método empleado deberá seguir las instrucciones descritas en cada sistema comercial, no siendo necesaria la solicitud de permiso anterior. El kit empleado deberá disponer de marcado CE otorgado para dicho uso4.
Plasma rico en plaquetas y úlceras cutáneasSe considera úlcera cutánea crónica a una pérdida de sustancia que afecta a la epidermis, la dermis y, en ocasiones, a planos más profundos, con extensión, forma y profundidad, que no cura en el tiempo esperado, presentando una escasa tendencia a la cicatrización. Se asocia con una fase inflamatoria prolongada, con mayor presencia de citoquinas proinflamatorias que las úlceras agudas. Las úlceras cutáneas crónicas más prevalentes en nuestro medio son las vasculares de extremidades inferiores, las del pie diabético y las úlceras por presión. El primer estudio de prevalencia de úlceras crónicas de extremidades inferiores en población española determinó que se aproximaba al 0,16%13. A pesar de un diagnóstico y tratamiento correctos, incluso en unidades de úlceras crónicas, entre un 10-20% de las úlceras no evolucionan favorablemente14, con la consiguiente repercusión psicosocial y un importante gasto sanitario asociado15. Entre los factores que se han involucrado en la promoción de la cronicidad de estas lesiones se encuentra el déficit de factores de crecimiento, degradados en exceso por proteasas bacterianas o celulares, y la producción de fibrina deficiente. Por lo tanto, para realizar una intervención efectiva hay que modificar este ambiente que impide la curación3. Para ello resulta fundamental la inducción de la fase reparativa de la cicatrización, acortando la fase inflamatoria previa.
La primera aplicación clínica de los preparados derivados de plaquetas se realizó en úlceras cutáneas crónicas de piernas. Se cubrían las heridas con colágeno embebido en proteínas plaquetarias. Con este producto, conocido como platelet-derived wound healing factors (PDWHF) se estimulaba la formación de tejido conectivo vascularizado en estas heridas1,16. A partir de entonces se han probado diferentes preparados plaquetarios, de aplicación en solución, gel o inyectado, mayoritariamente en casos puntuales o en series17–19, pero también en estudios piloto y ensayos clínicos20–28. Los resultados de casos aislados y pequeñas series publicadas son en muchos casos espectaculares, con un tiempo medio de curación de menos de 12 semanas. En estos trabajos destaca la variabilidad del tamaño y etiología de las lesiones, al igual que la metodología de obtención y aplicación del PRP. Con el uso de preparados manuales con técnica abierta se están publicando resultados similares a los obtenidos en las series de casos tratados con PRP obtenido con métodos comercializados17. En un ensayo clínico asignando aleatoriamente el tratamiento tópico con PRP o el tratamiento convencional (limpieza, desbridamiento y gasas bañadas en suero salino) se trataron un total de 14 úlceras distribuidas en: úlceras venosas (64%), úlceras por presión (29%) y otras (7%). A las 8 semanas la superficie cicatrizada en los pacientes tratados con PRP fue significativamente superior (72,94±22,25%) a la del grupo control (21,48±33,56%) (p<0,05) 28. Sin embargo, un metaanálisis reciente29 que recoge este y otros ensayos clínicos, un total de 9 con 325 pacientes, concluye que no hay diferencias entre el grupo tratado con PRP y el grupo control en términos de cicatrización. Cuatro de los ensayos incluyen úlceras de etiología mixta16,23,27,28, 3 recogen úlceras venosas24–26 y los 2 restantes úlceras en pie diabético21,22. La duración media de tratamiento fue de 12 semanas (rango: 8-40 semanas). Solo uno de los estudios presentaba bajo riesgo de sesgo23 y las variables resultado diferían entre ellos. Se contempla la proporción de úlceras completamente curadas en 7 trabajos, el área reepitelizada total en 3 de ellos, el porcentaje de área de la herida curada en 2 y las complicaciones de la herida en 3. Solo se observaron diferencias estadísticamente significativas, a favor del grupo tratado con PRP, en el porcentaje de área de la úlcera curada. Los autores concluyen que se necesitan más ensayos clínicos de mayor potencia para poder determinar el beneficio real del PRP en úlceras cutáneas, dado que estos resultados contrastan con la buena respuesta clínica recogida en múltiples trabajos. Este hallazgo puede deberse a la dificultad que entraña la realización un metaanálisis con estudios, que aun utilizando el mismo producto este ha sido obtenido de manera diferente, se ha aplicado en pacientes que no comparten criterios de inclusión y no existe uniformidad de las variables resultado medidas. Hay que tener en cuenta que la variabilidad inherente al proceso y de obtención y aplicación del PRP puede dificultar el diseño y la ejecución de estudios clínicos viables. Además de no conocerse la concentración ideal de plaquetas, leucocitos y factores de crecimiento, así como la potencial influencia del ejercicio o los fármacos previos a la extracción sanguínea, no está claro el papel del microambiente y del estímulo mecánico coexistente en las lesiones como factores que, por sí solos, pueden influir en la diferenciación celular o en la reparación tisular (sinérgicamente o de forma antagonista).
Además de su beneficio como terapia única se han descrito buenos resultados con el uso del PRP como adyuvante en la viabilidad de los injertos para el tratamiento de úlceras recalcitrantes30.
Plasma rico en plaquetas y envejecimiento cutáneoEl envejecimiento es un proceso multifactorial progresivo característico de las etapas finales del ciclo vital, en el que disminuye la funcionalidad tisular y orgánica del organismo, con una consiguiente menor adaptación a los cambios ambientales.
Más concretamente, el envejecimiento cutáneo engloba la disminución de la vascularización, un recambio celular y de la matriz intercelular reducido, disfuncionalidad anexial, atrofia grasa y pérdida de tono muscular. Estudios in vitro han demostrado la acción biorregeneradora del PRP mediante la estimulación de la proliferación de los fibroblastos, con un aumento de factores antiinflamatorios (HGF), angiogénicos (VEGF) y proteínas relacionadas con la remodelación de la matriz extracelular como el procolágeno-i, el ácido hialurónico o el inhibidor de metalopeptidasa 1 (TIMP-1)31,32. La principal función del procolágeno-i es la de aumentar la resistencia dérmica ante las fuerzas de tensión y estiramiento. El ácido hialurónico se encuentra en el líquido intersticial que rodea a estas fibras colágenas, con actividad lubricante. Además, debido a su gran capacidad de retención de agua se le atribuyen las propiedades de hidratación y firmeza cutánea. El TMP-1, al inhibir la acción de las metaloproteasas, estabiliza la matriz extracelular. La aplicación se realiza por vía tópica a modo de mascarilla o mediante inyecciones intradérmicas. Los estudios que evalúan el beneficio clínico del PRP en el envejecimiento cutáneo son escasos, y las variables medidas son mayoritariamente subjetivas, como el grado de satisfacción del paciente y del médico mediante comparación fotográfica33. En un estudio clínico aleatorizado con 100 pacientes con signos evidentes de envejecimiento cutáneo, se evaluó la eficacia y seguridad del PRP comparándolo con ácido hialurónico tras 3 sesiones de tratamiento. En 2 visitas de seguimiento, a los 3 y a los 6 meses, se valoró la hidratación y el pH de la piel, la evolución de la profundidad de las arrugas, así como la satisfacción de los pacientes. La mejoría de todas las variables en el grupo de PRP fue estadísticamente significativa34. Algunos trabajos sugieren también un papel beneficioso del PRP como adyuvante de otras técnicas de rejuvenecimiento. Se está extendiendo su uso tras las exfoliaciones químicas o físicas o tras el láser resurfacing.En un estudio se comprobó cómo era capaz de reducir el eritema y acelerar la curación de pacientes tratados con láser ablativo fraccionado de CO235.
Basándose en los beneficios descritos del PRP en la mejoría de los signos del envejecimiento, se han comercializado diferentes preparados de aplicación tópica, que poseen en su composición factores de crecimiento y proteínas solubles de matriz secretadas por fibroblastos dérmicos humanos.
Otra aplicación del PRP es la lipoescultura, empleada para optimizar los injertos de grasa libre que van a ser posteriormente infiltrados. En estudios in vitro se ha objetivado un aumento significativo del número de células adipocitarias. Desde un punto de vista clínico se ha comprobado cómo el PRP permite mantener de forma más prolongada el contorno restaurado en comparación con las infiltraciones grasas de manera aislada36,37.
Plasma rico en plaquetas y alopeciaEl complejo ciclo del folículo piloso es el responsable de la regulación del crecimiento del pelo. Los folículos pilosos pasan de anágeno (fase activa) a catágeno (involución por apoptosis) y posteriormente entran en telógeno (fase de reposo). Muchos factores de crecimiento participan en la regulación del ciclo del folículo, controlando la fase activa y promoviendo la inducción de catágeno o telógeno38.
Se ha demostrado recientemente el papel del PRP en la promoción de la supervivencia y crecimiento del pelo, tanto in vitro como in vivo39,40. Un estudio muestra cómo se puede estimular el crecimiento y aumentar la densidad de pelo si, previamente a la realización del trasplante, se embeben las unidades foliculares en PRP39. A pesar de que el mecanismo de acción específico del PRP sobre el folículo piloso es todavía desconocido, Li et al. han encontrado un incremento de secreción de FGF-7 y beta catenina, con la consiguiente proliferación de las células de la papila folicular y activación de vías de señalización extracelular dependientes de quinasas y Akt40. En este trabajo la inyección de PRP en los ratones promovía una aceleración en la transición de telógeno a anágeno en comparación con el grupo control. Kang et al. sugieren en un estudio preliminar los potenciales beneficios de la inyección interfolicular de un preparado de PRP con células CD34+, por su acción angiogénica, en el tratamiento de la alopecia de patrón femenino y masculino41.
Se ha realizado un ensayo clínico aleatorizado, doble ciego, en el que se evalúa el beneficio de la aplicación de PRP en 45 pacientes con alopecia areata. Al compararlo con placeboo acetónido de triamcinolona, se ha encontrado un aumento significativo en el repoblamiento, una disminución de la distrofia del pelo y menor prurito o escozor42. Además de su acción estimuladora de la proliferación celular, registrándose incremento de Ki-67 en las áreas tratadas, la conocida acción antiinflamatoria del PRP podría ayudar a explicar los buenos resultados obtenidos en la alopecia areata.
Plasma rico en plaquetas en otras aplicacionesDada su demostrada actividad en la promoción de la regeneración tisular, las aplicaciones para las que se sugiere el uso de PRP son muy variadas.
La actividad como adhesivo biológico es el fundamento del empleo del PRP para aumentar la viabilidad de colgajos cutáneos en el lecho receptor. Se emplea en cirugía plástica y dermatológica en los procesos que impliquen el empleo de colgajos para acelerar de la curación, mejorar el sellado eliminando espacios muertos, disminuir el sangrado y la necesidad de drenajes y vendajes compresivos, reducir el edema y dolor postoperatorio43.
Lee et al. evidenciaron mayor rapidez en la resolución del edema y eritema con la aplicación de PRP tras láser ablativo CO2 para el tratamiento de las cicatrices de acné en 14 pacientes. Estos autores afirman un efecto sinérgico del PRP, con mejoría clínica de la apariencia de las cicatrices44.
Nicoli et al. han descrito un caso de hidradenitis supurativa resistente a múltiples tratamientos, con buena respuesta a la combinación de cirugía, PRP y Hyalomatrix, un sistema liberador de ácido hialurónico45.
Consideraciones finalesEl PRP está demostrando un beneficioso potencial biorregenerador en múltiples aplicaciones en diferentes campos de la medicina, entre ellos la dermatología. Sin embargo, frente al creciente número de casos publicados con buenos resultados, destaca el escaso número y la calidad deficiente de los ensayos clínicos realizados para evaluar la eficacia del PRP en los diferentes usos sugeridos. En el informe anteriormente citado4 la AEMPS hace un llamamiento para que se realicen ensayos clínicos robustos y se disponga de mayor evidencia científica para poder establecer las indicaciones del PRP. En el caso de su aplicación en úlceras cutáneas crónicas la protocolización y extensión del uso a nivel hospitalario de la técnica podría suponer un importante impacto sobre la calidad de vida de los pacientes y de los costes sanitarios. En el Hospital General Universitario Gregorio Marañón estamos obteniendo excelentes resultados con la aplicación de una técnica manual abierta en una pequeña serie de pacientes con úlceras cutáneas crónicas. Tras la validación del método planificaremos un ensayo clínico aleatorizado y abierto para estudiar la utilidad del PRP en la curación de úlceras crónicas que no responden al tratamiento convencional.
Un mayor conocimiento de los principios biológicos del PRP y de los mecanismos moleculares implicados en la regeneración tisular favorecerá la optimización de las formulaciones y aplicaciones del PRP. Para que esta técnica segura, sencilla y con múltiples beneficios potenciales se establezca como un tratamiento rutinario con indicaciones establecidas en dermatología se necesitan más estudios que avalen su eficacia.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.