Presentamos el caso de una mujer de 30 años, primípara, que 5 días después del parto por cesárea presenta dehiscencia de uno de los extremos de la herida quirúrgica y una lesión en la pierna, que evolucionó a una úlcera bien constituida, ambas lesiones muy dolorosas. Fue diagnosticada inicialmente de infección cutánea y posteriormente de pioderma gangrenoso superficial; se trataron las lesiones con corticoides tópicos con buena respuesta al tratamiento. Tras el estudio de la paciente no se encontró patología subyacente. La asociación del pioderma gangrenoso con el embarazo o parto por cesárea se encuentra en la literatura como casos individuales. En la actualidad no se conoce la etiología del pioderma gangrenoso, aunque algunas teorías apuntan a un trastorno de la función inmunológica. Se sabe que la gestación determina un estado de inmunotolerancia que podría tener algún papel en el desarrollo del pioderma gangrenoso; futuras investigaciones podrán aclarar la relevancia de esta asociación.
We describe the case of a 30-year-old woman who, 5 days after giving birth to her first child by cesarean section, presented with dehiscence of one end of the surgical wound and a lesion on her leg that developed into a well-defined ulcer; both lesions were very painful. The patient was initially diagnosed with a skin infection and later with superficial pyoderma gangrenosum. The lesions were treated with topical corticosteroids and a good response was observed. No evidence was found of underlying disease. Isolated cases of pyoderma gangrenosum associated with pregnancy or cesarean delivery have been reported in the literature. The etiology of pyoderma gangrenosum is currently unknown, but some theories suggest an immunologic mechanism. Gestation is known to generate a state of immune tolerance that could play a role in the development of the disease and future studies may help to clarify the significance of this association.
La primera descripción de pioderma gangrenoso (PG) realizada por Brunsting et al en 1930 lo define como una ulceración de la piel producida por Streptococcus, de ahí la denominación «pioderma» como una infección purulenta de la piel provocada por organismos piógenos. No obstante, en la actualidad su etiología sigue siendo desconocida. Numerosas son las patologías que se han asociado con el PG y muchos los especialistas de otras áreas que deben enfrentarse a su diagnóstico, que es fundamentalmente clínico, descartando otras causas de ulceración cutánea.
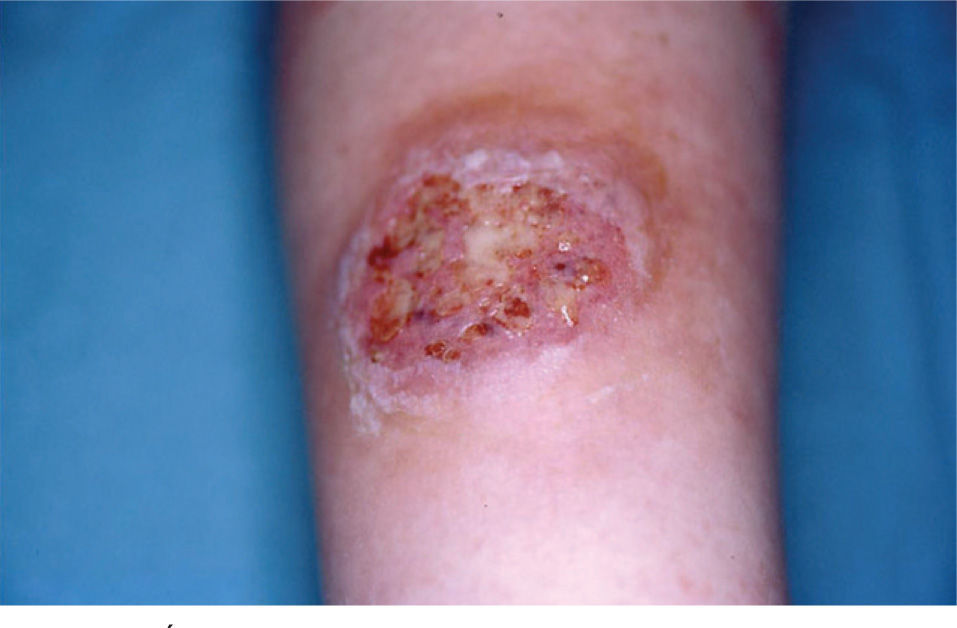
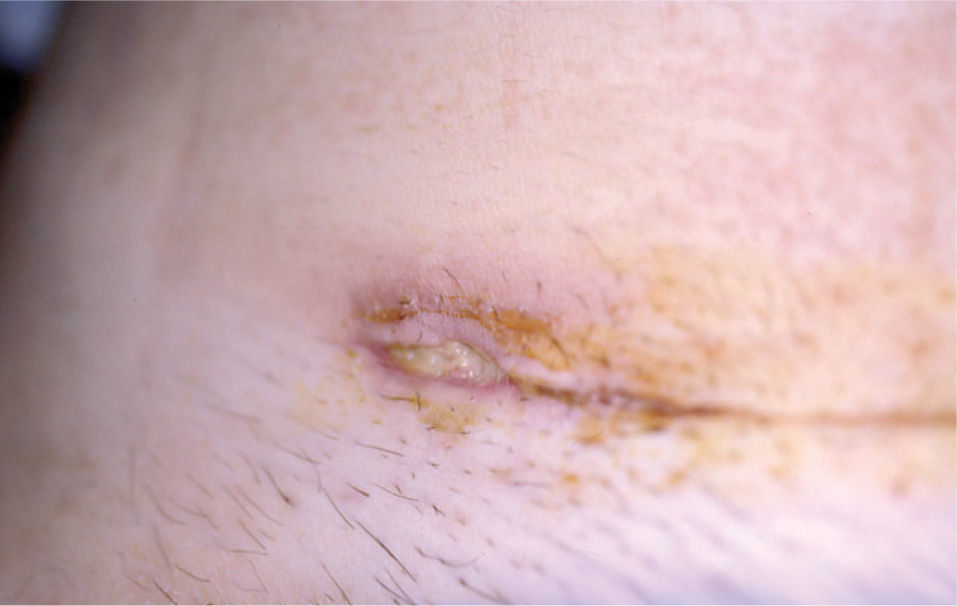
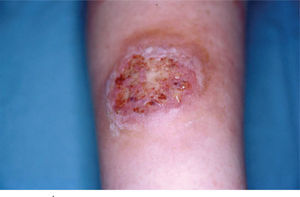
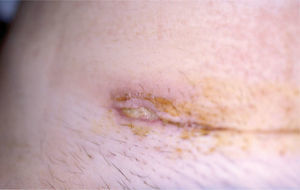
Caso clínicoMujer de 30 años sin antecedentes familiares ni personales de interés, que tuvo un parto por cesárea 9 días antes de la consulta. La paciente acude a Urgencias de Dermatología por una lesión dolorosa situada en la cara anterior de la pierna izquierda de 4 días de evolución, que se acompañaba de malestar general y fiebre de 38° C. En la exploración física observamos una úlcera de 4 cm de diámetro mayor, de bordes bien definidos y sobreelevados con fondo irregular y exudado seropurulento que asienta sobre una piel eritematoedematosa (fig. 1). Esta lesión era muy dolorosa de forma espontánea y a la palpación. En la exploración del resto de la superficie cutánea observamos en la cicatriz de la cesárea dehiscencia de los 3 cm laterales derechos de la cicatriz, con bordes violáceos, sobreelevados y fondo amarillento (fig. 2). Reinterrogamos a la paciente y explica que desde hace 5 días presenta las alteraciones antes descritas y por las que fue diagnosticada en Ginecología de infección de la herida quirúrgica y tratada con antibiótico tópico. Se realizó una analítica de urgencias donde destacaba en el sistemático una leucocitosis con desviación izquierda y trombocitosis.
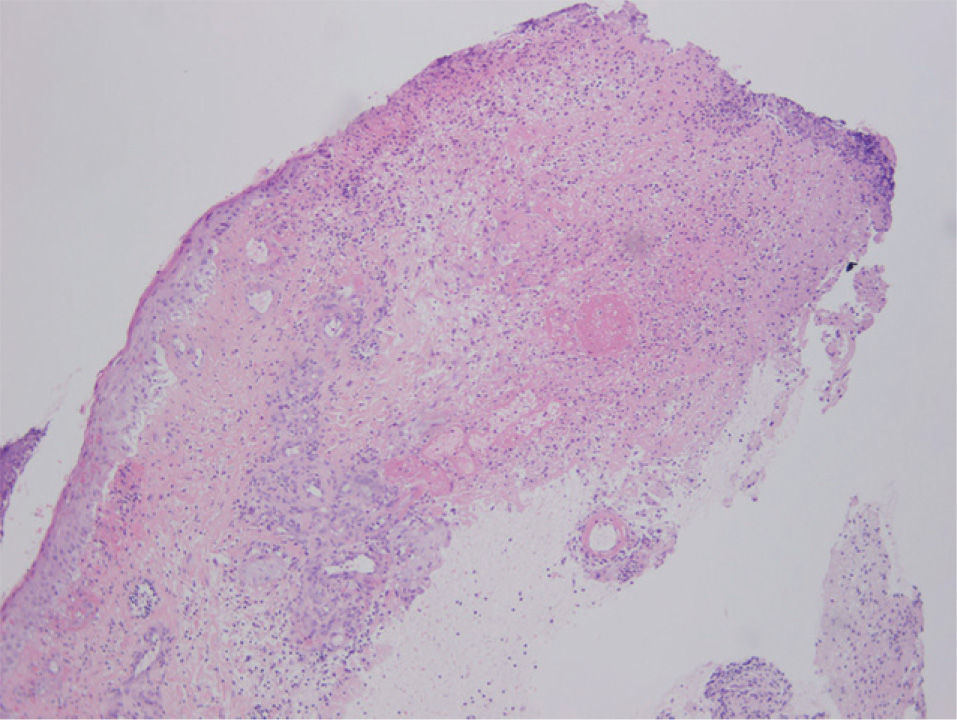
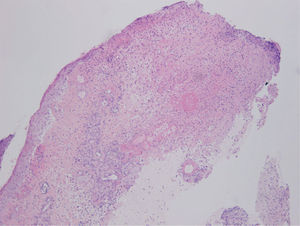
La sospecha diagnóstica inicial fue un proceso infeccioso, a nivel de la herida quirúrgica y la lesión de la pierna, por lo que se realizaron tomas para cultivo microbiológico y se inició antibioterapia empírica con amoxicilina-clavulánico 875/125 mg cada 8 horas y antiinflamatorios no esteroideos por vía oral, así como fomentos. Dos días después la paciente refería mejoría del estado general, la herida quirúrgica no se había modificado y la lesión de la pierna había empeorado, ya que el tamaño de la úlcera había aumentado. En la nueva exploración física no vemos cambios en la lesión de la herida quirúrgica y observamos cómo la piel edematosa de la pierna de la primera consulta se había convertido en un área de piel indurada, con una úlcera perfectamente constituida de bordes cortados a pico y fondo sanioso. Se realizaron biopsias cutáneas de ambas lesiones enviando también muestra para cultivo microbiológico. La histopatología de ambas lesiones era superponible. Mostraba una úlcera, que a nivel dérmico comunica con un resto epitelial escamoso con rasgos pseudoepiteliomatosos, que podría tener un origen infundibular, que aparece roto y en continuidad con un proceso dérmico necrótico y abscesificante profundo en relación con la úlcera, junto con un infiltrado inflamatorio mixto neutrofílico y linfocítico. Se observan depósitos fibrinoides alrededor del epitelio escamoso incluido en dermis y en los vasos periulcerosos. La epidermis que rodea la úlcera muestra hiperplasia irregular y una pústula corneal, posiblemente en relación con un ostium y con la inclusión epitelial descrita (fig. 3). El estudio de inmunofluorescencia directa resultó negativo.
La evolución clínica de las lesiones, la morfología de éstas y los hallazgos histopatológicos nos sugieren el diagnóstico de pioderma gangrenoso, por lo que se añaden al tratamiento corticoides tópicos a la espera de los resultados de las pruebas complementarias.
Se realizaron serologías que fueron negativas, determinación de anticuerpos que fueron normales, nuevo sistemático, bioquímica con proteinograma y determinación de hormonas tiroideas, todo ello dentro de la normalidad. Los cultivos realizados en la primera visita así como los de las biopsias, también resultaron negativos.
Siete días después del inicio del tratamiento con corticoides tópicos el edema y la induración que rodeaban la úlcera de la pierna habían desaparecido, comenzando ésta a cerrar. La herida quirúrgica había cicatrizado completamente. Un mes después la úlcera de la pierna había cerrado totalmente. Seis meses más tarde la paciente continuaba asintomática y las pruebas complementarias practicadas, entre las que se incluye sistemático, bioquímica y determinación de autoanticuerpos fueron normales.
DiscusiónEl PG es una enfermedad inflamatoria destructiva que se encuadra dentro de las llamadas dermatosis neutrofílicas. Las lesiones pueden desarrollarse de forma espontánea, después de la cirugía o de un traumatismo menor. Entre un 50-70% de los casos de PG se relaciona con otras patologías, siendo la asociación más frecuente con la enfermedad inflamatoria intestinal (colitis ulcerosa y enfermedad de Crohn). Otras enfermedades asociadas son la artritis, incluyendo artritis seronegativas, espondilitis de la enfermedad inflamatoria intestinal y artritis reumatoide, trastornos hematológicos como la leucemia mieloide, tricoleucemia, mielofibrosis y gammapatía monoclonal. El PG también se ha descrito en relación con otras dermatosis neutrofílicas como el síndrome de Sweet, la dermatosis pustular subcórnea y la enfermedad de Behçet. Otras asociaciones son con hepatitis activas o lupus eritematoso sistémico.
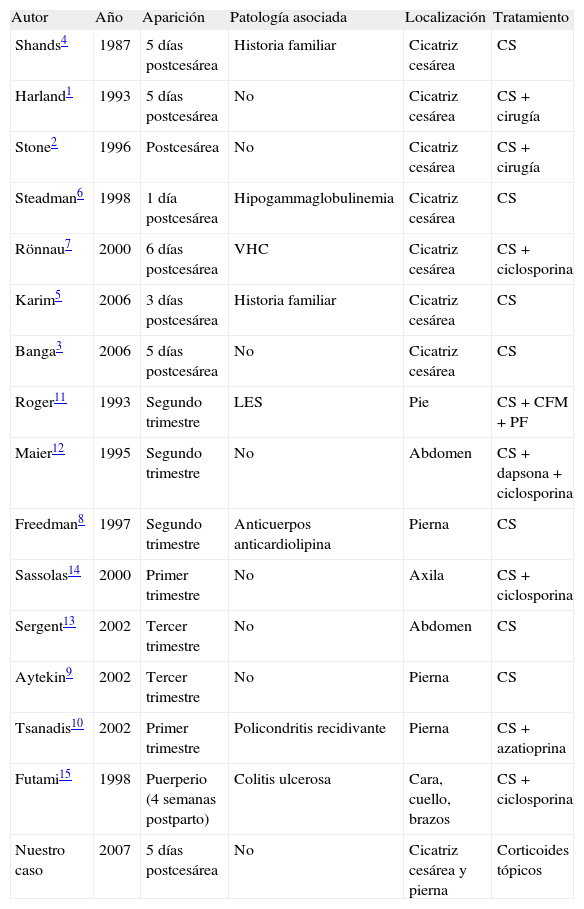
La aparición del PG durante la gestación es infrecuente, y en revisiones de series de 15, 21, 86 y 350 casos de PG no mencionan la asociación de éste con la gestación y/o parto por cesárea. En la literatura esta relación está recogida como casos individuales. Tenemos conocimiento de 7 casos descritos de PG durante la gestación, 7 en el postparto por cesárea y un caso durante el puerperio. En la tabla 1 se resumen las características clínicas de estas pacientes. De los 7 casos de PG después del parto por cesárea sólo tres no presentan ninguna patología asociada1–3. Shands et al4 presentan 5 pacientes de una misma familia que desarrollaron PG, tres de ellos después de cirugía abdominal (incluida cesárea) y dos tras mínimos traumatismos, sin existir otra patología asociada. Karim et al5 describen otro caso de PG en la cicatriz de cesárea con antecedente familiar de PG abdominal tras un parto vaginal normal, ambos sin otra patología subyacente. En los otros dos casos de PG tras el parto por cesárea se constató una hipogammaglobulinemia6 y una infección crónica por virus de la hepatitis C (VHC)7. En todos estos casos el PG se desarrolla en la cicatriz quirúrgica, apareciendo entre el primer y sexto día tras el parto por cesárea. De las pacientes en las que el PG aparece durante la gestación en tres de ellas lo hace en la pierna8–10, en una en el pie11, en dos en el abdomen12,13 y en otra en la axila14. Los casos descritos por Maier et al12, Sassolas et al14, Sergent et al13 y Aytekin et al9 no presentaban patologías asociadas. Dos de estas pacientes posteriormente tuvieron un parto por cesárea sin aparición de PG sobre la cicatriz, no obstante ambas estaban en tratamiento, una con ciclosporina y otra con corticoides orales más azatioprina, con mucha mejoría de las lesiones iniciales. Futami et al15 presentan un caso de múltiples PG en una puérpera con antecedentes personales de colitis ulcerosa y PG.
Características clínicas de los casos de pioderma gangrenoso asociado a gestación y/o parto por cesárea en la literatura
| Autor | Año | Aparición | Patología asociada | Localización | Tratamiento |
| Shands4 | 1987 | 5 días postcesárea | Historia familiar | Cicatriz cesárea | CS |
| Harland1 | 1993 | 5 días postcesárea | No | Cicatriz cesárea | CS + cirugía |
| Stone2 | 1996 | Postcesárea | No | Cicatriz cesárea | CS + cirugía |
| Steadman6 | 1998 | 1 día postcesárea | Hipogammaglobulinemia | Cicatriz cesárea | CS |
| Rönnau7 | 2000 | 6 días postcesárea | VHC | Cicatriz cesárea | CS + ciclosporina |
| Karim5 | 2006 | 3 días postcesárea | Historia familiar | Cicatriz cesárea | CS |
| Banga3 | 2006 | 5 días postcesárea | No | Cicatriz cesárea | CS |
| Roger11 | 1993 | Segundo trimestre | LES | Pie | CS + CFM + PF |
| Maier12 | 1995 | Segundo trimestre | No | Abdomen | CS + dapsona + ciclosporina |
| Freedman8 | 1997 | Segundo trimestre | Anticuerpos anticardiolipina | Pierna | CS |
| Sassolas14 | 2000 | Primer trimestre | No | Axila | CS + ciclosporina |
| Sergent13 | 2002 | Tercer trimestre | No | Abdomen | CS |
| Aytekin9 | 2002 | Tercer trimestre | No | Pierna | CS |
| Tsanadis10 | 2002 | Primer trimestre | Policondritis recidivante | Pierna | CS + azatioprina |
| Futami15 | 1998 | Puerperio (4 semanas postparto) | Colitis ulcerosa | Cara, cuello, brazos | CS + ciclosporina |
| Nuestro caso | 2007 | 5 días postcesárea | No | Cicatriz cesárea y pierna | Corticoides tópicos |
CFM: ciclofosfamida; CS: corticoides sistémicos; LES: lupus eritematoso sistémico; PF: plasmaféresis; VHC: virus de la hepatitis C.
La etiología del PG sigue siendo desconocida, aunque algunas teorías sugieren un trastorno de la función inmunológica. Se conoce que la gestación determina un estado de inmunosupresión humoral y celular, con una inhibición sérica de la formación de IL2 y de activación de IL1, así como una disminución en la quimiotaxis y adhesión de los polimorfonucleares. Se ha descrito la función inmunomoduladora de unas glucoproteínas específicas de la gestación denominadas pregnancy-specific glycoproteins (PSG); estas glucoproteínas estimulan la secreción de IL10 e IL6 e inhiben la producción de IL12 y TNF-α, es decir, inducen la secreción de citocinas antiinflamatorias. También se ha observado que durante la gestación existe un incremento de los niveles de varios factores de la coagulación. Asimismo durante el embarazo se establecen interacciones entre el sistema inmune y el sistema endocrino, que influyen en la cascada inflamatoria. Existe la posibilidad de que estas alteraciones inmunológicas en la mujer embarazada pudieran tener algún papel en el desarrollo del PG.
Todos los casos descritos de PG asociado a embarazo o parto por cesárea presentan una evolución clínica favorable, incluso los de grandes dimensiones como el descrito por Sassolas et al14 de 15 × 20 cm, o el que aportan Ronnau et al7 de 25 × 15 cm. En todos los casos el tratamiento es sistémico con corticoides asociados o no a ciclosporina7,12,14,15, ciclofosfamida11, dapsona12, azatioprina10 y/o plasmaféresis11. En algunos casos también se emplea el desbridamiento quirúrgico y la colocación de injerto cutáneo1,2.
Está bien documentado que en casos seleccionados de PG localizado el tratamiento tópico es suficiente para la resolución del cuadro, y más aún cuando éste se inicia de forma precoz, ya que el éxito del mismo es más probable cuanto menor sea el tamaño de la úlcera. El tratamiento tópico del PG es más efectivo cuando esta dermatosis es superficial y/o cuando no está asociado a otra patología. La evolución de una herida quirúrgica afecta de PG induce en muchas ocasiones la búsqueda inicial de una posible infección. Esta situación retrasa el diagnóstico correcto dando lugar a la instauración de múltiples tratamientos ineficaces y a la prolongación del proceso, pudiendo incluso no ser diagnosticado, como así describieron Shands et al4, en el que los familiares de la paciente presentan historias de infecciones de heridas quirúrgicas de tórpida evolución con tratamientos antibióticos múltiples y quirúrgicos que no son diagnosticados de PG en ese momento. El PG asociado a gestación y/o parto por cesárea puede ser una entidad infradiagnosticada, debido a su favorable evolución y al parecido con la infección de la herida quirúrgica, por lo que creemos es importante la colaboración interdisciplinar para establecer un diagnóstico precoz y un tratamiento adecuado.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.