El pénfigo vulgar (PV) es una enfermedad infrecuente y grave. Su tratamiento consiste en el uso de glucocorticoides sistémicos (GS) junto a fármacos ahorradores (FA) de los mismos.
ObjetivosDescribir y analizar las características demográficas y clínicas de pacientes con PV.
Materiales y métodosEstudio de cohorte retrospectivo, en adultos con PV, en un periodo de 12años.
ResultadosSe incluyeron 32 pacientes. En 20 pacientes (63%) el inicio fue en mucosas; la región oral fue la más afectada, seguida de la vulvar. La afectación mucosa fue más frecuente en mujeres (p=0,03). Los pacientes cuyo PV comenzó en esta localización afectaron en su evolución a más de una mucosa, de forma independiente de la edad y el sexo (p=0,003). El comienzo de la enfermedad antes de los 40años se asoció con un compromiso cutáneo generalizado (p=0,003), con la necesidad de tratamiento con FA (p=0,05) y con cierta refractariedad a los tratamientos (p=0,02). La azatioprina fue el FA más prescrito (n=22). Se observó corticodependencia en 8 pacientes (25%) y recaídas en 26 (81%). Se alcanzó una remisión completa con/sin tratamiento en 15 de los casos (47%). La mediana del tiempo libre de enfermedad fue de 14meses y la mortalidad, del 6% (n=2).
ConclusiónEl inicio del PV antes de los 40años podría ser un factor de mal pronóstico, ya que en estos pacientes observamos una mayor probabilidad de presentar compromiso cutáneo generalizado, requerimiento de FA y refractariedad al tratamiento.
Pemphigus vulgaris (PV) is an uncommon, serious disease that is treated with systemic corticosteroids and corticosteroid-sparing agents.
ObjectivesTo describe and analyze the demographic and clinical characteristics of patients with PV.
Material and methodsRetrospective cohort study of adults diagnosed with PV over a period of 12years.
ResultsPV presented with mucosal lesions in 20 of the 32 patients studied (63%); the most common site was the oral mucosa followed by the vulva. Mucosal involvement was more common in women (P=.03). Lesions were found at more than 1 mucosal site in patients whose disease began in the mucosa, independently of age or sex (P=.003). Disease onset before the age of 40years was associated with generalized skin lesions (P=.003), a need for corticosteroid-sparing therapy (P=.05), and refractory PV (P=.02). Azathioprine was the most widely prescribed corticosteroid-sparing agent (in 22 patients). Eight patients (25%) were dependent on corticosteroids and disease recurred in 26 (81%). Complete remission, with or without treatment, was achieved in 15 patients (47%). Patients remained disease-free for a median of 14months, and 2 patients died (6%).
ConclusionOnset before the age of 40 years could be a sign of poor prognosis in patients with PV, as it was significantly associated with a higher risk of generalized skin involvement, a need for corticosteroid-sparing therapy, and refractory disease.
El pénfigo vulgar (PV) es una enfermedad ampollar autoinmune, de evolución crónica, que afecta con mayor frecuencia a los pacientes entre la quinta y la sexta décadas de vida1,2.
Se manifiesta con ampollas flácidas que se rompen con facilidad y dejan erosiones dolorosas1. Baum et al. observaron que afecta de forma inicial a las mucosas en el 41,7% de los casos, compromete a estas y a la piel en el 37,4%, y se presenta con compromiso cutáneo exclusivo en el 20,4%3.
El diagnóstico se sustenta en la biopsia de piel para su estudio microscópico con hematoxilina-eosina e inmunofluorescencia directa4.
Sin tratamiento es una enfermedad potencialmente fatal. Antes de la introducción de los glucocorticoides sistémicos (GS) la mortalidad era del 60 al 90%5. En la actualidad, con el empleo de GS junto a fármacos ahorradores (FA) de los mismos, la mortalidad es del 10%6. La dosis inicial de GS es empírica, se basa en la experiencia clínica, suele ajustarse a la gravedad del cuadro y puede variar entre 0,5 y 2mg/kg/día7,8. Los FA, como el metotrexato, la azatioprina, el mofetil micofenolato (MM) y el rituximab, aumentan la eficacia, disminuyen el requerimiento y previenen los potenciales efectos adversos de los GS9,10. En los casos graves se pueden utilizar pulsos de metilprednisolona, ciclofosfamida o gammaglobulina endovenosa10,11. El uso de los GS y los FA ha cambiado a lo largo del tiempo. En los últimos 15años el tratamiento de primera línea consistía en GS y FA como azatioprina o MM, en caso de ser necesario8. En la actualidad la guía de recomendaciones de expertos internacionales para el diagnóstico y el tratamiento de PV de 2018 considera a los GS y al rituximab la primera línea de tratamiento, y a la azatioprina y el MM como FA de primera línea, de acuerdo con la evidencia científica actual12,13.
Durante la evolución y el seguimiento de los pacientes se suelen observar complicaciones relacionadas con la enfermedad y los tratamientos instaurados14,15.
Los objetivos de este trabajo fueron describir las características demográficas y clínicas de los pacientes con PV, los tratamientos utilizados, la respuesta terapéutica y la evolución, así como analizar los factores asociados a las recaídas o a la refractariedad de la enfermedad.
Materiales y métodosDiseñoEstudio observacional analítico de cohorte retrospectivo en un centro hospitalario de tercer nivel de complejidad, el Hospital Italiano de Buenos Aires, Argentina.
PoblaciónPacientes mayores de 18años con diagnóstico de PV por estudio microscópico con hematoxilina-eosina e inmunofluorescencia directa, en el período comprendido entre el 1 de septiembre de 2005 y el 31 de agosto de 2017, con un seguimiento mínimo de 6meses.
Se excluyeron los pacientes con diagnóstico concurrente de otras enfermedades ampollares o que estuviesen participando en otros protocolos de investigación.
Mediciones y variables exploratoriasLos datos demográficos y las características clínicas, terapéuticas y evolutivas de los pacientes se obtuvieron a partir de la historia clínica electrónica. El investigador principal validó los casos mediante la revisión de las evoluciones y los estudios complementarios.
Se registraron la edad al diagnóstico, el sexo, la forma de inicio, la presencia de compromiso de mucosas, las regiones cutáneas afectadas; la dosis inicial, el cambio de dosis, el tiempo total de tratamiento y la posibilidad de suspensión de los GS; la corticodependencia, el uso de FA, las complicaciones, los ingresos hospitalarios, las recaídas, la remisión completa con/sin tratamiento y la mortalidad global.
Las variables evolutivas se definieron según el Consensus statement on definitions of disease, end points, and therapeutic response for pemphigus y la guía de recomendaciones de expertos del 2018 (tabla 1)13,16. No existe una definición por consenso de corticodependencia en PV, por lo que se adoptó la de otras enfermedades17. Las intercurrencias vinculadas a la enfermedad y los efectos adversos de los tratamientos se definieron como complicaciones. Estos eventos se clasificaron en infecciones cutáneas y extracutáneas, complicaciones cutáneas no infecciosas, endocrinológicas, hematológicas, óseas/esqueléticas, oftalmológicas, psiquiátricas, digestivas, hepáticas, alteraciones de los lípidos, constitucionales, cardiovasculares, renales y urológicas, alteraciones del medio interno y otras.
Definición de las variables: Consensus statement on definitions of disease, end points, and therapeutic response for pemphigus y guía de recomendaciones de expertos del 2018
| Remisión completa con/sin tratamiento13,16 | Ausencia de lesiones por un lapso de al menos 2meses mientras el paciente recibía dosis equivalentes a terapia mínima o estaba libre de tratamiento |
| Recaída13,16 | Aparición de 3 o más lesiones que no resolvieron en forma espontánea en una semana o a la extensión de lesiones conocidas |
| Terapia mínima13,16 | Requerimiento de dosis iguales o inferiores a 10mg/día de prednisona, sus equivalentes o la mitad de la dosis plena del FA durante 2meses |
| Corticodependencia17 | Imposibilidad para descender la dosis de GS por debajo de la terapia mínima, sin que se produzcan recaídas |
| Refractariedad13,16 | Existencia de recaídas pese a dosis plenas en un mínimo período de tiempo según los fármacos utilizados |
FA: fármacos ahorradores; GS: glucocorticoides sistémicos.
La prueba de Shapiro-Wilk se empleó para verificar la ausencia de distribución normal de los datos, por lo que se comunicaron como mediana e intervalo intercuartílico. Las variables categóricas se describieron como frecuencias absolutas y relativas. Para evaluar la asociación entre variables categóricas se utilizó la prueba exacta de Fisher y para las cuantitativas se empleó la prueba de Mann-Whitney. Se consideraron estadísticamente significativos valores de p<0,05. El análisis estadístico se realizó con el software STATA versión 14.0.
El estudio fue aprobado por el Comité de Ética del Hospital Italiano de Buenos Aires (protocolo n.° 2980).
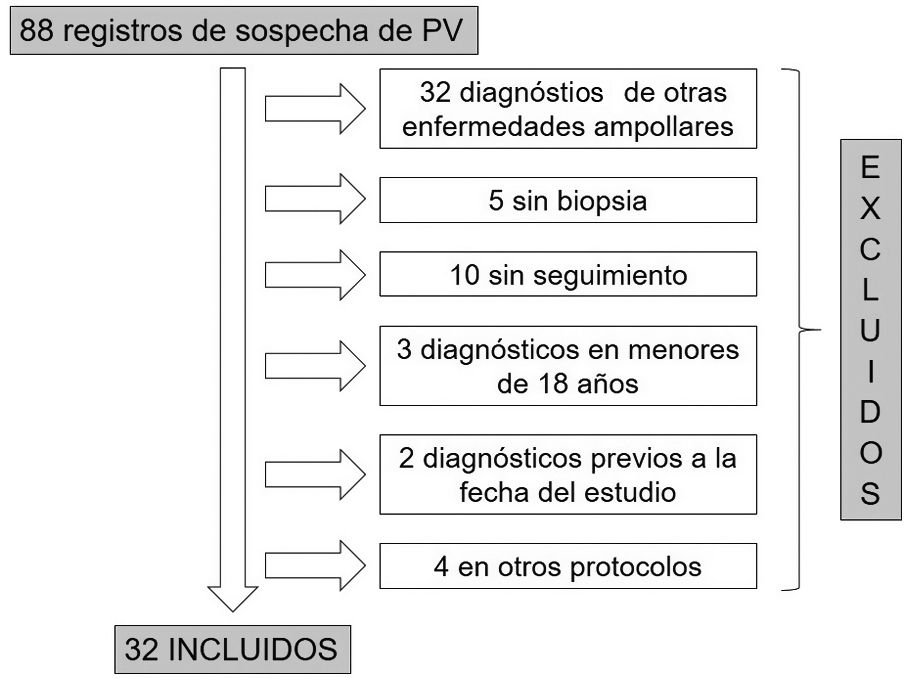
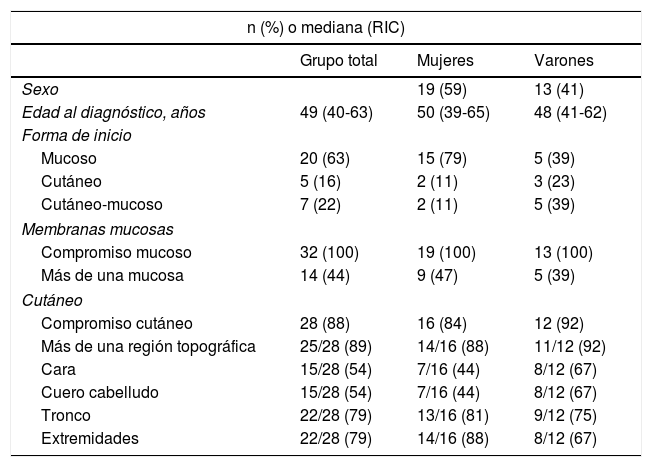
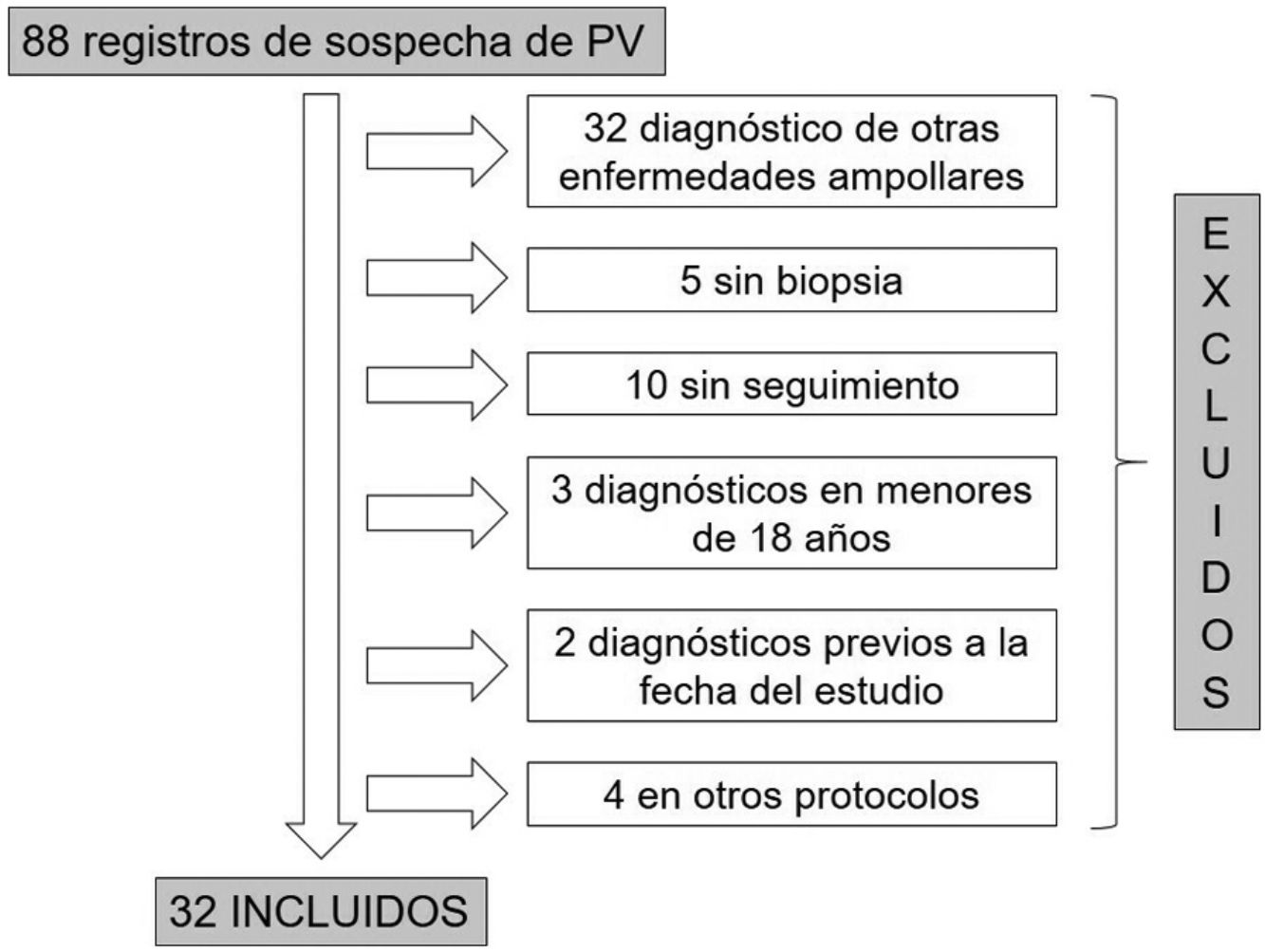
ResultadosDe las 88 historias clínicas de pacientes con sospecha de PV, 32 cumplieron los criterios de inclusión (fig. 1). De estos, 19 (59%) fueron mujeres y la mediana de edad al diagnóstico en ambos sexos fue de 49años, con un rango intercuartílico (RIC) de 40-63 (tabla 2).
Características demográficas y clínicas de los pacientes con PV (n=32)
| n (%) o mediana (RIC) | |||
|---|---|---|---|
| Grupo total | Mujeres | Varones | |
| Sexo | 19 (59) | 13 (41) | |
| Edad al diagnóstico, años | 49 (40-63) | 50 (39-65) | 48 (41-62) |
| Forma de inicio | |||
| Mucoso | 20 (63) | 15 (79) | 5 (39) |
| Cutáneo | 5 (16) | 2 (11) | 3 (23) |
| Cutáneo-mucoso | 7 (22) | 2 (11) | 5 (39) |
| Membranas mucosas | |||
| Compromiso mucoso | 32 (100) | 19 (100) | 13 (100) |
| Más de una mucosa | 14 (44) | 9 (47) | 5 (39) |
| Cutáneo | |||
| Compromiso cutáneo | 28 (88) | 16 (84) | 12 (92) |
| Más de una región topográfica | 25/28 (89) | 14/16 (88) | 11/12 (92) |
| Cara | 15/28 (54) | 7/16 (44) | 8/12 (67) |
| Cuero cabelludo | 15/28 (54) | 7/16 (44) | 8/12 (67) |
| Tronco | 22/28 (79) | 13/16 (81) | 9/12 (75) |
| Extremidades | 22/28 (79) | 14/16 (88) | 8/12 (67) |
RIC: rango intercuartílico.
En 20 pacientes (63%) la manifestación inicial fue la presencia de lesiones en alguna de las mucosas; en 7 (22%) comenzó con una afectación cutaneomucosa simultánea y en 5 (16%) con un compromiso cutáneo exclusivo. De los 20 pacientes que presentaron inicio en alguna de las mucosas, 18 tuvieron compromiso oral, 6 genital, 1faríngeo, 1esofágico y 1nasal. Cinco pacientes presentaron una afectación simultánea de más de una mucosa. De los 7 pacientes que comenzaron con afectación cutaneomucosa concurrente, 2 presentaron lesiones cutáneas generalizadas, 4 en el cuero cabelludo, 3 en el tronco, 2 en los miembros superiores y los pabellones auriculares, y 1 con una paroniquia. De los 5 pacientes que presentaron un inicio cutáneo exclusivo, 3 comenzaron con lesiones en el tronco, 2 en el cuero cabelludo, 1en los pabellones auriculares y los miembros superiores. En 25 pacientes (78,1%) existió compromiso simultáneo de más de una región.
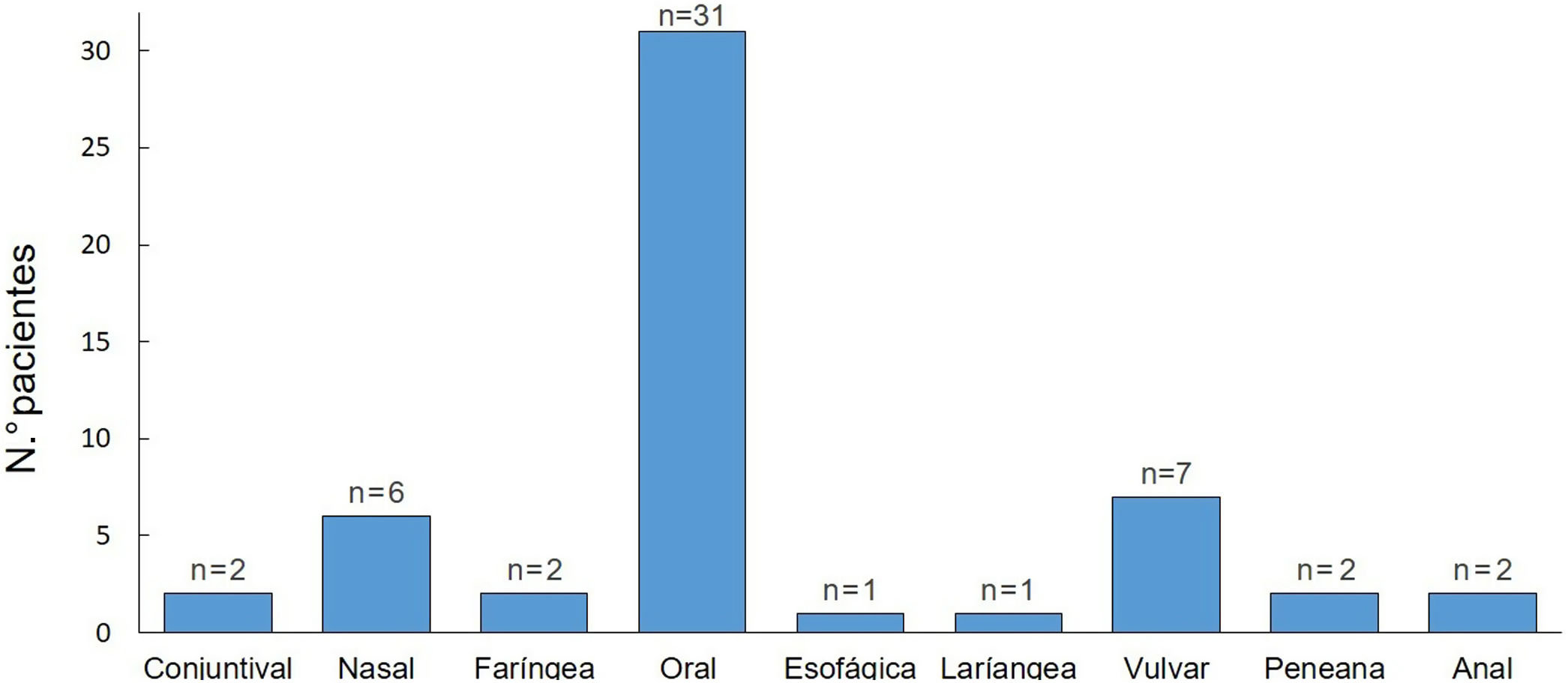
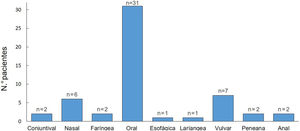
Todos los pacientes presentaron una afectación de mucosas durante el seguimiento. La mucosa oral fue la más frecuentemente afectada (97%) y la genital ocupó el segundo lugar (28%) (fig. 2). El 44% tuvieron una afectación de más de una mucosa.
La afectación cutánea se observó en 28 pacientes (88%). El tronco y las extremidades fueron las áreas afectadas con mayor frecuencia (ambos en 22/28 [79%]).
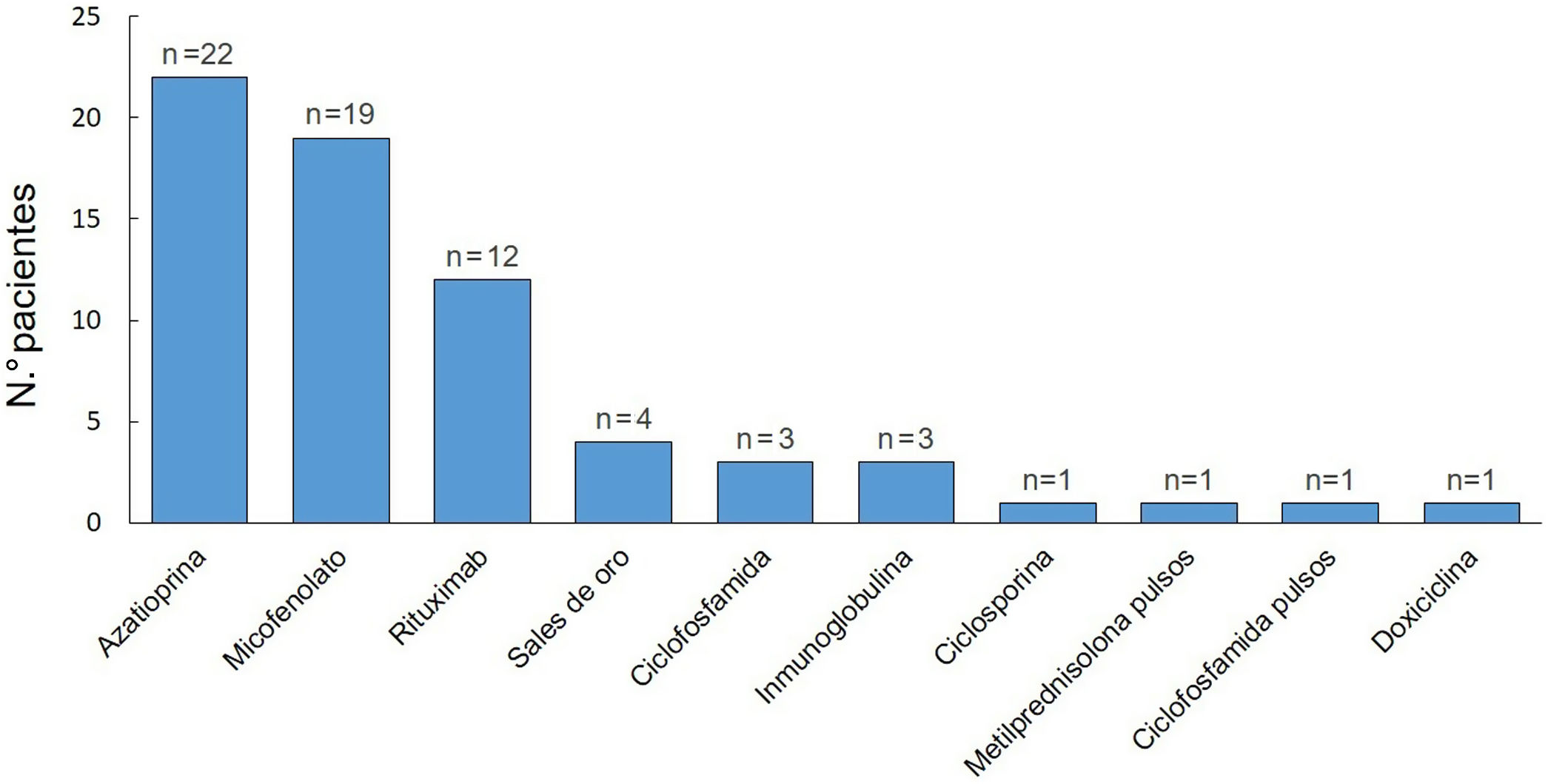
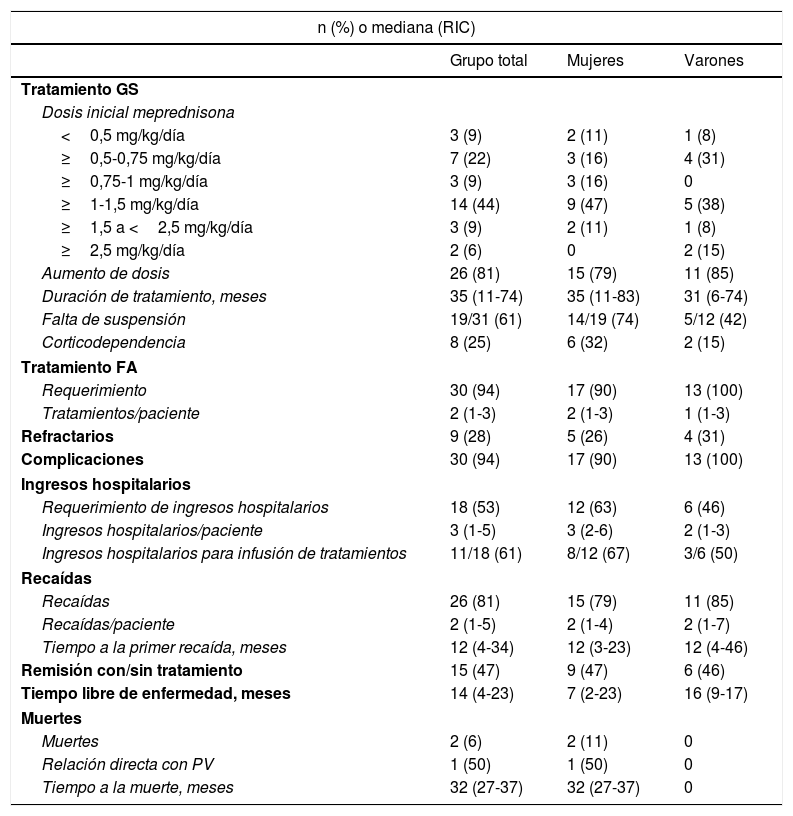
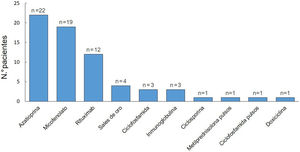
El tratamiento inicial en todos los pacientes fue con GS (tabla 3). La dosis de ≥1-1,5mg/kg/día fue la seleccionada para comenzar el tratamiento con mayor frecuencia (44%). El 81% (n=26) requirieron aumentar la dosis de GS durante el seguimiento y la mediana de duración de este tratamiento fue de 35meses (RIC11-74). Al momento de la última consulta, el 61% (19/31) continuaban con este fármaco. De los 32 pacientes, 8 presentaron corticodependencia. El 94% (n=30) recibieron FA (fig. 3). De estos últimos, la azatioprina fue el tratamiento de primera línea en 15 de los pacientes (50%) y el MM en 12 (40%). Como segunda línea se empleó rituximab en primer lugar, y luego MM y azatioprina con la misma frecuencia. La azatioprina fue el fármaco más empleado al considerar todas las líneas de tratamiento (22/30, 73%), y el segundo fue el MM, que se utilizó en el 63% (19/30).
Tratamiento y evolución de los pacientes con PV (n=32)
| n (%) o mediana (RIC) | |||
|---|---|---|---|
| Grupo total | Mujeres | Varones | |
| Tratamiento GS | |||
| Dosis inicial meprednisona | |||
| <0,5 mg/kg/día | 3 (9) | 2 (11) | 1 (8) |
| ≥0,5-0,75 mg/kg/día | 7 (22) | 3 (16) | 4 (31) |
| ≥0,75-1 mg/kg/día | 3 (9) | 3 (16) | 0 |
| ≥1-1,5 mg/kg/día | 14 (44) | 9 (47) | 5 (38) |
| ≥1,5 a <2,5 mg/kg/día | 3 (9) | 2 (11) | 1 (8) |
| ≥2,5 mg/kg/día | 2 (6) | 0 | 2 (15) |
| Aumento de dosis | 26 (81) | 15 (79) | 11 (85) |
| Duración de tratamiento, meses | 35 (11-74) | 35 (11-83) | 31 (6-74) |
| Falta de suspensión | 19/31 (61) | 14/19 (74) | 5/12 (42) |
| Corticodependencia | 8 (25) | 6 (32) | 2 (15) |
| Tratamiento FA | |||
| Requerimiento | 30 (94) | 17 (90) | 13 (100) |
| Tratamientos/paciente | 2 (1-3) | 2 (1-3) | 1 (1-3) |
| Refractarios | 9 (28) | 5 (26) | 4 (31) |
| Complicaciones | 30 (94) | 17 (90) | 13 (100) |
| Ingresos hospitalarios | |||
| Requerimiento de ingresos hospitalarios | 18 (53) | 12 (63) | 6 (46) |
| Ingresos hospitalarios/paciente | 3 (1-5) | 3 (2-6) | 2 (1-3) |
| Ingresos hospitalarios para infusión de tratamientos | 11/18 (61) | 8/12 (67) | 3/6 (50) |
| Recaídas | |||
| Recaídas | 26 (81) | 15 (79) | 11 (85) |
| Recaídas/paciente | 2 (1-5) | 2 (1-4) | 2 (1-7) |
| Tiempo a la primer recaída, meses | 12 (4-34) | 12 (3-23) | 12 (4-46) |
| Remisión con/sin tratamiento | 15 (47) | 9 (47) | 6 (46) |
| Tiempo libre de enfermedad, meses | 14 (4-23) | 7 (2-23) | 16 (9-17) |
| Muertes | |||
| Muertes | 2 (6) | 2 (11) | 0 |
| Relación directa con PV | 1 (50) | 1 (50) | 0 |
| Tiempo a la muerte, meses | 32 (27-37) | 32 (27-37) | 0 |
GS: glucocorticoides sistémicos; PV: pénfigo vulgar; RIC: rango intercuartílico.
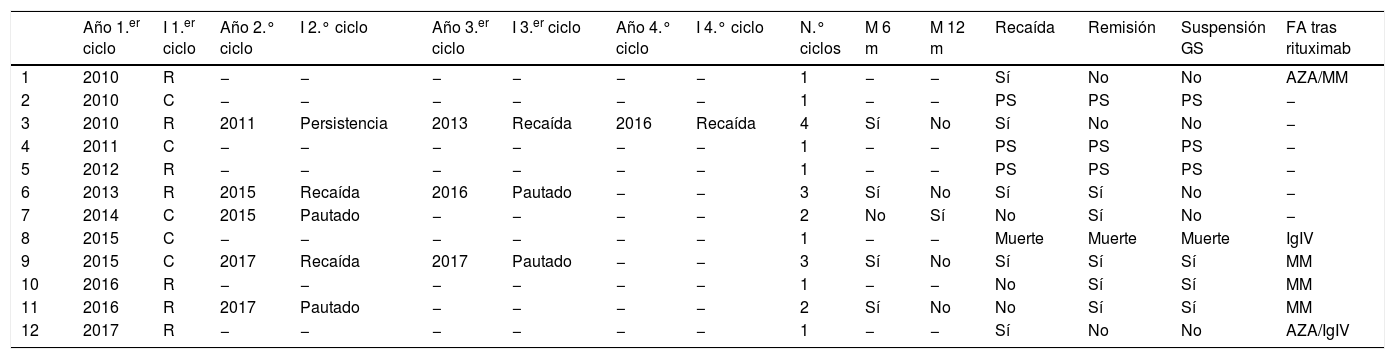
El rituximab se empleó en el 40% (12/30). Se indicó por enfermedad refractaria en el 58% (n=7) y en el 42% (n=5) por corticodependencia. Un paciente recibió rituximab como FA de primera línea, y en 5 se indicó como segunda línea. En los demás casos fue empleado como FA tras varias líneas de tratamiento. A 7 pacientes se les indicó por primera vez rituximab antes del año 2015 y la dosis utilizada fue de 375mg/m2 semanales durante 4semanas. A partir de 2015 se prescribió el primer ciclo de rituximab a 5 pacientes y la dosis fue de 1g en los días 0 y 15. Siete de los pacientes (7/12) recibieron un ciclo de tratamiento. El resto requirió más de un ciclo: 2 pacientes 2 ciclos, 2 requirieron 3 ciclos y 1, 4 ciclos. Cuatro pacientes recibieron una dosis de mantenimiento a los 6meses por única vez durante el período del estudio, debido a persistencia de erosiones en la mucosa oral en un caso y en los 3 restantes en forma programada, sin evidencia de recaída al momento de la prescripción. Además, un paciente recibió una dosis de mantenimiento al año del ciclo de tratamiento inicial de forma programada. Se requirió el uso de otros FA tras el rituximab en 6 pacientes y el MM fue el utilizado con mayor frecuencia. Solo 3 casos tratados con rituximab lograron la suspensión de los GS (tabla 4).
Tratamiento con rituximab (n=12)
| Año 1.er ciclo | I 1.er ciclo | Año 2.° ciclo | I 2.° ciclo | Año 3.er ciclo | I 3.er ciclo | Año 4.° ciclo | I 4.° ciclo | N.° ciclos | M 6 m | M 12 m | Recaída | Remisión | Suspensión GS | FA tras rituximab | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2010 | R | − | − | − | − | − | − | 1 | − | − | Sí | No | No | AZA/MM |
| 2 | 2010 | C | − | − | − | − | − | − | 1 | − | − | PS | PS | PS | − |
| 3 | 2010 | R | 2011 | Persistencia | 2013 | Recaída | 2016 | Recaída | 4 | Sí | No | Sí | No | No | − |
| 4 | 2011 | C | − | − | − | − | − | − | 1 | − | − | PS | PS | PS | − |
| 5 | 2012 | R | − | − | − | − | − | − | 1 | − | − | PS | PS | PS | − |
| 6 | 2013 | R | 2015 | Recaída | 2016 | Pautado | − | − | 3 | Sí | No | Sí | Sí | No | − |
| 7 | 2014 | C | 2015 | Pautado | − | − | − | − | 2 | No | Sí | No | Sí | No | − |
| 8 | 2015 | C | − | − | − | − | − | − | 1 | − | − | Muerte | Muerte | Muerte | IgIV |
| 9 | 2015 | C | 2017 | Recaída | 2017 | Pautado | − | − | 3 | Sí | No | Sí | Sí | Sí | MM |
| 10 | 2016 | R | − | − | − | − | − | − | 1 | − | − | No | Sí | Sí | MM |
| 11 | 2016 | R | 2017 | Pautado | − | − | − | − | 2 | Sí | No | No | Sí | Sí | MM |
| 12 | 2017 | R | − | − | − | − | − | − | 1 | − | − | Sí | No | No | AZA/IgIV |
AZA: azatioprina; C: corticodependencia; GS: glucocorticoides sistémicos; I: indicación; IgIV: inmunoglobulina intravenosa; M: mantenimiento; MM: micofenolato de mofetilo; PS: pérdida de seguimiento; R: refractariedad.
De los 32 casos, el 28% (n=9) presentaron enfermedad refractaria. El 81% presentaron recaídas, con una mediana de tiempo entre el diagnóstico y la primera recaída de 12meses (RIC6-34). De los 12 pacientes tratados con rituximab, el 42% (5/12) presentaron recaídas. En 4 casos se presentaron tras el primer ciclo del fármaco y en uno la recaída apareció luego del segundo ciclo.
Alcanzaron la remisión completa con/sin tratamiento el 47% (n=15), con una mediana de tiempo libre de enfermedad de 14 meses (RIC4-23) (tabla 3). De los que presentaron remisión sin el uso de rituximab (10/15), el 60% (6/10) habían realizado tratamiento con azatioprina, el 20% (2/10) con MM, el 10% (n=1) con azatioprina y MM. El 10% (n=1) no requirieron FA. Cinco pacientes lograron la remisión con rituximab. De ellos, 4 habían recibido de forma previa azatioprina y MM. La mediana de tiempo desde la primera infusión a la remisión de la enfermedad fue de 4meses (RIC3-8).
Durante la evolución, el 53% (n=18) requirieron al menos un ingreso hospitalario. Se registró un total de 44 episodios de ingresos. La mediana de los mismos por paciente fue de 3, con un RIC de 1 a 5. De estos, 19 fueron para infusión de tratamientos de un día de duración. Los 25 episodios restantes se debieron a la enfermedad, intercurrencias o complicaciones. La mediana de duración de los ingresos en esos casos fue de 8días, con un RIC de 2 a 15.
Respecto a las complicaciones, se constataron 190 eventos en 30 pacientes (n=32) (tabla 5). Las endocrinológicas fueron las más frecuentes (15%; n=29/190), seguidas por las óseas/esqueléticas (14%; n=27/190), con 15 casos de osteopenia/osteoporosis y 5 de fracturas vertebrales. Estas se produjeron pese a las medidas preventivas instauradas, que consistieron en la evaluación precoz por un endocrinólogo, prescripción de vitaminaD (72%, n=23), calcio (53%, n=17) y bifosfonatos (53%, n=17), según correspondiera. En tercer lugar observamos complicaciones infecciosas extracutáneas. Durante el seguimiento fallecieron 2 pacientes: uno por insuficiencia renal crónica en estadio terminal y otro por una neumonía adquirida en la comunidad.
Complicaciones: se constataron 190 eventos en 30 pacientes (n=30/32)
| Tipo | n |
|---|---|
| Infecciones cutáneas | 17 |
| Celulitis, tiña | 3 |
| Impetiginización de las erosiones de pénfigo, herpes zoster, pitiriasis versicolor, onicomicosis* | 2 |
| Herpes simplex, forunculosis, verrugas* | 1 |
| Infecciones extracutáneas | 18 |
| Candidiasis oral | 5 |
| Neumonía | 3 |
| Sepsis | 2 |
| Queratitis herpética, herpes genital, infección urinaria, gastroenteritis, hepatitis C, bronquitis, reactivación de CMV, cuadro de vía aérea superior* | 1 |
| Cutáneas no infecciosas | 10 |
| Estrías | 3 |
| Rosácea | 2 |
| Acné monomorfo, eritema multiforme, úlceras por decúbito, lipodermatoesclerosis aguda, caída de pelo* | 1 |
| Endocrinológicas | 29 |
| Síndrome de Cushing | 14 |
| Hiperglucemia/diabetes | 9 |
| Insuficiencia suprarrenal | 5 |
| Hiperparatiroidismo secundario | 1 |
| Hematológicas | 8 |
| Anemia | 5 |
| Leucopenia | 2 |
| Banda monoclonal | 1 |
| Óseas/esqueléticas | 27 |
| Osteoporosis/osteopenia | 15 |
| Fracturas vertebrales, mialgias o debilidad muscular* | 5 |
| Artritis por cristales, artralgias* | 1 |
| Oftalmológicas | 16 |
| Cataratas | 11 |
| Glaucoma | 4 |
| Xeroftalmia | 1 |
| Alteración del metabolismo lipídico | |
| Elevación de triglicéridos y colesterol | 11 |
| Psiquiátricas | 5 |
| Depresión | 2 |
| Ansiedad, angustia, psicosis* | 1 |
| Digestivas | 5 |
| Hemorragia digestiva | 3 |
| Diarrea | 2 |
| Hepáticas | |
| Elevación de transaminasas de causa no infecciosa | 1 |
| Cardiovasculares | 16 |
| Hipertensión arterial | 5 |
| Trombosis venosa profunda | 4 |
| Edemas, insuficiencia cardíaca* | 3 |
| Tromboembolismo | 1 |
| Renales y urológicas | 7 |
| Proteinuria, insuficiencia renal* | 2 |
| Hematuria, cristaluria, retención aguda de orina* | 1 |
| Alteración del medio interno | 3 |
| Hipercalemia, hiponatremia, hipomagnesemia* | 1 |
| Constitucional y estado general | 11 |
| Disminución de peso | 4 |
| Aumento de peso | 3 |
| Astenia, adinamia* | 2 |
| Otros | 6 |
| Amenorrea, metrorragia* | 2 |
| Hipertrofia gingival, temblor* | 1 |
| Total | 190 |
De acuerdo con el sexo, el inicio del PV en las mucosas fue más frecuente en mujeres (n=15, 79%) que en varones (n=5, 39%), p=0,03.
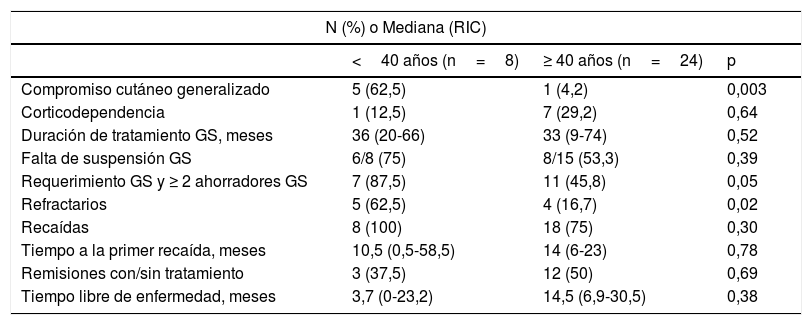
Se analizaron las variables según el diagnóstico de PV antes o después de los 40años de edad (tabla 6). Los pacientes en los cuales la enfermedad apareció antes de los 40años presentaron con mayor frecuencia compromiso cutáneo generalizado, con afectación de la cara, del cuero cabelludo, del tronco y de las extremidades (n=5; 63%; p=0,003). Estos pacientes requirieron más de 2 tratamientos, incluidos GS y uno o más FA (p=0,05), presentaron recaídas de forma más frecuente (p=0,30) y tuvieron una probabilidad mayor de ser refractarios (p=0,02).
Diferencias por edad entre pacientes con PV (n=32)
| N (%) o Mediana (RIC) | |||
|---|---|---|---|
| <40 años (n=8) | ≥ 40 años (n=24) | p | |
| Compromiso cutáneo generalizado | 5 (62,5) | 1 (4,2) | 0,003 |
| Corticodependencia | 1 (12,5) | 7 (29,2) | 0,64 |
| Duración de tratamiento GS, meses | 36 (20-66) | 33 (9-74) | 0,52 |
| Falta de suspensión GS | 6/8 (75) | 8/15 (53,3) | 0,39 |
| Requerimiento GS y ≥ 2 ahorradores GS | 7 (87,5) | 11 (45,8) | 0,05 |
| Refractarios | 5 (62,5) | 4 (16,7) | 0,02 |
| Recaídas | 8 (100) | 18 (75) | 0,30 |
| Tiempo a la primer recaída, meses | 10,5 (0,5-58,5) | 14 (6-23) | 0,78 |
| Remisiones con/sin tratamiento | 3 (37,5) | 12 (50) | 0,69 |
| Tiempo libre de enfermedad, meses | 3,7 (0-23,2) | 14,5 (6,9-30,5) | 0,38 |
GS: glucocorticoides sistémicos; RIC: rango intercuartílico.
Los pacientes mayores de 40años fueron más propensos a presentar remisiones con/sin tratamiento (p=0,69) y tuvieron un tiempo libre de enfermedad que fue en promedio 11meses más prolongado (p=0,38). Sin embargo, estos resultados no alcanzaron significancia estadística para establecer diferencias.
El inicio en las mucosas fue un predictor independiente del compromiso de múltiples mucosas (p=0,003).
DiscusiónEn nuestro estudio se encontraron dos resultados relevantes. En primer lugar se observó que el inicio del PV antes de los 40años puede ser un factor de mal pronóstico, ya que estos casos manifiestan con mayor frecuencia compromiso cutáneo generalizado, requieren mayor número de FA y son más refractarios a los tratamientos empleados. En segundo lugar, se evidenció que los pacientes que presentaron el comienzo de la enfermedad en las mucosas evolucionaron con compromiso de más de una de ellas, independientemente de la edad y del sexo.
El curso más benigno en los que desarrollaron PV después de los 40años se podría explicar por la teoría de la inmunosenescencia, tal como sucede en el lupus eritematoso sistémico de inicio tardío. La inmunosenescencia predispone a los adultos mayores a presentar una alta prevalencia de autoanticuerpos, enfermedades autoinmunes, cánceres e infecciones. Sin embargo, cuando una enfermedad autoinmune se presenta en edades avanzadas, suele tener un curso clínico benigno y respuesta satisfactoria a los tratamientos inmunosupresores, que se explica por el mayor número de célulasT reguladoras periféricas que se encuentran en estos pacientes18,19.
Al comparar nuestros resultados con los de Svecova20 en población eslovaca, encontramos como similitudes el predominio de PV en mujeres, la frecuencia del inicio del cuadro en mucosas, el compromiso genital, la frecuencia de recaídas y coincidencias con respecto a la azatioprina como FA más empleado. Por otro lado, observamos diferencias en el compromiso de más de una mucosa, que fue más frecuente en el trabajo consultado (68%) y en el tratamiento. La dosis inicial de GS comunicada por Svecova fue mayor a la de nuestro estudio (1,5-2mg/kg/día en el 64% de los pacientes), mientras que los FA fueron empleados con menor frecuencia por este autor (29%). Por último, en el trabajo consultado la frecuencia de casos refractarios al tratamiento fue inferior a la de nuestra casuística (14%) y alcanzaron la remisión con/sin tratamiento una cifra superior de pacientes (75%). Sin embargo, la mortalidad global comunicada por Svecova fue superior (11%).
El tratamiento en nuestro medio, con menores dosis iniciales de GS y mayor prescripción de FA, resulta en una frecuencia similar de recaídas, menor remisión y mayor refractariedad. Es probable que, en relación con los avances sobre la utilidad del rituximab en el PV y con las recomendaciones de la nueva guía de expertos, se modifique la estrategia terapéutica en la práctica clínica en los países latinoamericanos12,13. Sin embargo, todavía no existe consenso con respecto a cuál es el intervalo adecuado para efectuar los ciclos de mantenimiento (6meses vs 12meses), ni sobre la dosis óptima (500mg vs 1g) para prevenir las recaídas y mantener la remisión de la enfermedad21. Joly et al.12 consideran que el primer ciclo de mantenimiento debería administrarse tras 6meses del ciclo de tratamiento, debido a que el 73% de los pacientes de su estudio presentaron recaídas antes de los 12meses. En nuestro estudio, 4 pacientes presentaron recaída tras el primer ciclo de rituximab y en uno se produjo después del segundo.
Si bien no es la primera serie de pacientes con PV, este trabajo consigna con detalle el requerimiento de ingresos hospitalarios y la relación de las variables con la edad de inicio de la enfermedad, aspectos novedosos de interés para el conocimiento de esta enfermedad.
Las limitaciones de este trabajo están relacionadas con el diseño metodológico (estudio retrospectivo, unicéntrico, con un número bajo de casos) y el periodo de inclusión durante el cual el tratamiento de la enfermedad fue cambiando. Además, no se pudieron determinar autoanticuerpos anti-desmogleína por falta de disponibilidad del método. Finalmente, encontramos dificultad para comparar algunos resultados con la bibliografía, ya que aún no existe consenso mundial para clasificar la enfermedad como leve, moderada o grave13. Con respecto a esto último, consideramos primordial la definición de puntos de corte de las herramientas de medida de gravedad, al igual que la estandarización de conceptos como corticodependencia en PV.
En conclusión, en este estudio se ha observado que los pacientes con un inicio de la enfermedad antes de los 40años tienen un pronóstico peor y que el inicio de la enfermedad en las mucosas es un predictor independiente para la posterior afectación de múltiples mucosas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.