El condiloma acuminado está causado por el virus del papiloma humano (VPH), cuyos genotipos se han descrito tradicionalmente como de bajo y alto riesgo (AR) oncogénico. Clásicamente, los genotipos más frecuentes son el 6, el 11, el 16 y el 18, incluidos en las dos primeras vacunas desarrolladas. Nuestro objetivo es valorar cambios en la prevalencia de estos genotipos tras 10 años desde la instauración de la vacuna profiláctica en nuestro medio.
Material y métodosSe trata de un estudio observacional descriptivo retrospectivo realizado en la UITS de un Servicio de Dermatología entre enero de 2016 y junio de 2019, seleccionando posteriormente a los pacientes diagnosticados de condilomas acuminados.
ResultadosSe han diagnosticado 362 pacientes con condilomas acuminados, realizándose genotipado en 212 pacientes (58,6%). Se han detectado 32 genotipos distintos, siendo los más frecuentes el 6, el 11, el 16 y el 42. En el 93,9% la detección de VPH fue positiva, detectándose hasta 299 genotipos, lo que corresponde a 1,5 por paciente. En el 26,6% de pacientes se detectaron más de un genotipo distinto de VPH. En el 24,1% se detectó al menos un genotipo de AR. No se observó asociación estadísticamente significativa entre la presencia de un genotipo de AR y las variables estudiadas. En el 91,4% de las lesiones se aisló al menos uno de los cuatro genotipos cubiertos por las dos primeras vacunas desarrolladas.
ConclusionesLa prevalencia de los genotipos de VPH incluidos en las dos primeras vacunas profilácticas desarrolladas ha disminuido. La implicación de al menos uno de los cuatro genotipos más frecuentes se ha mantenido estable con respecto a hace 10 años. Las infecciones por múltiples genotipos y la presencia de al menos un genotipo de AR oncogénico ha aumentado ligeramente.
Genital warts are caused by the human papillomavirus (HPV), whose genotypes have traditionally been classified as low risk or high risk (oncogenic). The first 2 prophylactic vaccines included the most common genotypes at the time: HPV-6, HPV-11, HPV-16, and HPV-18. The aim of this study was to evaluate the prevalence of HPV types in our setting 10 years after the introduction of HPV vaccines.
Material and methodsDescriptive, observational, retrospective study of patients diagnosed with genital warts at the sexually transmitted infection unit of a dermatology department between January 2016 and June 2019.
ResultsIn total, 362 patients were diagnosed with genital warts during the study period, and 212 (58.6%) underwent genotyping. Thirty-two distinct HPV types were observed, the most common being HPV-6, HPV-11, HPV-16, and HPV-42. HPV DNA was detected in 93.9% of the samples analyzed, and there were 299 genotypes (mean, 1.5 per patient). Overall, 26.6% of patients had more than a single HPV genotype, while 24.1% had at least 1 high-risk type. No significant associations were found between the presence of high-risk HPV types and any of the study variables. At least 2 of the 4 HPV types targeted in the original vaccines were detected in 94.1% of lesions.
ConclusionsCompared to 10 years ago, the prevalences of HPV types included in the first 2 prophylactic vaccines have decreased, while the proportion of patients with at least 1 of the 4 most common types has remained unchanged. We also observed a slight increase in infections with multiple HPV types or at least 1 high-risk type.
El condiloma acuminado, o verruga genital, es la infección de transmisión sexual (ITS) más prevalente en el mundo1, estimándose que aproximadamente el 5-10% de la población tendrá al menos un episodio a lo largo de su vida2. Está causado por el virus del papiloma humano (VPH), el cual pertenece a la familia de virus reconocida como Papillomaviridae. Los diferentes papilomavirus se han descrito tradicionalmente como genotipos, ya que la clasificación se basa en el grado de homología de secuencia del ADN del virus. Los tipos se identifican por números siguiendo el orden histórico de su descripción. Más de 150 genotipos han sido identificados, y aproximadamente unos 40 pueden provocar infección a nivel genital. Tradicionalmente estos genotipos se han subdividido en función de su potencial capacidad de malignizar en tipos de bajo riesgo oncogénico, que se encuentran fundamentalmente en las verrugas genitales, y los tipos de alto riesgo que frecuentemente se asocian a carcinoma cervical invasor y a otros tumores malignos del área genital y orofaríngea3,4. De esta forma 18 tipos del VPH han sido clasificados como genotipos de alto riesgo (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73 y 82) y 16 fueron clasificados como genotipos de bajo riesgo (6, 11, 40, 42, 43, 44, 54, 61, 67, 69, 70, 71, 72, 81, 84 y 89). Aquellos que no pertenecen a ninguno de estos dos grupos se han considerado como de riesgo indeterminado5. Los VPH de alto riesgo se pueden diferenciar de los otros tipos de VPH principalmente por la estructura y función de los productos de E6 y E7. En las lesiones benignas causadas por el VPH, el ADN viral se encuentra en forma episómica, no integrado en el genoma de la célula hospedadora, al contrario que en las lesiones malignas6.
Clásicamente, los genotipos más frecuentemente aislados en las lesiones tisulares de condilomas acuminados son el 6, el 11, el 16 y el 18, genotipos incluidos en las dos primeras vacunas desarrolladas7. Estos genotipos son los más frecuentes independientemente del área geográfica estudiada, del sexo5 y de la presencia, o no, del virus de inmunodeficiencia humana (VIH)8. Existen estudios donde se demuestra la presencia de genotipos de alto riesgo oncogénicos hasta en el 35% de las verrugas genitales9, especialmente entre las mujeres10. En nuestro medio, según una tesis doctoral realizada durante los años 2007 y 2008, los cinco genotipos del VPH más prevalentes eran por orden de frecuencia decreciente, los genotipos VPH 6, 11, 16, 18 y 81, estando implicados en el 90% de las lesiones los cuatro genotipos más frecuentes. En dicho estudio se encontraron genotipos de alto riesgo oncogénico hasta en el 20% de condilomas acuminados1.
La determinación del genotipo de VPH no está indicada de rutina en pacientes con condilomas acuminados, ya que esto no aporta información clínica ni modifica el tratamiento, reservándose únicamente en casos de diagnóstico dudoso o en la población pediátrica, para descartar o confirmar la presencia de VPH por su posible asociación con un abuso sexual.
En los últimos años ha adquirido gran relevancia la administración de vacunas como una importante medida profiláctica para evitar la infección por el VPH, y de esta forma evitar y prevenir la aparición de lesiones precancerosas11. Una condición sine qua non del éxito de la prevención frente a las neoplasias asociadas al VPH es la administración de la vacuna antes del primer contacto sexual. Actualmente, existen tres vacunas autorizadas en España frente al VPH, siendo las primeras en desarrollarse la bivalente, que cubre únicamente frente a los tipos de VPH 16 y 1812 y la tetravalente, que protege frente a cuatro tipos de VPH (6, 11, 16, 18). Esta última vacuna es capaz de reducir la incidencia de verrugas genitales por su capacidad de inmunizar frente a los genotipos de bajo riesgo responsables de las mismas en la mayoría de ocasiones2. En 2017 se empezó a comercializar la tercera vacuna desarrollada, nonavalente (Gardasil-9®), que añade protección frente a VPH-31, 33, 45, 52 y 58. En el calendario vacunal está incluida la vacunación frente al VPH exclusivamente para las niñas y, por ahora, ninguna comunidad autónoma se ha planteado vacunar a los niños.
Nuestro objetivo es valorar cambios en la prevalencia de los genotipos de VPH encontrados en los condilomas acuminados más de 10 años después de la instauración de la vacuna profiláctica en nuestro medio. Como objetivo secundario, queremos determinar si ha disminuido gracias a la vacuna la prevalencia de genotipos de alto riesgo oncogénico y relacionar su presencia con alguna de las variables analizadas.
Material y métodoSe ha diseñado un estudio observacional ambispectivo, donde se han recogido datos tanto de forma retrospectiva como de forma prospectiva y consecutiva de todos los pacientes que han consultado en la Unidad de Infecciones de Transmisión Sexual (UITS) del Servicio de Dermatología del Consorcio Hospital General Universitario de Valencia (CHGUV), desde enero de 2016 hasta junio de 2019. Nuestra UITS atiende a cualquier paciente tanto del área hospitalaria como de fuera de ella. Estos podían consultar de urgencias, remitidos directamente a urgencias de dermatología cualquier día del año, remitidos desde los centros de atención primaria vinculados al hospital, de los dermatólogos de área, así como de otros servicios hospitalarios, especialmente desde la Unidad de Enfermedades Infecciosas, ginecología o urología. Posteriormente se seleccionaron todos los pacientes diagnosticados de condiloma acuminado.
Desde hace más de 10 años, en nuestra UITS se realiza genotipado del VPH en los pacientes con condilomas acuminados de rutina, siempre y cuando el paciente acepte, con un objetivo tanto diagnóstico como investigacional. En estos pacientes se realizó una toma de biopsia de tejido que se seccionaba en dos fragmentos, uno para estudio histológico con hematoxilina-eosina y otro para tipaje del VPH mediante la técnica HPV Direct Flow CHIP®, un kit de diagnóstico in vitro del virus. Permite la detección cualitativa y el genotipado de 36 genotipos de VPH mediante la amplificación de un fragmento de la región L1 del papilomavirus mediante PCR seguido de hibridación reversa sobre una membrana que contiene sondas específicas. Además, en este protocolo, las muestras clínicas pueden amplificarse directamente, sin necesidad de una extracción previa de ADN.
Se recogieron datos epidemiológicos (sexo, edad, nacionalidad, orientación sexual, motivo de consulta, modo de contacto en la UITS, antecedentes de ITS previas, vacunación previa frente al VPH), así como datos clínicos (localización de los condilomas, genotipos detectados, afectación interna detectada con anuscopia) mediante una entrevista oral abierta y un cuestionario estandarizado previamente autorizado por el por el Comité Ético de Investigación Clínica de nuestro centro.
Se realizó un análisis estadístico descriptivo de todas las variables, empleando la media y la desviación estándar (DS) para variables cuantitativas y porcentajes para variables cualitativas. Los contrastes de hipótesis se realizaron empleando el test χ2 o el test exacta de Fisher según conviniera. Los datos estadísticos se analizaron mediante el programa SPSS versión 21.0 (IBM Corp., Armonk, NY) y se consideró significativo un p valor<0,05.
ResultadosDurante el periodo comprendido entre enero de 2016 hasta junio de 2019, se han visitado a un total de 1.181 pacientes con sospecha de enfermedad venérea en la UITS del CHGUV, los cuales han generado un total de 1.254 primeras visitas y se han realizado 1.003 diagnósticos de ITS. Del total de diagnósticos venéreos, 702 (70%) se realizaron en varones cisgénero y 301 (30%) en mujeres cisgénero. No hubieron casos de personas transgénero.
Se han diagnosticado un total de 362 pacientes con condilomas acuminados, constituyendo el 36,8% del total de ITS diagnosticadas. El 61% de los diagnósticos se realizó en varones (221) con una edad media de 36,5 años y el 39% (141) en mujeres con una edad media de 34,6 años, sin diferencias estadísticamente significativas. Se detectaron 29 casos (8%) en menores de 20 años, 115 casos (31,8%) entre los 21 a los 30 años, 106 casos (29,3%) entre los 31 a los 40 años, 75 casos (20,7%) entre los 41 a los 50 años y 37 casos (10,2%) en mayores de 50 años. El 83,5% de los pacientes (285) heterosexuales, el 86,5% (313) de nacionalidad española y el 16,2% (58) VIH positivos. No existían diferencias estadísticamente significativas en la edad media de los pacientes en función del sexo (hombres 35 años vs. mujeres 34 años, p = 0,3) o de la orientación sexual (heterosexuales 35 años vs. homosexuales 33 años, p = 0,2).
Se realizó genotipado de la lesión en 212 pacientes (58,6%), siendo negativo para la detección de VPH en 13 pacientes (6,1%). Se han detectado 32 genotipos distintos. En 199 pacientes (93,9%) la detección de VPH fue positiva, detectándose un total de 299 genotipos, lo que corresponde a 1,5 por paciente. En 53 de los 199 pacientes (26,6%) se detectaron más de un genotipo distinto de VPH. En 48 pacientes (24,1%) se detectó al menos un genotipo de alto riesgo. Con base en la clasificación del genotipo bajo riesgo/alto riesgo, los resultados obtenidos en nuestro estudio se muestran en la tabla 1. Para facilitar tanto el análisis estadístico como la exposición de los resultados, se incluyeron los genotipos de riesgo intermedio como de bajo riesgo.
Prevalencia de la infección por virus del papiloma humano en las lesiones de condiloma acuminado, atendiendo a la clasificación de bajo riesgo y alto riesgo
| Número de casos (%) | Valor p | |||
|---|---|---|---|---|
| Hombres(n = 118) | Mujeres(n = 81) | Total(n = 199) | ||
| Número de genotipos distintos | ||||
| 1 | 93 (78,8) | 53 (65,4) | 146 (73,4) | |
| 2 | 14 (11,9) | 10 (12,3) | 24 (12,1) | 0,7 |
| 3 | 6 (5,1) | 11 (13,6) | 17 (8,5) | |
| 4 | 3 (2,5) | 4 (4,9) | 7 (3,5) | |
| 5 | 2 (1,7) | 2 (2,4) | 4 (2) | |
| 6 | 0 (0) | 1 (1,4) | 1 (0,5) | |
| ≥ 2 genotipos distintos | 25 (21,1) | 28 (34,5) | 53 (26,6) | 0,04 |
| ≥ 1 genotipos de BR* (sin genotipos de AR) | 96 (81,3) | 54 (66,7) | 150 (75,4) | 0,04 |
| ≥ 1 genotipo de AR (sin genotipos de BR ni RI) | 4 (3,4) | 4 (4,9) | 8 (4) | 0,4 |
| Genotipos de BR* y de AR | 20 (16,9) | 20 (24,7) | 40 (20,1) | 1,0 |
| VPH-6/VPH-11 | 109 (92,4) | 64 (79) | 173 (86,9) | 0,04 |
| VPH-16/ VPH-18 | 9 (7,6) | 10 (12,3) | 19 (9,5) | 0,3 |
| VPH-6/VPH-11/VPH-16/VPH-18 | 113 (95,7) | 69 (85,2) | 182 (91,4) | 0,06 |
| VPH-6/VPH-11/VPH-16/VPH-18 exclusivamente | 93 (78,8) | 48 (59,2) | 141 (70,8) | 0,01 |
BR: bajo riesgo; AR: alto riesgo; RI: riesgo intermedio; VPH: virus del papiloma humano.
Tal como refleja la tabla 2, no se observa asociación estadísticamente significativa entre la presencia de un genotipo de alto riesgo y las siguientes variables estudiadas: sexo, edad media, orientación sexual, nacionalidad, localización de las lesiones, antecedente de condilomas acuminados o presencia de VIH.
Variables estudiadas asociadas a genotipos de VPH de alto riesgo
| Datos | Número de casos (%) | Valor p | |
|---|---|---|---|
| AR-Sí(n = 48) | AR-No(n = 151) | ||
| Sexo | |||
| Hombre | 23 (47,9) | 96 (63,6) | 0,06 |
| Mujer | 25 (52,1) | 55 (36,4) | |
| Edad media, años ± SD | 35,3 ± 11,8 | 35,2 ± 11,5 | 1,0 |
| Edad menor de 30 años | |||
| Sí | 19 (39,6) | 60 (39,5) | 0,1 |
| No | 29 (60,4) | 91 (60,5) | |
| Edad menor de 40 años | |||
| Sí | 32 (66,7) | 102 (67,1) | 0,1 |
| No | 16 (33,3) | 49 (32,9) | |
| Orientación sexual | |||
| Heterosexual | 39 (81,3) | 119 (78,8) | 1,0 |
| Homosexual | 9 (18,7) | 29 (19,2) | |
| Nacionalidad | |||
| España | 43 (89,6) | 129 (85,4) | 0,6 |
| Otra | 5 (10,4) | 22 (14,6) | |
| Localización de las lesiones | |||
| Anal/Perianal | 20 (41,7) | 71 (47) | |
| Resto | 28 (58,3) | 80 (53) | 0,5 |
| ITS previas | |||
| Sí | 22 (45,8) | 58 (38,4) | 0,5 |
| No | 26 (54,2) | 87 (57,6) | |
| Presencia de VIH | |||
| Sí | 9 (18,7) | 26 (17,2) | 1,0 |
| No | 39 (81,3) | 123 (82,8) | |
| Antecedente de CA | |||
| Sí | 6 (12,5) | 22 (14,6) | 0,4 |
AR: alto riesgo; ITS: infecciones de transmisión sexual; VIH: virus de inmunodeficiencia humana; VPH: virus de papiloma humano; CA: condilomas acuminados; SD: desviación estándar.
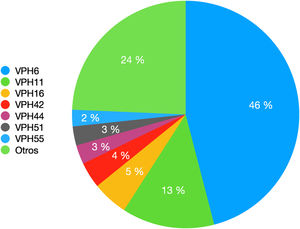
Los genotipos del VPH encontrados por orden de frecuencia decreciente se reflejan en la figura 1. Otros genotipos detectados son el VPH-31, VPH-52 y VPH-73 en seis pacientes (3%) o el VPH-18 y VPH-62 en cinco pacientes (2,5%). Se han detectado cuatro casos (2%) de cada uno de los siguientes genotipos de VPH: 43, 68, 81. Se han detectado tres casos (1,5%) de cada uno de los siguientes genotipos de VPH: 35, 39, 45, 54. Se han detectado dos casos (1%) de cada uno de los siguientes genotipos de VPH: 40, 53, 56, 61, 66, 72, 82. Finalmente, se ha detectado un (0,5%) caso de cada uno de los siguientes genotipos de VPH: 2, 31, 58, 67, 70, 84.
Ningún varón había sido vacunado en la infancia, mientras que 14 de las 141 mujeres diagnosticadas de condilomas acuminados (9,9%) habían sido vacunadas previamente con la vacuna profiláctica frente al VPH, cinco de ellas con Cervarix® detectándose en dos de ellas un VPH-6, en otras dos un VPH- 11 y en una de ellas un VPH-40. Otra paciente estaba vacunada también con Cervarix® y se detectaron cuatro genotipos distintos (6, 39, 51, 73) y en otra de ellas se detectaron tres genotipos distintos (11, 42, 67). De las otras siete pacientes vacunadas, en cinco de ellas se desconocía el tipo de vacuna recibida y en otras dos pacientes vacunadas con Cervarix®, la detección de VPH fue negativa. Ningún hombre había sido vacunado frente al VPH.
DiscusiónEn el presente trabajo hemos evidenciado que los condilomas acuminados son la ITS más prevalente en nuestro medio, constituyendo el 36,8% del total de ITS diagnosticadas, en consonancia con la UITS del Instituto Catalán de la Salud13. Sabemos que las características de una consulta monográfica hospitalaria puede influir en las de tipo de paciente observado y, por tanto, encontrar diferencias con otras UITS donde se asistan enfermedades agudas como la del Hospital Clínic de Barcelona14.
Pese a haber más hombres diagnosticados de condiloma acuminado, este diagnóstico representaba solo el 31% de los varones diagnosticados de una ITS, pero casi el 50% de todas las mujeres con una ITS, con diferencias estadísticamente significativas. Esto se encuentra en consonancia con el trabajo doctoral del Dr. Hernández, en el que el mayor porcentaje de casos (54,7%) fue diagnosticado entre mujeres1. Este trabajo representa mejor la prevalencia por sexo de esta enfermedad dado que recoge pacientes visitados en nuestra UITS durante tres años.
La tendencia sexual predominante ha sido la heterosexual en el 83% de nuestros pacientes, en consonancia con lo publicado en una gran cohorte de Alemania11 o de Portugal. La edad media de nuestros pacientes diagnosticados de condilomas acuminados ha sido de 35 años. Azevedo et al. observaron que los homosexuales afectados eran más jóvenes, diferencias que no hemos podido establecer en nuestro estudio10.
Hemos detectado ADN de VPH en el 94% de los pacientes genotipados, porcentaje mayor que algunas series publicadas15, aunque discretamente menor que el 99% descrito por Hernández-Bel1. Estas diferencias han podido ser debidas a errores en el diagnóstico clínico-histopatológico-molecular y a una menor exhaustividad a la hora de la toma de muestras (tejido insuficiente, por ejemplo) al ser un estudio enmarcado dentro de la práctica clínica habitual.
Hemos detectado 32 genotipos distintos, el doble que los reportados por Rana Al-Awadhi et al. en su estudio con 156 pacientes en Kuwait9, y 1,5 genotipos distintos por paciente, siendo esta proporción 1,1 hace 10 años1. En dicho momento el 14% de pacientes presentaban infección por dos genotipos distintos, no encontrándose ningún caso con más de dos genotipos. En nuestro estudio, el 26,6% de los pacientes ha presentado dos o más genotipos distintos, prácticamente la misma tasa que la publicada por Hernández-Suárez et al.5 Las coinfecciones han sido significativamente más frecuente entre las mujeres que en los varones. La vacunación sistemática exclusivamente de las mujeres en la infancia así como el uso de diferentes métodos diagnósticos de genotipado a lo largo de los años pueden explicar este hallazgo.
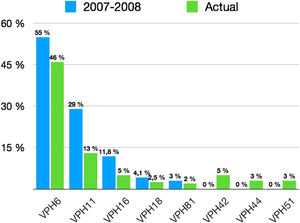
En cuanto al genotipo específico de VPH, hemos observado un cambio en la prevalencia de los más frecuentemente detectados en comparación con el estudio realizado hace 10 años previamente a la instauración de la vacunación profiláctica frente al VPH (fig. 2).
Teniendo en cuenta el número de pacientes en los que se ha detectado ADN de VPH, el 24% de ellos han presentado un VPH de alto riesgo oncogénico, frente al 20% descrito por Hernández-Bel1, a expensas principalmente del aumento de genotipos no incluidos en las vacunas profilácticas como el 51, 31, 52 o 73. La presencia de estos genotipos no se ha relacionado con ninguna de las variables clínico-epidemiológicas estudiadas, en consonancia con la literatura9, aunque algunos estudios han relacionado la aparición de genotipos de alto riesgo con una edad menor o con un tamaño mayor de las lesiones anogenitales9. Por otra parte, solo en ocho de los 199 pacientes genotipados (4%) se detectó un genotipo de alto riesgo en ausencia de genotipos de bajo riesgo. Aunque es infrecuente que los genotipos de alto riesgo causen condilomas acuminados o incluso pueda tratarse de un error de detección en el laboratorio, el porcentaje es similar al de otras series publicadas1,16.
Obviamente la prevalencia de genotipos incluidos en la vacuna bivalente y tetravalente (6, 11, 16, 18) ha disminuido. Sin embargo, el porcentaje de genotipos de bajo riesgo en ausencia de genotipos de alto riesgo se ha mantenido estable (75,4%), en comparación con la tesis doctoral anteriormente mencionada (78,7%), principalmente a expensas del aumento del número de pacientes con condilomas acuminados provocados por VPH-61. Esto puede ser debido a que en en la Comunidad Valenciana se administró la vacuna bivalente a partir de 2011 en lugar de la vacuna tetravalente, la cual ha demostrado ser altamente efectiva contra las cepas de VPH que tienen más probabilidad de causar verrugas genitales2.
En nuestro estudio, la presencia de genotipos de bajo riesgo oncogénico con ausencia de genotipos de alto ha sido más frecuente entre los varones de forma estadísticamente significativa. Esta tendencia también se observaba en 2007-2008 (83,1 vs. 75%, p = 0,19)1. Existen varios trabajos publicados, multicéntricos con un mayor número de pacientes, como el del grupo francés de Aubin, que también encuentran estas diferencias entre sexo y genotipos del VPH de alto y bajo riesgo con resultados estadísticamente significativos17.
En nuestra serie, en el 70,8% de todos los casos de condilomas acuminados han estado implicados únicamente los genotipos del VPH-6, 11, 16 y 18, un porcentaje menor del estudiado hace 10 años (87%), principalmente por la implementación de la vacunación frente al VPH en mujeres. Las mujeres vacunadas de forma profiláctica en la infancia habrán estado protegidas frente al VPH-6 y 11 y, por tanto, no habrán desarrollado lesiones en caso de infectarse. Sin embargo, dado que las infecciones por múltiples genotipos han aumentado hasta el 26,6% de todas las lesiones (14,2% en dicho estudio1), la implicación de al menos uno de estos cuatro genotipos (solos o en combinación con otros genotipos) se ha mantenido estable (91,4% en nuestra serie vs. 92,3% en la serie de Hernández-Bel)1. Esto matiza la afirmación que se realizó entonces de que «si en los próximos años se lograra una vacunación masiva frente al VPH en nuestro medio sanitario, alrededor del 90% de los condilomas analizados podrían evitarse con la administración de la vacuna tetravalente», puesto que la vacunación parcial universal de una parte de la población (únicamente mujeres) ha hecho que se mantenga la presencia de estos cuatro genotipos en nueve de cada 10 lesiones. Únicamente el 10% de las mujeres diagnosticadas de condilomas acuminados habían sido vacunadas frente al VPH, porcentaje similar al publicado recientemente en Alemania11. Al presentar estas una media de edad de 34 años, se entiende que cuando se incluyó en el calendario vacunal hace aproximadamente 10 años, la mayoría de ellas no llegaron a ser incluidas.
Como conclusión, destacamos que la prevalencia de los genotipos de VPH incluidos en las dos primeras vacunas profilácticas desarrolladas y que clásicamente eran responsables de la mayoría de condilomas acuminados han disminuido a expensas de la aparición de otros genotipos de VPH que han aumentado. Sin embargo, la implicación de al menos uno de los cuatro genotipos más frecuentes se ha mantenido estable con respecto a hace 10 años. Por otra parte, las infecciones por múltiples genotipos y la presencia de al menos un genotipo de alto riesgo oncogénico ha aumentado ligeramente. Probablemente la política inicial de por un lado emplear la vacuna bivalente y no la tetravalente y, por otro lado, inmunizar únicamente a parte de la población (niñas) haya contribuido a estos resultados. Sería interesante realizar un gran estudio poblacional para determinar si la incidencia de condilomas acuminados ha disminuido, como si que parece demostrar la vacuna tetravalente frente a la bivalente y a las mujeres no vacunadas y, en unos años, valorar si la instauración de la nueva vacuna nonavalente, que cubre los genotipos de alto riesgo oncogénico 16, 18, 31, 33, 45, 52 y 58, así como los de bajo riesgo oncogénico 6 y 11, logra disminuir la prevalencia de genotipos de alto riesgo en las lesiones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.