La radiodermatitis aguda (RA) es el efecto adverso más común de la radioterapia. Actualmente, no existe un método objetivo y reproducible para medir RA.
ObjetivoEl objetivo principal es identificar y cuantificar los efectos de la radioterapia en la piel mediante tomografía de coherencia óptica (TCO) usando un modelo computacional. Los objetivos secundarios son determinar el grado de RA según diferentes esquemas de radioterapia y el efecto del tratamiento tópico adyuvante.
MétodosEstudio de serie de casos prospectivo unicéntrico de pacientes con cáncer de mama candidatas a radioterapia.
ResultadosTreinta y nueve mujeres fueron incluidas y distribuidas según el esquema de radioterapia de 15, 20 y 25 fracciones. Se diseñó un modelo computacional para analizar cuantitativamente los hallazgos de la TCO. Después de la radioterapia, la exploración TCO fue más sensible y mostró cambios en la vascularización en el 84,6% de los pacientes (frente al 69,2% de los pacientes con signos clínico-dermatoscópicos de RA). La TCO cuantificó un aumento en la vascularización al final de la radioterapia (p<0,05) y una disminución después de 3 meses (p=0,032). Los cambios en el eritema por TCO fueron más pronunciados en el régimen de 25 fracciones.
ConclusiónUn modelo computacional basado en TCO permite la identificación y cuantificación de los cambios de vascularización en la piel irradiada, incluso en ausencia de RA clínica. Esto puede permitir el diseño de protocolos estandarizados para RA más allá del color de la piel de los pacientes.
Acute radiation dermatitis (ARD) is the most widely reported radiotherapy-induced adverse event. Currently, there is no objective or reliable method to measure ARD.
ObjectiveOur main objective was to identify and quantify the effects of radiotherapy with a computational model using optical coherence tomography (OCT) skin scanning. Secondary objectives included determining the ARD impact of different radiotherapeutic schemes and adjuvant topical therapies.
MethodsWe conducted a prospective, single-center case series study in a tertiary referral center of patients with breast cancer who were eligible for whole breast radiotherapy (WBRT).
ResultsA total of 39 women were included and distributed according to the radiotherapeutic schemes (15, 20, and 25 fractions). A computational model was designed to quantitatively analyze OCT findings. After radiotherapy, OCT scanning was more sensitive revealing vascularization changes in 84.6% of the patients (vs 69.2% of the patients with ARD by clinical examination). OCT quantified an increased vascularization at the end of WBRT (P<.05) and a decrease after 3 months (P=.032). Erythematous skin changes by OCT were more pronounced in the 25-fraction regime.
ConclusionAn OCT computational model allowed for the identification and quantification of vascularization changes on irradiated skin, even in the absence of clinical ARD. This may allow the design of standardized protocols for ARD beyond the skin color of the patients involved.
El cáncer de mama es la neoplasia maligna más prevalente en todo el mundo, ya que representará 1 de cada 4 neoplasias malignas diagnosticadas en mujeres1. Para las mujeres con cáncer de mama en estadio inicial, la radioterapia adyuvante de la mama es un componente esencial de la terapia conservadora y se ha demostrado que disminuye las recidivas locales y mejora la supervivencia global2–4. La irradiación de toda la mama (WBI) anteriormente se realizaba utilizando un programa fraccionado estándar de 5 semanas con una dosis total de 50Gy. Sin embargo, 3 grandes ensayos clínicos aleatorizados han demostrado que la WBI hipofraccionada, con una dosis total de 40,05-42Gy, consigue un control local de la enfermedad y unos resultados cosméticos equivalentes a los del fraccionamiento estándar. Por lo tanto, un régimen de WBI hipofraccionado de 3 semanas se considera actualmente el tratamiento estándar de aquellas pacientes con un cáncer de mama en estadio temprano, que sea operable y con ganglios negativos4,5. Además, la adición de una dosis de refuerzo de radiación al lecho tumoral será una pieza importante en la terapia adyuvante, ya que mejorará el control local si se compara con la WBI sin dosis de refuerzo6,7.
A pesar de estos nuevos avances, la toxicidad cutánea aguda o crónica sigue siendo un hallazgo frecuente (80-90% de los pacientes); esta toxicidad tendrá además una gravedad y una progresión que serán impredecibles8–10. Esto ha impulsado varios intentos de encontrar cual es el mejor tratamiento tópico y profiláctico para la radiodermitis aguda (RA). Sin embargo, por el momento el tratamiento de la RA no está estandarizado ya que no está basado en la evidencia científica; múltiples agentes han sido propuestos como alternativa terapéutica (aloe-vera, sucralfato, esteroides, trolamina, ácido hialurónico, biafina, caléndula, manzanilla, aceite de almendras, vitamina C, etc.)8,10–17. Se han desarrollado diferentes escalas de clasificación para la RA (RTOG, NCI CTCAE, LENT/SOMA)18–20. Sin embargo, todas ellas son algo subjetivas y difíciles de replicar21–24. La tomografía de coherencia óptica (TCO) es una modalidad de imagen no invasiva basada en la interferometría de baja coherencia que proporciona imágenes in vivo y detalladas de las microestructuras tisulares superficiales hasta una profundidad de 2mm con una resolución en tiempo real de 4-10μm. La TCO puede utilizarse para adquirir imágenes de las capas dérmica y epidérmica de la piel, los apéndices cutáneos y los vasos sanguíneos. Además, la TCO dinámica (D-TCO) permite detectar el flujo sanguíneo in vivo y visualizar la microvasculatura cutánea25. Por lo tanto, la TCO permite estudiar un proceso continuo como la cicatrización de heridas y la vascularización26, y podría ser una herramienta prometedora en el tratamiento y la investigación de varias patologías cutáneas27,28.
El objetivo principal del estudio fue demostrar la utilidad de la TCO para medir los cambios cutáneos inducidos por la radioterapia. Los objetivos secundarios fueron comparar el grado de la RD entre distintos regímenes de radioterapia y evaluar la tolerabilidad de un tratamiento tópico estandarizado.
Material y métodosDiseño del estudioSe trata de un estudio prospectivo y observacional diseñado con la finalidad de evaluar los cambios cutáneos observados mediante el examen clínico, la dermatoscopia e imágenes de TCO obtenidas a partir de un escáner dinámico de la piel, en pacientes incluidas de manera consecutiva y diagnosticadas de cáncer de mama en un centro de referencia terciario sometidas a radioterapia estándar en 3 esquemas diferentes (15, 20 o 25 fracciones).
Además de las recomendaciones generales, para poder estandarizar la cohorte, se utilizó una crema reparadora hipoalergénica, que contenía sulfato de cobre, zinc y un ingrediente reparador postbiótico C+Restore®, el cual se aplicó diariamente, en las zonas diana hasta 1 mes después de finalizar la radioterapia1. Se registraron todos los acontecimientos adversos incluida la RA durante y 3 meses después de la radioterapia.
Población de estudioPacientes voluntarias mayores de 18 años candidatas a radioterapia por cáncer de mama según el esquema habitual del servicio de radio-oncología de un centro de referencia terciario. Fecha de inclusión: de enero de 2020 a julio de 2021 hasta incluir, al menos, 10 pacientes de cada grupo de fraccionamiento. La recogida de datos concluyó en noviembre del 2021. Todas las pacientes firmaron un consentimiento informado y el estudio fue aprobado por el comité ético de investigación del Hospital Clínic de Barcelona (registro HCB/2019/0796).
Los 3 esquemas de radioterapia mamaria utilizados fueron un esquema hipofraccionado con una dosis total de 40,05Gy en 15 fracciones (2,67Gy/fracción) (esquema-15), el mismo esquema hipofraccionado más una dosis de refuerzo secuencial en el lecho quirúrgico para una dosis total de 13. 35Gy en 5 fracciones (2,67Gy/fracción) (esquema-20), y radioterapia de mama y ganglios linfáticos regionales en un esquema normofraccionado más refuerzo concomitante para una dosis total de 57,5Gy en 25 fracciones (2,30Gy/fracción) (esquema-25).
Intervenciones y evaluacionesLos pacientes fueron controlados estrechamente por el dermatólogo y el oncólogo radioterapeuta para garantizar la detección precoz de toxicidad cutánea en el campo irradiado. Se descartaron todas las afecciones dermatológicas cutáneas previas. Los participantes fueron evaluados clínicamente, mediante dermatoscopia y TCO-scanning en 3 momentos diferentes: antes (t0), al final (dosis máxima recibida, tF) y 3 meses después del final de la radioterapia (t+3m). Se permitió un margen de ventana de ±3 días en tF y de ±7 días en t+3m. Ambas mamas (tratadas y no tratadas) se examinaron y registraron sistemáticamente mediante imágenes clínicas y de dermatoscopia de áreas de 25mm×25mm, y mosaicos de TCO (6mm×6mm) para cubrir los 4 cuadrantes de ambas mamas. La mama no irradiada se utilizó sistemáticamente como control interno. Figuras suplementarias (Fig. S1) muestran un ejemplo de la información dinámica obtenida por la TCO.
El grado de la RA se categorizó en base a la escala de Criterios Terminológicos Comunes para Eventos Adversos (CTCAE) (grado 0: ausencia de lesiones perceptivas, grado I: presencia de eritema leve, descamación seca; grado II: presencia de eritema de moderado a leve, descamación húmeda irregular, confinada principalmente a los pliegues y arrugas de la piel, edema moderado; grado III: presencia de descamación húmeda en zonas distintas de los pliegues o arrugas de la piel; hemorragia inducida por traumatismo menor o abrasión; y grado IV: presencia de necrosis cutánea o úlceras).
Antes de la radioterapia, se evaluaron el estado funcional basal, los síntomas y el estado general de rendimiento de los pacientes mediante un cuestionario de calidad de vida (EORTC QLQ-C30)25. Al final del estudio, se midió la tolerancia cutánea de los pacientes mediante una prueba estandarizada (calidad de vida a nivel dermatológico; DLQI).
Análisis estadísticoPara realizar los análisis estadísticos se utilizó SPSS con python y bibliotecas estadísticas y de procesamiento de imágenes (statsmodel, opencv, skimage y numpy). Se utilizaron ANOVA y la prueba de Chi-cuadrado para evaluar las diferencias intergrupos entre las variables cuantitativas y cualitativas. Para comparar las determinaciones de la TCO, primero normalizamos las mediciones intrapaciente utilizando la 1ª adquisición de cada mama (no irradiada). A continuación, calculamos las diferencias en el biomarcador de vascularización en los 2 puntos posteriores en el tiempo y calculamos las diferencias estadísticas entre las adquisiciones mediante la prueba t.
ResultadosPoblación de estudio y características basalesOnce de los 59 pacientes invitados a participar se negaron a hacerlo, 9 se perdieron durante el seguimiento debido al bloqueo por el COVID-19, y 39 fueron incluidos y completaron el análisis por protocolo (Fig. 1). La tabla 1 del apéndice AT (véase el material suplementario) muestra los datos demográficos de los participantes incluidos.
En general, la edad media de los pacientes fue de 58,5 años, tenían un fototipo predominantemente claro (I-III, 76,92%) y eran no fumadores (79,49%). En cuanto a los esquemas de radioterapia, el 38,46% de los pacientes recibieron el esquema-15; el 35,89% el esquema-20; y el 24,64%, el esquema-25. Se observaron diferencias estadísticamente significativas entre los distintos grupos de radioterapia en cuanto a la edad (mayor en el esquema-25; P=.0078) y el índice de masa corporal (IMC) (mayor en el esquema-25; P=.0392). No se observaron diferencias significativas en función del fototipo cutáneo, el hábito tabáquico o el estado funcional basal.
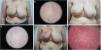
Cambios dermatológicos inducidos por la radioterapiaEl examen clínico y la dermatoscopia permitieron detectar la RA en el 69,2% de los pacientes. Al final de la terapia (tF), 12 pacientes (30,8%) no presentaban RA, 25 pacientes (64,1%) tenían RA de grado 1, y 2 pacientes (5,1%) presentaban RA de grado 2. Ningún paciente presentó toxicidad de grado 3-4. Ningún paciente presentó toxicidad de grado 3-4. En t+3m, los pacientes no mostraron ningún cambio clínico ni medible dermatoscópicamente (Fig. 2).
Evaluación de la exploración con la TCOSe diseñó un novedoso modelo computacional para procesar volúmenes de la TCO y detectar la cantidad de sangre en la imagen - TCO de la muestra. La imagen - TCO podía detectar diferencias en cuanto a la vascularización de la piel y cuantificar la cantidad de sangre en cada volumen. Mediante una serie de técnicas de visión por ordenador se dibujaron las regiones vascularizadas. Brevemente, primero utilizamos una separación basada en el color para dibujar la circulación sanguínea del volumen y las estructuras de la piel. A continuación, se utilizaron una serie de técnicas morfológicas basadas en operadores de dilatación y erosión para eliminar cualquier ruido adquirido a nivel de fotograma. Por último, se añadió la información volumétrica y se filtró para eliminar cualquier ruido provocado por los movimientos involuntarios del paciente. A continuación, se utilizó la suma de los píxeles rojos de la imagen como biomarcador cuantificable del eritema (y la vascularización) en un volumen de la TCO.
Se realizó un enfoque comparativo estudiando los cambios cutáneos de cada paciente en la mama irradiada frente a la no irradiada al final de la radioterapia (tF). Los análisis cuantitativos mostraron un aumento estadísticamente significativo del eritema tras irradiar los campos (tF) (P<.05) (Fig. 3A). Luego, se repitió el proceso 3 meses después de finalizar el tratamiento (t+3m). Los resultados mostraron una disminución estadísticamente relevante del eritema (P=.032) en los campos irradiados (Fig. 3A).
Resultados cuantitativos de la vascularización por la TCO de toda la cohorte. Los números positivos reflejan un volumen sanguíneo superior al de la muestra comparativa. Los números negativos indican una disminución del flujo. Las mamas tratadas y no tratadas reflejan la comparación entre la mama que recibió radiación y la contralateral que no la recibió en ese momento. A: Comparación entre las mamas contralaterales tratadas y no tratadas en los puntos tF (azul: final de la terapia) y t+3m en el tiempo (naranja: 3 meses después del final de la terapia). B: Comparación de las mamas tratadas en los puntos tF (azul) y t+3m en el tiempo (naranja) frente a t0 (línea de base). C: Comparación de las mamas no tratadas en los puntos tF (azul) y t+3m en el tiempo (naranja), frente a t0.
Cada mama también se comparó consigo misma al inicio (t0) en diferentes puntos temporales; en tF la mama irradiada mostró un aumento significativo del índice de eritema (P=.024) (Fig. 3B) y una disminución del índice de eritema en t+3m (P=.07) (Fig. 3B). A este respecto, las imágenes de la TCO revelaron diferencias estadísticamente significativas en cuanto a la vascularización de las mamas tratadas.
En general, al final de la radioterapia (tF), casi todas las pacientes (33 de 39) mostraron un aumento significativo de su índice de eritema según la TCO (Figs. 3B y 4), mientras que, en t+3m, las mamas irradiadas mostraron una disminución significativa del índice de eritema (Figs. 3B y 4). En cuanto a las mamas no irradiadas evaluadas en los 3 momentos diferentes, no se encontraron diferencias significativas (Fig. 3C).
Evolución de la vascularización con la radioterapia medida cuantitativamente con imágenes de la TCO a través de diferentes esquemas de fraccionamiento de la radioterapia. A: Cambios en la vascularización de todas las muestras de la cohorte al inicio de la RT (t0), al final (tF) y 3 meses después (t+3m). B: Cambios medios de vascularización comparando los 3 regímenes del esquema de radioterapia: Esquemas de 15 (rosa claro), 20 (rosa oscuro) y 25 fracciones (negro).
También se compararon los cambios de vascularización mediante la TCO a lo largo del tratamiento radioterápico (t0, tF y t+3m) en los 3 protocolos de esquemas radioterápicos diferentes (regímenes de 15, 20 y 25 fracciones) (Fig. 4). La TCO mostró claramente diferencias cuantitativas entre los regímenes en términos del cambio medio del índice de eritema (Fig. 4B). El esquema-25 desencadenó los mayores cambios de intensidad del índice de eritema, con un aumento significativo en tF. En t+3m, el régimen más corto (15 fracciones) alcanzó la disminución más prominente del índice de eritema frente al tratamiento más largo (25 fracciones), que mostró la disminución más baja del índice de eritema (Fig. 4B).
Calidad de vida y tolerancia del tratamiento adyuvanteNo se notificó ningún acontecimiento adverso asociado a las pruebas de imagen con la TCO ni con el tratamiento adyuvante tópico. Todos los pacientes mostraron una excelente tolerancia a la crema reparadora adyuvante. Ninguno de ellos abandonó la rutina diaria de utilizar la terapia adyuvante en las zonas irradiadas.
DiscusiónLa RA es el acontecimiento adverso asociado con mayor frecuencia a la radioterapia mamaria. A pesar de que suele ser de intensidad leve a moderada, puede afectar enormemente a la calidad de vida de las pacientes y poner en riesgo la finalización del protocolo de la radioterapia22. En la actualidad, las clasificaciones de la RA utilizadas con mayor frecuencia son las escalas clínicas subjetivas basadas en los cambios cutáneos percibidos a simple vista, los cuales serán difíciles de reproducir y de cuantificar21. La falta de una evaluación objetivamente cuantificable de la RA plantea retos importantes, como la predicción precisa del grado de toxicidad cutánea, el desarrollo de dermatitis crónica por radiación y la medición del efecto de los tratamientos tópicos adyuvantes. El presente estudio demuestra que la exploración cutánea no invasiva con la TCO detecta cambios estadísticamente significativos en la piel irradiada tras la radioterapia mediante un nuevo índice de eritema computacional cuantitativo objetivo.
Como se demostró en este estudio, el examen clínico apenas podía clasificar la RA en los grados 0, 1 ó 2, con diferencias muy sutiles entre cada grupo. Además, la dermatoscopia no fue lo suficientemente sensible para identificar cambios en la piel y casi un tercio de los pacientes no presentaba ningún cambio. Por el contrario, mediante un algoritmo específicamente diseñado de imágenes dinámicas de la TCO, pudimos detectar y cuantificar los cambios inducidos en diversas zonas irradiadas incluso cuando el examen clínico no permitía percibir tales diferencias. El análisis comparativo con la mama no irradiada demostró que estos cambios sólo se observaban en las zonas tratadas. Estos resultados respaldan la opinión de que las diferencias observadas en la TCO de la mama irradiada son reales y no se deben a artefactos de medición o cambios fisiológicos. Por lo tanto, la exploración cutánea con la TCO permite la medición cuantitativa del eritema asociado a los cambios cutáneos inducidos por la radioterapia.
En segundo lugar, las imágenes de la TCO pudieron demostrar que los cambios de vascularización alcanzan su máximo nivel de intensidad hacia el final de la radioterapia, con el mayor aumento del índice de eritema frente a la línea de base y 3 meses después de la radioterapia. En este punto, la piel ha recibido la dosis total de radiación y el proceso de cicatrización aún está en sus inicios. Los cambios más destacados se observaron en el esquema-25: pacientes con mayor riesgo de recurrencia locorregional que, en consecuencia, reciben radioterapia de mama y ganglios linfáticos regionales.
Además, 3 meses después de finalizar la radioterapia, las imágenes de la TCO revelaron una disminución significativa del índice de eritema de las zonas objetivo en todos los grupos, incluso frente a la piel no tratada de referencia. Por lo tanto, los cambios observados parecen ser en su mayoría reversibles y centrados únicamente en las zonas irradiadas. Curiosamente, el esquema de radioterapia más corto (esquema-15) mostró una disminución más prominente del índice de eritema al final de la terapia.
Estudios anteriores han explorado el desarrollo y la aplicación de métodos objetivos para evaluar la vascularización, la inflamación y los cambios fibróticos inducidos por la radioterapia en la piel (imágenes hiperespectrales, imágenes térmicas, flujometría con láser Doppler, espectrofotometría de reflexión, oxigenación tisular). Lamentablemente, estas técnicas han tenido un éxito limitado y no se han aplicado en la práctica diaria29. Recientemente, un estudio prospectivo que evaluaba la RA con microscopía confocal de reflectancia (MCR) demostró que la exocitosis, la espongiosis, la epidermis desorganizada y las papilas dérmicas anormales estaban presentes con frecuencia en la RA y se correlacionaban con el grado de gravedad de la RA30. Entre las modalidades de imagen no invasivas utilizadas para evaluar la piel, la TCO puede proporcionar un equilibrio ideal entre la resolución y la profundidad, junto con el modo dinámico para medir los cambios de la vascularización. Una de las principales aplicaciones de la TCO en dermatología ha sido el estudio de los trastornos fibróticos26, ya que la orientación, la organización y las propiedades reflectantes del colágeno cutáneo hacen que el tejido sea birrefringente y detectable para la TCO. En cuanto a la RA, Photiou et al. demostraron que las imágenes semanales con la TCO de piel irradiada podían detectar la RA precoz con tasas de precisión de hasta el 88,3%31.
Múltiples estudios anteriores han intentado demostrar los beneficios del uso de una terapia adyuvante específica; sin embargo, la falta de mediciones objetivas de los efectos es una de las principales limitaciones de dichos estudios8,21. En un intento de estandarizar la prevención y el tratamiento de la RA en nuestra cohorte, utilizamos una crema protectora reparadora hipoalergénica que contenía sulfato de cobre y zinc y un ingrediente reparador postbiótico C+ Restore® que fue bien tolerado.
En cuanto a las limitaciones de este estudio, se trata de un estudio unicéntrico con un seguimiento corto. Por otra parte, dado que la TCO es una técnica de imagen novedosa no invasiva, no está disponible de manera amplia en todos los hospitales. Por lo tanto, el uso de la TCO en la práctica clínica habitual es, en la actualidad, limitado. En cuanto al efecto terapéutico de la crema aplicada, este estudio fue de una muestra pequeña y no se incluyó ningún brazo aleatorizado. Por lo tanto, no se pudieron explorar adecuadamente los efectos del tratamiento ni extraer conclusiones. Por último, la edad y el índice de masa corporal (IMC) no se distribuyeron homogéneamente entre los distintos grupos de radioterapia, lo que podría haber influido en nuestros resultados. Sin embargo, se trataba de un sesgo esperado, ya que los pacientes más jóvenes (< 60 años) casi siempre reciben un esquema “boost”, mientras que en los pacientes de más edad (> 60 años), normalmente con un IMC más elevado, el esquema “boost” suele estar indicado sólo en casos de tumores de alto riesgo.
ConclusionesEste estudio es el primer estudio prospectivo realizado sobre un nuevo algoritmo computacional de imágenes cutáneas no invasivas de la TCO para detectar y cuantificar los efectos de la microvasculatura inducida por la radioterapia. La TCO reveló cambios en la vascularización incluso en ausencia de otros signos clínicos. Los esquemas de radioterapia más intensos y prolongados mostraron cambios vasculares más prominentes, aunque en su mayoría reversibles tras 3 meses de radioterapia. Futuros estudios deberían explorar si los acontecimientos adversos de aparición tardía asociados a la radioterapia en términos de cicatrización y fibrosis podrían detectarse precozmente con la TCO asociados a un aumento persistente de la vascularización. Este estudio podría ser un paso preliminar para estandarizar la determinación, la graduación y la clasificación de la RA. Es importante destacar que este método también podría tener en cuenta la diversidad étnica existente, especialmente aquella en la que el enrojecimiento no es visible, y podría evaluar objetivamente el impacto de diferentes medidas preventivas.
Financiación/apoyoEste estudio fue financiado parcialmente por Pierre Fabre Intl. Los laboratorios Pierre Fabre financiaron parte del análisis computacional y proporcionaron muestras gratuitas de crema tópica a los pacientes. Ningún análisis o resultado ha sido manipulado o controlado por la empresa.
La investigación en la Unidad de Melanoma del Hospital Clinic Barcelona fue financiada parcialmente por Instituto de Salud Carlos III (ISCIII), Madrid, España a través de los proyectos PI18/01077, PI18/00419, PI18/0959 y PI22/01457, y cofinanciado por la Unión Europea, CIBER de Enfermedades Raras del Instituto de Salud Carlos III, España, cofinanciado por ISCIII-Subdirección General de Evaluación, y el Fondo Europeo de Desarrollo Regional (FEDER), “una manera de hacer Europa”; AGAUR 2017_SGR_1134 y Programa CERCA de la Generalitat de Catalunya, España; Comisión Europea dentro del VI Programa Marco, Contrato No. LSHC-CT-2006-018702 (GenoMEL), por la Comisión Europea bajo el 7° Programa Marco, Diagnoptics, y el programa de investigación e innovación Horizonte 2020 de la Unión Europea en virtud de los acuerdos de subvención 875171 Qualitop (Horizonte 2020), 965221 iTOBOS (Horizonte 2020) y 101096667 MELCAYA (HORIZON-RIA-Call: HORIZON-MISS-2021-CANCER-02) en el marco del programa de investigación e innovación Horizonte Europa; el National Cancer Institute (NCI) of the U.S. National Institute of Health (NIH) (CA83115); una subvención de “Fundació La Marató de TV3”201331-30, Cataluña, España; y una beca de “Fundación Científica de la Asociación Española Contra el Cáncer”GCB15152978SOEN, España y “Fundación Leo Messi”.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.