La micosis fungoide (MF) supone el 60% de los linfomas cutáneos. Aunque generalmente es de curso indolente, el 25% progresa a estadios avanzados, con una mediana de supervivencia de 68 meses en estadios IIB y de 33 meses en estadios IVB1. Las opciones terapéuticas con las que contamos para estos estadios son limitadas. En los últimos años han aparecido nuevas moléculas como el brentuximab vedotina (BV), para el tratamiento de las micosis fungoides CD30-positivas (MF-CD30+)2.
Describimos una serie de 5 casos, 2 mujeres y 3 varones, de MF-CD30+ en estadios avanzados tratadas con BV, con una mediana de edad al diagnóstico de 67 años (52-83). Clínica y patológicamente, los pacientes tenían una MF eritrodérmica, una MF intersticial y 3 MF con transformación a célula grande3. Todas ellas presentaban IHQ con CD30+ con una expresividad de más del 20% en alguna muestra en piel antes del inicio del tratamiento. El tiempo medio de evolución de la enfermedad era de 4,8 años. La media de tratamientos previos recibidos por cada paciente fue de 6,6 (4-9) y la mediana de duración del tratamiento con BV fue de 3 ciclos (1-16) (tabla 1).
Características clínicas de los pacientes y respuesta clínica al tratamiento
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | |
|---|---|---|---|---|---|
| SexoVariantes clínico-patológicas | MujerMF con TCG | VarónMF con TCG | VarónMF con TCG | MujerMF eritrodérmica | VarónMF intersticial |
| Edad | 59 | 83 | 67 | 76 | 52 |
| Tratamientos previos | Fototerapia, INF, PEG-INF, bexaroteno, metotrexato, mogamulizumab, doxorrubicina liposomal, RTCT, fotoféresis | Mtx-IL, alitretinoina, acitretino, doxorrubicina liposomal, CHOP, bexaroteno, vorinostat, mogamulizumab, INF | PUVA, gemcitabina, RTCT, campath, alentuzumab, doxorrubicina liposomal | PUVA, mogamulizumab, bexaroteno, doxorrubicina liposomal, vorinostat | acitretina, bexaroteno, RT, doxorrubicina liposomal |
| Estadio clínico/TNMB | T4N0M0B0 IIIA | T3N0M1B2 IVB | T3N3M1B0 IVB | T4N0M0B2 IVA1 | T3NxM0B0 IIB |
| Respuesta en piel7 | RP | RP | RP | EP | RP |
| Respuesta en ganglios | NA | NA | EP | NA | EP |
| Respuesta en víscera | NA | RC | EP | NA | NA |
| Respuesta en sangre | NA | RC | NA | EP | NA |
| Respuesta global | RP | RC | EP | EP | EP |
| Número de ciclos de BV | 16 | 16 | 3 | 1 | 3 |
| Efectos adversos | Parestesia Artralgias Mialgias | Parestesia Astenia Artralgias | - | - | - |
BV: brentuximab vedotina; CHOP: ciclofosfamida, doxorrubicina, vincristina y prednisona; EP: enfermedad en progresión; INF: interferón; MF: micosis fungoide; Mtx-IL: metotrexato intralesional; NA: no aplicable; PEG-INF: interferón pegilado; PUVA: psoraleno-UVA; RC: respuesta completa; RP: respuesta parcial; RT: radioterapia; RTCT: radioterapia cutánea total con electrones; TCG: transformación en células grandes.
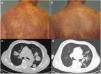
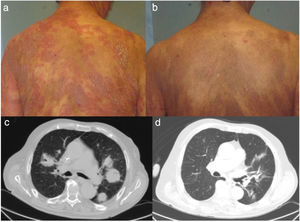
El paciente 1, una mujer de 59 años con una MF en estadio T4N0M0B0, obtuvo una respuesta clínica en piel a las 6 semanas de inicio del tratamiento, con una duración de la respuesta de 12 meses (fig. 1a y b). El paciente número 2, un varón de 83 años, con una MF en estadio T3N0M1B2, obtuvo una respuesta parcial en piel a las 12 semanas. Este paciente presentó infiltración específica por una proliferación de linfocitos CD4+, CD30+ en ambos pulmones, obteniendo una respuesta visceral a las 15 semanas de inicio del tratamiento (fig. 1c y d). La duración de la respuesta en vísceras fue de 9 meses. El paciente número 3, un varón de 63 años, con una MF con lesiones tumorales en estadio T3N3M1B0, presentó una respuesta rápida en piel a las 2 semanas de inicio del tratamiento, con una progresión posterior de la enfermedad tanto ganglionar como visceral. El paciente número 4, una mujer de 76 años con una MF eritrodérmica, en estadio T4N0M0B2, experimentó una progresión de la enfermedad. El paciente número 5, un varón de 52 años, con una MF intersticial con lesiones tumorales (estadio T3NxM0B0), obtuvo una respuesta parcial en piel a las 2 semanas, con una progresión posterior de la enfermedad en piel y ganglios.
Respuesta clínica y radiológica de 2 de los pacientes en tratamiento con brentuximab. a) Lesiones cutáneas en la paciente número 1 antes de iniciar el tratamiento sistémico. b) Respuesta clínica en piel a las 6 semanas de inicio del tratamiento, con una disminución del eritema y la infiltración, así como de la extensión de las lesiones. c) Corte axial de TAC de tórax con contraste. Masas tumorales en ambos campos pulmonares correspondientes a una proliferación de linfocitos CD4+, CD30+. d) Desaparición completa de las masas tumorales tras la octava infusión de brentuximab.
En resumen, se obtuvieron 4 respuestas parciales en la piel, de las cuales 2 progresaron, y una respuesta completa en vísceras. La mediana de tiempo hasta la respuesta clínica en la piel fue de 6 semanas (2-12) y de 15 semanas en las vísceras. La duración de la respuesta global en los 2 pacientes que experimentaron respuesta, parcial en la piel y completa en las vísceras, sin progresión, fue de 9 y 12 meses, respectivamente.
Los eventos adversos más frecuentes fueron la neuropatía sensorial periférica (G3 máximo alcanzado) que aparecía tras un número medio de 2 infusiones; seguida de astenia y artralgias. Ninguno de estos eventos obligó a la suspensión del fármaco. La neuropatía sensorial en uno de los pacientes se resolvió en el momento de finalizar el tratamiento con BV, mientras que en el otro continuó hasta las 16 semanas posteriores a su finalización.
El BV es un anticuerpo monoclonal anti-CD30, una glicoproteína transmembrana expresada en linfocitos B y T activados. Este anticuerpo está unido a la monometil auristatina E (MMAE), un agente encargado de desorganizar la red de microtúbulos que conduce a la detención del ciclo celular y la posterior apostosis4. El ensayo clínico multicéntrico aleatorizado fase 3 ALCANZA concluyó que el tratamiento con BV era superior al de bexaroteno o metotrexato, independientemente de la edad, sexo, tipo de linfoma cutáneo (MF-CD30+ o LCACG -linfoma cutáneo anaplásico de células grandes-) o si la afectación era solo cutánea o cutánea y visceral5. En el ensayo, sin embargo, hasta un tercio de los pacientes presentaban enfermedad en estadios tempranos y una mediana de solo 2 líneas previas de tratamiento, sin incluirse lo que a nuestro juicio suponen el grueso de pacientes de práctica clínica habitual para este tipo de tratamientos. Autores como Papadavid et al. han compartido su experiencia en el tratamiento con BV de 3 pacientes con MF foliculotropa y transformación a célula grande y un paciente con síndrome de Sézary (SS)6. Los 3 pacientes con MF mostraron respuesta completa o parcial mientras que el paciente con SS presentó enfermedad estable7.
En nuestra serie de casos, el dato más sorprendente fue la rápida respuesta en la piel desde el inicio de la primera infusión, especialmente para las lesiones tumorales, que sufrían una progresión rápida a la necrosis cutánea. Además, el paciente número 5, con un diagnóstico de MF intersticial y lesiones cutáneas tipo tumor, experimentó este efecto tras una sola dosis de BV. Otro de los hallazgos más interesantes ha sido la respuesta completa, por criterio de vísceras, observada en un paciente con afectación específica pulmonar y que se mantuvo durante 9 meses.
En nuestra experiencia, BV ofrece una rápida respuesta de las lesiones tumorales pero con un mantenimiento de la respuesta muy heterogéneo. Aún es necesario conocer en qué tipo de pacientes y en qué momento de la evolución de la enfermedad es idóneo su uso. Asimismo, se requieren nuevos estudios que posicionen al fármaco en la práctica clínica, incluyendo su combinación con otros agentes y la terapia de mantenimiento tras las respuestas alcanzadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.