Diagnóstico por imagen
El diagnóstico de las malformaciones vasculares cutáneas se basa en la historia clínica y la exploración física1-4. Los estudios mediante técnicas de imagen encuentran su indicación en aquellos casos en los que existan dudas sobre la naturaleza de la lesión, siendo una herramienta complementaria para esclarecer y confirmar el diagnóstico. Adicionalmente, van a permitir analizar la extensión de las lesiones y evaluar el componente no visible de las mismas. Por último, en algunas situaciones no sólo van a guiar la conducta terapéutica a seguir, sino que además van a formar parte integral del tratamiento mediante el uso de agentes embolizantes y esclerosantes.
La radiografía simple se ha visto hoy en día ampliamente superada por otras técnicas de imagen, y tiene un valor limitado incluso para demostrar el grado de afectación ósea y la presencia de calcificaciones; la tomografía computarizada (TC) es notablemente más sensible en este aspecto y proporciona una información anatómica mucho más exacta.
La radiografía simple permite demostrar la presencia de flebolitos en las malformaciones venosas y detecta las raras calcificaciones que a veces se producen en algunas malformaciones linfáticas5,6. Las malformaciones venosas y arteriovenosas como tal no son visibles en la radiografía simple, pero sí sus efectos sobre las estructuras óseas adyacentes (hipertrofia o atrofia asimétrica, osteoporosis, lesiones líticas, etc.)7-9.
La ecografía asociada al doppler proporciona además de información anatómica datos hemodinámicos, como la velocidad y dirección del flujo, de gran utilidad tanto en las malformaciones de alto flujo (arteriovenosas) como en las de bajo flujo (venosas)10-12. Se trata de una técnica no invasiva, inocua al no hacer uso de las radiaciones ionizantes, muy accesible, económica y especialmente eficaz en niños al no requerir de excesiva cooperación por parte del paciente.
La principal limitación de la ecografía es que al ser una técnica operador dependiente es difícil conseguir una reproducibilidad de los hallazgos. Las malformaciones venosas se muestran hipoecoicas, con un aspecto parecido al de los quistes, si bien mediante la utilización del doppler el flujo venoso se tornará evidente, sobre todo tras la realización de maniobras de compresión, a diferencia de las anteriores. Las malformaciones linfáticas macroquísticas se presentan como una masa hipoecoica o anecoica multiloculada con septos de grosor variable. En el caso de las malformaciones arteriovenosas el papel de la ecografía, gracias al doppler, se limita a confirmar la naturaleza vascular de la lesión que mostrará ondas tanto arteriales como venosas.
La definición de los tejidos blandos con la TC es superior a la radiografía simple convencional, pero muy inferior a la obtenida con la resonancia magnética (RM). Su gran ventaja es la excelente demostración que proporciona de las estructuras óseas y calcificaciones. Entre las desventajas está que se trata de una técnica basada en la utilización de radiaciones ionizantes, y la necesidad casi siempre de usar medios de contraste que no resultan inocuos debido a su nefrotoxicidad y posibles reacciones adversas. Además, en el caso de los pacientes pediátricos es necesario el uso de sedación, ya que la calidad de los estudios se deteriora por el movimiento13-16.
La RM proporciona una excelente diferenciación tisular que, junto a la capacidad de obtener imágenes en múltiples planos espaciales, la convierte en la mejor exploración radiológica para demostrar las relaciones anatómicas y estudiar los tejidos circundantes en contacto con las malformaciones vasculares. Además de proporcionar información anatómica, también es capaz de aportar datos hemodinámicos. Así, la presencia de flujo veloz o turbulento va a condicionar una disminución en la intensidad de la señal, mientras que en aquellos casos en los que exista flujo lento o trombosis la intensidad aumentará17-19. Al igual que la ecografía no utiliza radiaciones ionizantes, por lo que resulta también de gran utilidad no sólo a la hora de efectuar el diagnóstico, sino también para realizar controles evolutivos o postratamiento. El gadolinio utilizado como medio de contraste es tremendamente seguro, careciendo en general de efectos adversos importantes, aunque acaba de demostrarse en pacientes nefrópatas una posible relación etiopatogénica con la dermopatía fibrosante.
La limitación más importante de la RM es que requiere colaboración por parte del paciente, siendo necesario utilizar sedación en pacientes claustrofóbicos y en la población pediátrica. El uso de equipos abiertos puede aminorar este inconveniente, aunque por regla general éstos suelen ser de menor campo, lo que limita la calidad de la imagen y la rapidez del estudio en aquellos casos en los que deban realizarse múltiples secuencias de adquisición.
La RM es la técnica de elección para la valoración inicial de las malformaciones venosas, ya que permite delimitar la extensión completa de la lesión en diversos planos anatómicos de manera no invasiva20,21. En las secuencias en T1 presentan una señal menor a la de la grasa adyacente, mientras que en T2 sucede lo contrario.
En las malformaciones linfáticas la RM permite realzar el contraste entre la lesión y los tejidos vecinos, delineándola anatómicamente20,21. En las secuencias en T1 la intensidad de señal es similar o ligeramente inferior a la del músculo, mientras que en las secuencias en T2 aparece un marcado incremento de la señal, siendo incluso mayor que la de la grasa o el músculo adyacente.
La flebografía está indicada en las malformaciones venosas o de bajo flujo22. La flebografía mediante punción directa de la lesión, junto con la utilización de torniquetes para redirigir el flujo, va a permitir delimitar anatómicamente la extensión y componentes de la malformación, así como el volumen de los diversos compartimentos venosos. Clásicamente ha sido la técnica de elección para estudiar la existencia y permeabilidad del sistema venoso profundo en extremidades de pacientes con malformaciones venosas extensas o combinadas tipo síndrome de Klippel-Trenaunay.
Como ya se ha comentado anteriormente, en el caso de las malformaciones arteriovenosas los estudios de RM resultan insuficientes para definir con precisión las aferencias, eferencias, nidus, patrones y velocidades de flujo. Así, a pesar de los avances con la RM en 3D, la arteriografía es la técnica de elección para valorar la angio-arquitectura de la lesión, siendo un requisito previo siempre que se contemple el tratamiento mediante embolización, de forma que una arteriografía además de diagnóstica puede ser terapéutica.
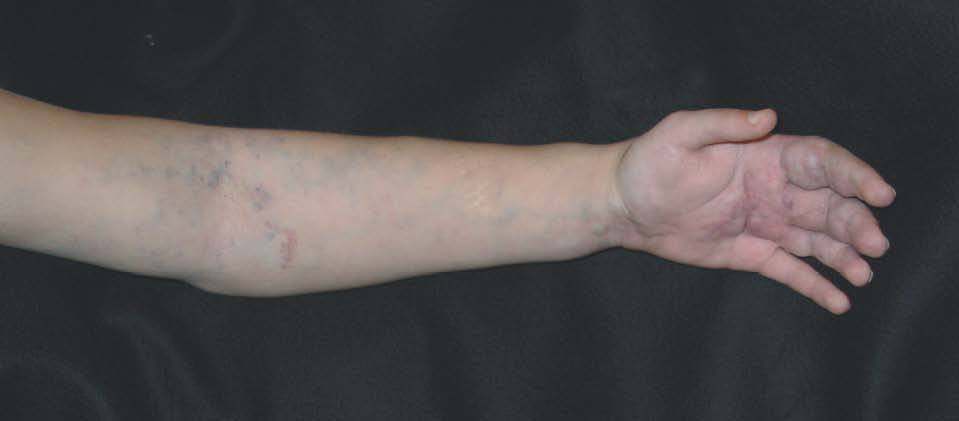
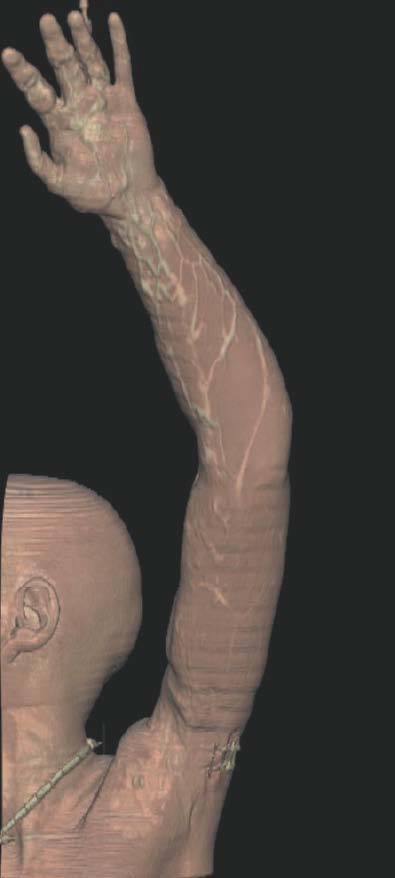
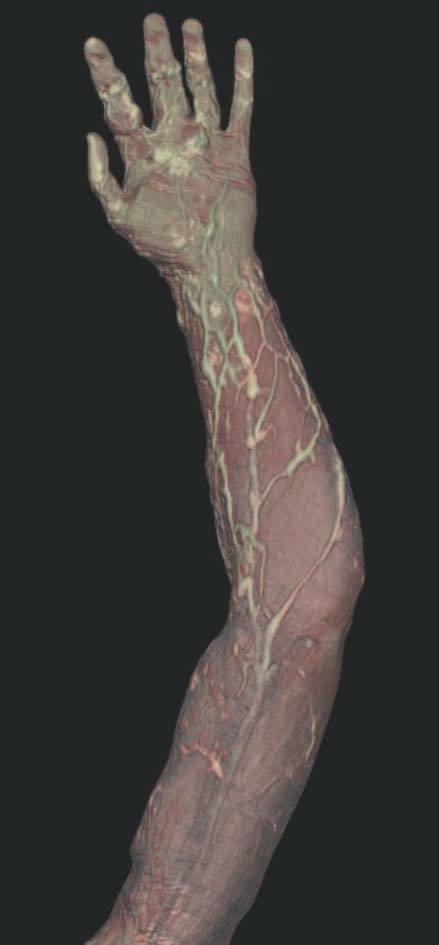
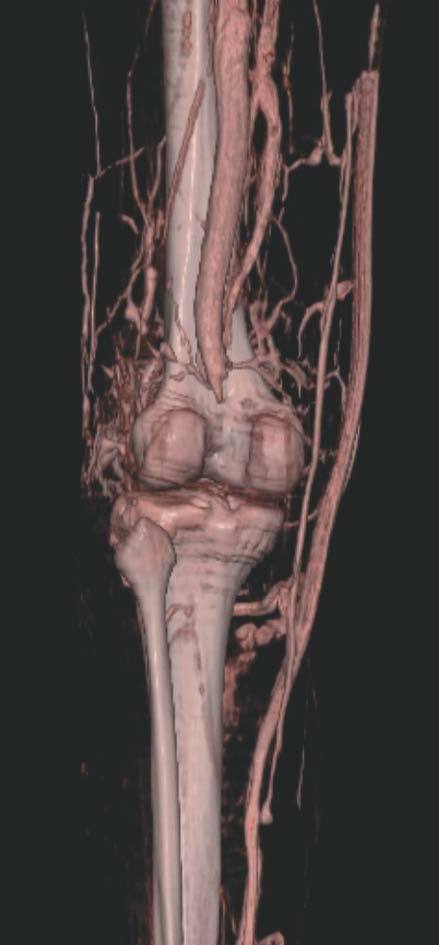
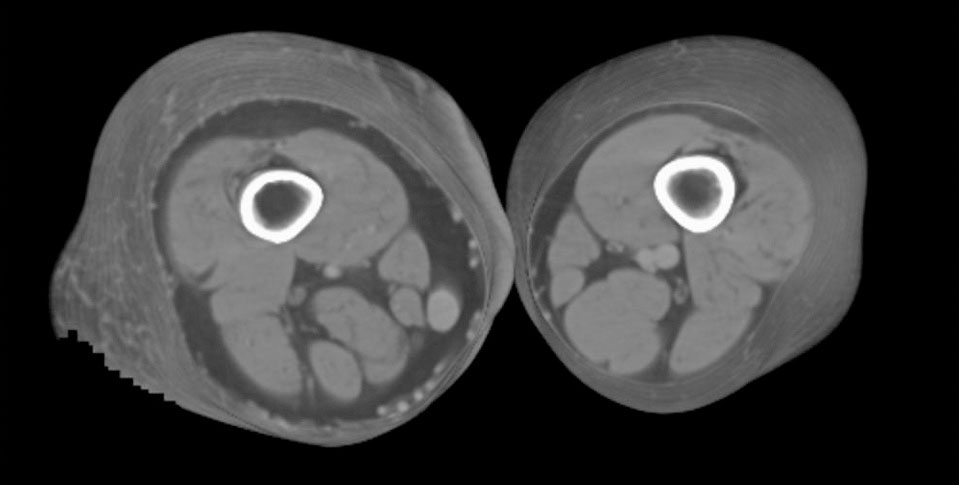
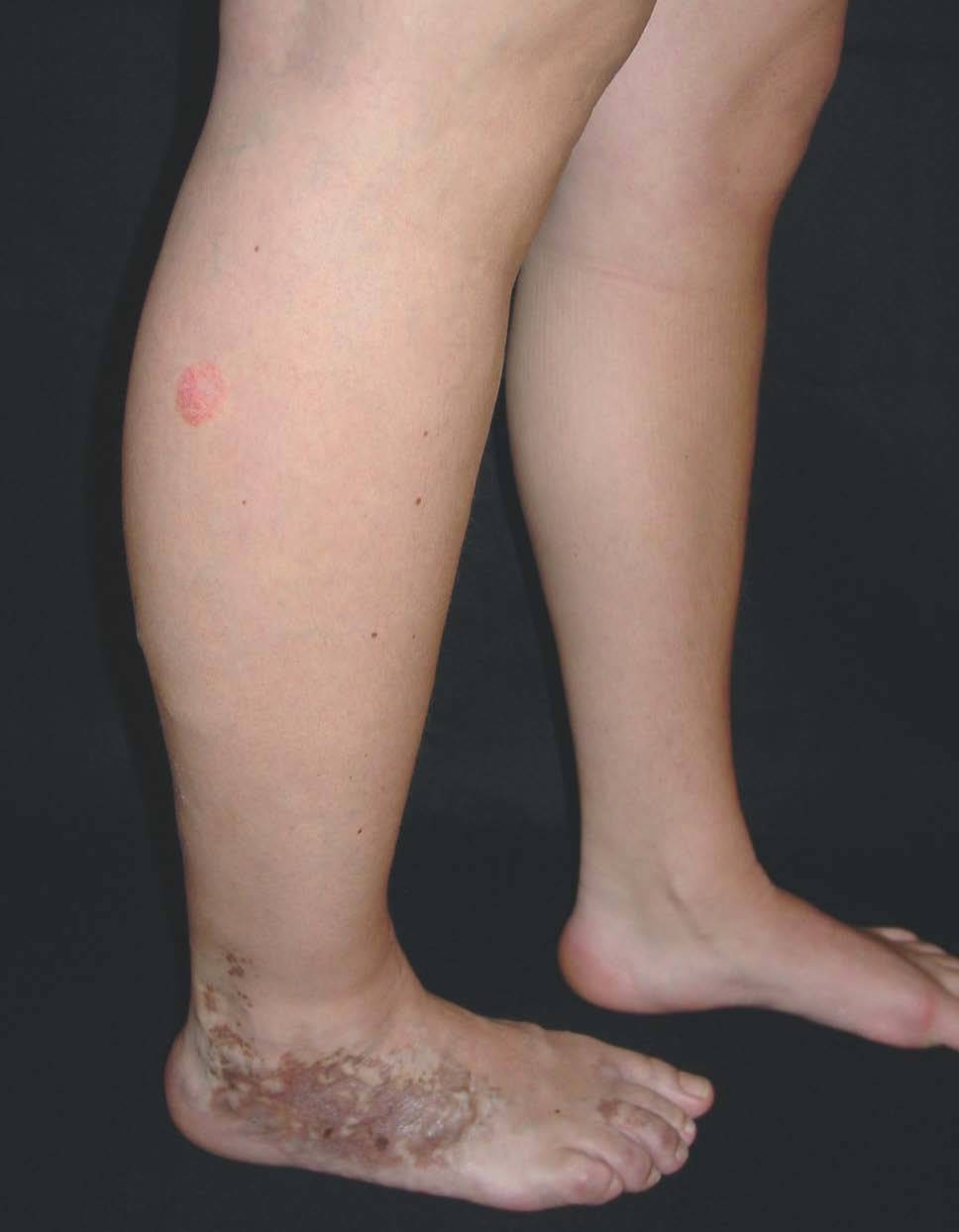
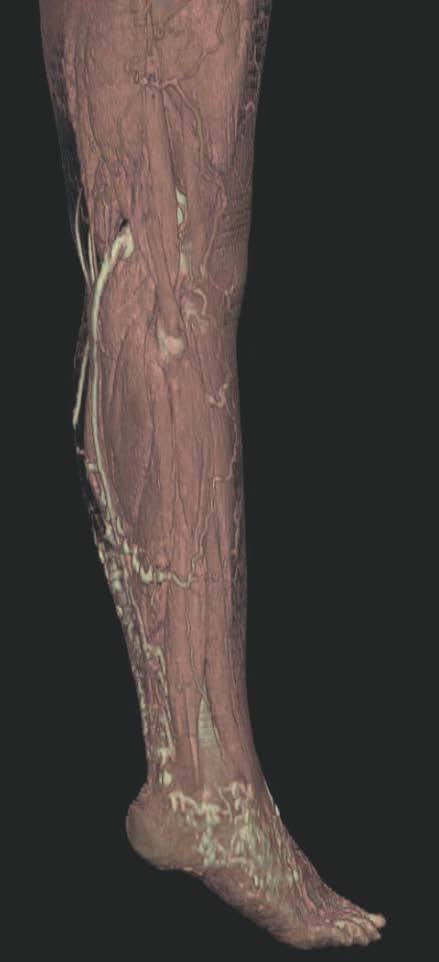
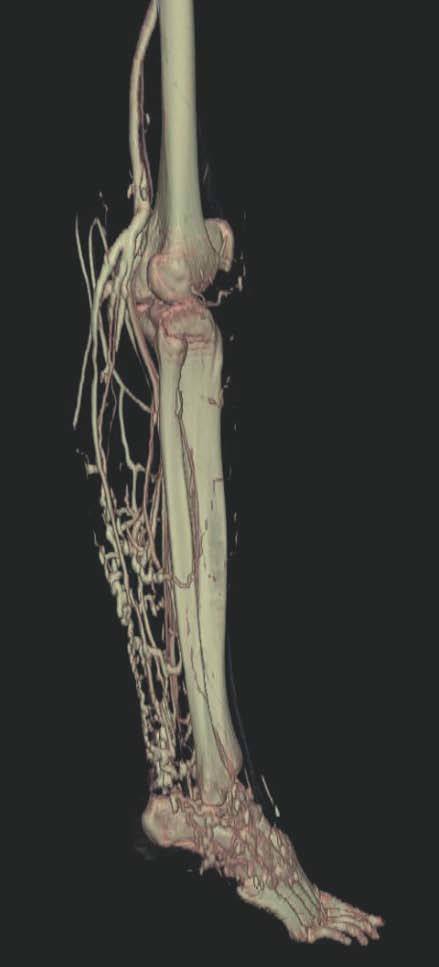
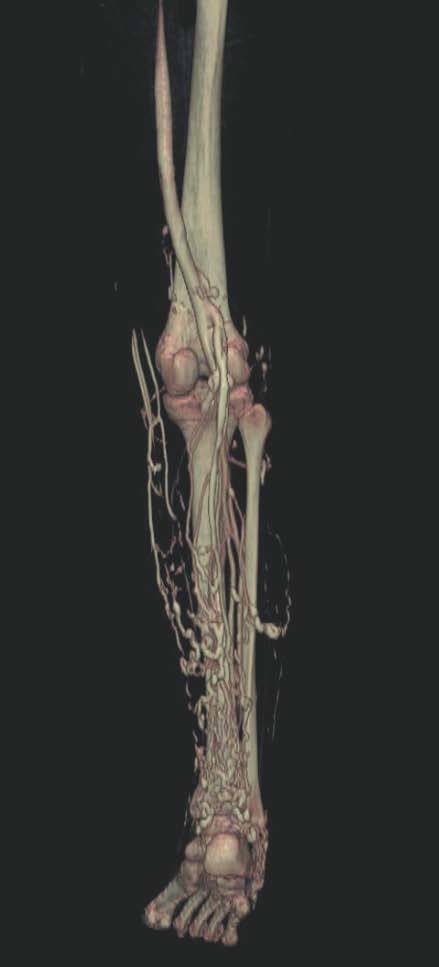
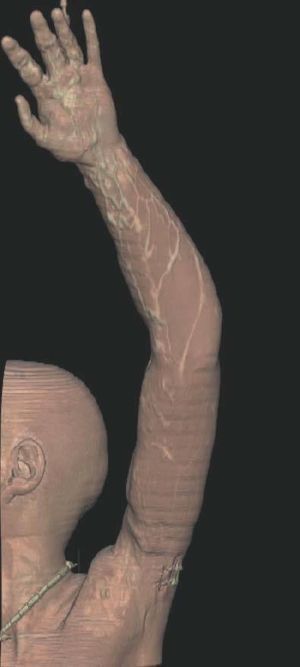
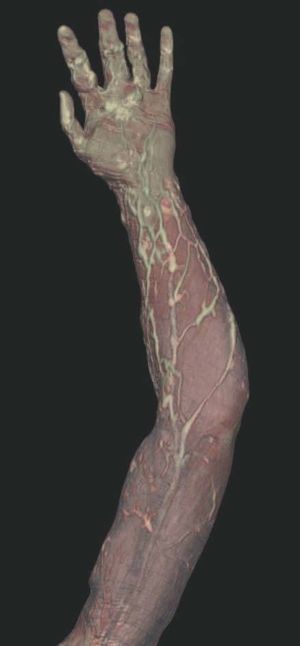
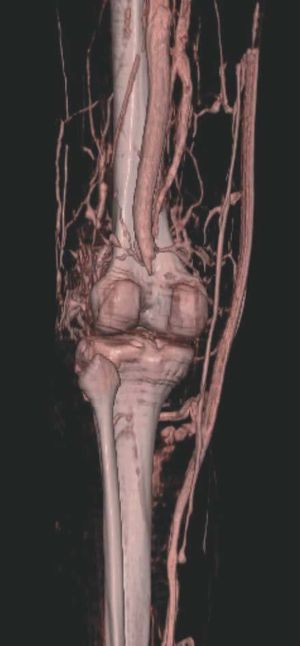
Hoy en día la utilización de los nuevos equipos TC multicorona y RM permiten la adquisición de imágenes con gran rapidez, pudiendo realizar reconstrucciones multiplanares de gran calidad, así como estudios angiográficos no invasivos13,23. Recientemente hemos estudiado 16 pacientes con síndrome de Klippel-Trenaunay mediante una venografía tomografía computarizada multicorte (TCM) o una venografía resonancia magnética tridimensional (RM-3D), utilizando imágenes axiales convencionales, reconstrucciones multiplanares (RMP), proyecciones de máxima intensidad (PMI) e imágenes tridimensionales (figs. 1-3). Las imágenes axiales convencionales fueron de utilidad para evaluar el tejido blando y el hueso y permitieron localizar el sistema venoso profundo y los vasos anómalos superficiales, determinando su relación con estructuras adyacentes. Las imágenes axiales, RMP y PMI fueron empleadas para trazar el origen, trayecto y extensión de las malformaciones venosas. Las imágenes de la superficie cutánea permitieron evaluar la localización y la extensión de la mancha en vino de Oporto y demostrar la hipertrofia de la extremidad. Las reconstrucciones tridimensionales permitieron demostrar las varicosidades y el origen y trayectoria de los vasos aberrantes (figs. 4 y 5). Ninguno de los pacientes requirió otra técnica complementaria invasiva (flebografía convencional) para confirmar el diagnóstico y planificar las estrategia terapéutica24.
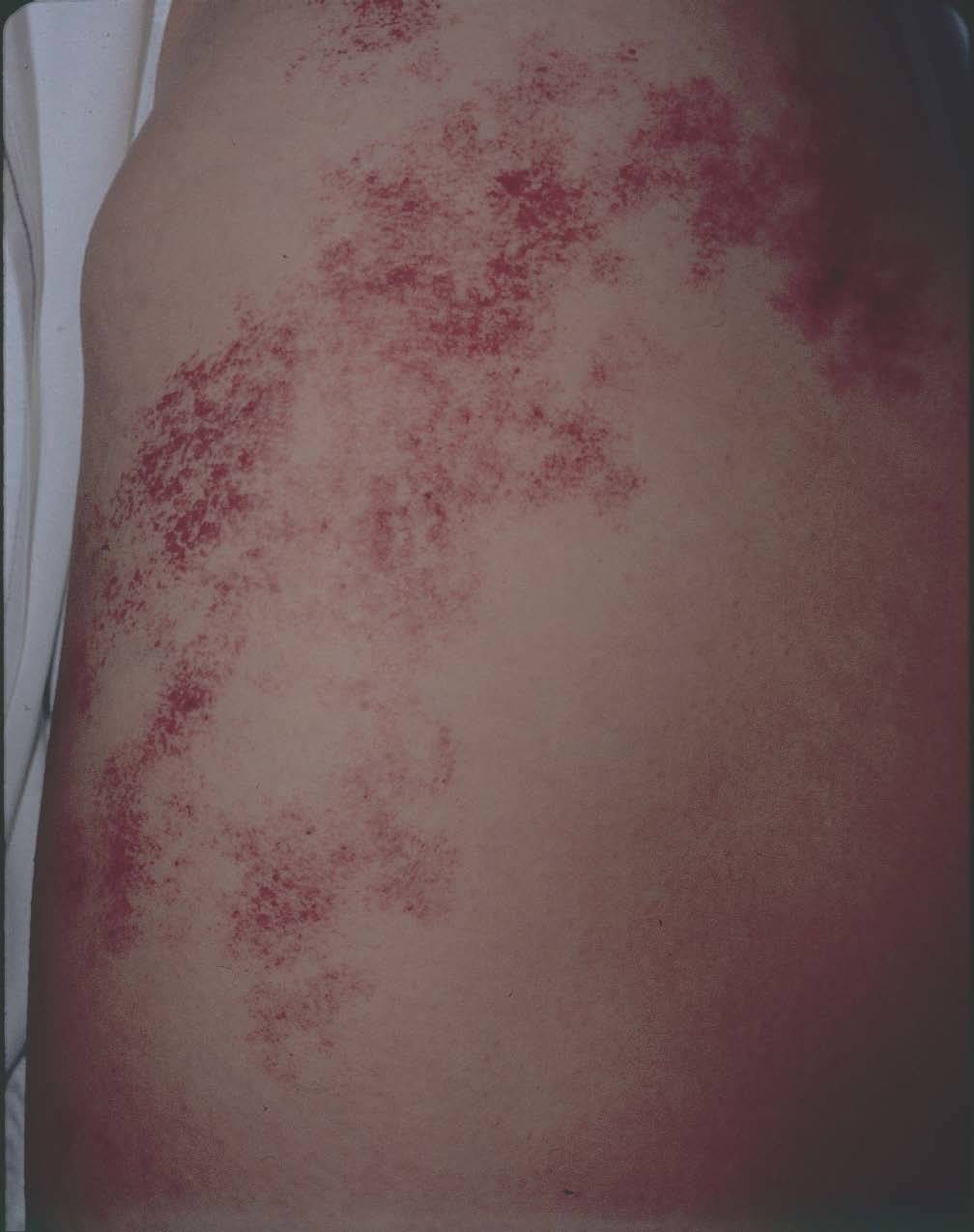
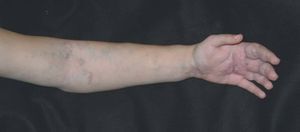
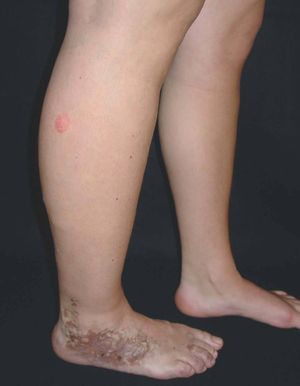
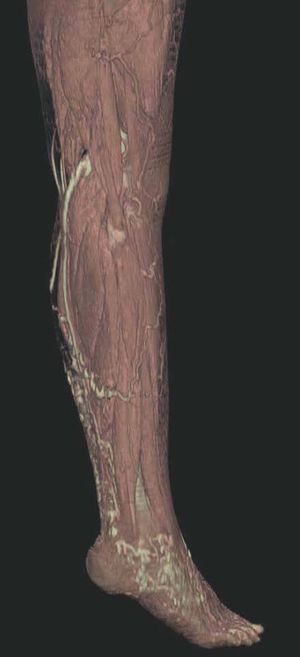
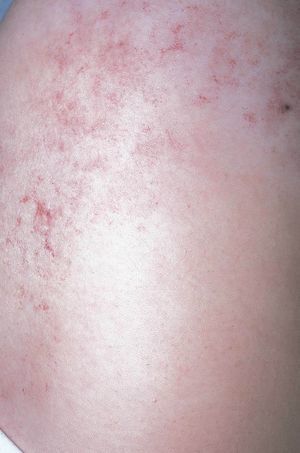
Figura 1. Mujer de 16 años con malformación venosa extensa en extremidad superior izquierda y afectación de predominio distal.
Figura 2. En angio-tomografía axial computarizada (TAC) se aprecia una correlación de los vasos superficiales con la afectación clínica.
Figura 3. En un detalle de la angio-tomografía axial computarizada (TAC) se observa la relación de los vasos con estructuras internas.
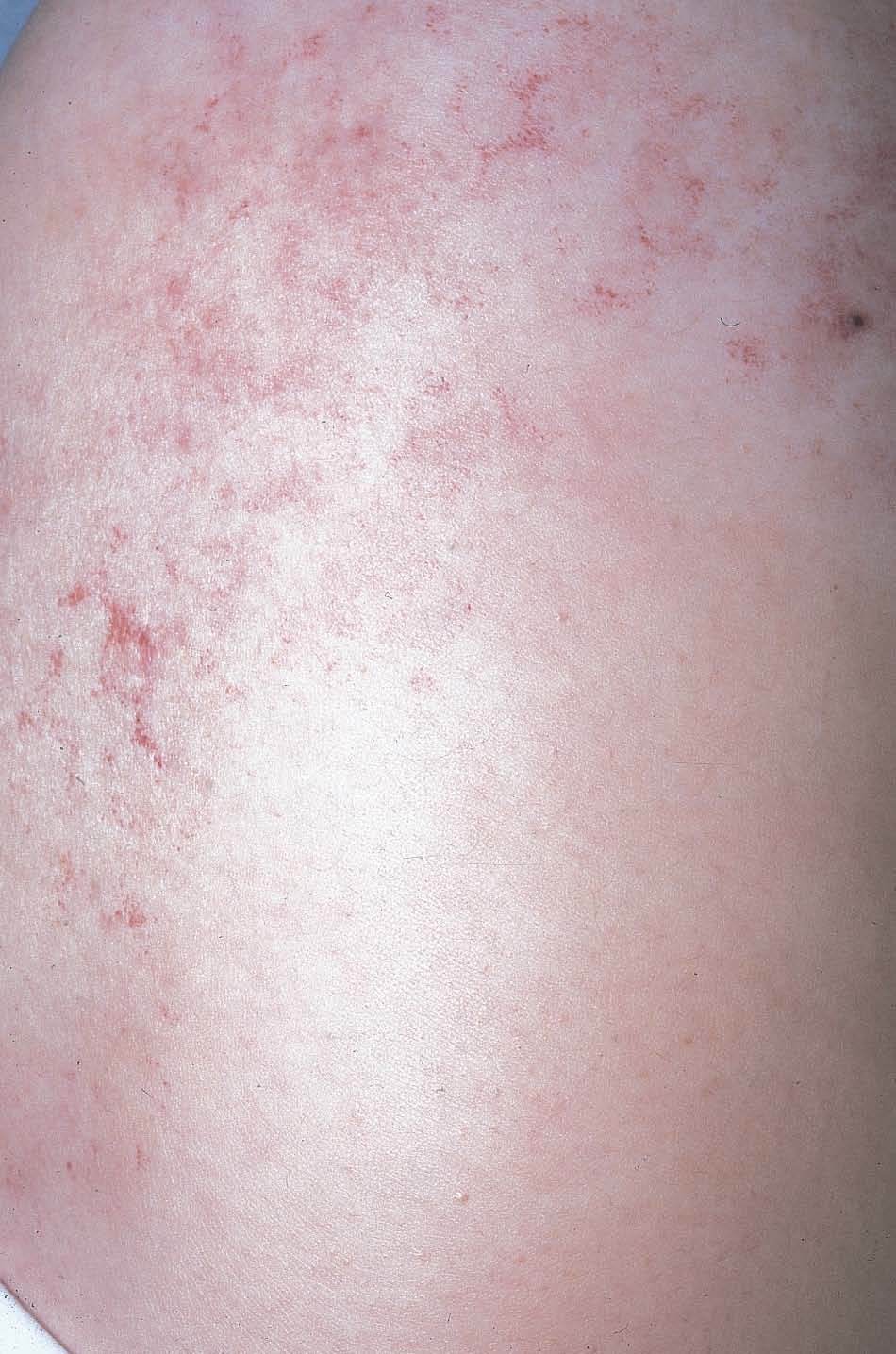
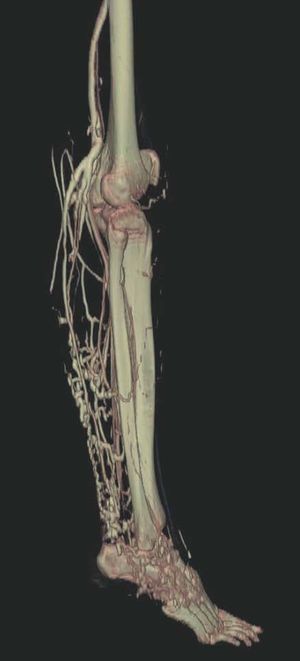
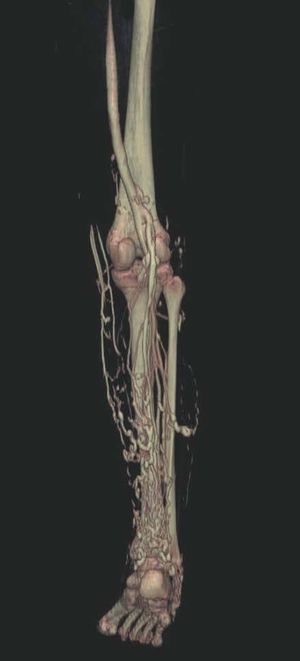
Figura 4. Agenesia de la vena poplítea en paciente con síndrome de Klippel-Trenaunay.
Figura 5. Hipertrofia músculo-esquelética e hipoplasia de vena femoral superficial en paciente con síndrome de Klippel-Trenaunay.
Así, podemos concluir que una venografía TC o una venografía RM en 3D en niños y embarazadas para limitar la radiación puede ser la prueba de elección para estudiar a fondo una malformación vascular extensa localizada en una extremidad. Esta técnica permite conocer la localización exacta de la lesión en un plano tridimensional, detectando una posible infiltración musculoesquelética y extensión torácica y/o abdominopélvica, además permite valorar cambios en la densidad ósea (osteoporosis) y dismetrías, así como comprobar la existencia de sistema venoso profundo y su permeabilidad (figs. 6-9). También son de utilidad para detectar anormalidades del sistema venoso superficial, demostrar las presencia de venas aberrantes o ciáticas y determinar su extensión y vía de drenaje. Aunque estos procedimientos siguen siendo inferiores a la arteriografía o flebografía convencionales al no proporcionar el mismo grado de información sobre la hemodinámica de la malformación, representan un avance muy significativo, y en nuestra experiencia sólo será necesaria la complementación con procedimientos invasivos en casos de hipoplasias vasculares donde no esté claro el funcionamiento hemodinámico del vaso24,25.
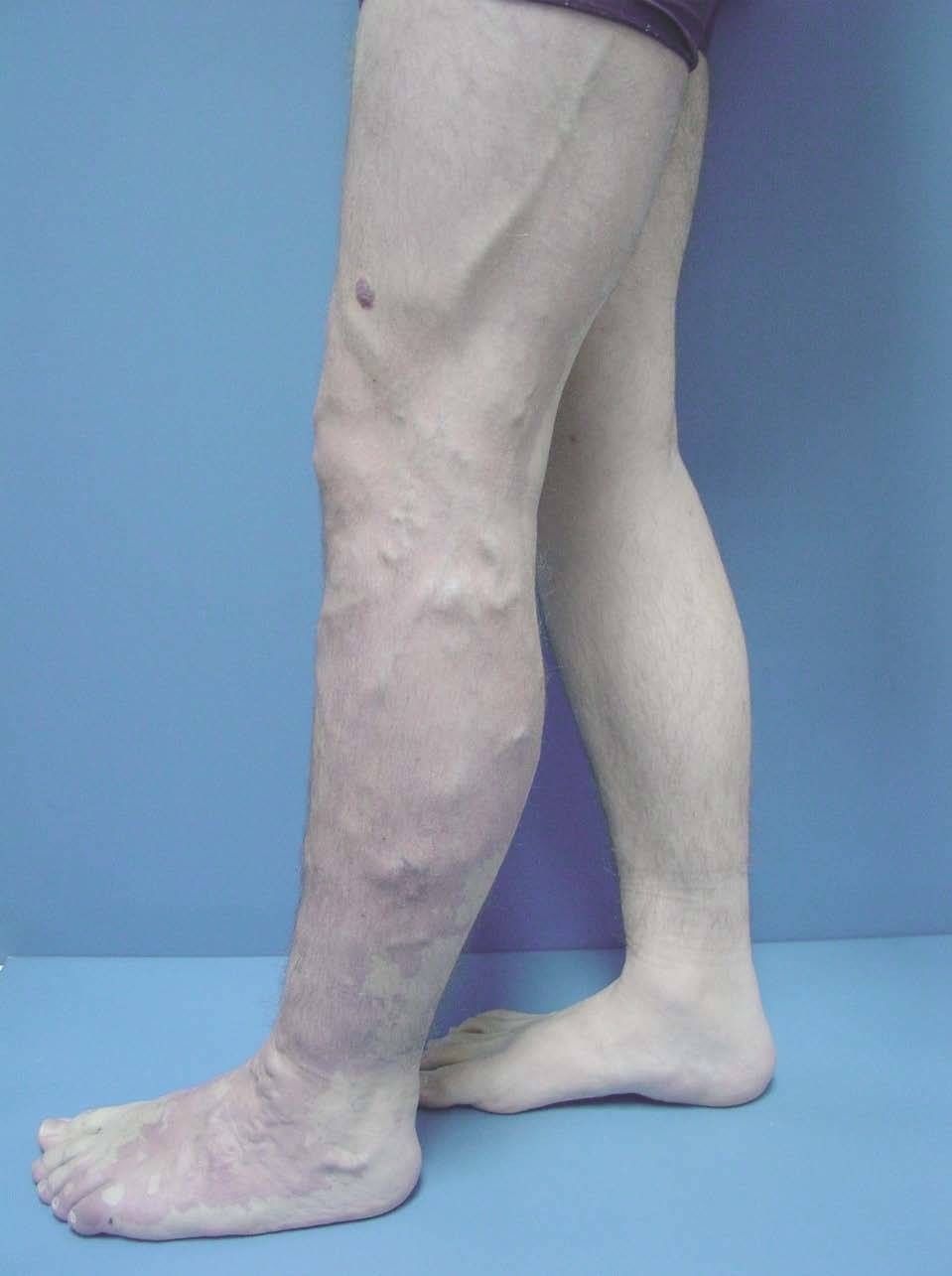
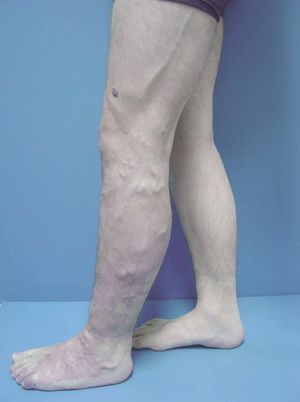
Figura 6. Dilataciones varicosas, más evidentes en tobillo, asociadas a cambios pigmentarios postulcerosos e hipertrofia de la extremidad, en paciente con síndrome de Klippel-Trenaunay.
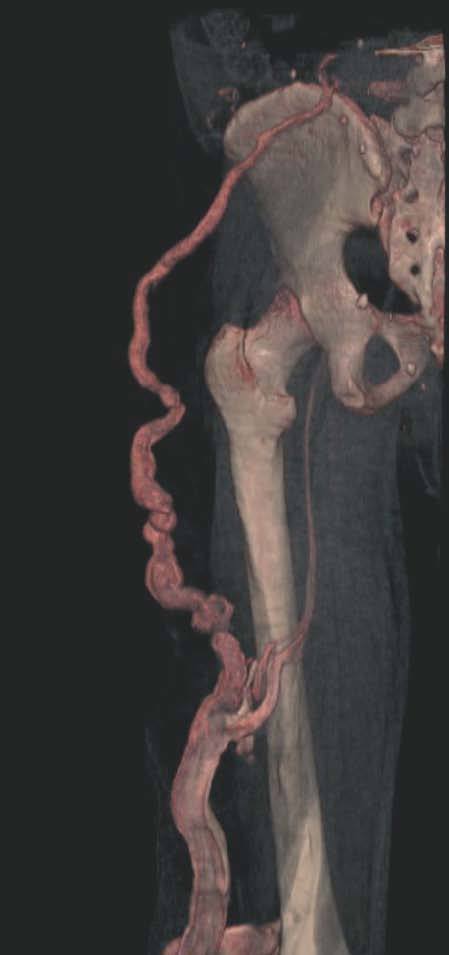
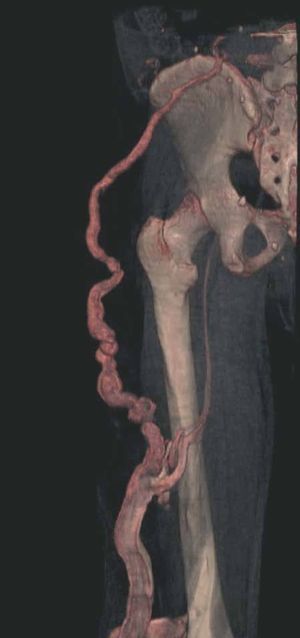
Figura 7. La angio-tomografía axial computarizada (TAC) muestra tridimensionalmente la relación de los vasos con el tejido muscular.
Figura 8. Tras sustracción de tejidos blandos en la angio-tomografía axial computarizada (TAC) destacan venas anómalas en región gemelar y tobillo sobre plano óseo (vista lateral).
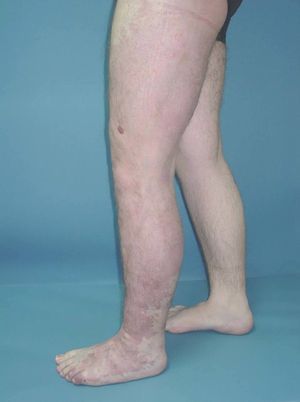
Figura 9. Detalle de la figura anterior (vista posterior).
Específicamente debe realizarse una RM de la columna vertebral en las malformaciones vasculares presentes en la línea media de la espalda, especialmente en la región lumbosacra, para detectar defectos del cierre del tubo neural a distintos niveles. También en las manchas en vino de Oporto faciales con sospecha de síndrome de Sturge-Weber se realizará un RM cerebral para valorar una posible afectación neurológica26.
Estudio histopatológico
El diagnóstico de una malformación vascular es fundamentalmente clínico y raramente necesitará un estudio histopatológico. Como se ha comentado anteriormente puede existir una duda diagnóstica con tumores vasculares, en concreto con los hemangiomas congénitos no involutivos que, aunque son extremadamente raros, podrían confundirse por su similitud evolutiva con algún tipo de malformación vascular y requerirán estudio anatomopatológico.
Histológicamente una mancha en vino de Oporto se caracteriza por la presencia de capilares y vénulas de pared fina, con luz dilatada, localizados preferentemente en la dermis reticular superficial, aunque en ocasiones pueden extenderse hasta el tejido celular subcutáneo. Al igual que otras proliferaciones vasculares las malformaciones venulares pueden presentar un elevado número de mastocitos de significado impreciso27.
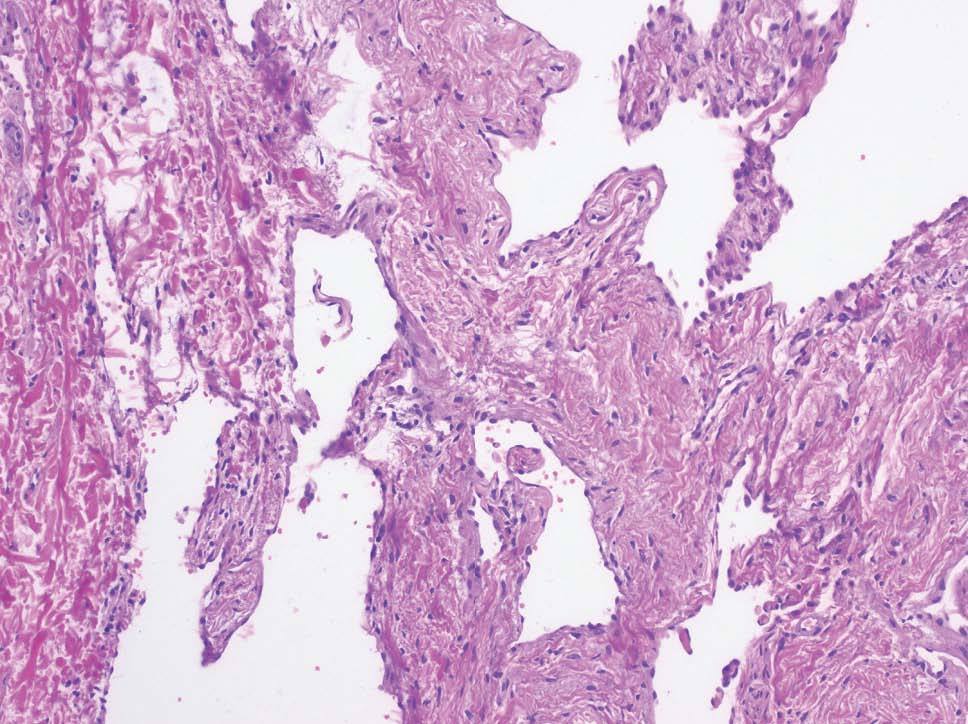
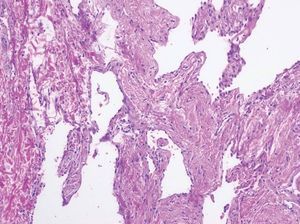
Las malformaciones venosas están constituidas por vasos ectásicos de tamaño variable, que asientan en la dermis profunda y tejido celular subcutáneo. Algunos son de pared fina, mientras que otros presentan una capa muscular gruesa. Es frecuente la presencia de trombosis y flebolitos, así como el hallazgo de áreas de hemorragia con depósitos de hemosiderina y calcificaciones extravasculares (fig. 10).
Figura 10. Vasos ectásicos de pared fina en dermis profunda correspondientes a malformación venosa. Hematoxilina-eosina, x100.
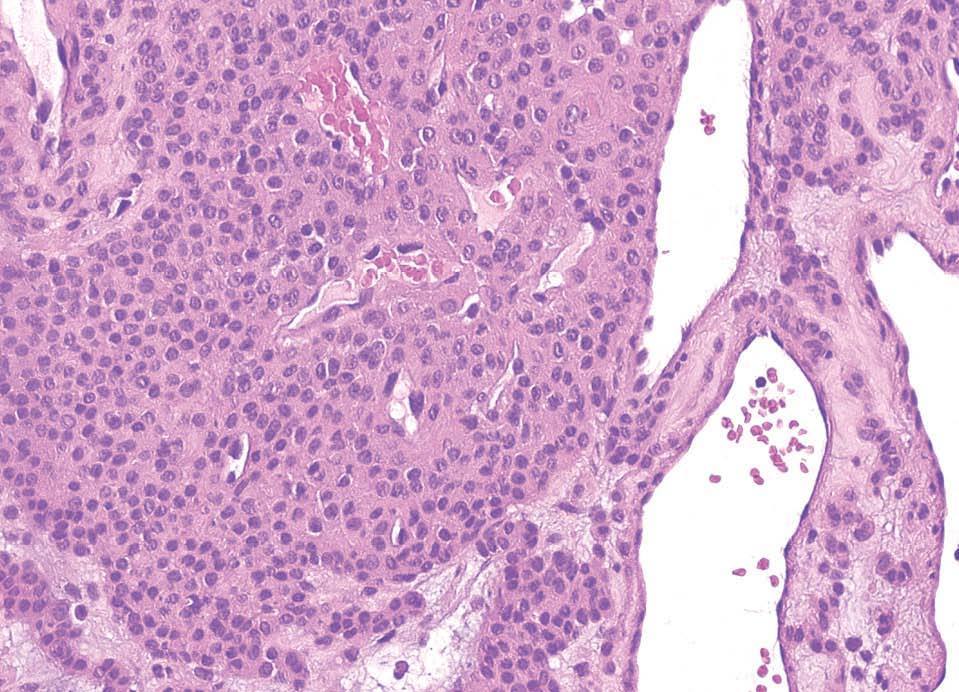
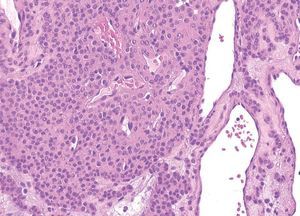
Las malformaciones glomuvenosas están formadas por canales vasculares irregulares tapizados por células endoteliales que contienen hematíes en su luz. En el espesor de las paredes de estas estructuras vasculares se observan células glómicas, que pueden confluir formando cordones en el estroma de la lesión (fig. 11). Con frecuencia aparecen nódulos dérmicos unidos dispuestos en un patrón en «reloj de arena». Inicialmente estas células glómicas fueron consideradas como pericitos, aunque luego se han definido como células musculares lisas modificadas que expresan vimentina, actina muscular específica y actina alfa del músculo liso28.
Figura 11. Malformación glomuvenosa. Lesión vascular caracterizada por vasos interconectados por cordones de células glómicas. Hematoxilina-eosina, x200.
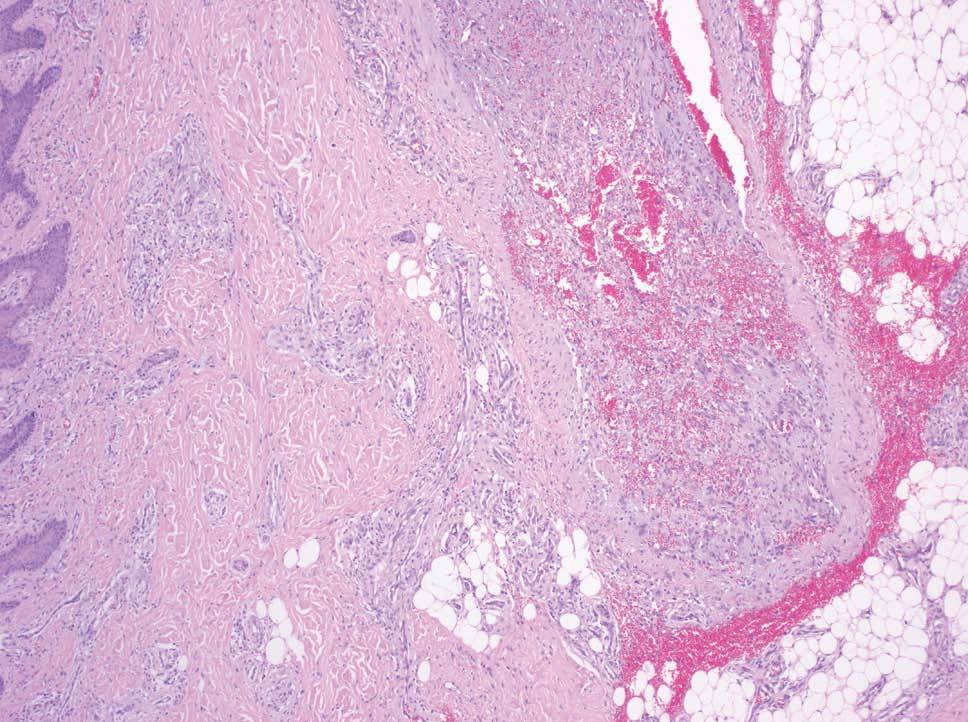
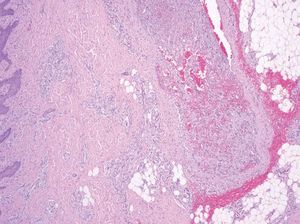
Las malformaciones arteriovenosas en pacientes jóvenes muestran únicamente un incremento de capilares, vénulas y arteriolas dispuestos holgadamente sobre un tejido fibromixomatoso donde no aparecen vasos de gran calibre. Por el contrario, con el paso de los años se aprecian venas agrandadas y arterias tortuosas. En las venas se produce una arterialización debido a un aumento de presión por la derivación arterial. Aunque ocurren por millones en lesiones de gran tamaño, la continuidad entre una arteria y una vena es difícil de detectar en el estudio patológico (fig. 12), al contrario que la fístula arteriovenosa de origen traumático o quirúrgico, que es única29.
Figura 12. Vaso de pared gruesa en malformación arteriovenosa. Las arterias y las venas «arterializadas» pueden ser difíciles de distinguir. Hematoxilina-eosina, x40.
Histopatológicamente las malformaciones linfáticas quísticas se componen de vasos irregulares dilatados e interconectados en el tejido celular subcutáneo. Los higromas quísticos están constituidos por grandes cavidades uni o multiloculares rodeadas por tejido conectivo laxo. Finalmente, las áreas de linfangiomatosis están formadas por amplios canales linfáticos dilatados e interconectados entre sí, cubiertos por una hilera de células endoteliales aplanadas. Las lesiones habitualmente afectan a la dermis y tejido celular subcutáneo y pueden extenderse hasta el hueso subyacente30.
Exploraciones complementarias
Como anteriormente se ha documentado, ante malformaciones vasculares venosas o combinadas extensas debe realizarse un estudio básico de coagulación que incluya entre otras las siguientes determinaciones: tiempo de protrombina, fibrinógeno, dímero-D, número de plaquetas y complejos solubles de fibrina. La existencia de un perfil pro-coagulante predispone a estos pacientes a presentar trombosis venosas de repetición y riesgo de tromboembolismos pulmonares, que pueden acentuarse después de una sesión de escleroterapia, una cirugía, una fractura ósea, un encamamiento prolongado o un embarazo, hasta el punto de requerir tratamiento profiláctico con heparina de bajo peso molecular31,32.
Por otra parte siempre debe valorarse la densidad ósea de la extremidad afecta, al menos con una radiografía simple, para detectar precozmente una desmineralización y prevenir, en la medida de lo posible, una fractura patológica33. El tratamiento de elección de la osteoporosis localizada en estos pacientes es un bifosfonato tipo alendronato, y en caso de afectación severa con antecedente de fractura de estrés un fármaco anabolizante como el teriparatide (fragmento recombinante de la hormona paratiroidea)34,35.
En pacientes con malformaciones vasculares activas en expansión fundamentalmente del tipo arteriovenoso se puede detectar algún marcador sérico de angiogénesis que, aunque hoy en día sea experimental y corresponda al campo de la investigación, quizás en un futuro no muy lejano se convierta en diana terapéutica de algún tratamiento antiangiogénico específico36.
Tratamiento
Las malformaciones vasculares son padecimientos marcados tanto por la anomalía anatómica de los vasos afectados como por sus peculiaridades hemodinámicas, teóricamente parecidas pero diferentes en cada paciente. La presentación clínica de las lesiones es extremadamente variable y va desde manchas asintomáticas con repercusión meramente estética hasta lesiones de alto flujo o localizaciones peculiares que pueden comportarse como auténticos tumores e incluso poner en peligro la vida del enfermo. Al mismo tiempo, al tratarse de enfermedades relativamente raras es difícil alcanzar la suficiente experiencia en su manejo para establecer pautas contrastadas de tratamiento.
Al contrario que los hemangiomas, las malformaciones vasculares son radiorresistentes, no responden a corticosteroides sistémicos o intralesionales, ni a interferón ni a fármacos citostáticos, siendo la crioterapia también de escasa utilidad. La cirugía está indicada en las malformaciones bien descritas y de moderado tamaño, donde las posibilidades de restauración anatómica y funcional son máximas (figs. 13-16). En las malformaciones difusas de gran tamaño y extensión, endocavitarias o con infiltración de masas musculares, se encuentran actualmente las mayores limitaciones terapéuticas. Por su carácter invasivo sobre estructuras próximas, las malformaciones venosas suelen ser de morfología compleja y con frecuencia se asocian a anomalías del sistema venoso profundo de las extremidades, limitando así las posibilidades de exéresis completa mediante cirugía37. En ocasiones, tras varias intervenciones quirúrgicas, las lesiones recidivan y los pacientes acaban volviendo a un estado muy similar al inicial, con importante repercusión sobre su estado anímico38. La embolización, procedimiento útil aunque delicado para las malformaciones con componente arteriovenoso, es poco eficaz en las grandes malformaciones venosas puras.
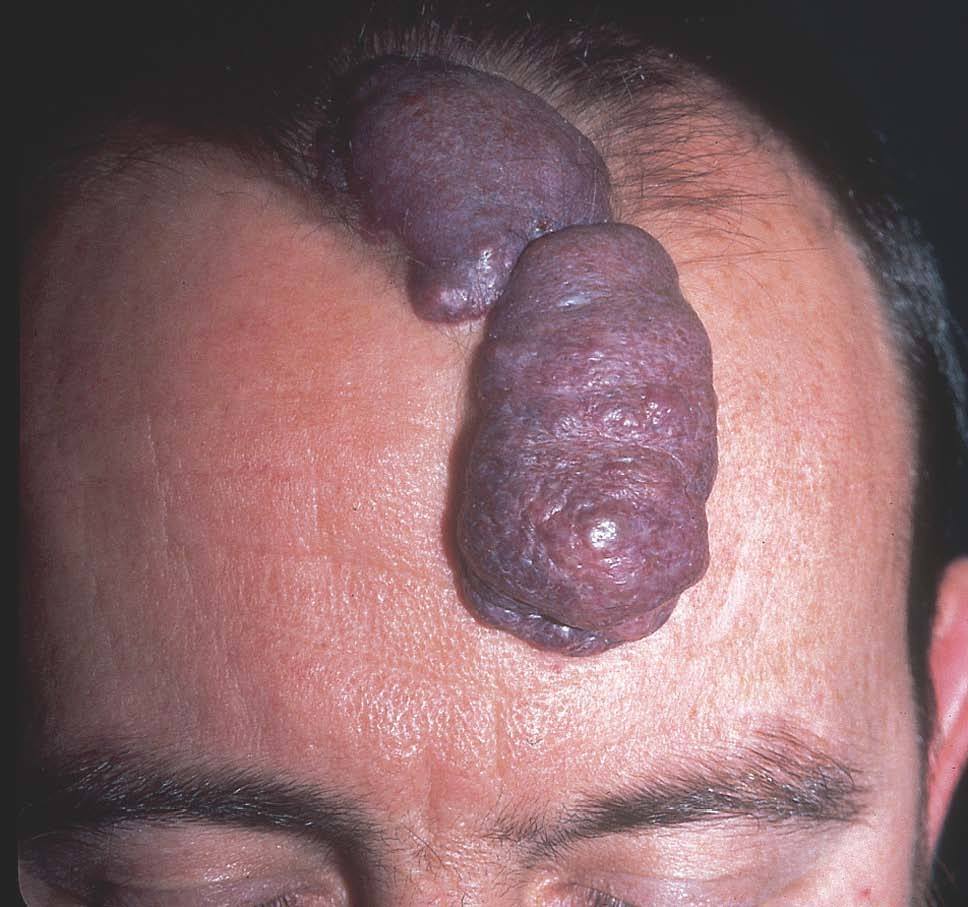
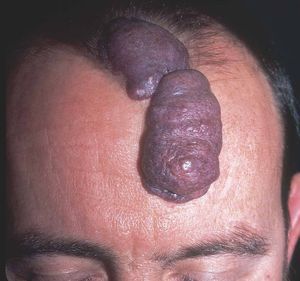
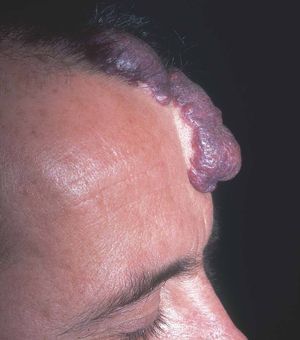
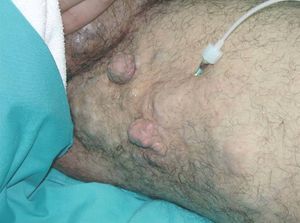
Figura 13. Paciente con mancha en vino de Oporto hipertrófica de morfología lineal en frente.
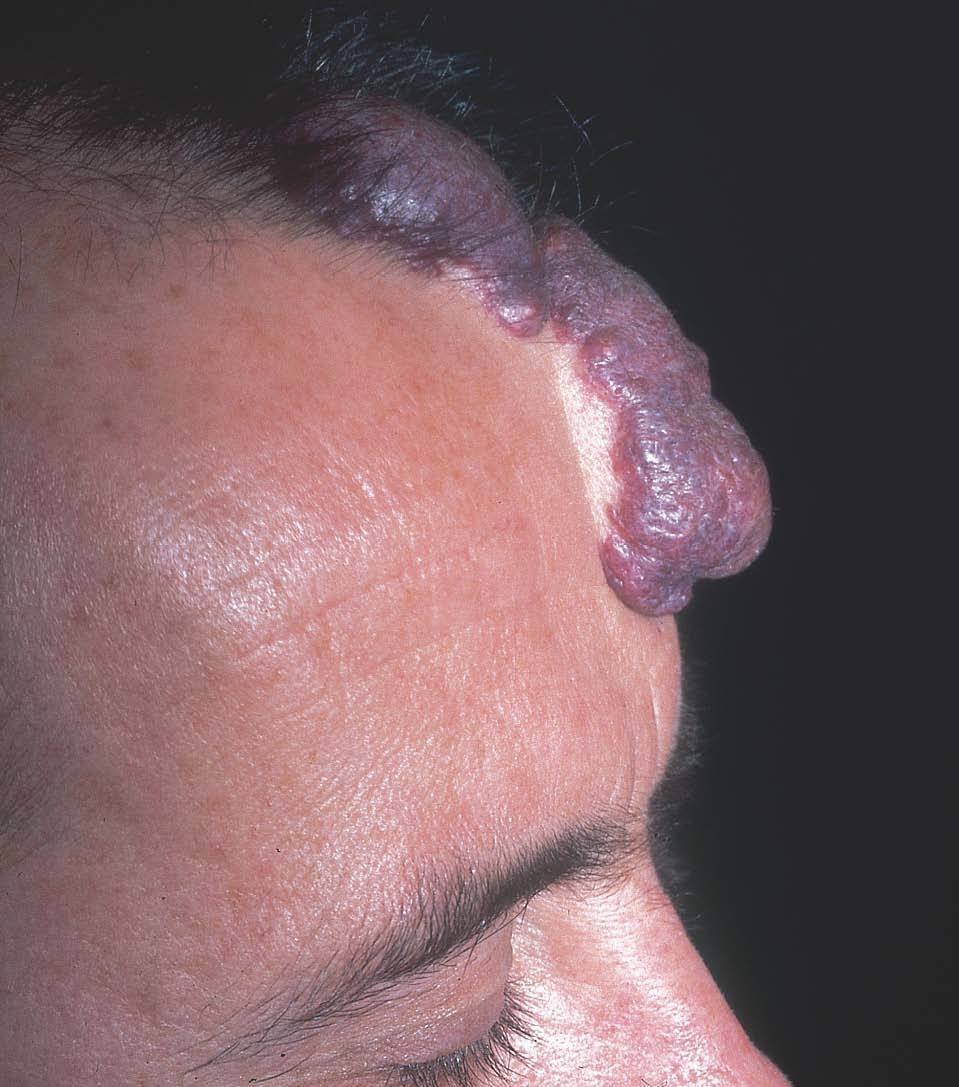
Figura 14. Visión lateral del paciente de figura anterior.
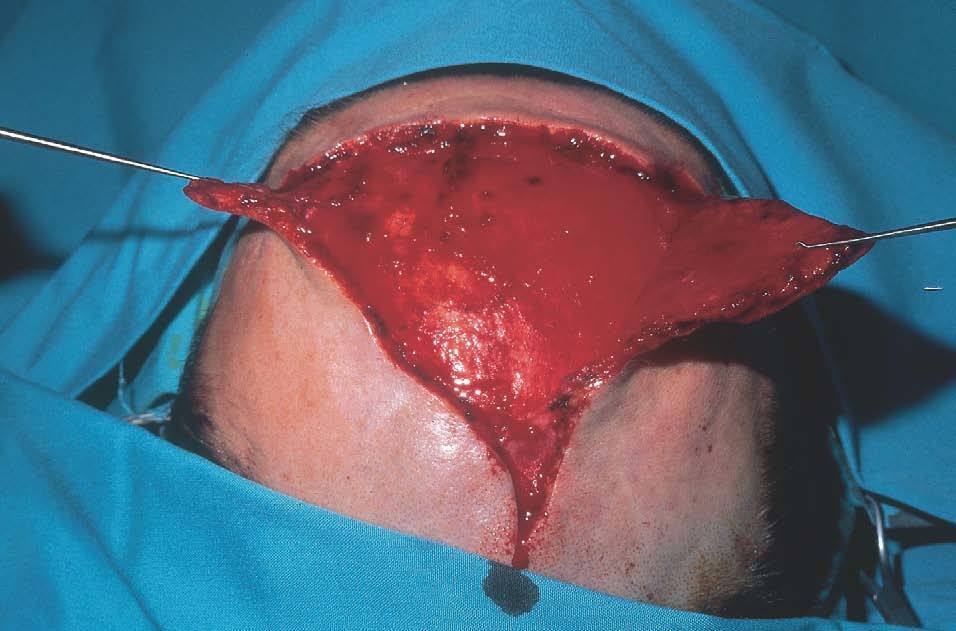
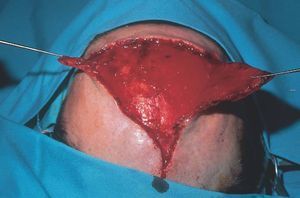
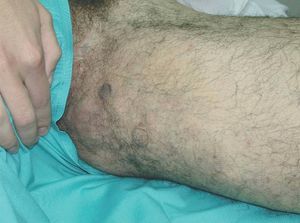
Figura 15. Extirpación de mancha en vino de Oporto hipertrófica y labrado de dos colgajos de avance en A-T.
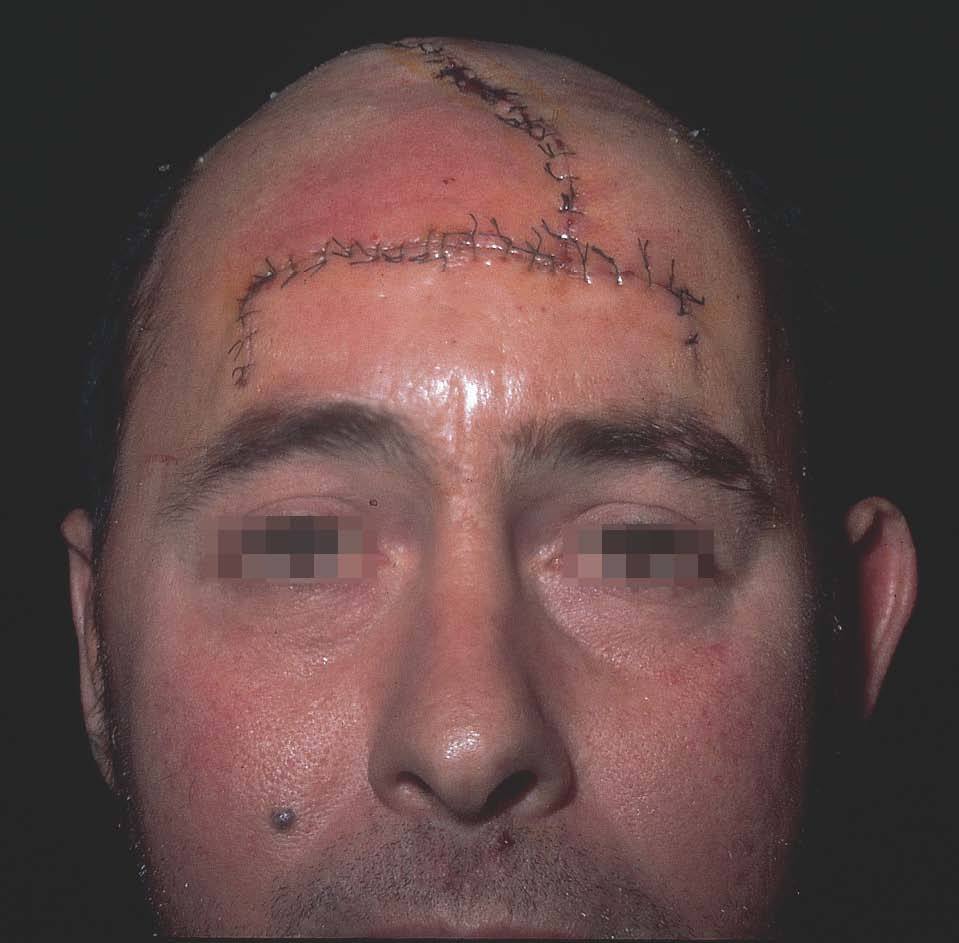
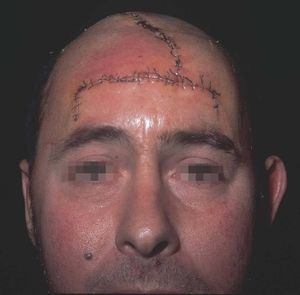
Figura 16. Resultado tras cierre inmediato.
El tratamiento sintomático es esencial en estos pacientes; así, en las malformaciones venosas las medias o prendas de compresión fuerte realizadas a medida, la prevención de sobreinfecciones o su tratamiento específico con antibióticos en malformaciones linfáticas, la analgesia pautada para lesiones dolorosas, etc., son puntos clave en la lucha por mejorar la calidad de vida.
Posiblemente uno de los avances más importantes de la medicina moderna haya sido incorporar el concepto de abordaje multidisciplinar en el diagnóstico, tratamiento y seguimiento de los pacientes, ampliando la visión global del enfermo más allá de la propia especialidad individual y favoreciendo el trabajo en equipo. El concepto de abordaje multidisciplinar de las malformaciones vasculares fue discutido e introducido por primera vez en el I Samsung International Symposium for Congenital Vascular Malformations de Seúl en diciembre de 199639, en el que se concluyó que las malformaciones vasculares debían ser atendidas y enfocadas por unidades multidisciplinares aunando los esfuerzos de todos los especialistas implicados en su manejo. Esta visión del problema es esencial, ya que en la mayoría de las malformaciones vasculares será necesario utilizar una combinación adecuada de varios procedimientos, puesto que la aplicación de uno sólo no suele ser suficiente.
Tratamiento quirúrgico
El objetivo del tratamiento quirúrgico debe ser la resección completa, siempre que sea posible, puesto que cualquier tejido residual dará lugar, invariablemente, a una recidiva. El tratamiento quirúrgico aislado de las malformaciones vasculares sólo es posible en lesiones muy localizadas y accesibles40,41, como los aneurismas venosos, algunas lesiones infiltrantes pequeñas y en las raras lesiones arteriovenosas mono-pediculares, de localización accesible y extensión limitada, que pueden ser tratadas mediante ligadura y extirpación total.
La resecabilidad de la lesión debe ser evaluada con rigor antes de proponer a un enfermo como candidato a la cirugía. Así, la lesión ideal para ser tratada exclusivamente con cirugía debe ser aislada y superficial, sin extensión a planos profundos y sin infiltración de estructuras adyacentes. La extensión más allá de la fascia con afectación de músculos, tendones, huesos y/o invasión de estructuras como la pelvis o la región glútea son contraindicaciones para tratar sólo con cirugía, ya que en el mejor de los casos, a pesar de una buena planificación terapéutica y una meticulosa cirugía, será un tratamiento paliativo temporal42, con un riesgo elevado de accidentes tromboembólicos43. En las proximidades de estructuras nerviosas es aconsejable la utilización de un electrocauterio bipolar. Debe prestarse una especial atención a la hemostasia del campo quirúrgico, puesto que el sangrado incontrolado dificulta enormemente la disección y eleva el riesgo de lesionar estructuras adyacentes.
En las malformaciones linfáticas el tratamiento habitualmente es conservador, puesto que raramente afectan a la función de la extremidad o del órgano implicados y suelen ser motivo de consulta por una preocupación estética. La excepción, aunque frecuente, son aquellas lesiones que por su peculiar localización cervical puedan ser potencialmente peligrosas, obstruyendo la vía aérea44.
En el aspecto práctico es difícil en las malformaciones arteriovenosas y linfáticas, sobre todo en las difusas, encontrar un plano de disección durante la exéresis, siendo los márgenes de la lesión casi imposibles de delimitar, por lo que la resección debe ser lo más amplia posible. Cualquier lesión residual, por ejemplo una mácula cutánea residual semejante a una mancha en vino de Oporto, dará lugar a una recidiva a corto plazo, motivo por el que son frecuentes las reintervenciones. La utilización de la RM y de la angiografía digital preoperatorias, especialmente evaluadas de forma dinámica, son particularmente útiles para establecer esos márgenes macroscópicos.
El objetivo del tratamiento quirúrgico de una malformación arteriovenosa es erradicar el nidus de la malformación. Esta cirugía con frecuencia es muy hemorrágica e ineficaz, puesto que rápidamente se produce un reclutamiento de vasos colaterales que brindan nueva suplencia al nidus. Una embolización previa facilita el acto quirúrgico y disminuye el sangrado. A continuación la resección debe realizarse lo más pronto y de la forma más completa posible, con márgenes amplios respecto a los límites del nidus.
Laserterapia
El láser de colorante pulsado produce una fototermólisis selectiva con la hemoglobina intravascular como diana, y hoy en día es el tratamiento de elección de la mancha en vino de Oporto45. La luz del láser, absorbida por la oxihemoglobina, se convierte en calor y daña el endotelio vascular produciendo trombosis y destrucción del vaso. Los efectos secundarios más frecuentemente descritos tras la aplicación del láser de colorante pulsado son la aparición de ampollas y costras, hiperpigmentación, hipopigmentación, desarrollo de cicatrices atróficas o hipertróficas e infecciones. Las ampollas y costras se observan a las pocas horas del tratamiento y raramente dejan cicatrices residuales tras su resolución. El efecto secundario más frecuente es la hiperpigmentación, que suele resolverse de forma espontánea en 6-12 meses46, aunque se debe intentar prevenir con el uso de fotoprotección. La aparición de cicatrices atróficas o hipertróficas varía según las distintas series, habiéndose descrito hasta en un 5 % de los casos46.
Dentro de un gran número de aparatos de láser de colorante pulsado, cada cual más versátil, interesa ceñirnos a los siguientes parámetros y valores de oscilación: diámetro del haz del láser (5-10 mm), longitud de onda (585-600 nm), densidad de energía o fluencia (7-15 J/cm2) y duración del pulso (450 μm-1500 ms). Un estudio reciente muestra buenos resultados en un 63 % de los pacientes con un aclaramiento mayor del 75 % de la lesión tras 4 sesiones utilizando un sistema dinámico de enfriamiento cutáneo, usando una longitud de onda de 595 nm, pulsos de 1,5 ms de duración y fluencias entre 11-12 J/cm2, frente a otro grupo tratado con 585 nm, en el que la mejoría del 75 % sólo se consiguió en el 40 % de los pacientes47. Algunos de los parámetros que pueden mejorar los resultados finales son la utilización de pulsos de duración largos (1,5 ms)48, longitudes de onda más altas (600 nm)49 o fluencias mayores47. En lactantes y niños el tratamiento se inicia con fluencias bajas, pudiendo aumentar 0,5-1 J/cm2 en cada sesión en función de la respuesta y posibles efectos secundarios.
Respecto al intervalo entre sesiones el estándar clásico es con un mínimo de 6 semanas de diferencia, aunque un trabajo reciente muestra mejores resultados cuando las sesiones son aplicadas cada dos semanas50.
A pesar de las controversias acerca del momento más apropiado para iniciar el tratamiento con láser, en general se admite que debe ser lo más precoz posible51. El número de sesiones requeridas en niños será menor, como consecuencia de que hay una respuesta más rápida51; además, la tasa de recurrencias disminuye en el grupo tratado por primera vez con menos de 10 años52. En la mayoría de los casos se necesitan entre 4 y 8 sesiones para obtener una respuesta satisfactoria, y sólo en un 10 % de los pacientes habrá una respuesta completa. Aproximadamente la mitad de los pacientes presenta un aclaramiento del 75 %, y hasta un tercio de los mismos lo que se considera una respuesta pobre (mejoría inferior al 50 %).
El principal inconveniente del tratamiento temprano es la necesidad de utilizar sedación (anestesia general), ya que el procedimiento es doloroso y provoca angustia y ansiedad incontrolables en un niño. El anestesista debe usar bajas concentraciones de O2 para evitar una ignición, por ejemplo tras la combustión de un tallo piloso, que podría extenderse por la vía aérea53. La experiencia nos reafirma en este protocolo, ya que facilita sesiones más extensas con mejor resultado a largo plazo y un perfecto equilibrio entre el médico, el paciente y los familiares, difícil de conseguir en procedimientos invasivos en niños en vivo y en directo. El uso de diferentes sistemas de enfriamiento de la superficie cutánea, como la aplicación dinámica de criógeno pulverizado, o la aplicación constante de aire frío54, previa a la irradiación con láser, puede evitar en algunos casos la anestesia en prepúberes y permitir la utilización de energías más altas, minimizando el riesgo de daño epidérmico55.
En las malformaciones venulares, mediante videomicroscopía56, se aprecian tres modelos de ectasia en el plexo papilar, según se afecten los vasos verticales, los profundos horizontales o ambos. Es importante reconocer y diferenciar estos patrones para predecir la respuesta al tratamiento con láser, ya que el primer modelo responde mejor que los otros57. Como anteriormente se señaló, la clasificación de las malformaciones venulares se hace en función del grado de ectasia, siendo las de grado I las que tienen los vasos más pequeños y las de grado IV las mayores. Los vasos más profundos persisten tras el tratamiento, ya que pueden dilatarse o incluso proliferar mediante angiogénesis extendiéndose de nuevo hacia zonas más superficiales58. La localización de las lesiones y el color de las mismas también condicionan el grado de respuesta al tratamiento con láser. Concretamente, lesiones situadas en V2 responden peor que las que afectan V1 o V3; la cara y el cuello responden claramente mejor que lesiones situadas en el tronco y las extremidades59.
Hasta un tercio de los pacientes no mejora a pesar de múltiples sesiones, en parte por la limitada penetrabilidad del láser en el tejido (1 a 1,5 mm), que impide tratar vasos localizados a mayor profundidad60, y en parte también porque pueden existir otros elementos no vasculares de tipo hamartomatoso que no son dianas de esta tecnología61. Pacientes adultos con mancha en vino de Oporto de color morado intenso, con elementos tuberosos e hipertrofia de la hemifacies afecta, requerirán tratamiento quirúrgico, bien mediante curetaje y electrocoagulación, escisión simple o reducción quirúrgica en cuña más vermillectomía de la hipertrofia labial. En estos casos los láseres de CO2 o de Nd:YAG también son eficaces62. En casos y zonas resistentes la administración de un doble pase con el láser de colorante pulsado mejora la respuesta63. También se ha demostrado cómo el solapamiento de impulsos puede favorecer la penetrabilidad, sin asociar efectos secundarios sobre la epidermis64.
Aquellos pacientes que no respondan al láser de colorante pulsado, pueden ser tratados con luz pulsada intensa, con el láser de Nd:YAG (1.064 nm)65 y el láser de KTP (532 nm). En una serie de pacientes resistentes al láser de colorante pulsado se obtuvieron resultados satisfactorios (mejoría mayor del 50 %) en un 17 % de los pacientes tratados con el láser de KTP. Las fluencias empleadas con mejores resultados se situaban entre 18 y 24 J/cm2, con duraciones del pulso entre 9-14 ms66. Estos aparatos permiten altas fluencias y la posibilidad de ajustar la duración del pulso al tiempo de relajación térmica de la estructura a destruir; de todas formas, aunque la tolerancia es mejor, con ausencia de púrpura, pueden producir mayor incidencia de cicatrices o alteraciones en la pigmentación66 (figs. 17 y 18). Aunque el número de estudios publicados con luz pulsada intensa es menor que con los láseres descritos, se obtienen mejorías entre un 70-100 % en el 70 % de los pacientes67,68.
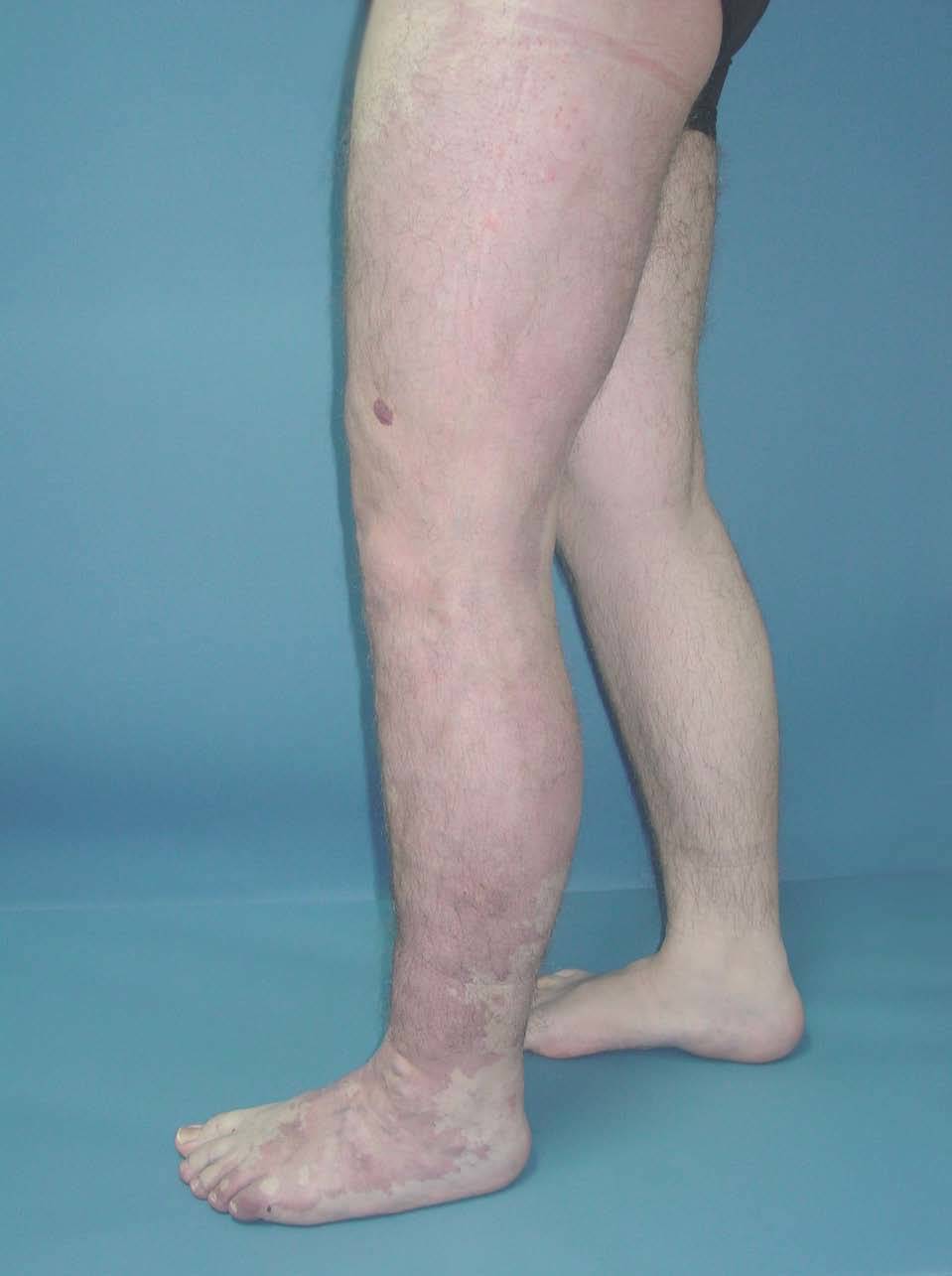
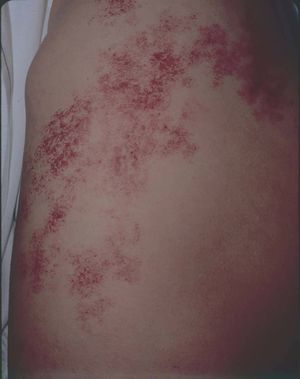
Figura 17. Mujer con malformación venular difusa en muslo sin otras características de síndrome de Klippel-Trenaunay, previa al tratamiento con láser de Nd:YAG.
Figura 18. Se aprecia una respuesta casi completa tras tres sesiones de tratamiento con láser de Nd:YAG.
El tratamiento de las malformaciones venosas con láser se limita a lesiones muy superficiales, al componente superficial de lesiones profundas tratadas con otros procedimientos (por ejemplo escleroterapia) o a lesiones de mucosas. El láser más empleado es el de Nd:YAG, que utiliza una onda continua de luz infrarroja a 1.064 nm con una penetrabilidad en la piel entre 5 y 7 mm. Este aparato puede aplicarse de modo intralesional69-71 a través de un catéter introducido en el interior de la lesión, visualizándose el proceso mediante control ecográfico.
Sobre la mucosa el láser de Nd:YAG, con una potencia constante de 30 w, una fibra de 600 μm de diámetro y una duración del pulso variable, es muy agradecido72. El procedimiento, que se realiza habitualmente bajo anestesia general, es seguro, no requiere el uso concomitante de sistemas de enfriamiento de la superficie y apenas presenta riesgo de fibrosis o cicatriz residual. Al incidir el impacto en la mucosa se observa una retracción inmediata del área tratada y la aparición de unos puntos blanquecinos que son útiles para no solapar los impactos. En grandes malformaciones venosas de la mucosa la aplicación del láser, previa a la cirugía, permite eliminar el componente superficial de la malformación y crear una banda de fibrosis que facilita una mejor disección de la lesión, disminuyendo el sangrado durante la intervención. Si se tratan áreas extensas en la cavidad oral, sobre todo en la porción posterior, deben administrarse corticosteroides sistémicos para reducir la inflamación y prevenir un posible compromiso de la vía aérea.
La ablación con láser CO2 está indicada especialmente en las malformaciones linfáticas superficiales de mucosas, caracterizadas clínicamente por la presencia de múltiples vesículas. Generalmente son lesiones difusas que alcanzan planos profundos, incluyendo el músculo subyacente72. Aunque este tratamiento no es curativo, permite controlar la enfermedad y mejorar de forma evidente la calidad de vida de los pacientes. A pesar de ello la recurrencia es la norma y son necesarios tratamientos periódicos. Como una infección asociada puede estimular el crecimiento de una malformación linfática, se aconseja realizar el procedimiento bajo cobertura antibiótica y antiinflamatoria con corticosteroides orales.
Embolización
La embolización es especialmente útil en las malformaciones arteriovenosas, y puede ser usada tanto de manera adyuvante como terapéutica en su manejo. A pesar de los avances de los últimos años, especialmente en nuevos materiales empleados (coils, diferentes partículas, polímeros y pegamentos)73-75, esta técnica se considera una solución temporal, ya que el aporte sanguíneo en una determinada localización anatómica no es estático, y el desarrollo de circulación colateral será inevitable76.
Como adyuvante una embolización previa a la cirugía suele ser el procedimiento más apropiado a la hora de enfocar el tratamiento de las malformaciones arteriovenosas. Así, tras mapear la lesión con una arteriografia y detectar el nidus y sus aferencias, se procede a embolizar desde la porción más distal a la proximal. De esta manera se reduce la vascularización de la lesión y el riesgo potencial de sangrado durante la intervención. Debido a que con gran rapidez se establecerá una nueva circulación colateral, se recomienda no retrasar la excisión quirúrgica más de 48 horas después de realizar el procedimiento77.
Terapéuticamente la embolización se utiliza de forma paliativa, para evitar el sangrado de lesiones extensas irresecables, o de forma curativa. Este último concepto no es muy real, y es preferible hablar más de control de la lesión que de curación. En estos casos es necesario un procedimiento gradual a través del nidus, desde la porción proximal a la distal, incluyendo tanto las arterias activas como las suplentes, teniendo que repetir frecuentemente el tratamiento por la revascularización de la lesión. El procedimiento no está exento de riesgos, y debe realizarlo un radiólogo intervencionista familiarizado con la técnica, ya que entre los efectos secundarios se puede producir la suelta de material y embolización a distancia, con necrosis distal y daño neurológico. Además, todo el material embolizante empleado debe ser aplicado bajo control fluoroscópico.
Escleroterapia
La escleroterapia consiste en la eliminación de venas varicosas mediante la inyección de una sustancia esclerosante en su interior. Los agentes esclerosantes originan una irritación química de la capa íntima de las venas, producida por la inflamación tras el contacto con las células endoteliales78. Posteriormente, de forma secundaria, se genera la formación de un trombo que impide la circulación de la sangre y favorece que paulatinamente las venas se transformen en cordones fibrosos esclerosados que acaban reabsorbiéndose. De acuerdo con su potencia los agentes esclerosantes pueden ser clasificados como mayores (alcohol, iodo y tetradecil sulfato de sodio), intermedios (salicilato sódico y polidocanol), o menores (glicerina cromada). El polidocanol (Etoxiesclerol®), al igual que el tetradecil sulfato de sodio, es un agente detergente, con un polo hidrófilo y otro hidrófobo, que actúa alterando la tensión superficial sobre las células endoteliales. Concretamente el polo hidrófobo se une a la superficie celular, mientras la porción hidrófila atrae agua dentro de la célula, originando una rápida e intensa hidratación endotelial79. El polidocanol tiene una excelente tolerancia local y general80, y está comercializado en Europa desde hace más de 20 años para la esclerosis de varices, aunque todavía no se encuentra aprobado por la Food and Drug Administration (FDA) americana. Sus ventajas contrastan con el carácter agresivo sobre la malformación y tejidos limítrofes de la escleroterapia con etanol, cuya inyección dolorosa exige hospitalización con anestesia general, está contraindicada en niños y puede producir necrosis de piel y mucosas, trombosis del sistema venoso profundo a nivel de extremidades, embolia pulmonar y colapso cardiorrespiratorio por espasmo pulmonar. Además, la administración de etanol no es fácilmente repetible como exige el procedimiento de escleroterapia, en el que la recanalización parcial tras la trombosis intravascular inicial suele ser frecuente81.
La escleroterapia convencional con esclerosantes líquidos, que en la mayor parte de los casos de las anomalías vasculares es un tratamiento paliativo, ofrece buenos resultados en lesiones reducidas82. Está indicada en las subsidiarias de cirugía como apoyo preoperatorio buscando una reducción del tamaño de la lesión, o bien como complemento postoperatorio83. Por el contrario, la escleroterapia convencional de las grandes malformaciones venosas es ineficaz, debido a las limitaciones intrínsecas de los líquidos inyectados sujetos a dilución e inactivación progresiva en un gran volumen hemático, a la irregular distribución del esclerosante sobre los endotelios del territorio tratado, a la dificultad de manejo y control del esclerosante una vez inyectado y a la imperceptibilidad al eco-doppler en el interior de los vasos.
Esta situación fue superada con la incorporación de la forma farmacéutica de microespuma para administrar los esclerosantes84. El uso moderno de las espumas en escleroterapia tiene su origen en el trabajo de Orbach en 1944, con su técnica del air-block, consistente en la introducción de aire antes de la inyección del esclerosante para intentar vaciar de sangre el vaso y favorecer una mayor acción de este último85. Posteriormente Orbach utilizó burbujas gruesas de esclerosante obtenidas por agitación de la ampolla que contenía el líquido esclerosante y comprobó un incremento de acción en relación con la forma líquida. Este procedimiento sólo se mostró útil en pequeñas venas y el interés inicial se difuminó durante décadas. En 1993 Juan Cabrera, cirujano vascular español, creó la forma farmacéutica de microespuma inyectable formando microburbujas de soluciones esclerosantes surfactantes en un ambiente de gases fisiológicos de alta solubilidad en los líquidos corporales86,87. Otros autores producen espuma con estas mismas soluciones mediante técnicas específicas denominadas por los nombres de sus descriptores: Monfreux, Tessari, Frullini, etc88. Hoy en día la técnica de Tessari es una de las más populares y obtiene espuma mediante el uso de dos jeringas unidas a una llave de tres vías. Estas espumas «caseras» utilizan aire atmosférico, rico en nitrógeno gas de baja solubilidad en los fluidos corporales, tienen un tamaño irregular de burbuja y una alta variabilidad en su cohesión interna. Las técnicas de aplicación de las espumas también son variables89, aunque el consenso de Tegernsee90 recomendó, por motivos de seguridad, no inyectar un volumen superior a 5 cc de espuma por sesión de tratamiento.
La microespuma esclerosante está compuesta de gases fisiológicos como el oxígeno y el dióxido de carbono (CO2), y obtiene microburbujas de un tamaño muy reducido con la suficiente estabilidad y cohesión internas para ser inyectadas dentro de los vasos. La superficie de contacto entre el esclerosante y la pared del vaso aumenta enormemente en una proporción inversa al diámetro de las burbujas. La microespuma de polidocanol desplaza a la sangre favoreciendo un contacto homogéneo entre el esclerosante y el endotelio, facilitando la destrucción endotelial86,87. Además el procedimiento es visible en tiempo real mediante ecografía. La alta solubilidad del CO2 y su ausencia de toxicidad permite la inyección de grandes volúmenes, inalcanzables para espumas configuradas con aire atmosférico90-94. A veces es necesario inyectar un volumen de microespuma entre 20-100 cc para el tratamiento de malformaciones venosas extensas. Por el contrario, en el caso de las espumas caseras, el volumen de gas que puede inyectarse es limitado por la baja solubilidad del nitrógeno a los 5 cc aconsejados, y en ellas sólo puede modificarse la concentración.
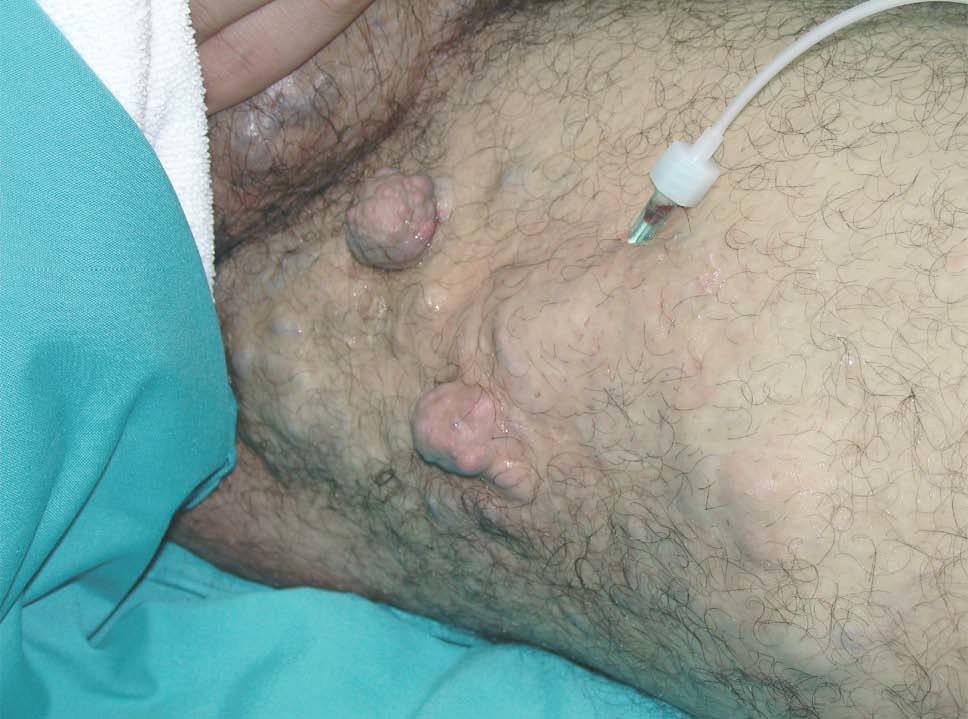
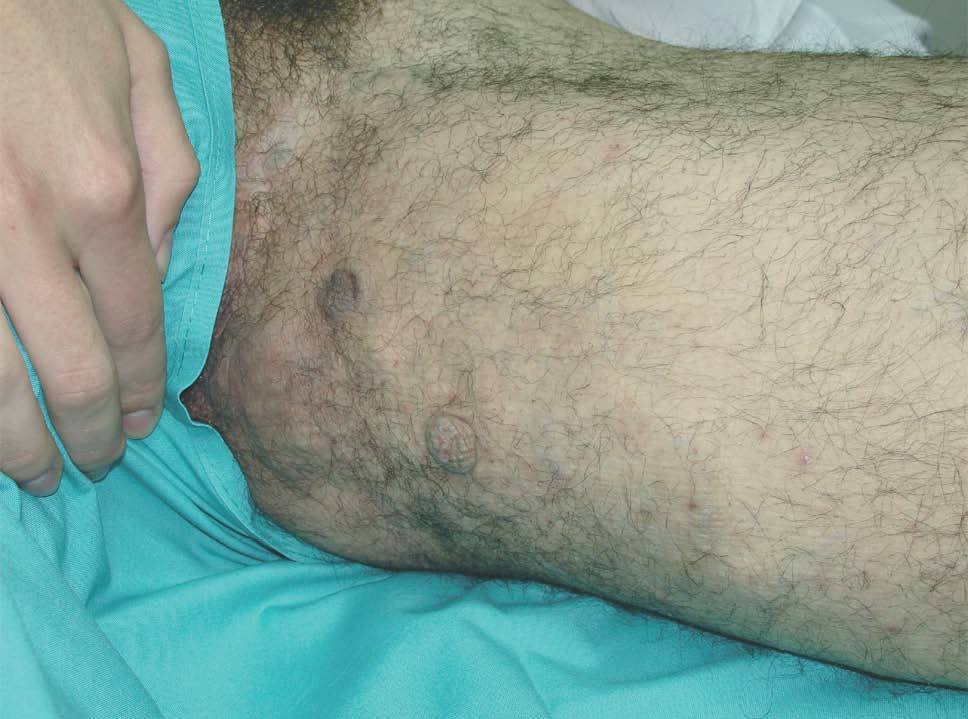
Actualmente hemos tratado más de 120 pacientes con malformaciones vasculares congénitas de predominio venoso mediante escleroterapia con microespuma de polidocanol. En una primera serie publicada 50 pacientes (18 varones y 32 mujeres, con un rango de edad entre 8 y 62 años) fueron divididos siguiendo la clasificación de Hamburgo en tres grupos, el primero con lesiones infiltrantes (n = 16), el segundo con lesiones limitadas (n = 19) y el tercero con malformaciones vasculares combinadas tipo síndrome de Klippel-Trenaunay (n = 15)95. En algunos casos, además de estudio ecográfico se realizaron otras pruebas de imagen complementarias. En todos los pacientes se utilizó microespuma de polidocanol administrada bajo inyección guiada por eco-doppler. En cada sesión se administraron entre 20 y 80 cc de microespuma correspondientes a 3-6 ml de polidocanol al 2 %. La concentración de polidocanol inyectado osciló entre 0,25 a 3 %, dependiendo del tamaño de la malformación y de las características hemodinámicas del área a tratar. Así, las malformaciones infiltrantes requirieron concentraciones mayores (2-3 %), mientras que las venas laterales anómalas de los pacientes con síndrome de Klippel-Trenaunay fueron tratadas con concentraciones menores (0,25-0,5 %). El procedimiento fue realizado sin anestesia y el número de sesiones osciló entre 1 y 46 (media = 12), sólo en 21 pacientes se realizaron más de 10 sesiones. Las sesiones fueron repetidas cada 2-4 semanas. En 46 pacientes (92 %) hubo mejoría clínica y radiológica, y sólo 4 pacientes no respondieron. De los 46 respondedores, en 18 (39 %) se apreció una desaparición total de la malformación tratada, en 15 (33 %) hubo una reducción igual o mayor del 50 % y en 13 (28 %) la reducción de la malformación fue menor del 50 %. De los 39 pacientes que presentaban dolor hubo desaparición en 25 y reducción en los otros 14; 5 pacientes tenían úlceras crónicas que cicatrizaron en su totalidad, y en otros 9 había episodios de hemorragia que disminuyeron o desaparecieron en el 100 % de los casos. Respecto a los efectos secundarios, 4 pacientes desarrollaron pigmentación cutánea que desapareció espontáneamente. En dos pacientes tras la esclerosis superficial con microespuma de polidocanol al 0,5 % se desarrolló una pequeña necrosis. Otro paciente tuvo una necrosis cutánea más extensa debido a la inyección accidental de una arteria distal. En ningún caso se documentó trombosis del sistema venoso profundo, embolismo pulmonar o lesiones neurológicas. La mejor respuesta a la esclerosis fue en el síndrome de Klippel-Trenaunay, con eliminación total de las áreas patológicas en el 80 % de los pacientes, y sólo una recurrencia de pequeñas varicosidades (menores del 20 % de la lesión original) en 10 de ellos95 (figs. 19-21).
Figura 19. Varón de 16 años con síndrome de Klippel-Trenaunay. Se observa mancha en vino de Oporto difusa y vena embrionaria lateral.
Figura 20. Vena ciática persistente en paciente con síndrome de Klippel-Trenaunay.
Figura 21. Paciente de figura 19 tras 7 sesiones de escleroterapia con microespuma de polidocanol. Nótese la ausencia de venas laterales y la persistencia de la mancha en vino de Oporto.
Las malformaciones vasculares del polo cefálico deben tratarse con moderación, ya que las venas de la cabeza y el cuello carecen de válvulas, y las localizadas en los dos tercios superiores de la región facial van a comunicar directamente con el seno cavernoso a través de las venas oftálmicas superior e inferior.
La eficacia terapéutica de la microespuma de polidocanol depende de su acción mecánica, desplazando la sangre en el interior de los vasos. Si el flujo sanguíneo está aumentado se produce dilución de la microespuma inyectada, reduciendo su efecto. En la práctica habitual es frecuente en algunas malformaciones venosas apreciar pequeñas fístulas arteriovenosas que restan eficacia al tratamiento, reducen la extensión del territorio inicialmente trombosado tras la inyección y favorecen su recanalización parcial precoz.
La escleroterapia con microespuma de polidocanol es bien tolerada sin efectos secundarios dignos de consideración. La simplicidad, la reproducibilidad, su bajo coste, su carácter ambulatorio y la seguridad del procedimiento, hacen de ella la técnica de elección para la eliminación anatómica y funcional de un territorio venoso patológico96 (figs. 22 y 23).
Figura 22. Dilataciones venosas prominentes con elementos exofíticos en raíz de muslo durante una sesión de escleroterapia con microespuma de polidocanol.
Figura 23. Paciente de la figura anterior. Resultado a los tres meses tras tres sesiones de tratamiento.
Escleroterapia de malformaciones linfáticas
Las malformaciones linfáticas pueden esclerosarse con dextrosa, tetraciclinas, bleomicina y OK-432. El mecanismo de acción de todas estas sustancias es su difusión al estroma, con irritación e inflamación que favorecen la retracción y contractura cicatricial de la lesión. Previamente a la inyección hay que aspirar el mayor volumen posible de linfa y «vaciar» la malformación al máximo.
El OK-432 (picibanil; Chugay Farmaceutical CO; Tokio, Japón) es un preparado de bacterias muertas obtenido por incubación del cultivo de Estreptococcus piogenes (grupo A, tipo III) de origen humano con penicilina G benzatina, sin capacidad infectante ni repercusión sistémica.
Además de su acción esclerosante al OK-432 se le atribuyen diversas acciones inmunofarmacológicas como aumento de la citotoxicidad de células NK, de linfocitos T citotóxicos, de células LAK y de macrófagos, y estimulación y síntesis de citocinas como TNF e interferones, que aumentan la permeabilidad endotelial, acelerando el drenaje linfático y favoreciendo la retracción de la cavidad quística97. Su primer uso clínico en el tratamiento de 9 pacientes con higroma quístico data del año 1987, con una regresión completa en 8 de ellos98. Posteriores publicaciones del mismo grupo de trabajo, con series de 23 y 64 pacientes respectivamente, demuestran excelentes o buenos resultados en el 93 % de los linfangiomas quísticos, y en el 47 % de los linfangiomas tipo cavernoso99,100. Con los años, publicaciones de varias series de pacientes101,102 por otros autores han confirmado la eficacia de este procedimiento, proponiendo la escleroterapia con OK-432 como el tratamiento de elección de las malformaciones linfáticas, especialmente de las lesiones macroquísticas. Aunque la mayor parte de las lesiones tratadas corresponden al polo cefálico por incidencia natural de esta patología, se ha visto una respuesta satisfactoria en cualquier localización incluso en grandes lesiones retroperitoneales103 o de localización compleja como la región periorbitaria104 sin limitación respecto a la edad del paciente. El único motivo de exclusión para esta terapia es la alergia a penicilina.
La dosis máxima sugerida es de 0,3 mg de OK-432 por sesión99,105. En general, la lesión regresa sin cicatriz ni alteración de la anatomía local y, tras seguimientos de varios años en las series publicadas, no se observan recidivas.
Conflicto de intereses
Declaro no tener ningún conflicto de intereses.
Correspondencia:
Pedro Redondo.
Departamento de Dermatología. Clínica Universitaria de Navarra.
Avda. Pío XII, s/n. Pamplona. España.
predondo@unav.es
Aceptado el 9 de febrero de 2007.