La luz de Wood (LW) es una herramienta diagnóstica útil, económica y de fácil aprendizaje. A pesar de sus ventajas, el uso de la LW entre los dermatólogos es limitado. En la poroqueratosis, se ha descrito el signo de «collar de diamantes», correspondiente a la fluorescencia blanca de la escama hiperqueratósica. Las lesiones subclínicas de morfea se observan como máculas oscuras bien delimitadas. Dentro de los trastornos pigmentarios destaca la fluorescencia azulada del vitíligo, el aumento del contraste del melasma epidérmico y la fluorescencia roja foliculocentrada de la hipomelanosis macular progresiva. Respecto a las infecciones cutáneas, el eritrasma presenta una fluorescencia rojo coral; la tiña versicolor, fluorescencia amarillo-verdosa; la Pseudomonas aeuriginosa, fluorescencia verde, y la escabiosis, fluorescencia blanco-azulada en los surcos acarinos. En el cáncer cutáneo, la LW se ha empleado para delimitar los márgenes quirúrgicos tanto de lentigo maligno como de cáncer cutáneo no melanoma, con resultados variables.
Wood's light (WL) is a useful, economical and easy-to-learn diagnostic tool. Despite its advantages, the use of LW among dermatologists is limited. In porokeratosis, the “diamond necklace” sign has been described, corresponding to the white fluorescence of the hyperkeratotic scale. Subclinical morphea lesions are seen as well-defined dark macules. Among the pigmentary disorders, the bluish fluorescence of vitiligo, the increased contrast of epidermal melasma, and the follicular-centered red fluorescence of progressive macular hypomelanosis stand out. Regarding skin infections, erythrasma presents a coral red fluorescence; tinea versicolor, yellow-green fluorescence; Pseudomonas aeuriginosa, green fluorescence; and scabies, blue-white fluorescence in the acarine grooves. In skin cancer, LW has been used to delimit the surgical margins of both lentigo maligna and non-melanoma skin cancer, with variable results.
La luz de Wood (LW) es un método diagnóstico rápido, económico, accesible y no invasivo, basado en el uso de una fuente de radiación ultravioleta (UV) con una longitud de onda de aproximadamente 365nm. Desde su invención en 1903 por el físico Robert Wood, ha facilitado el diagnóstico de múltiples enfermedades cutáneas1. Clásicamente ha sido empleada en infecciones fúngicas superficiales y en alteraciones pigmentarias. En los últimos años, pareciera que la utilización de la LW ha disminuido entre los dermatólogos2. En este artículo revisaremos la utilidad de la luz de Wood en dermatosis inflamatorias como infecciosas y en el manejo del cáncer cutáneo.
Aspectos técnicos y dispositivosOriginalmente, la LW consistía en una lámpara de mercurio con un filtro de silicato de bario con óxido de níquel, que permitía el paso de radiación UV de longitud de onda de 320 a 400 nanómetros (nm), con un pico en 365nm1. Las lámparas de Wood clásicas asocian una lupa de aumento de 1,5×. Sin embargo, pueden ser aparatosas y de alto coste y esto puede dificultar su utilización3. Actualmente están disponibles linternas LED de luz negra, livianas y de pequeño tamaño, con picos de emisión de 365 a 395nm y precios alrededor de 15 a 30 euros. Se han demostrado igualmente efectivas para detectar la fluorescencia, aunque carecen de lupa de magnificación4-6. Recientemente, se ha incorporado luz ultravioleta de 365nm de longitud de onda (UV365) a algunos dermatoscopios, lo que ha permitido describir con más detalle los patrones de fluorescencia de diversas enfermedades cutáneas7.
La capacidad diagnóstica de la LW se basa en el fenómeno de fluorescencia. Los fotones de la UV365 excitan electrones de moléculas llamadas fluoróforos que, al volver al estado energético basal, liberan fotones en el rango de la luz visible8. En las longitudes de onda de la LW, la fluorescencia endógena de la piel se origina principalmente en la dermis, donde los enlaces cruzados de pepsina y colagenasa del colágeno estructural emiten una fluorescencia azulada8,9. Sin embargo, la melanina absorbe eficientemente esta longitud de onda, disminuyendo la intensidad de la fluorescencia. Esto permite que la LW resalte las diferencias entre hipo o hiperpigmentaciones10,11. La LW también evidencia la acumulación fluoróforos exógenos, como sustancias producidas por infecciones fúngicas y bacterianas, o endógenos, como en el caso de las porfirias (tabla 1).
Aplicaciones de la luz de Wood en dermatología
| Patología | Hallazgos con luz de Wood | |
|---|---|---|
| Dermatosis inflamatorias | Poroqueratosis | Borde blanco azulado |
| Morfea en placas | Mácula oscura | |
| Trastornos pigmentarios | Hipomelanosis macular progresiva | Fluorescencia roja centrada en los folículos |
| Vitíligo | Coloración azul/no fluorescencia | |
| Melasma | Epidérmico: aumento del contraste. Dérmico: no contrasta | |
| Infecciones | Tiña versicolor | Fluorescencia amarillo-verdosa |
| Eritrasma | Fluorescencia rojo coral | |
| Tricobacteriosis | Color azulado | |
| Pseudomonas aeruginosa | Fluorescencia verde | |
| Microsporum | Fluorescencia verde-azulado | |
| Trichophyton schoenleinii | Color azul pálido | |
| Parasitosis | Escabiosis | Surco blanco azulado y ácaro verdoso |
| Cáncer cutáneo | Lentigo maligno/lentigo maligno melanoma | Aumento del contraste de pigmentación |
| CBC/CEC + 5-ALA | Coloración rojiza | |
| Trastornos metabólicos | Porfiria eritropoyética congénita | Fluorescencia rojo-rosada en orina, sangre y esmalte dental |
| Porfiria cutánea tarda | Fluorescencia rojo-rosada en orina y heces | |
| Porfiria hepatoeritropoyética | Fluorescencia rojo-rosada en orina, sangre y esmalte dental | |
| Protoporfiria eritropoyética | Fluorescencia rojo-rosada en sangre |
CBC: carcinoma basocelular; CEC: carcinoma escamoso cutáneo; 5-ALA: ácido 5 aminolevulínico.
Fuente: Dyer et al.16.
La LW debe utilizarse en una habitación a oscuras1. Clásicamente se recomendaba encender la lámpara 60 s antes de la exploración, ya que las lámparas de mercurio no emiten el espectro de radiación completo hasta alcanzar una presión suficientemente elevada12. Con las lámparas LED este decalaje temporal no es necesario. La fuente de luz debe sostenerse a 10-12cm de distancia la piel1, aunque con las lámparas LED de luz más focalizada puede ser necesario alejarlas 30 o 40cm. En caso de sospecha de infecciones, debe evitarse lavar la piel antes, ya que se puede diluir los fluoróforos y causar falsos negativos1. Sin embargo, en trastornos de la pigmentación o lesiones pigmentadas, es preferible lavar la cara y eliminar cosméticos y fotoprotectores, ya que estos pueden distorsionar la imagen y dificultar la delimitación clínica de lesiones13. Entre las causas de falsos positivos destacan las escamas hiperqueratósicas y secreciones como saliva, suero, semen y leche13, así también elementos exógenos como rotuladores de colores, detergentes de ropa, pelusas, zumo de limón, cosméticos, tintes y pomadas13.
PrecaucionesLa exposición crónica a la radiación UVA, presente en la LW, está asociada al desarrollo de cataratas y envejecimiento ocular14,15. Sin embargo, los oftalmólogos han indicado que la LW no tiene efectos oculares negativos16. Se recomienda cubrir los ojos de los niños, ya que su cristalino carece del pigmento protector de los adultos que absorbe la radiación UVA, de manera que esta puede alcanzar la retina14,15,17. Además, los niños tienden a mirar a la luz directamente.
Luz de Wood en dermatosis inflamatorias o autoinmunesEn el examen de lesiones de poroqueratosis con LW, se ha descrito el signo de «collar de diamantes», correspondiente a la fluorescencia blanca de la escama hiperqueratósica que rodea el centro azul-negruzco6,18 (fig. 1 A-B). Sin embargo, esta fluorescencia es inconstante6. En la poroqueratosis folicular, se observa un patrón de fluorescencia blanca punteada en el interior, correspondiente a la lamela de los folículos dilatados6. Bajo la LW las lesiones subclínicas de morfea se observan como máculas oscuras bien delimitadas, lo que puede facilitar el diagnóstico precoz y el seguimiento de estos pacientes19.
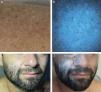
Luz de Wood en trastornos pigmentariosEl uso por excelencia de la LW es en los trastornos pigmentarios, como en el caso del vitíligo16,20,21. La ausencia de melanina permite visualizar la fluorescencia azulada natural de la dermis con un borde muy bien delimitado10,11. Bajo dermatoscopia con luz UV365 se ha descrito fluorescencia folicular homogénea en un 40% de los casos de vitíligo7. La LW puede detectar lesiones subclínicas, permitiendo un diagnóstico precoz, y evaluación de la respuesta al tratamiento21-23 (fig. 1 C-D). En la esclerosis tuberosa, la LW puede poner de manifiesto las máculas hipomelánicas, especialmente la despigmentación en confeti, menos aparente bajo luz visible que las clásicas máculas lanceoladas24-26. En el melasma, la LW puede ayudar a identificar la profundidad del depósito de melanina y potencialmente predecir la respuesta a tratamientos27-29 (fig. 2). En el melasma epidérmico, la hiperpigmentación se oscurece bajo la LW29-31. En cambio, el melasma dérmico no muestra aumento del contraste29-31. Sin embargo, la correlación histológica de la clasificación del melasma por LW es controvertida: hay estudios que sugieren una buena correlación, mientras que otros indican que todos los melasmas tienen un componente dérmico27,28,32.
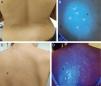
La hipomelanosis macular progresiva es un trastorno pigmentario causado por Cutibacterium acnes, una bacteria grampositiva que habita en el folículo piloso y produce coproporfirina III33-36. La LW acentúa las zonas de hipopigmentación y muestra fluorescencia roja en los folículos de las zonas hipopigmentadas33-35 (fig. 3 A-B). La LW permite diferenciarla de la pitiriasis versicolor, que presenta fluorescencia amarillenta (fig. 3 C-D); de la pitiriasis alba, que debido a la paraqueratosis irregular no muestra fluorescencia, o de la hipopigmentación postinflamatoria y la hipomelanosis gutatta idopática, que muestran la fluorescencia azulada de la dermis20,35.
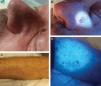
Luz de Wood en infecciones cutáneasEl eritrasma, producido por Corynebacterium minutissimum, presenta fluorescencia rojo coral por la producción de coproporfirina III37,38 (fig. 4). Esto permite diferenciarlo de otras causas de intertrigo que no muestran fluorescencia como el intertrigo irritativo, la candidiasis o la psoriasis inversa37,38. En el caso de la tinea cruris, hasta un 25% pueden presentar fluorescencia azul-verdosa, si están causadas por Microsporum, que produce el fluoróforo pteridina7,16. La tricobacteriosis, causada por Corynebacterium flavescens, presenta una fluorescencia blanca-amarillenta adherida al pelo axilar37,39,40 y se desconoce el fluoróforo que la origina16,41. La pitiriasis versicolor muestra una fluorescencia amarillo-verdosa, originada por la porfirina pitirialactona producida por la Malassezia globosa42-44. En las tinea capitis por Microsporum canis se observa una fluorescencia azul por el fluoróforo pteridina45-48. Las infecciones por Tricophyton generalmente no presentan fluorescencia, únicamente Tricophytonschoenleinii, causante de la tiña fávica, muestra una fluorescencia azul pálida16,20. Las infecciones por Pseudomona aeruginosa presentan fluorescencia verde, debido la pioverdina, pigmento quelante del hierro49-51. El uso de LW en heridas con sospecha de sobreinfección puede permitir el diagnóstico precoz de sobreinfección por este patógeno, así también en las infecciones ungueales («uña verde»)51,52 (fig. 5A).
En la escabiosis, la LW evidencia una fluorescencia blanca azulada en el surco acarino53,54 (fig. 5 B-C). Si se evalúa el surco con un dermatoscopio con luz UV365, se puede observar un punto de fluorescencia blanca o verde correspondiente al cuerpo del ácaro53,54.
Luz de Wood en cáncer cutáneo y cirugía dermatológicaLentigo malignoLa delimitación de los márgenes tumorales en el lentigo maligno (LM) puede ser difícil. Pese a que las guías recomiendan realizar márgenes quirúrgicos de entre 5 a 10mm, un estudio reciente (n=846) mostró que se requerían márgenes de 15mm para alcanzar márgenes libres en el 97% de los casos (solo un 62% de los LM tenían márgenes libres con resecciones con 5mm de margen)55. En el LM, el contraste generado por la LW entre la fluorescencia endógena de la piel sana y el oscurecimiento de las zonas con pigmento epidérmico puede ser útil para delimitar el tumor56-59 (fig. 6 A-B), y hay centros que utilizan LW sistemáticamente previo a realizar cirugía micrográfica de Mohs (CMM) en el LM55. Se han descrito series de casos de LM en los que la LW permitió delimitar exitosamente el tumor, resultando en márgenes libres en el primer estadio de CMM, además de permitir la detección precoz de recurrencias56,58,59. Hemos encontrado solo un estudio prospectivo comparando la delimitación de márgenes quirúrgicos de LM con LW versus el examen clínico (n=60) en CMM57. El estudio siguió una estricta metodología: dibujaron y midieron la delimitación prequirúrgica con LW, comparándola con la delimitación clínica. Luego se realizó la extirpación a 5mm por fuera de los márgenes delimitados clínicamente. Finalmente, se comparó el dibujo de la delimitación prequirúrgica con LW con el defecto quirúrgico final (tras obtener márgenes libres con CMM). Solo en 7 casos (12%) la LW incrementó la delimitación de los márgenes de resección comparada con el examen clínico y solo en uno de ellos los márgenes observados con la LW se correspondían histológicamente con márgenes afectados por el LM. En este paciente, la LW hubiera reducido el número de estadios necesarios de CMM. En los 6 casos restantes, la LW sobrestimó los márgenes tumorales. Los autores concluyeron que la utilidad de la LW en CMM del LM era limitada, ya que hubiera sobrestimado los márgenes quirúrgicos, llevando a defectos finales de mayor tamaño de manera innecesaria57. Sin embargo, la LW presentó un alto valor predictivo negativo (87%), por lo que se puede deducir que, si la LW no resalta zonas sospechosas fuera de la delimitación prequirúrgica clínica, la probabilidad de que haya tumor es bastante baja y se podrían realizar márgenes ajustados (de 5mm), aunque esto debe ser evaluado en estudios prospectivos con un mayor número de pacientes.
A) Lentigo maligno en el lóbulo de la oreja derecha, muy difícil de apreciar y de delimitar. B) Con luz de Wood se logró una delimitación más precisa, permitiendo márgenes libres en el primer estadio con cirugía de Mohs. La flecha negra muestra la zona de biopsia previa, claramente visible bajo luz de Wood.
En el carcinoma basocelular (CBC) y en el carcinoma escamoso cutáneo (CEC), se puede utilizar LW por sí sola (fig. 7 A-B) o tras aplicar ácido 5-aminolevulínico (5-ALA), donde las células tumorales emiten fluorescencia roja bajo LW debido a la acumulación del fluoróforo protoporfirina IX60. En un estudio prospectivo con 27 pacientes con CBC se utilizó fluorescencia por 5-ALA para delimitar el debulking en CMM61. Se realizaron fotografías de fluorescencia digital y se marcó el margen de resección 1mm alrededor de la fluorescencia. En 15 pacientes el diámetro de la lesión por fluorescencia fue mayor que el diámetro clínico. En el 44% el margen delimitado por fluorescencia coincidía con el histopatológico y la concordancia era más frecuente en tumores ≤ 1cm que en> 1cm. Concluyeron que se podría asegurar una exéresis completa con un margen de 2mm del tumor delimitado por fluorescencia en lesiones<1cm y en las que la fluorescencia coincide con la lesión clínica. En tumores> 1cm serían necesarios márgenes de 3mm61. Respecto a los CBC faciales, en un estudio previo de diseño similar (n=26) el diagnóstico por fluorescencia mostró una sensibilidad del 38% y una especificidad del 88%. Los autores concluyeron que no era útil para delimitar lesiones en la zona H62. Sin embargo, en otro estudio prospectivo en CBC faciales (n=10), el diagnóstico con 5-ALA y LW con biopsias periféricas preoperatorias de zonas de fluorescencia tenue, consiguió márgenes libres en el 90% de los pacientes63. Dos estudios previos con CMM (n=22 y n=12) encontraron una buena correlación de la fluorescencia con la histología en alrededor del 50% de los pacientes64,65. Otros autores realizaron biopsias seriadas en zonas de fluorescencia y no fluorescencia (n=10) y exéresis según fluorescencia (n=28), encontrando una sensibilidad entre el 79 y el 94%, y una especificidad entre el 82 y el 100%, respectivamente66,67.
A) Carcinoma basocelular mal delimitado en la zona paranasal izquierda. B) Delimitación prequirúrgica con luz de Wood. C) Cicatriz de melanoma en el antebrazo derecho, previa ampliación de márgenes. Difícil de detectar clínicamente. D) La luz de Wood permite encontrar fácilmente la cicatriz (flechas negras).
Un estudio prospectivo en pacientes con CEC tratados con CMM comparó 38 individuos con márgenes de debulking delimitados por fluorescencia vs. 29 delimitados clínicamente. El grupo con diagnóstico por fluorescencia requirió menos estadios de CMM68.
Enfermedad de Paget extramamariaLa enfermedad de Paget extramamaria (EPE) es una neoplasia intraepitelial infrecuente, y se caracteriza por elevadas tasas de recurrencia a pesar de escisiones extensas o CMM69-71.
Un estudio prospectivo con 36 pacientes con EPE comparó márgenes quirúrgicos delimitados por biopsias sucesivas en la zona de fluorescencia roja tras aplicar 5-ALA y LW vs. exéresis amplias con 2cm de margen71. El grupo con 5-ALA y LW presentó áreas de resección significativamente menores, menor tiempo quirúrgico y menores secuelas funcionales. No hubo diferencias en las tasas de recurrencia a los 5 años71. Otro método consiste en la inyección de fluoresceína sódica por vía intravenosa, que se acumula las dilataciones vasculares subdérmicas de las zonas afectadas por la EPE y emite fluorescencia verde bajo LW72. Un estudio retrospectivo en 8 pacientes con EPE vulvar tratadas mediante vulvectomía utilizó este mapeo. Primero se realizaron biopsias de zonas captantes sin afectación macroscópica, evidenciando lesiones satélites en un 50% de las pacientes. Esto permitió una mejor delimitación de los márgenes de vulvectomía en un segundo tiempo. Tras una media de 32 meses de seguimiento, ninguna de las pacientes presentó recurrencias70.
En nuestra experiencia, la LW puede ser una herramienta valiosa para ayudar a delimitar márgenes quirúrgicos de LM y de CBC o CEC, y utilizamos lámparas LED con UVA365 muy frecuentemente. Sin embargo, puede sobrestimar57,62,66 e infraestimar61,67 los márgenes quirúrgicos en algunos casos y la mayoría de la evidencia clínica proviene de estudios de pequeño tamaño y con metodología heterogénea. Por este motivo se requieren más estudios prospectivos, de mayor tamaño muestral y de metodología homogénea, para poder realizar recomendaciones al respecto.
Detección de zonas previamente biopsiadasUno de los errores médicos graves más frecuentes en dermatología es extirpar una lesión distinta a la previamente biopsiada, por identificar el área erróneamente o por no encontrarla73,74. La LW puede ayudar a detectar las zonas de biopsias previas, evitando errores quirúrgicos73,74 (fig. 7 C-D).
Uso de la luz de Wood en la práctica clínicaEn 2012 la revista canadiense de medicina de familia la situó en el primer lugar del top 10 de procedimientos diagnósticos olvidados75. Aunque hay estudios que afirman que su uso ha incrementado con el tiempo, la mayoría alude a su infrautilización en la práctica clínica diaria76,77. Una encuesta realizada en Andalucía mostró que únicamente el 42,5% de los dermatólogos disponía de LW y la usaba; el 26% la tenía, pero no la usaba, y el 33% no la tenía a su alcance2.
ConclusionesLa LW representa una herramienta fundamental en el arsenal diagnóstico en dermatología. Es una técnica rápida, económica y de fácil aprendizaje. Puede resaltar características específicas de trastornos pigmentarios, y de dermatosis inflamatorias, infecciosas y parasitarias, proporcionando información valiosa para el diagnóstico y la planificación terapéutica. Además, podría ayudar en la delimitación de los márgenes quirúrgicos del LM y del cáncer cutáneo no melanoma, aunque la evidencia es aún escasa, y en algunos casos, contradictoria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.