INTRODUCCION
El lupus eritematoso, con sus distintas variedades de lupus eritematoso sistémico (LES), lupus eritematoso discoide (LED) y lupus eritematoso cutáneo subagudo (LECS), puede diagnosticarse también en la edad pediátrica. En los últimos años, las distintas formas de lupus infantil han sido objeto de gran número de revisiones y actualizaciones, y gracias a ellas sabemos que se trata en general de cuadros similares a los del adulto, pero con algunos rasgos diferenciales que se desarrollarán a lo largo de este artículo.
Además de las variedades clásicas de lupus eritematoso, existe una forma de lupus infantil, el lupus eritematoso neonatal (LEN), que es propia y exclusiva de los niños. Se trata de una enfermedad del lactante debida al paso transplacentario de autoanticuerpos maternos al niño. Aunque todas las formas de lupus eritematoso infantil han sido fuente de infinidad de publicaciones en los últimos años, probablemente el LEN sea la variedad de lupus pediátrico que más interés ha suscitado, con algunas novedades importantes que se comentarán en este apartado.
A continuación se describen las distintas variedades de lupus eritematoso infantil, tanto las clásicas, como el LEN, atendiendo a los hallazgos clínicos y patológicos. También se revisarán las teorías patogénicas propuestas y se llevará a cabo un repaso de las pautas terapéuticas recomendadas en cada caso.
LUPUS ERITEMATOSO SISTÉMICO
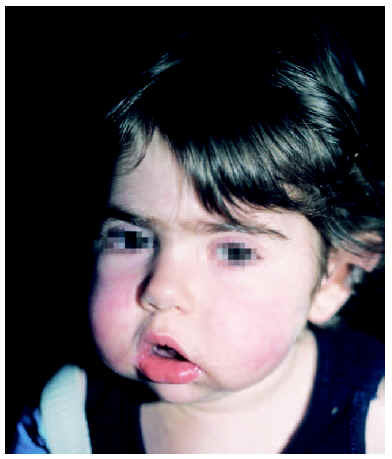
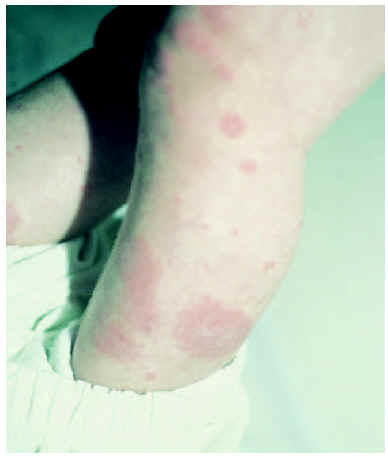
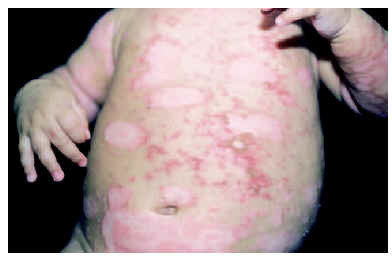
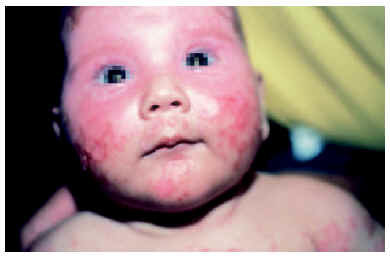
En los niños la forma más frecuente de lupus eritematoso es el LES. De hecho, hasta una cuarta parte de todos los casos de LES comienza antes de los 16 años, con un pico entre los 10 y los 14. El inicio antes de los 5 años de edad es excepcional1-3, aunque posible (figs. 1 y 2). Igual que en los adultos, afecta con más frecuencia a las niñas, en un proporción mujer:varón de 4-18:11,3,4.
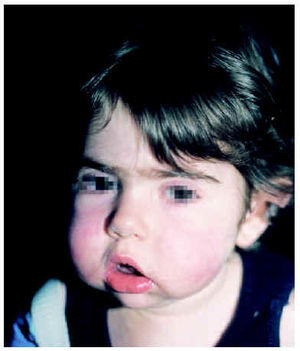
Fig. 1.--Eritema violáceo en ambas mejillas y facies cushingoide por tratamiento crónico con corticoides orales.
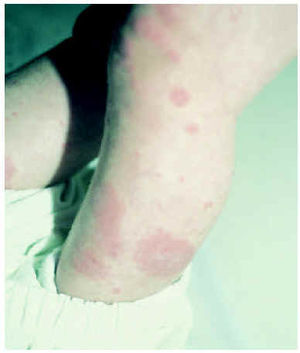
Fig. 2.--Placas arciformes eritematosas en las piernas.
Las manifestaciones del LES pediátrico, en general, son las mismas que las del adulto, aunque con algunas peculiaridades. Clásicamente se tiende a considerar que el LES infantil tiene peor pronóstico que el del adulto, basándose sobre todo en una mayor frecuencia de afectación renal en el momento del diagnóstico. Pese a ello, parece ser que durante el curso de la enfermedad los porcentajes de afección renal en ambos grupos de edad tienden a equipararse1. Los marcadores de mal pronóstico con más relevancia en los niños son la presencia de enfermedad neurológica o renal, la corta edad al diagnóstico y/o la existencia de hipertensión arterial4.
Al iniciarse el LES infantil es común encontrar afectación articular (artralgias y/o artritis) asociada a un exantema «en alas de mariposa», fiebre y malestar general. No obstante, otras posibles manifestaciones durante el curso de la enfermedad, en orden decreciente, son las renales, neuropsiquiátricas, cardiacas, pulmonares, gastrointestinales y las adenopatías. Entre las alteraciones analíticas se incluyen también en orden decreciente de frecuencia la anemia, la leucopenia y la trombopenia. En más del 90 % de los casos se detectan anticuerpos antinucleares (ANA) positivos, y en la mitad anti-ADN. Según Font et al1, en los niños es más frecuente encontrar nefropatía, fiebre y linfadenopatías al inicio de la enfermedad que en los adultos, y exantema malar y corea durante el desarrollo de ésta.
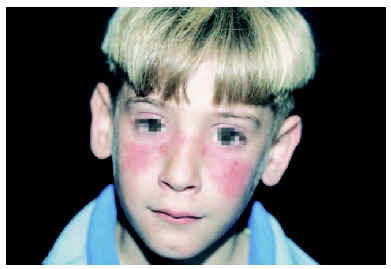
De las manifestaciones cutáneas específicas del LES, la más frecuente es el exantema malar o exantema «en alas de mariposa» (fig. 3), seguido de lesiones de tipo LED3,5. Dentro de las lesiones cutáneas inespecíficas, las más frecuentes son las úlceras orales y las vasculitis5.
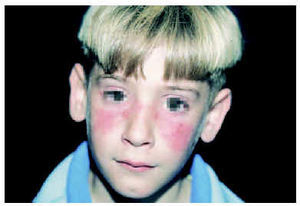
Fig. 3.--Eritema «en alas de mariposa».
En el LES infantil, además de las alteraciones analíticas posibles, ya comentadas, también es frecuente encontrar déficit del complemento3,5 que justifican un riesgo incrementado de infecciones. Otras causas de inmunodepresión en el LES infantil son la disfunción de los linfocitos T y B, la presencia de neutropenia o linfopenia, así como el uso de terapia inmunosupresora o la existencia de una anesplenia funcional2. De hecho, las infecciones constituyen la primera causa de muerte en el LES pediátrico, seguidas por la enfermedad renal2. Los autoanticuerpos más frecuentemente encontrados son los ANA, pero también pueden aparecer los anti-ADN de cadena doble (ADNds), anti-Sm, anti-Ro, anti-La y anti-U1RNP. Los anticuerpos antifosfolípido (APL) se asocian también en la edad pediátrica con un riesgo incrementado de trombosis y fenómenos embólicos relacionados, especialmente, con la presencia de anticuerpos anticardiolipina según unos autores6, o con la presencia del anticoagulante lúpico, según otros7. El síndrome antifosfolípido es raro en la infancia y sólo de forma excepcional se asocia a una coagulación intravascular diseminada8.
El estudio anatomopatológico de las biopsias del LES infantil demuestra los mismos hallazgos que el LES del adulto, es decir, un patrón de dermatitis perivascular superficial y profunda, con infiltrados densos preferentemente linfocitarios, degeneración vacuolar de la capa basal, depósitos dérmicos de mucina y, en lesiones evolucionadas, engrosamiento de la membrana basal.
El tratamiento de las lesiones cutáneas del LES se detalla en los apartados del LED y del LECS. En el tratamiento del LES infantil no debe olvidarse que se trata de una enfermedad multisistémica y que, por tanto, requiere un abordaje multidisciplinario. El control inicial suele conseguirse con corticoides por vía oral, que en muchos casos se utilizan de modo crónico a la mínima dosis posible. Los antipalúdicos (hidroxicloroquina, 5 mg/kg/día) deberían utilizarse de rutina, ya que espacian los brotes7. Por otro lado, es esencial utilizar antihipertensivos cuando el paciente lo requiera puesto que a largo plazo es un importante factor de riesgo en la morbimortalidad de estos niños. Según exista afección renal o no y, según los casos, cuando ésta sea resistente a corticoides y/o de curso crónico, deberemos recurrir al uso de inmunosupresores como la azatioprina, ciclofosfamida, metotrexato o ciclosporina, entre otros. Conviene recordar que el uso de estos tratamientos en niños conlleva un riesgo de alterar el crecimiento y de aumentar las infecciones, así como un potencial oncogénico y de ocasionar infertilidad. No obstante, haciendo un uso racional del arsenal terapéutico, prácticamente todas las opciones de tratamiento del LES se pueden usar también en niños9. En los casos con presencia de APL lo más aceptado es la anticoagulación inicial con heparina y posteriormente con warfarina, si existe el antecedente de algún episodio trombótico7. Pocas veces hay que asociar aspirina a la warfarina6. No es necesario anticoagular a niños con APL sin antecedentes tromboembólicos.
LUPUS ERITEMATOSO DISCOIDE
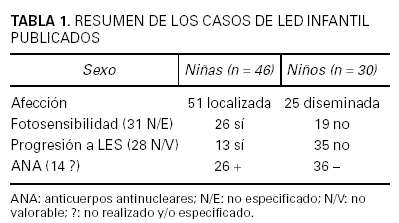
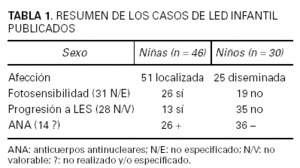
El LED es poco frecuente en la infancia; sólo el 2 % de todos los LED aparecen antes de los 10 años. Hasta el año 2003 la serie más larga publicada era la de George y Tunnessen10 con 8 casos descritos, de modo que los trabajos de revisión en este campo se basaban esencialmente en este estudio y en los pocos casos que se habían publicado aisladamente11. En el último año se han publicado dos series de 16 y 27 casos, respectivamente, de LED pediátrico12,13, lo cual, sumado a series más cortas y casos aislados, ha permitido valorar un total de 76 casos publicados10-25 cuyas características se resumen en la tabla 1.
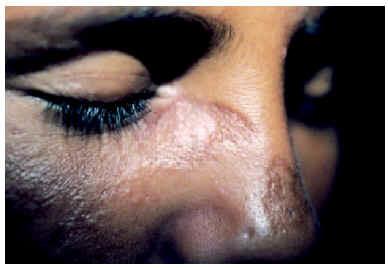
El LED infantil, como el del adulto, se caracteriza por la presencia de lesiones cutáneas típicas en ausencia de afección sistémica. Evoluciona con la aparición de lesiones localizadas o diseminadas (cuando afectan a áreas por encima y por debajo del cuello), a modo de máculas o manchas eritematosas, más o menos recubiertas de escamas adherentes, con tapones foliculares, telangiectasias y atrofia. Las lesiones tienden a curar dejando cicatriz con áreas de atrofia, hiper o hipopigmentación y telangiectasias20,26 (fig. 4). Las lesiones del LED infantil asientan sobre todo en la cabeza, pero pueden afectar también al cuello, al tórax y a las extremidades superiores. Se ha descrito una forma excepcional en la que el LED infantil se manifestó con lesiones arciformes plantares22. El curso de la enfermedad es crónico10.
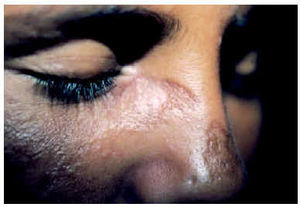
Fig. 4.--Lesiones atróficas hiperpigmentadas en mejillas y dorso nasal.
Desde la revisión de George y Tunnessen se consideraba que en los niños no hay preferencia de sexo en el LED, pero con los casos revisados hasta 2003, la proporción es algo mayor en las niñas que en los niños, con una relación de 3 a 2 (tabla 1). Por otro lado, la prevalencia de fotosensibilidad era considerada menos frecuente en la edad pediátrica que en los adultos, que la padecen en el 60 %. Con la revisión de todos los casos publicados actualmente podemos decir que los porcentajes son similares (un 58 % de los casos de LED infantil).
El estudio de autoanticuerpos demuestra un porcentaje de ANA positivos en torno al 42 % de los casos de LED infantil en la mayoría de los grupos10-25, aunque llama la atención la elevada proporción de ANA positivos en el grupo de Ruiz Maldonado (63 %)13.
En cuanto al porcentaje de casos que progresan a LES, los datos actuales no contradicen a los previos, es decir, parece que el LED infantil tiene mayor probabilidad de evolucionar a LES que el del adulto. Mientras que los pacientes adultos con LED progresan a LES en un 6-10 % de los casos, en los niños esta progresión se observa en un 27 % de los casos publicados. Para valorar este parámetro, de los 76 casos publicados se excluyen aquellos en los que no se especificaba el tiempo de seguimiento y aquellos en los que este periodo era menor a 2 años. Parece que todos los que progresan a LES lo hacen a edades tempranas, lo que sugiere además una asociación entre el LED infantil y el LES infantil10. Por otro lado, en adultos, la presencia de lesiones de lupus discoide se considera un signo de buen pronóstico27, mientras que en los niños no parece proteger del desarrollo de formas graves de LES10,18. Además, rasgos que en los adultos se han relacionado con mayor probabilidad de progresión a LES como las lesiones diseminadas, la larga evolución, o la falta de respuesta al tratamiento no parecen tener este valor predictivo en los niños13. Por la imposibilidad de prever los casos que evolucionarán a LES y el elevado porcentaje de progresión, se recomiendan controles periódicos como mínimo semestrales de estos niños, incluyendo estudio de la función renal y hepática, así como estudio de autoanticuerpos.
Dentro de las formas de lupus eritematoso cutáneo crónico, además del LED, también se ha descrito en niños el lupus profundo o paniculitis lúpica, aunque es muy poco frecuente24,28-30. Se trata de placas eritematosas y/o nódulos subcutáneos localizados preferentemente en la cara, las nalgas, los brazos o los muslos, que curan dejando depresiones residuales. Puede asociar lesiones suprayacentes de lupus discoide. Histológicamente, aparece una paniculitis predominantemente lobulillar, con o sin rasgos epidérmicos de LED31.
El hallazgo histológico más constante en el LED infantil es la degeneración vacuolar de la capa basal13,32. Además suelen encontrarse otras alteraciones epidérmicas, como hiperqueratosis, tapones foliculares o atrofia epidérmica13. En la dermis se aprecia un denso infiltrado linfocitario perivascular y perianexial, así como edema endotelial y melanófagos13,32. La inmunofluorescencia es positiva en la mayoría de los casos (aproximadamente un 80 %) y, como en los adultos, presenta depósitos variables de inmunoglobulinas (IgG, IgM, IgA) y C3 en la membrana basal.
El tratamiento del LED debe emplearse para controlar la actividad de la enfermedad y para prevenir la cicatrización residual. La fotoprotección es esencial, de modo que debe evitarse la exposición solar excesiva, así como prescribirse un filtro solar que preferiblemente será de un factor de protección solar igual o superior a 30. La aplicación de una crema de corticoides potentes (de los grupos III o IV), o bien el uso de corticoides intralesionales, pueden servir para controlar o incluso aclarar completamente las lesiones23. En casos que progresen de forma importante pese a los corticoides tópicos, y en formas extensas, pueden utilizarse antipalúdicos o dapsona. La hidroxicloroquina en dosis de 4 a 6 mg/kg/día se considera segura10,19,23. Si se utiliza cloroquina, la dosis máxima es 4,4 mg/kg/día31. El uso de estos fármacos requiere de un control oftalmológico periódico, así como de la realización de hemograma y bioquímica básica cada 4 o 6 meses. En el caso de utilizar dapsona, ésta debe prescribirse a dosis de 50 mg al día12,33, y es importante hacer una determinación previa de los niveles de glucosa-6-fosfato deshidrogenasa, así como hemogramas periódicos para prevenir o detectar, respectivamente, el desarrollo de una metahemoglobinemia. También se ha utilizado talidomida en 8 casos de LED pediátrico13.
LUPUS ERITEMATOSO CUTANEO LINEAL
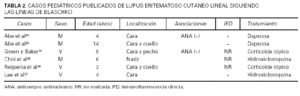
El lupus eritematoso cutáneo lineal es una forma de lupus similar al discoide, pero sus lesiones se distribuyen siguiendo las líneas de Blaschko. De esta forma de lupus se han descrito 6 casos infantiles33-37. Algunos autores consideran esta entidad como una forma de LED con distribución lineal; sin embargo, de acuerdo con Abe et al33, esta forma de lupus es diferente de la discoide por la configuración lineal de las lesiones y porque ninguno de los casos descritos evoluciona a LES. El lupus eritematoso cutáneo lineal asienta preferentemente en la cara y el cuello, puede asociar ANA positivos33,34 y raramente se asocia a fotosensibilidad35. Estos casos de lupus eritematoso parecen representar formas mosaico de la enfermedad, de modo que las áreas afectadas derivarían de clones de células anómalas distribuidas siguiendo las líneas de desarrollo embriológico de la piel38,39. Los hallazgos de los 6 casos de lupus eritematoso cutáneo lineal infantil siguiendo las líneas de Blaschko publicados se resumen en la tabla 2.
El diagnóstico diferencial se plantea sobre todo con el liquen estriado, pero en el lupus lineal las lesiones no tienen por qué ser papulosas, y además son más persistentes que en el liquen estriado. Desde el punto de vista histopatológico, la presencia de degeneración vacuolar de la capa basal, el engrosamiento de la membrana basal, el depósito de mucina y los tapones córneos orientan el diagnóstico hacia lupus eritematoso, mientras que la acantosis con paraqueratosis y espongiosis focal, los queratinocitos necróticos y el infiltrado liquenoide orientan a liquen estriado.
Además del lupus eritematoso «discoide» lineal también se han descrito otras formas de lupus eritematoso lineales en la edad pediátrica, como el LES ampolloso lineal40, el lupus eritematoso profundo lineal41,42 y una forma de esclerodermia lineal asociada a lupus discoide43.
LUPUS ERITEMATOSO CUTANEO SUBAGUDO
El LECS constituye una forma especial de lupus eritematoso descrita por Sontheimer et al44 en 1979 y que representa el 7-27 % de los pacientes con lupus45. Hasta la fecha sólo se han descrito 5 casos de LECS infantil46-50, sin que existan diferencias significativas con el cuadro clínico del adulto51. Probablemente estos datos no reflejen la incidencia real y el LECS sea un proceso infradiagnosticado en la etapa infantil50. El lupus neonatal comparte con el LECS características similares como la fotosensibilidad, la presencia de anticuerpos anti-Ro/SSA y su carácter no cicatrizal52. Esto, unido a la semejanza clínica en muchas lesiones, hace pensar en un mecanismo patogénico común53.
El LECS se define por la existencia de una erupción de morfología y distribución características, con leve o ninguna afectación sistémica, y la presencia de anticuerpos anti-Ro circulantes54. Las lesiones cutáneas pueden adoptar un patrón psoriasiforme y/o anular-policíclico, y afectan áreas fotoexpuestas como la cara, el cuello, el escote, los hombros o la cara extensora de los brazos. Raramente se extienden por debajo de la cintura, y respetan de manera característica nudillos, axilas y caras laterales del tronco. Las lesiones curan dejando hipopigmentaciones postinflamatorias transitorias, aunque en ocasiones pueden quedar telangiectasias persistentes. A diferencia del LED las lesiones no dejan cicatriz. El cuadro evoluciona a brotes, normalmente en relación con exposiciones solares. Este fenómeno puede reproducirse tras la exposición a una radiación ultravioleta B en un 71 % de los pacientes, mientras que en el LES esto sólo ocurre en el 20 % de los casos54. Otras manifestaciones cutáneas menos frecuentes incluyen la alopecia no cicatrizal, úlceras mucosas dolorosas, livedo reticularis, telangiectasias periungueales y faciales, fenómeno de Raynaud, vasculitis, lupus discoide y esclerosis44.
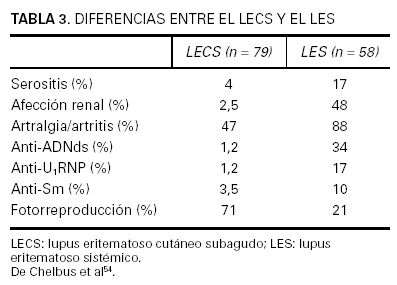
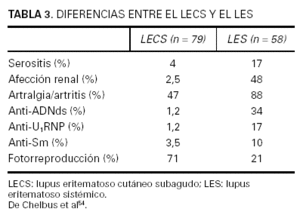
La afectación sistémica es mucho menos importante que en el LES. Las artralgias y artritis están presentes entre el 50 y el 75 % de los casos44,54. Las mialgias y la fiebre o malestar son menos frecuentes. La existencia de afección renal, neurológica o de vasculitis sistémica varía según los distintos trabajos entre un 2,5 y un 50 %, pero siempre de forma mucho menos agresiva que en el LES, lo que es especialmente cierto en el caso de la afectación renal54. Existe serositis en un 4 % de los casos. A pesar de la leve semiología sistémica, más del 50 % de los casos cumplen por lo menos cuatro criterios de la American Rheumatism Association (ARA) para el diagnóstico de LES, lo que ha llevado en muchos casos a cierta confusión nosológica en su diferenciación. En la tabla 3 pueden compararse los parámetros en los que existe una diferencia estadísticamente significativa entre el LECS y el LES.
Las diferencias histológicas del LECS con respecto al LED son más cuantitativas que cualitativas. Los hallazgos más constantes son la degeneración hidrópica de la capa basal y la existencia de un infiltrado inflamatorio perivascular y perianexial de células mononucleares en la dermis44,54,55. Otros fenómenos como los tapones foliculares y la hiperqueratosis son menos frecuentes que en el LED. La inmunofluorescencia directa pone de manifiesto depósitos de IgG, IgM o IgA y de componentes del complemento en la unión dermoepidérmica de piel lesional en un 60 % de los casos. El hallazgo de moléculas de IgG con un patrón moteado en los queratinocitos refleja la presencia de anticuerpos anti-Ro circulantes56.
Los ANA son positivos en un 70 % de los casos. Los más característicos son, sin embargo, los anticuerpos anti-Ro, presentes en el 60 % de los pacientes. Mucho menos frecuentes son los anticuerpos ADNds, el factor reumatoide y los anticuerpos antimúsculo liso45. Se han encontrado un déficit de factores del complemento en 2 de los 5 casos publicados de LECS infantil, lo que obliga a descartar una deficiencia del complemento en estos pacientes. Las alteraciones descritas incluyen el déficit homozigoto de C247 y niveles disminuidos de C450. Otros hallazgos frecuentes son la leucopenia, la trombocitopenia y el aumento de la velocidad de sedimentación globular.
La fotoprotección y la corticoterapia tópica son la base del tratamiento, aunque en ocasiones se necesitan ciclos orales de corticoides. En los casos más graves o refractarios pueden añadirse antipalúdicos, a veces asociados a los corticoides. Sólo se precisan otros inmunosupresores o dosis altas de corticoides de manera excepcional.
LUPUS ERITEMATOSO NEONATAL
El LEN es una enfermedad rara del recién nacido que evoluciona con afectación cutánea, cardiaca o ambas. En ocasiones asocia alteraciones hepáticas y/o hematológicas que no suelen tener repercusión clínica57. Se relaciona con la existencia de autoanticuerpos maternos circulantes en la sangre del niño, esencialmente anticuerpos anti-Ro58. Se calcula que afecta a uno de cada 12.000 a 20.000 nacidos vivos57,59. A pesar de su rareza, es la dermatosis más frecuente de las adquiridas por vía transplacentaria y mediadas por anticuerpos59. Aunque la enfermedad cutánea es de buen pronóstico, con resolución espontánea hacia el séptimo mes de vida, las alteraciones cardiacas, representadas casi siempre por un bloqueo cardiaco completo, suelen ser permanentes. A pesar de lo mucho que se ha publicado en los últimos años acerca de esta entidad, muchas veces pasa inadvertida o se confunde con otros cuadros, de forma que está infradiagnosticada.
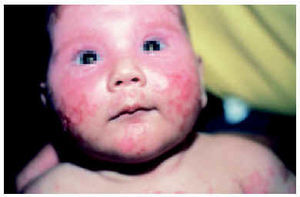
McCuistion y Schoch, en 1954, fueron los primeros en sospechar que un caso de LEN observado por ellos podía deberse al paso de «algún factor» materno al niño60, pero hasta 1980 no se asoció con los anticuerpos anti-Ro61. El LEN afecta con más frecuencia a las niñas que a los niños en una proporción de 3:157. Evoluciona con manifestaciones cutáneas en un 50 % de los casos y cardiacas en otro 50 %; sólo en un 10 % de los casos coexisten síntomas cutáneos y cardiacos. Las lesiones cutáneas aparecen generalmente en las primeras semanas de vida, pero pueden estar presentes ya al nacimiento57,62. No es raro que se manifiesten tras una exposición solar o tras la fototerapia para el tratamiento de una ictericia neonatal63. Estas lesiones cutáneas suelen ser manchas o placas eritematosas de configuración anular, con o sin descamación, que recuerdan al LECS (fig. 5). Para algunos autores el LEN es una forma pediátrica de éste. También se han descrito otras variedades de afectación cutánea, con lesiones que recuerdan al LED64, telangiectasias65-67, púrpura (que suele reflejar una trombopenia asociada) y lesiones que simulan un eritema exudativo multiforme, o incluso un vitíligo, sobre todo en casos evolucionados68,69. Existen formas atípicas en las que sólo la histología y/o los anticuerpos orientarán al diagnóstico62,70-72. Aunque las lesiones pueden aparecer en cualquier localización, la cara y el cuero cabelludo son las zonas afectadas con más frecuencia, probablemente por ser las áreas más fotoexpuestas57,58,63,64. La presencia de un eritema periocular a modo de máscara es muy típica y puede ser clave para sospechar el diagnóstico58,73 (fig. 6). Las lesiones cutáneas tienden a resolverse de manera espontánea antes del año de vida, coincidiendo aproximadamente con el aclaramiento de los anticuerpos maternos de la sangre del niño. A veces deja hipopigmentación o hiperpigmentación y telangiectasias residuales que suelen curar en meses o años. Raramente deja también atrofia. La histopatología del LEN muestra como rasgos más constantes la degeneración vacuolar de la capa basal, el edema dérmico y el infiltrado linfohistiocítico74. La inmunofluorescencia es negativa en la mitad de los casos y en la otra mitad se encuentran depósitos de complemento y de IgG y/o IgM en la zona de la membrana basal74.
Fig. 5.--Placas anulares eritematodescamativas en tronco.
Fig. 6.--Eritema periocular de bordes policíclicos y descamativos.
En la mitad de los casos el LEN se manifiesta con afectación cardiaca, que marca el pronóstico, y que casi siempre consiste en un bloqueo cardiaco completo congénito57. El bloqueo puede detectarse precozmente en el feto57 y, a diferencia de las lesiones cutáneas, no se resuelve. Aunque en la mitad de los casos es bien tolerado, los casos restantes requieren la implantación de un marcapasos permanente. De éstos, un 10 % no responden al implante y mueren por fallo cardiaco. Otras formas de afectación cardiaca como la persistencia del conducto arterioso, miocarditis o fibroelastosis endocárdica son más raras. De los pacientes que tienen enfermedad cardiaca sólo el 10 % tienen lesiones cutáneas. Otras alteraciones frecuentes en el lupus eritematoso neonatal son las hepáticas e incluyen hepatomegalia, hepatitis y colestasis, casi siempre transitorias y sin repercusión clínica. También son frecuentes las alteraciones del hemograma, sobre todo la trombopenia, aunque también se pueden encontrar anemia y leucopenia, casi siempre de buen pronóstico. La afectación sintomática de otros órganos como el sistema nervioso central, pulmones y el tracto gastrointestinal es excepcional67,75. Prendiville et al76 realizaron tomografía computarizada de modo sistemático a todos los niños con LEN y encontraron alteraciones en 9 de 10 casos estudiados. Las alteraciones detectadas incluyeron atenuación de la sustancia blanca cerebral, calcificaciones de los ganglios basales y ventriculomegalias. Así mismo encontraron anomalías en la ecografía cerebral de 6 de 10 pacientes estudiados. Estas anomalías fueron quistes subependimales y sustancia blanca y vasos lenticulostriados ecogénicos. Pese a estos hallazgos no se demostró repercusión clínica, salvo un caso de macrocefalia.
La etiopatogenia del LEN es muy controvertida. El factor patogénico más claro es la presencia de anticuerpos anti-Ro maternos, de clase IgG, en la circulación del niño. Estos anticuerpos se encuentran en más del 95 % de los casos y su aclaramiento del suero del lactante coincide con la resolución de las lesiones cutáneas y la normalización de los parámetros analíticos alterados. Además, experimentos en animales han logrado reproducir lesiones cutáneas y cardiacas del LEN tras la administración de anticuerpos anti-Ro75. No obstante, la presencia de anticuerpos anti-Ro no es suficiente para producir la enfermedad, ya que sólo un 1-2 % de las mujeres con estos anticuerpos tendrán hijos afectados57 y no todos sus hijos con anticuerpos anti-Ro desarrollarán un LEN, incluso con discordancias entre gemelos77,78. También se encuentran anticuerpos anti-La en el 50 % de los casos y pocas veces anti-U1RNP, casi siempre asociados a anti-Ro. El papel patogénico de éstos no está tan claro, pero en cualquier caso, hay pacientes en los que sólo se encuentran anticuerpos anti-La79 o anti-U1RNP80 sin anti-Ro. Los pacientes en los que sólo se encuentran anti-U1RNP parecen tener mejor pronóstico que los anti-Ro y/o anti-La positivos79. En ocasiones es preciso realizar varias determinaciones para demostrar la presencia de los autoanticuerpos en el niño enfermo. Si la sospecha clínica es elevada y la determinación de anticuerpos anti-Ro es negativa, puede recurrirse a técnicas de inmunoprecipitación de proteínas y ARN para confirmar el diagnóstico81. Aunque el perfil de autoanticuerpos en la madre y el hijo no siempre es el mismo, los autoanticuerpos que se encuentren en el niño siempre se encontrarán en la madre, pues es de ella de quien proceden.
Los estudios del HLA han demostrado que las madres de estos niños tienen mayor frecuencia de antígenos de histocompatibilidad (HLA)-B8, DR3 y DQ257,82. Algunos autores creen que determinados HLA maternos se correlacionan con la evolución del LEN83, pero no se ha conseguido demostrar en niños con LEN un HLA asociado con mayor frecuencia que otros84. Se cree que factores como el sexo o la radiación ultravioleta pueden influir también en la expresión del LEN. Es bien conocido que la erupción puede iniciarse o agravarse tras una exposición solar. De hecho, la luz ultravioleta induce la translocación de antígenos SSA/Ro, SSB/La, U1RNP y Sm a la membrana plasmática85. Pese a todo, la exposición solar no es fundamental para la manifestación de la enfermedad, como demuestra el hecho de que algunos niños nacen con lesiones y éstas aparecen también en piel no fotoexpuesta. En cuanto al sexo las niñas padecen LEN tres veces más que los niños y se ha demostrado que los estrógenos incrementan la expresión de los antígenos SSA/Ro y SSA/La en la superficie de los queratinocitos.
En el tratamiento del LEN es fundamental la fotoprotección. Pueden asociarse corticoides tópicos de baja potencia86. Para las telangiectasias persistentes puede utilizarse el láser de colorante pulsado66. El uso de corticoides orales se reserva para casos de grave afectación cardiaca, hepática o hematológica, pero la indicación por estas dos últimas causas es rara. De los casos con bloqueo cardiaco completo, la mitad requiere el implante de un marcapasos permanente.
Es necesario seguir a estos niños a largo plazo, pues parece que tienen un riesgo incrementado de desarrollar alguna enfermedad autoinmune durante la infancia87. Además de controlar a los niños conviene vigilar también a sus madres, que aunque en el momento del diagnóstico suelen estar asintomáticas, tienen un alto riesgo de desarrollar una enfermedad del tejido conjuntivo. Por otro lado, conviene advertirlas de que el riesgo de tener hijos afectados en futuros embarazos es del 25 %, y de que haber tenido un hijo con afectación sólo cutánea no excluye la posibilidad de tener otros con afectación cardiaca. Como método de diagnóstico precoz del bloqueo cardiaco en el feto se recomienda realizar ecocardiografías seriadas a partir de la decimosexta semana de gestación en mujeres embarazadas con anticuerpos anti-Ro y/o anti-La positivos88.