El término livedo reticularis describe un retículo cutáneo de coloración rojo-violácea que afecta preferentemente a las extremidades. Su origen es la interrupción del flujo sanguíneo en las arteriolas dérmicas, ya sea por espasmo, inflamación u obstrucción intravascular, y se asocia a entidades de diversa etiología y gravedad. Para establecer la causa de una livedo reticularis es fundamental conocer la evolución del cuadro (si la livedo reticularis es o bien crónica o bien aguda o fulminante), la presencia de otros signos cutáneos, como nódulos, púrpura retiforme o necrosis, y la posible asociación con síntomas generales y/o datos analíticos que apunten hacia un determinado proceso sistémico. El objetivo de esta revisión es proporcionar un método diagnóstico y terapéutico para el abordaje de la livedo reticularis.
The term livedo reticularis refers to a reddish-violet reticular discoloration of the skin that mainly affects the limbs. It is caused by an interruption of blood flow in the dermal arteries, either due to spasm, inflammation, or vascular obstruction, and is associated with diseases of varying etiology and severity. To establish the cause of livedo reticularis, it is essential to determine its course (chronic, acute, or fulminant), the presence of other cutaneous signs such as nodules, retiform purpura or necrosis, and the possible association of general symptoms or laboratory findings that suggest a particular systemic process. The aim of this review is to describe the diagnosis and treatment of the disease.
El término livedo reticularis es utilizado para nombrar un síndrome que se caracteriza por la presencia de un retículo de coloración rojo-violácea en la piel, que afecta preferentemente a las extremidades, pero que puede ser generalizado. Esta coloración reticulada es secundaria a una alteración orgánica o funcional de las arterias y/o arteriolas. Las causas que pueden ocasionar livedo reticularis son múltiples, ya que múltiples son las causas que pueden afectar a las arteriolas (tabla 1). El origen es la disminución o el cese del flujo sanguíneo en determinados puntos del trayecto vascular, ya sea por espasmo, por inflamación de la pared de la arteriola o por obstrucción intravascular. La obstrucción intravascular, a su vez, puede estar causada por trombosis, por fenómenos embólicos o por alteraciones de la pared vascular.
Causas de livedo reticularis
| Espasmo arteriolar | Respuesta al frío |
| Inducido por fármacos (ergotamina, cocaína) | |
| Inflamación vascular | |
| No infecciosa (vasculitis) | Poliarteritis nudosa sistémicaPoliarteritis nudosa cutáneaEnfermedad de WegenerSíndrome de Churg-StraussPoliangitis microscópicaVasculitis por fármacos (tiouracilo)Vasculitis asociada a LES o a AR |
| Infecciosa | Fenómeno de Lucio |
| Obstrucción vascular sin inflamación | |
| Trombosis | Síndrome antifosfolipídicoSíndrome de SneddonVasculopatía livedoideLES, ARNecrosis por cumarinasCoagulación intravascular diseminadaDisproteinemias (crioglobulinemia tipo I)Factores genéticos procoagulantes (factor V)Anemia de células falciformesFarmacológica |
| Embolización | Mixoma auricularColesterol |
| Alteración de la pared vascular | CalcifilaxisHiperoxaluria |
AR: artritis reumatoide; LES: lupus eritematoso sistémico.
Para comprender estos fenómenos es preciso conocer la anatomía y la fisiología de la vascularización cutánea. Como ocurre en cualquier otro órgano, la irrigación sanguínea llega a la piel a través de arterias, que se transforman en arteriolas a nivel del tejido celular subcutáneo, en su punto de unión con la dermis, formando el plexo vascular profundo de la piel, que transcurre paralelo a la epidermis. Este plexo está constituido por la arteria nutricia y arteriolas de 100 micras de diámetro con una pared formada, de fuera a dentro, por dos capas musculares, una capa elástica y el endotelio vascular. A partir de este plexo parten arteriolas comunicantes, más pequeñas, en dirección perpendicular a la epidermis, hasta llegar a la dermis superficial, donde forman el plexo vascular superficial, también paralelo a la epidermis, con arteriolas de muy pequeño tamaño (10 micras), cuya pared está formada por una sola capa muscular con ausencia de la capa elástica interna. De aquí parten los capilares que irrigan las papilas, iniciando el camino de retorno a través de vénulas poscapilares y posteriormente vénulas de mayor tamaño, que siguen paralelamente un trayecto inverso a los vasos aferentes1. Todo este conjunto forma un entramado tridimensional que se comporta como una unidad. Sin embargo, las repercusiones clínicas de la lesión vascular son distintas según las características de los vasos afectados y de su localización en el espesor de la piel.
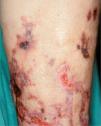
La disminución del flujo arteriolar causa livedo reticularis, pero el cese completo de este flujo por obstrucción de la luz arteriolar puede ocasionar infartos hemorrágicos. Los territorios infartados se manifiestan inicialmente como lesiones purpúricas en retículo (púrpura retiforme), que pueden tornarse claramente equimóticas y evolucionar a la formación de necrosis más o menos extensas y ulceraciones secundarias. Por estos motivos, las necrosis o ulceraciones cutáneas de origen arterial o arteriolar suelen tener contornos reticulares y de aspecto estrellado. La presencia de una reacción inflamatoria intensa en la pared vascular y en la dermis perivascular se traduce clínicamente en forma de nódulos subcutáneos, dolorosos, muchas veces entremezclados en la trama reticular o siguiendo un trayecto vascular.
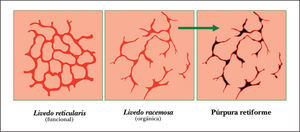
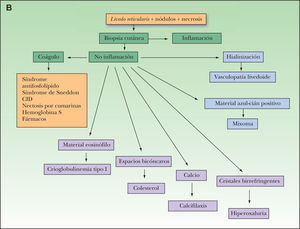
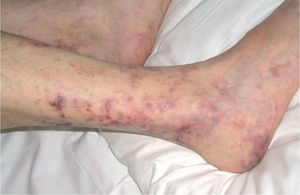
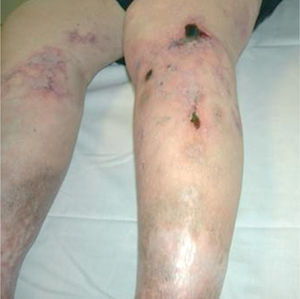
Metodología diagnósticaPara hacer el diagnóstico de un cuadro de livedo reticularis de las piernas debe valorarse su asociación a nódulos subcutáneos o a púrpura retiforme, necrosis y ulceraciones secundarias (tabla 2). Algunos autores distinguen entre livedo reticularis (red con círculos regulares y completos) y livedo racemosa (red con círculos irregulares e incompletos), considerando que la livedo racemosa es siempre secundaria a un proceso orgánico y no funcional (fig. 1)2. Son importantes los datos obtenidos de una cuidadosa historia clínica, que debe incluir los antecedentes farmacológicos (cumarínicos, somníferos, ergotamina), enfermedades asociadas conocidas (insuficiencia renal, arteriosclerosis, enfermedad autoinmune sistémica, gammapatía monoclonal, etc.), procedimientos quirúrgicos recientes (cateterismo, angioplastia) o abortos previos. Es fundamental el conocimiento de la evolución del cuadro, si es o bien crónica o bien aguda o fulminante, la asociación con otros síntomas (fiebre, disnea, artralgias) y la valoración de los datos obtenidos gracias a una exploración clínica sistémica (soplos, signos de neumonitis, rigidez de nuca, etc.). La asociación de fiebre orienta hacia el origen infeccioso del cuadro clínico. Sin embargo, hay que tener en cuenta que la fiebre puede ser secundaria a un proceso inflamatorio generalizado, casi siempre grave, como un brote de lupus eritematoso sistémico (LES) o vasculitis sistémica.
Asociaciones clínicas de livedo reticularis con púrpura, necrosis y/o nódulos
| Livedo reticularis aislada (por espasmo) | Livedo reticularis con púrpura retiforme, necrosis, úlceras, nódulos (por obstrucción luz vascular) |
| Frío | |
| Farmacológica | |
| LES, AR | |
| PAN | PANGranulomatosis de Wegener, síndrome de Churg-Strauss, PAM, LES, ARVasculitis por fármacos (tiouracilo)Fenómeno de Lucio |
| Síndrome de Sneddon | |
| Síndrome antifosfolipídico | Síndrome antifosfolipídicoVasculopatía livedoideCIDNecrosis por cumarinasCrioglobulinemia tipo ITrombofiliasAnemia de células falciformesFarmacológicaMixoma auricularColesterolCalcifilaxisHiperoxaluria primaria |
AR: artritis reumatoide; CID: coagulación intravascular diseminada; LES: lupus eritematoso sistémico; PAM: poliangitis microscópica; PAN: poliarteritis nudosa.
Representación esquemática de la livedo reticularis, livedo racemosa y púrpura retiforme. Modificada de Sepp N35.
Se deben realizar análisis de laboratorio que incluyan el hemograma completo, pruebas de coagulación, función renal, sedimento urinario y proteinuria, anticuerpos antinucleares (ANA), complemento, anticuerpos anticitoplasma de neutrófilo (ANCA), crioglobulinas, criofibrinógeno, anticuerpos antifosfolípido (Ac aPL), serología del virus de la hepatitis B (VHB) y del virus de la hepatitis C (VHC). En determinados casos se debe proceder al estudio más completo de los factores de la coagulación (niveles de proteína C y proteína S, mutaciones del factor V Leyden, mutaciones del gen de la protrombina –G20210A–, homocisteína, mutación C677T de la metilentetrahidrofolato reductasa)3,4.
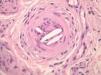
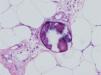
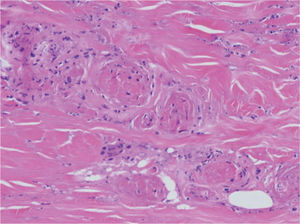
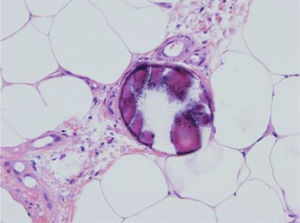
Ante un cuadro clínico de livedo reticularis con púrpura, necrosis o nódulos subcutáneos se debe proceder a realizar una biopsia cutánea de un nódulo, del borde de una lesión necrótica o de áreas del retículo eritemato-violáceo o purpúrico, que comprenda todo el grosor de la dermis, llegando hasta la hipodermis. Si se selecciona bien la zona, puede ser suficiente una muestra de tejido obtenida por punch, método de elección para evitar ulceraciones de difícil cicatrización. El análisis anatomopatológico nos permitirá conocer el origen inflamatorio o no de la lesión (figs. 2A y 2B). En el caso de las lesiones inflamatorias es importante determinar el calibre de los vasos afectados y el tipo de células que componen el infiltrado inflamatorio (polinucleares neutrófilos, células mononucleares o células gigantes). En ausencia de inflamación la biopsia nos permitirá conocer la causa de la obstrucción de la luz vascular (coágulo, cristales de colesterol, calcio, proliferación endotelial, hialinización, etc.). A partir de estos datos se procederá a completar el estudio de las posibles causas y a la instauración del tratamiento adecuado que, en ocasiones, puede tener un carácter urgente por la gravedad del cuadro clínico.
La musculatura lisa de las arteriolas puede responder a diversos estímulos desencadenando una vasoconstricción, lo cual puede ocurrir de manera fisiológica como respuesta al frío, en un intento de mantener constante la temperatura corporal. También determinados fármacos pueden ocasionar esta respuesta. Es clásicamente conocido el efecto vasoconstrictor de los alcaloides derivados del cornezuelo de centeno, como la ergotamina, que habían sido utilizados para favorecer la contracción de útero en el posparto. La acción vasoconstrictora es tan intensa que pueden causar graves necrosis de las extremidades. Otros fármacos de efecto vasoconstrictor son la cocaína, la anfetamina y la efedrina. La isquemia puede afectar también a las paredes de los vasos, causando trombosis e inflamación secundaria, por lo que el cuadro puede ser confundido con una verdadera vasculitis.
Inflamación vascularVasculitisLas vasculitis que afectan a arteriolas cutáneas son la poliarteritis nudosa (PAN), en sus variantes sistémica y cutánea, la granulomatosis de Wegener, el síndrome de Churg-Strauss, la poliangitis microscópica (PAM), las poliangitis relacionadas con enfermedades sistémicas como el LES o la artritis reumatoide (AR) y ciertas vasculitis secundarias a fármacos, como el tiouracilo.
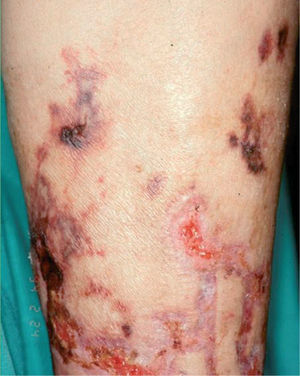
Estas enfermedades se expresan en la piel en forma de livedo reticularis, nódulos subcutáneos inflamatorios, púrpura palpable, necrosis y ulceraciones secundarias (fig. 3). Los síntomas y signos generales pueden ser importantes y dependen de la enfermedad y de los órganos afectados, por lo que la exploración sistémica es definitiva para mostrar las claves del diagnóstico. La biopsia cutánea permite determinar el tipo de vasos afectados y el tipo de infiltrado inflamatorio5. La PAN afecta a arterias y arteriolas del plexo profundo casi exclusivamente, mientras que en el resto de procesos están afectados al mismo tiempo los vasos del plexo superficial y los vasos del plexo profundo. La afección de los vasos de localización superficial y de pequeño calibre explica la presencia clínica de púrpura palpable en las poliangitis, en la granulomatosis de Wegener y en el síndrome de Churg-Strauss. El infiltrado inflamatorio en el plexo superficial está formado por polinucleares neutrófilos con fenómenos de leucocitoclasia, mientras que el infiltrado del plexo profundo es distinto según las entidades. En la PAN, en la PAM y en las poliangitis relacionadas con LES, AR y fármacos está compuesto por polinucleares neutrófilos. En la granulomatosis de Wegener y en el síndrome de Churg-Strauss el infiltrado del plexo profundo es de tipo granulomatoso, con macrófagos y linfocitos. En esta última entidad son abundantes los eosinófilos y hay gran tendencia a la necrosis tisular.
A pesar de que las lesiones cutáneas son frecuentes y pueden contribuir al diagnóstico, estas enfermedades presentan afección sistémica importante con compromiso del estado general y afección orgánica, sobre todo de pulmón y riñón, grave y a veces fulminante, lo que requiere un diagnóstico precoz y rápida instauración de tratamiento. Por estos motivos, ante la sospecha clínica de vasculitis sistémica se debe solicitar, de forma urgente, la determinación de los ANCA que pueden confirmar sin dilación estos graves diagnósticos.
Los ANCA antimieloperoxidasa predominan en la PAM y el síndrome de Churg-Strauss, mientras que los ANCA antiproteinasa 3 predominan en la granulomatosis de Wegener6. El estudio debe completarse con la determinación de crioglobulinas y marcadores de VHB y VHC.
Inflamación vascular por infecciónLas enfermedades de origen infeccioso, con diseminación hematógena de los gérmenes, pueden ocasionar inflamación vascular. La afectación de la piel forma parte del proceso septicémico y se caracteriza por la aparición de pápulas eritematosas, purpúricas o pustulosas. Habitualmente este tipo de procesos afecta a los vasos del plexo superficial, con trombosis e infiltrado por polinucleares, cuyo cuadro puede confundirse con el de una vasculitis de vasos pequeños.
El fenómeno de Lucio es una forma reaccional de la lepra lepromatosa difusa no tratada. Los pacientes presentan brotes de lesiones necróticas con bordes irregulares y estrellados que posteriormente se ulceran, afectando a las piernas predominantemente, aunque también pueden afectar a extremidades superiores y tronco. Estas lesiones son secundarias a inflamación de los vasos del plexo superficial y profundo, con trombosis, proliferación endotelial, infiltrado inflamatorio por macrófagos y presencia de bacilos ácido-alcohol resistentes en las paredes de los vasos. Es un cuadro grave, con afectación importante del estado general y de mal pronóstico.
Obstrucción vascular sin inflamaciónEste grupo de procesos, agrupados también bajo el nombre de pseudovasculitis, pueden ocasionar una sintomatología clínica muy similar a las vasculitis, de las que es importante hacer el diagnóstico diferencial, ya que el tratamiento indicado para las vasculitis (corticoides, inmunosupresores) puede empeorar gravemente estos procesos7. Aunque las causas de la obstrucción intravascular son diversas, el endotelio vascular parece desempeñar un papel fundamental en el desarrollo de estos procesos8. En estos casos la livedo reticularis se asocia a signos de infarto hemorrágico (púrpura retiforme) y a necrosis/ulceraciones secundarias, de contornos también reticulados o estrellados, que corresponden a las zonas infartadas.
TrombosisLos estados de hipercoagulabilidad pueden causar fenómenos trombóticos en las arteriolas de la piel y ocasionar livedo reticularis y necrosis cutáneas extensas. Las causas son diversas y los síntomas acompañantes están en relación con el origen del proceso trombótico y con la afección orgánica o multisistémica acompañante.
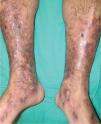
El síndrome antifosfolipídico (SAF) es una trombofilia autoinmune adquirida que se caracteriza por la presencia de Ac aPL, fenómenos trombóticos arteriales y venosos (tromboflebitis, tromboembolismo pulmonar, accidentes vasculares cerebrales) y/o pérdidas fetales recurrentes. Los anticuerpos responsables del proceso son el anticoagulante lúpico, los anticuerpos anticardiolipina (Ac aCL) y los anticuerpos anti-β2 glicoproteína I9. La presencia de livedo reticularis generalizada, estable, que no desaparece en un ambiente cálido, es el signo más constante de la enfermedad y está significativamente asociado a otras manifestaciones de afección arterial. Los pacientes pueden presentar también púrpura, necrosis, trombosis venosas superficiales, úlceras crónicas de las piernas, atrofia blanca, acrocianosis, perniosis, hemorragias subungueales e infartos digitales10. Este síndrome puede ser primario, pero frecuentemente se encuentra asociado a LES y a otras enfermedades autoinmunes.
El síndrome de Sneddon es un síndrome caracterizado por livedo reticularis generalizada asociada a fenómenos tromboembólicos, cuadro clínico indistinguible del SAF. Sin embargo, la asociación con la presencia de Ac aPL no es constante y es altamente variable (desde el 0 hasta el 80 %) según las series2.
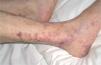
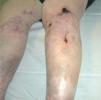
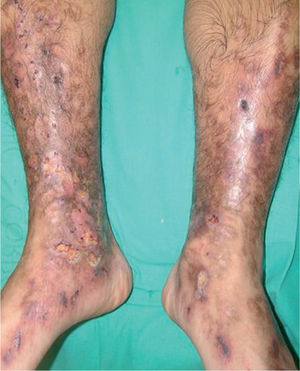
La vasculopatía livedoide se caracteriza por la aparición, en forma de brotes, de lesiones purpúricas y necróticas, de contornos estrellados, dolorosas, con livedo reticularis, que afectan a ambas piernas al mismo tiempo, con predominio en la zona maleolar y las plantas de los pies. Las lesiones evolucionan a la formación de cicatrices atróficas, con telangiectasias y pigmentación en los bordes (atrofia blanca) (fig. 4). No hay evidencias de afección orgánica, aunque algunos casos se asocian a síndrome de Raynaud, acrocianosis, signos de insuficiencia venosa periférica o a enfermeda des autoinmunes del colágeno11, sobre todo LE y esclerodermia. Se ha descrito también asociada a carcinomas, linfoma o mieloma4. Desde el punto de vista anatomopatológico se distingue por la trombosis y la hialinización de los vasos dérmicos sin vasculitis (fig. 5). Es destacable la presencia de diversas anomalías de la coagulación en muchos de los pacientes, con predominio de factores procoagulantes4: Ac aPL12, criofibrinógeno, disminución de la actividad de la antitrombina III, mutaciones heterocigotas del factor V13, deficiencia de la proteína C14, aumento de la agregación plaquetaria, crioglobulinemia15, aumento del inhibidor-1 de la activación del plasminógeno16.
En la crioglobulinemia de tipo I se acumulan inmunoglobulinas IgG o IgM de carácter monoclonal. Esta disproteinemia se asocia a procesos linfoproliferativos de las células B (mieloma, linfoma B, macroglobulinemia). La estructura de estas inmunoglobulinas no parece distinta de las normales, por lo que las causas de su tendencia a la precipitación por el frío no son bien conocidas. La precipitación intravascular de las inmunoglobulinas causa obstrucción arterial y los precipitados se visualizan en forma de un material amorfo y eosinófilo localizado en la luz vascular, con ausencia de inflamación (fig. 6)17. Los órganos preferentemente afectados en la crioglobulinemia tipo I son piel, riñón, hígado y sistema nervioso. Las lesiones cutáneas pueden ser la primera manifestación de la enfermedad y se observan en forma de acrocianosis, necrosis distales de extremidades inferiores y síndrome de Raynaud.
El LES y la AR pueden presentar livedo reticularis generalizada, sin evidencia de vasculitis o trombosis. En este caso el síndrome puede ser secundario a un enlentecimiento del flujo vascular (por aumento de la viscosidad o por estados de trombofilia), a una intensa respuesta vasoconstrictora al frío o a una combinación de ambos mecanismos.
La coagulación intravascular diseminada (CID) es un síndrome de evolución aguda y muy grave (purpura fulminans), consistente en la aparición de extensas áreas de necrosis hemorrágica durante el curso o inmediatamente después de un proceso infeccioso (meningococo, estreptococo grupo A, estafilococo, pneumococo) o de otras situaciones clínicas graves (politraumatismos, síndromes obstétricos, tóxicos). Es secundario a la brusca activación intravascular de los mecanismos de la coagulación, que ocasiona depleción de plaquetas y de diversos factores (fibrinógeno, protrombina, factor V, factor VIII, proteína C). La afección cutánea es generalizada, con extensas placas hemorrágicas y necrosis de contornos estrellados y bien delimitados, aunque no suele evidenciarse livedo reticularis (fig. 7).
Una de las posibles complicaciones del tratamiento con cumarínicos consiste en la aparición, en los diez primeros días de tratamiento, de extensas áreas de equimosis y necrosis cutáneas, de bordes bien delimitados y estrellados, que afectan al tórax, nalgas, muslos y brazos de manera simétrica. En la biopsia del borde de las lesiones se observa trombosis de los vasos dérmicos con ausencia de signos de inflamación. Este cuadro es poco frecuente y se presenta en individuos con deficiencias congénitas o adquiridas de la proteína C.
La anemia de células falciformes es la forma homocigota de la hemoglobinopatía S. La hemoglobina S tiene menor afinidad por el oxígeno y distorsiona la morfología de los hematíes. Es una enfermedad grave y las manifestaciones clínicas son consecuencia de fenómenos de oclusión vascular en la microcirculación por los hematíes falciformes, que pueden afectar a todos los órganos y que se manifiestan en individuos jóvenes. En la piel ocasiona úlceras crónicas en la zona maleolar, muy persistentes y con escasa tendencia a la curación.
Se han descrito casos de livedo reticularis, nódulos y lesiones necróticas de causa farmacológica en pacientes en tratamiento con la combinación de difenhidramina y piritildiona, usada como hipnótico. Esta complicación no se ha observado en relación con la ingesta de cada uno de estos fármacos aisladamente. El cuadro clínico es secundario a trombosis masiva de los vasos dérmicos, sin signos de vasculitis. La combinación de difenhidramina y piritildiona, administrada a dosis altas y de manera prolongada, puede causar estados de hipercoagulabilidad, que en individuos predispuestos con base autoinmune podría causar el cuadro clínico descrito18. En pacientes en tratamiento prolongado con hidroxiurea por enfermedades mieloproliferativas se ha observado la aparición de lesiones necróticas, muy dolorosas, con ulceración secundaria de bordes atróficos y fibrosos, en la zona maleolar o en los pies19. Aunque en algunos casos se ha demostrado inflamación perivascular y depósito de fibrina, la patogenia de estas lesiones no está claramente dilucidada20. Las ulceraciones son rebeldes al tratamiento y sólo curan al retirar la medicación21.
EmbolizaciónEmbolos procedentes de un mixoma auricular o de placas de ateroma pueden obstruir las arterias o arteriolas periféricas ocasionando cuadros de livedo y necrosis. Se han descrito procesos similares secundarios a la inyección intraarterial accidental de cemento para una vertebroplastia22, o polidocanol23.
El mixoma es un tumor benigno originado en las células del endotelio y localizado frecuentemente en la aurícula izquierda. Fragmentos de este tumor pueden desprenderse causando embolias distales, con la sintomatología característica de livedo reticularis, necrosis, cianosis distal y hemorragias en astilla. Frecuentemente los pacientes afectados de un mixoma auricular presentan síntomas generales en forma de fiebre, artralgias, pérdida de peso; síntomas que asociados a las lesiones cutáneas pueden hacer pensar en una vasculitis sistémica o en un LES. La biopsia de una lesión de la piel muestra obstrucción de la luz arteriolar por un material amorfo, basófilo, que mediante las tinciones de azul alcián o hierro coloidal se demuestra su composición mixoide.
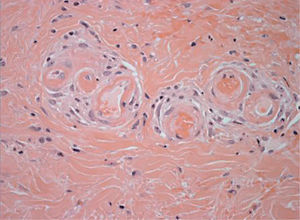
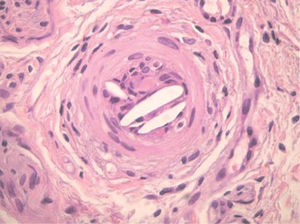
Los émbolos por colesterol se producen por desprendimiento de placas de ateroma de la aorta o de grandes arterias, ya sea de forma espontánea o por maniobras quirúrgicas, cateterismos, angioplastias, angiorradiologías o después de iniciar tratamiento anticoagulante o trombolítico. Las lesiones cutáneas secundarias a implantación de los émbolos en las arterias y arteriolas de la piel son muy frecuentes y suelen ser la primera manifestación de la enfermedad. Aparecen en forma de livedo reticularis, que se intensifica con la bipedestación, coloración azulada de los pies, tenue retículo en plantas, púrpura retiforme, necrosis, ulceraciones, nódulos y cianosis (fig. 8)24. La biopsia cutánea permite demostrar la embolización por cristales de colesterol, ya que luz de las arterias y arteriolas del plexo profundo se encuentran ocluidas y en su luz se observan unos espacios bicóncavos en forma de agujas, que representan el molde de los cristales en el interior del trombo (fig. 9). Puede observarse también un infiltrado inflamatorio por neutrófilos, eosinófilos y linfocitos en las fases iniciales, y por células gigantes en fases tardías. Los pacientes presentan frecuentemente leucocitosis con eosinofilia, trombocitopenia, proteína C reactiva elevada y aumentos de la velocidad de sedimentación, como signos de inflamación aguda secundaria. La embolización puede ocurrir en los vasos de diferentes órganos. Mediante un examen del fondo de ojo puede observarse el colesterol, como cristales amarillentos, en los vasos de la retina (placas de Hollenhorst). La afectación de los vasos renales es frecuente, dato que oscurece el pronóstico del proceso.
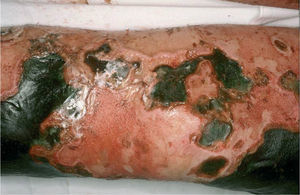
Alteración de la pared vascularLas alteraciones del metabolismo del calcio y del fósforo en los pacientes con insuficiencia renal avanzada e hipoparatiroidismo secundario pueden ocasionar calcificaciones metastásicas de arterias, tejidos blandos, articulaciones y órganos. La calcifilaxis es una calcificación de la media de las arterias, que ocasiona la aparición brusca de livedo reticularis, infartos hemorrágicos, necrosis, ulceraciones y placas violáceas, infiltradas, bien delimitadas y extremadamente dolorosas en las extremidades, a veces con aspecto de «piel de naranja» (fig. 10)25. Es un cuadro grave, muchas veces fatal. Existe gran riesgo de calcifilaxis cuando el producto calcio × fósforo es superior a 65mg/ml. El diagnóstico radica en la demostración de calcio en las paredes de los vasos dérmicos, tanto superficiales como profundos (fig. 11)26. La patogenia no es clara y hay autores que suponen la necesaria conjunción del aumento del producto fosfocálcico con alteraciones de la pared de los vasos, secundarias a la insuficiencia renal. En algunos pacientes se ha demostrado deficiencia de la proteína C, que podría actuar como factor de predisposición o como marcador de otras alteraciones que conducirían al desarrollo del proceso.
La hiperoxaluria primaria es un proceso hereditario autosómico recesivo, causado por deficiencia de enzimas hepáticas: a) alanina-glioxilato-aminotransferasa (AGT) o tipo I (glicólico aciduria), o b) D-glicerato-dehidrogenasa o tipo II (L-glicérico aciduria), que causa aumento de la concentración corporal de oxalato cálcico, con la consecuente precipitación de cristales de este producto en las articulaciones, riñón, corazón, ojos y piel27. La enfermedad se presenta en la infancia, en la adolescencia o en la edad adulta, predominantemente con insuficiencia renal, precedida o no por nefrolitiasis. En la piel se reflejan las complicaciones vasculares en forma de livedo reticularis, púrpura retiforme, necrosis, ulceraciones y acrocianosis. En la biopsia cutánea se observa el depósito de cristales amarillento-grisáceos en forma de agregados en dermis, tejido celular subcutáneo y en las paredes de los vasos de estas zonas. Pueden observarse además vasos dilatados, trombosis y necrosis focales del tejido graso28. Por el hecho de presentarse en pacientes con insuficiencia renal debe hacerse el diagnóstico diferencial con la calcifilaxis29.
Principios del tratamiento de la livedo reticularis de las piernasSe han descrito las diversas y variadas causas que pueden desencadenar el cuadro de livedo reticularis de las piernas, habitualmente asociado a nódulos, necrosis y úlceras. El tratamiento debe ser especialmente seleccionado e indicado para cada caso individual, ya que el riesgo de tratamientos nocivos es importante y de graves consecuencias5,30.
Las vasculitis sistémicas requieren tratamiento con corticoides e inmunosupresores. Las dosis y combinaciones dependerán del estado clínico del paciente y del grado de afección orgánica. La alteración visceral grave requiere corticosteroides y pulsos de ciclofosfamida. Para el tratamiento de mantenimiento puede ser útil la asociación de corticosteroides a dosis bajas con metotrexato o azatioprina. Para mantener el control de la afección pulmonar en el síndrome de Wegener se recomienda el tratamiento de mantenimiento con cotrimoxazol.
No se dispone de un tratamiento efectivo para la livedo reticularis generalizada del SAF o del síndrome de Sneddon. Las lesiones cutáneas secundarias a trombosis pueden tratarse con aspirina a dosis bajas, antiagregantes plaquetarios, aunque algunos casos pueden precisar el uso de anticoagulantes cumarínicos31.
En la vasculitis livedoide y en todos los procesos secundarios a trombofilia, se recomienda en primer lugar dejar de fumar o de usar parches o caramelos de nicotina. El tratamiento médico se basa en el uso de aspirina, pentoxifilina, dipiridamol y oxígeno hiperbárico. Algunos autores indican la necesidad de combinar tratamiento con inmunosupresores32 o inmunoglobulina endovenosa para obtener mejores resultados33. La hidroxicloroquina se indica sobre todo en los casos asociados a SAF3,34. En casos de criofibrinogenemia puede recomendarse el tratamiento con danazol o estanozolol. En determinados estados de hipercoagulabilidad pueden estar indicados los cumarínicos o la heparina de bajo peso molecular. Los pacientes con mutación en la metilentetrahidrofolato reductasa deben ser tratados con ácido fólico y los pacientes con alteraciones del inhibidor-1 del activador del plasminógeno con la infusión endovenosa del activador del plasminógeno tisular.
No existen tratamientos claramente efectivos para los procesos embólicos ni para la calcifilaxia o la hiperoxaluria. Son procesos graves cuya complicación más importante es la obstrucción de las arterias renales y la consiguiente insuficiencia renal, que requiere las medidas terapéuticas específicas. En los casos por embolia por colesterol se recomienda utilizar corticosteroides sistémicos, pues parecen frenar una cascada de inflamación que se desencadena secundariamente y que puede conducir a un final irreversible.
Conflicto de interesesDeclaramos no tener ningún conflicto de intereses.