Dentro de la patología tumoral dermatológica, los linfomas representan un pequeño grupo de la misma. Los linfomas primarios cutáneos T (LPCT) tienen una incidencia de 0,36 casos/100.000 habitantes/año, lo que constituye una pequeña proporción de linfomas no Hodking1.
El linfoma T de células grandes anaplásico CD30+ (LTCGA30+) pertenece a este grupo y se define como una neoplasia compuesta por linfocitos atípicos grandes de morfología anaplásica, pleomórfica o inmunoblástica, y que expresan el antígeno CD-30 en la mayoría de ellos (>75%)2. En la clasificación WHO-EORTC de linfomas cutáneos está incluido en el apartado de linfomas cutáneos de células T y células NK, en el subgrupo de procesos linfoproliferativos CD30+ cutáneos primarios3,4, teniendo una buena respuesta al tratamiento y pronóstico favorable, a diferencia de la variante ganglionar primaria5,6, más agresiva.
Presentamos un caso de linfoma T anaplásico (CD30+) cutáneo de evolución infrecuente y agresiva, con aparición de metástasis cerebral en el curso del tratamiento quimioterápico que contribuyó al fallecimiento del paciente.
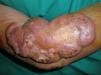
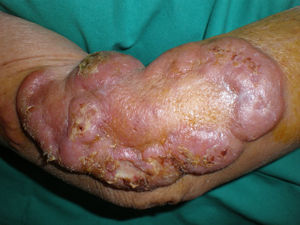
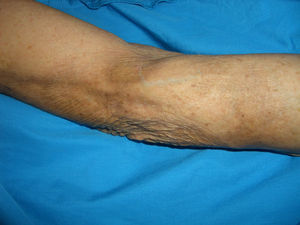
Se trata de una mujer, 84 años de edad, visitada por presentar varias lesiones tumorales cutáneas, ulceradas algunas, violáceas, en antebrazo y brazo derecho, de 2 años de evolución (fig. 1). En la exploración también presentaba una adenopatía axilar derecha, de gran tamaño, dura y no desplazable sobre planos profundos.
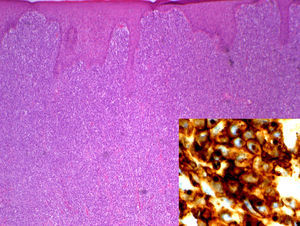
En el estudio biópsico se observa una tumoración que ocupa toda la dermis, destruyendo los anejos cutáneos, aunque respetando la epidermis (fig. 2), constituida por células linfoides atípicas de talla grande con marcado pleomorfismo nuclear, nucléolo patente, muchas veces múltiple y citoplasma eosinófilo. El índice mitótico es elevado, con presencia de hasta 4 mitosis por campo de gran aumento, muchas de ellas atípicas.
El estudio inmunohistoquímico (IHQ) junto con la morfología descrita confirma el diagnóstico. Se constata positividad para el antígeno leucocitario común (CD-45), CD-30 y CD-4; y negatividad para: queratinas (AE1-AE3 y queratinas 7 y 20), EMA, S-100, CD-3, CD-20 y p-80 (ALK1). El CD30 muestra positividad de membrana y citoplásmica paranuclear en más del 95% de las células (fig. 2).
En las exploraciones complementarias el TAC toráco-abdominal mostró adenopatías axilares derechas sugestivas de metástasis. En la citometría de flujo de sangre periférica no se detectaron linfocitos atípicos circulantes.
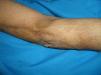
La paciente inició tratamiento quimioterápico de 6 ciclos de terapia CHOP, con buena respuesta inicial (fig. 3), aunque a los 6 meses reingresa en el hospital por presentar dolor retroocular y diplopia. En el estudio de resonancia magnética se constató una lesión cerebral en el lóbulo temporal derecho, compatible con linfoma.
La paciente fallece 6 meses después del diagnóstico, siendo la causa inmediata el colapso cardiorrespiratorio, la intermedia la afectación cerebral por el linfoma y la fundamental el LTCGA30+ cutáneo.
Los LTCGA 30+cutáneos suponen un 30% de los LPCT y constituyen el segundo grupo en frecuencia después de la micosis fungoide/síndrome de Sezary. Tienen por lo general un buen pronóstico, con una supervivencia media del 96 al 100% a los 5 años4.
El LTCGA 30+ afecta a adultos de ambos sexos, pero es más frecuente en varones y se manifiesta clínicamente, en la mayoría de los casos, como una lesión tumoral única o bien en forma de pápulas agrupadas o generalizadas. Las lesiones tienen tendencia a la ulceración. En un 20% son multifocales y aproximadamente un 10% de los pacientes presentarán diseminación extracutánea con presencia de adenopatías4.
La evolución de las lesiones cutáneas de nuestra paciente antes del ingreso, fue de dos años, presentando la adenopatía axilar desde 6 meses antes del mismo. Aunque tuvo una respuesta favorable desde el punto de vista cutáneo, tras el tratamiento con CHOP presentó metástasis cerebral, lo que contribuyó a su fallecimiento.
Es un hecho bien conocido la diferente evolución del LTCGA 30+ con afectación ganglionar primaria (más agresivo), frente a la forma primaria cutánea3. En nuestro caso la negatividad para EMA en el estudio IHQ es coherente con un origen cutáneo primario2, ya que prácticamente nunca los LTCGA 30+ cutáneos expresan EMA a diferencia de los nodales. También sugiere un origen cutáneo la negatividad para p-80 (ALK)2. Con todo ello se descartó que se tratara de un LTCGA 30+ primario ganglionar con afectación secundaria de la piel. Tampoco se constató clínica ni morfológicamente antecedentes de una micosis fungoide que hubiera evolucionado hacia un cuadro LTCGA 30+, situación asociada a un muy mal pronóstico2.
Respecto al pronóstico del LTCGA 30+ en general es favorable, siendo la supervivencia a los 10 años superior al 90%. Los pacientes con lesiones diseminadas cutáneas, como es nuestro caso, parecen tener un mayor riesgo de afectación extracutánea7. En el trabajo de Grange et al8 sobre factores pronósticos en linfomas cutáneos, el número de lesiones, tamaño, tipo histológico, así como los niveles de LDH y la presencia de síntomas clínicos B (pérdida de peso, fiebre inexplicable y sudoración nocturna), se correlacionan con el pronóstico. Sin embargo, llama la atención sobre la falta de estudios con criterios uniformes, existentes. Por otro lado, la edad avanzada empeora el pronóstico, influyendo las comorbilidades asociadas a esta etapa de la vida.
En cuanto al tratamiento en lesiones múltiples localizadas puede emplearse radioterapia, metotrexate, interferón solo o asociado a bexaroteno o poliquimioterapia (CHOP), siendo esta última el tratamiento de elección en lesiones diseminadas4. Diversos autores5,9,10 insisten en la necesidad de ser poco agresivo dado el buen pronóstico, en general, de los LTCGA 30+. Sin embargo, no hay que olvidar que los pacientes con edad avanzada, lesiones múltiples y afectación ganglionar son de mayor riesgo y pueden tener un curso agresivo, como es el caso de la paciente que presentamos, que falleció a pesar de inicialmente responder favorablemente a 6 ciclos de CHOP.
Al Dr. Miguel Ángel Marín Cárdenas, del Servicio de Radiodiagnóstico del Hospital Universitario Miguel Servet de Zaragoza, por facilitarnos los estudios y la imagen de resonancia magnética.