El miedo a realizar intervenciones en la uña por el riesgo de distrofia residual, la dificultad de procesado y de interpretación de las biopsias ungueales, así como la falta global de experiencia en este campo han hecho que las melanoniquias ungueales en general (y las lesiones melanocíticas subungueales en particular) sean un tema poco atractivo tanto para dermatólogos como para patólogos. A pesar de la indudable complejidad de este campo, el manejo de las técnicas de biopsia ungueal, el correcto procesado y orientación de las muestras y el conocimiento de las particularidades histológicas del aparato ungueal pueden facilitar mucho esta labor. La biopsia longitudinal escisional ofrece la interpretación histológica más sencilla y tiene bajo riesgo de generar distrofia ungueal, si se realiza correctamente. Los datos clínicos y epidemiológicos son fundamentales: el diagnóstico de melanoma subungueal en la infancia es excepcional, e incluso lesiones con características clínicas y/o histológicas atípicas constituyen, con toda probabilidad, lesiones benignas. La presencia de melanocitos suprabasales y otros hallazgos que serían sospechosos de malignidad en lesiones en otras localizaciones se consideran normales en el aparato ungueal. El melanoma subungueal tiene un patrón lentiginoso en estadios precoces y parece que la presencia de un infiltrado inflamatorio, acompañando a lesiones subungueales lentiginosas atípicas, es uno de los primeros hallazgos diagnósticos de esta lesión.
Both dermatologists and pathologists sometimes find daunting the evaluation of melanonychia (especially subungual melanocytic lesions) because of the fear of performing nail surgery due to the risk of dystrophy, difficulties processing and interpreting nail biopsy specimens, and a general lack of experience in the field. Nevertheless, mastery of nail biopsy techniques, correct processing and orientation of specimens, and familiarity with the histologic particularities of the nail apparatus can attenuate the undoubted complexity and facilitate the tasks involved. Longitudinal excision is the biopsy technique that ensures the simplest histologic interpretation, and it is associated with a low risk of nail dystrophy when performed correctly. Clinical and epidemiological data are crucial. Subungual melanoma in childhood, for instance, is very rare and even lesions with atypical clinical and/or histologic features are probably benign. The presence of suprabasal melanocytes and other findings that would suggest malignancy at other sites are considered normal in the nail apparatus. Subungual melanoma shows a lentiginous pattern in the early stages of disease, and detection of an inflammatory infiltrate accompanying atypical lentiginous subungual lesions would appear to be one of the first diagnostic findings.
Tradicionalmente, el diagnóstico y el tratamiento de las melanoniquias ha sido un tema poco atractivo tanto para dermatólogos como para patólogos. Uno de los motivos que justifican este hecho es la baja prevalencia de estas lesiones. Como consecuencia, la poca experiencia en esta patología condiciona que los dermatólogos tengan reticencias a efectuar biopsias por temor a inducir una distrofia ungueal1–6. Frecuentemente, esto conduce a la realización de biopsias parciales o inadecuadas que pueden ser insuficientes para obtener un diagnóstico histológico fiable3,6–8. Los patólogos, por el mismo motivo, tienen dificultades para la interpretación de biopsias ungueales8,9. Además del escaso número de estas, deben lidiar con muestras inapropiadas tanto por la toma de la biopsia (por ejemplo, por no incluir la matriz en una lesión melanocítica o por una orientación transversal en lugar de longitudinal) como por el propio procesado de la muestra7,10. A este respecto, es relativamente frecuente que la preparación histológica obtenida a partir de una biopsia ungueal, cuya consistencia exige técnicas de procesado especiales, incluya, en muchas ocasiones, artefactos de tracción o esté mal orientada2,10,11. Por si esto fuera poco, la uña constituye una localización especial y la densidad y la distribución de melanocitos son diferentes a las del resto de la piel7–9,11,12.
A pesar de todo lo anteriormente expuesto, es posible realizar biopsias adecuadas de las lesiones melanocíticas ungueales sin apenas inducir alteraciones permanentes, con técnicas relativamente sencillas1,4,6,11. Por otro lado, aunque la interpretación histológica de estas lesiones no es fácil, una biopsia adecuada y un correcto procesamiento y orientación de la muestra, así como el conocimiento de las peculiaridades de los melanocitos ungueales, la facilitan4,7,9,13. El presente artículo pretende analizar las características clínicas e histológicas de las lesiones melanocíticas de la uña y ofrecer un algoritmo diagnóstico de las lesiones pigmentadas del aparato ungueal, incluyendo una revisión detallada de las distintas técnicas de biopsia.
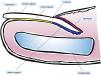
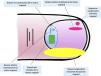
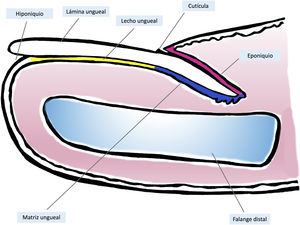
Anatomía clínica e histológica del aparato unguealEl conocimiento de la anatomía clínica e histológica de la uña es indispensable para la posterior evaluación de las lesiones melanocíticas7,11,12,14,15. El aparato ungueal está constituido por la matriz, el lecho, la lámina, la cutícula y el tejido conectivo que soporta estas estructuras (fig. 1)7,11,14,15. La lámina está separada del resto del dedo por los surcos periungueales (un surco proximal y dos laterales)13. La matriz es la porción epitelial más proximal del aparato ungueal, es responsable de la producción de la lámina y se continúa distalmente con el lecho7,11,14. Tanto la matriz como la lámina se encuentran cubiertas por el pliegue ungueal proximal. En algunos dedos, es posible ver la lúnula, una estructura blanquecina convexa con forma de semiluna que se corresponde con la parte más distal de la matriz, mientras que el lecho es la principal estructura que se transparenta a través de la lámina11,13,14.
Anatomía macroscópica de la uña normal: el aparato ungueal está cubierto en su parte más proximal por el pliegue ungueal proximal. El epitelio de la cara ventral de este pliegue se denomina eponiquio (en rosa), y produce la cutícula verdadera (en negro), que se adhiere firmemente a la lámina. La matriz ungueal (en azul) se divide en matriz proximal y distal, es la productora de la lámina y se continúa distalmente con el lecho. Tanto la matriz como el lecho están cubiertos por la lámina ungueal. Finalmente, el lecho (en amarillo) termina distalmente en el hiponiquio.
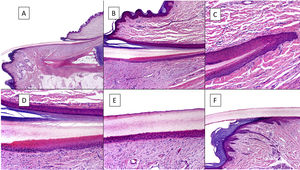
Histológicamente, la mejor correlación con la anatomía macroscópica de la uña se obtiene con biopsias longitudinales (fig. 2)7,14,16,17. El pliegue ungueal proximal está constituido por piel acra y se encuentra cubierto por una película de queratina que constituye la falsa cutícula. Esta continúa en la cara ventral del pliegue con la verdadera cutícula, producida por el eponiquio7,11,14,16. La matriz se subdivide en proximal y distal. En los cortes próximos a la línea media del dedo, el epitelio de la matriz proximal presenta grandes crestas longitudinales y oblicuas, mientras que, en las zonas laterales, es más plano y de menor grosor9,14. La matriz proximal es la principal responsable de la producción de la lámina ungueal (hasta el 80%), especialmente en su cara dorsal o expuesta3,7,9,11,14,16,18. La cara ventral de la lámina se origina a partir de la matriz distal. Por tanto, un daño en la proximal tiene más probabilidad de generar una distrofia ungueal residual3,7,11,14,16,18,19.
Anatomía histológica de la uña normal. A) Anatomía microscópica de la uña normal en un corte longitudinal. B) Detalle de la matriz ungueal y el eponiquio. C) Repliegue entre la matriz proximal y el eponiquio. D) En la porción inferior, se aprecia la típica queratinización sin capa granulosa de la matriz para formar la lámina con un aspecto similar a la queratinización tricolémica. En la porción superior, se aprecia el eponiquio con su queratinización ortoqueratósica característica. E) Detalle del lecho ungueal con su típica epidermis aplanada sin capa granulosa cubierta directamente por la lámina. F) Detalle del hiponiquio con una epidermis con queratinización ortoqueratósica de características similares a las del resto de la piel acra normal (no subungueal).
La queratinización de la lámina ungueal, que se produce en la banda queratogénica de la matriz, ocurre abruptamente sin estrato granuloso, de modo muy similar a la queratinización tricolémica9,14,16. El epitelio del lecho ungueal continúa distalmente a la matriz, es delgado y presenta unas crestas longitudinales, interdigitadas con la dermis subyacente, que solo se aprecian en cortes transversales7,11,14. Finalmente, el límite distal de la uña está constituido por el hiponiquio, separado del resto del dedo por el pliegue ungueal distal11,14,16. La dermis que soporta el aparato ungueal es poco celular y carece de anejos cutáneos. La hipodermis es también escasa9,11,14,16.
La uña es una localización especial respecto a su distribución melanocítica7,11,14,16,18. El número normal de melanocitos del aparato ungueal es casi seis veces menor que el que se observa en otras ubicaciones: de 200/mm2 frente a unos 1.150/mm2 en piel normal7,9,11,14,20. En el eponiquio y en el lecho ungueal, los melanocitos son escasos (0 a 50/mm2), se encuentran en estado quiescente y se hallan predominantemente en los estratos basales del epitelio7,11,14,16,18. En la matriz, la densidad melanocítica es algo mayor (100 a 200/mm2) y los melanocitos pueden ubicarse en los estratos suprabasales, sin que esto constituya un hallazgo patológico, especialmente en la matriz proximal7,15,16,18,20. Los melanocitos en esta última también son quiescentes y apenas producen melanina, mientras que los de la matriz distal son más activos (aproximadamente el 50% producen melanina)7,11,16. Es por ello, que la mayoría de las lesiones melanocíticas pigmentadas del aparato ungueal se originan en la matriz, principalmente en la distal (hasta un 85%) y, por tanto, se presentan con una clínica de melanoniquia longitudinal7,16. Sin embargo, hasta el 25% de los melanomas subungueales se originan en el lecho por lo que, debido a la escasa actividad de síntesis de melanina de estos melanocitos, son frecuentemente amelanóticos2,7,11,14,21.
Debido a su escasa densidad y a su estado quiescente, puede ser difícil visualizar los melanocitos ungueales con la tinción de hematoxilina-eosina, y es necesario el uso de alguna técnica inmunohistoquímica7,18,20,22. Las tinciones citoplasmáticas como Melan-A y HMB45 son menos precisas y pueden teñir incluso los queratinocitos en las lesiones con una síntesis muy activa de pigmento7,20,23,24. Las tinciones nucleares, como MiTF y SOX10 son más limpias y permiten una identificación más precisa de la densidad melanocítica y de su localización en los estratos del epitelio7,20,23,24. Los melanocitos ungueales no se tiñen bien con S100 y su uso debería limitarse7,9,11,13,16,20.
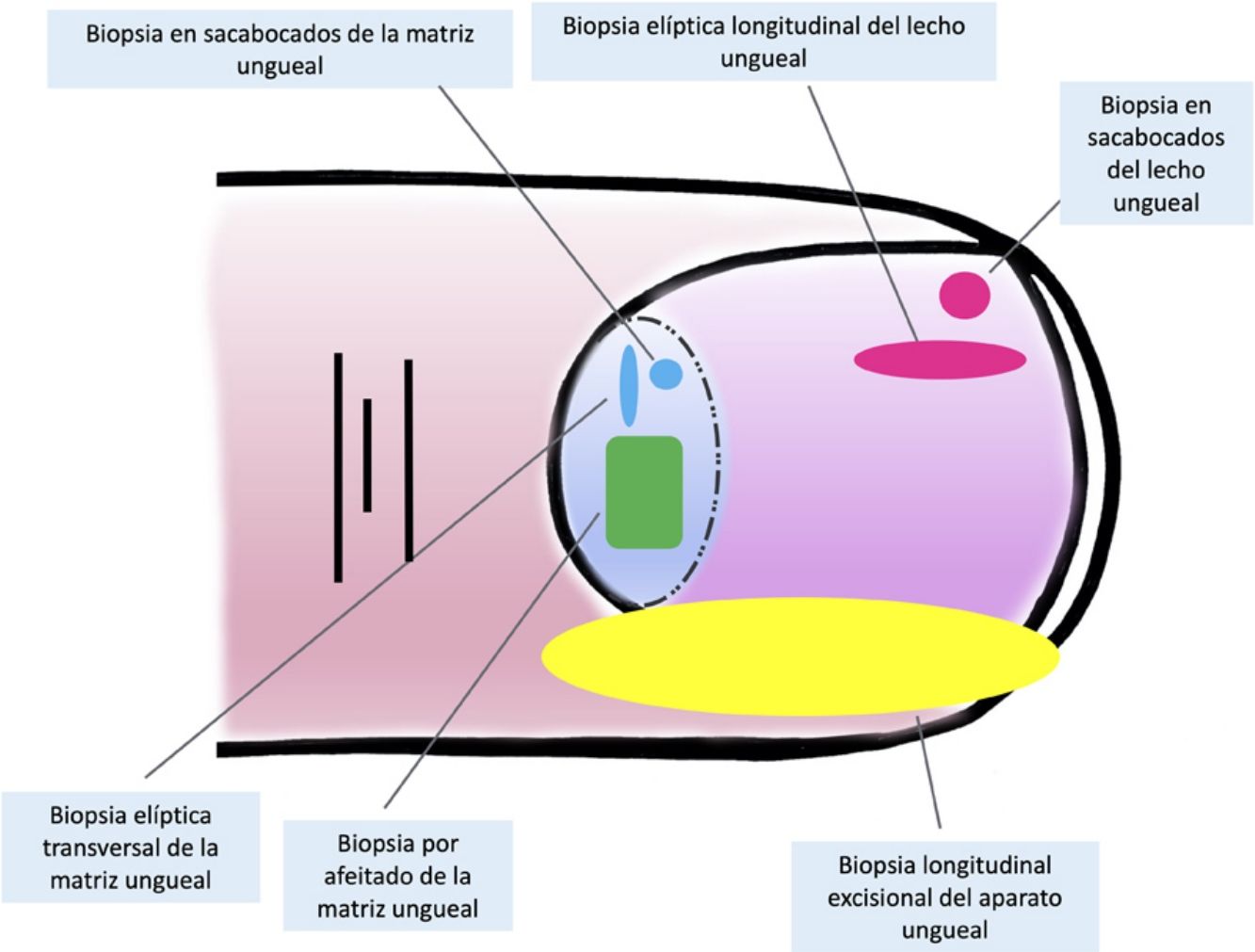
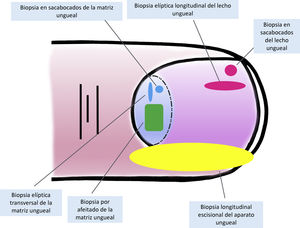
Técnicas de biopsia del aparato unguealUno de los principales motivos, si no el más relevante, para llevar a cabo una biopsia del aparato ungueal es descartar un melanoma subungueal7,16,19,25. Hay muchas técnicas distintas y, para seleccionar la más apropiada, hay que tener en cuenta tanto la necesidad de obtener una muestra rentable para su estudio, como su dificultad técnica y el riesgo de distrofia ungueal residual2,11,14,16,25. Teniendo en cuenta que la gran mayoría de las lesiones melanocíticas se asientan en la matriz ungueal, es preciso incluirla en casi todos los casos. Sin embargo, puesto que la mayoría de las lesiones aparecen en la matriz distal, podría no ser necesario considerar la matriz proximal en la biopsia, disminuyendo así el riesgo de distrofia16,17,25. La dermatoscopia ungueal es útil en el estudio de las melanoniquias longitudinales y facilita la identificación de los signos clínicos de alarma6,26–28. La dermatoscopia ungueal intraoperatoria (una vez retirada la placa ungueal) puede, además, mejorar la precisión para localizar el origen de la pigmentación5,6,26,29,30.
Para la biopsia del lecho ungueal, pueden realizarse tanto biopsias elípticas longitudinales como en sacabocados16,19,21. Puesto que la mayoría de las pigmentaciones de origen melanocítico se asientan en la matriz, una biopsia aislada del lecho ungueal es inadecuada en este contexto, ya que no obtendría el material histológico de interés para su estudio7,9.
Las biopsias aisladas de la matriz consisten, principalmente, en la elíptica, en este caso, transversal (en general, las primeras deben orientarse transversalmente)21,31, la biopsia en sacabocados y la longitudinal escisional, de la que hablaremos más adelante2,14,19,21. Las biopsias elípticas y en sacabocados pueden hacerse directamente o previa avulsión de la lámina ungueal2,5,13,14,19. Si después de este procedimiento, la pigmentación estudiada tiene un diámetro pequeño, puede hacerse una biopsia en sacabocados2,13,14,19,25. En las pigmentaciones anchas es preferible la longitudinal transversa de la matriz14,19,25. En los últimos años ha cobrado especial interés la biopsia por afeitado de la matriz5,6,13,21,25,32. Esta técnica se realiza tras la retirada del pliegue ungueal proximal y la avulsión de la lámina proximal. Con una hoja de bisturí, se procede al afeitado y exéresis de la parte de interés de la matriz, o bien de la matriz completa. Posteriormente, se recoloca la lámina ungueal en su lugar y se cierra la incisión del pliegue por aproximación directa6,21,25,32. Esta biopsia por afeitado permite la inclusión total de la matriz en bandas anchas de melanoniquia y tiene una probabilidad baja de distrofia ungueal residual4–7,21,32,33.
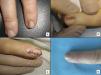
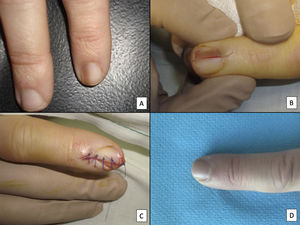
A pesar del indiscutible papel que desempeñan todas estas técnicas, la mayoría de los autores consideran la biopsia longitudinal escisional (o incisional, en lesiones muy amplias) como la técnica de elección para el estudio histológico del aparato ungueal7,16,17,20,21,31. Las biopsias longitudinales ofrecen la mejor correlación anatómica y permiten el estudio de la distribución de la lesión dentro de la arquitectura global del aparato ungueal, facilitando su análisis16,21,31,34. En general, se considera que la biopsia longitudinal escisional es la técnica de elección para el estudio de las melanoniquias longitudinales finas y de localización lateral, quedando como consecuencia una uña más estrecha pero con un riesgo bajo de distrofia residual7,11,14,16,21,31. Sin embargo, cuando la melanoniquia se sitúa en la zona central de la lámina hay menos consenso y muchos autores abogan por alguna de las otras técnicas descritas previamente, puesto que una distrofia residual en la zona central de la uña generaría una indentación permanente4,7,11,14,16,21,31. En nuestra experiencia, la biopsia longitudinal puede emplearse con seguridad, incluso en bandas de melanoniquia de localización central (fig. 3). En este caso, la técnica consiste en la realización de un huso que incluya la totalidad de la banda pigmentada (o su parte más representativa si es demasiado ancha), desde el hiponiquio hasta el pliegue ungueal proximal, llegando en profundidad hasta el periostio de la falange distal. Una vez realizada la exéresis, se realiza una aproximación directa del defecto con puntos de sutura, desde la lámina en la superficie hasta el tejido fibrocolágeno ungueal más profundo. Para disminuir el riesgo de distrofia puede evitarse colocar puntos en la zona de la matriz proximal, suturando en su lugar el pliegue ungueal proximal y el área correspondiente a la matriz distal y al lecho proximal. Efectuada de este modo, esta técnica tiene un riesgo bajo de distrofia residual y la única consecuencia sería la de una lámina más estrecha (igual que ocurre cuando se realiza a nivel lateral). Por tanto, en nuestra opinión, la biopsia longitudinal escisional debería ser considerada como la técnica de elección en la mayoría de los escenarios, puesto que proporciona la mejor visión arquitectural de la lesión. Siguiendo el método descrito, quedando los bordes bien aproximados y la matriz correctamente enfrentada, no hay un riesgo excesivo de distrofia ungueal residual. En la figura 4 se muestran las distintas técnicas de biopsia del aparato ungueal.
Biopsia longitudinal escisional del aparato ungueal. A) Melanoniquia longitudinal marrón pálido, que histológicamente correspondió a una hipermelanosis ungueal. B) Bajo anestesia local se realiza una exéresis longitudinal en forma de huso desde el pliegue ungueal proximal hasta el hiponiquio, incluyendo todo el aparato ungueal. C) Sutura por aproximación directa del defecto, desde la placa ungueal en la superficie hasta el tejido conectivo ungueal en profundidad. D) Tras un año, el resultado es una uña normal sin ningún signo de distrofia residual, únicamente más estrecha.
Finalmente, el procesado correcto de la muestra histológica es tan exigente como su obtención. La lámina ungueal es un tejido muy duro, difícil de cortar, que condiciona frecuentemente la producción de artefactos de tracción, despegamientos del epitelio y, en definitiva, una mala orientación del corte, dificultando su interpretación3,7,10,11,16. Hay distintos métodos para ablandar la pieza ungueal antes de su tallado3,9–11,13,31, cuyo estudio escapa al objetivo del presente artículo. Quizás el más simple sea la inmersión de la pieza en agua destilada durante unas horas antes de su inclusión en formalina. Nunca deben utilizarse preparaciones que contengan ácidos, puesto que pueden dañar el material genético de la muestra y comprometer los estudios inmunohistoquímicos y de biología molecular11,13.
Lesiones melanocíticas del aparato unguealLa mayoría de las lesiones melanocíticas del aparato ungueal se presentan como una melanoniquia longitudinal. Esta consiste en una banda pigmentada que se extiende desde la matriz hasta el borde libre de la uña, causada por la presencia de pigmento en la lámina ungueal6,7,9,35. En ocasiones, también puede verse una melanoniquia total de la lámina. Cabe destacar que la melanoniquia longitudinal no es exclusiva de las lesiones melanocíticas y muchas otras entidades pueden presentarse con clínica similar, como el síndrome de Laugier, las pigmentaciones exógenas por fármacos, la pigmentación étnica, entre otras7,16,23,35,36.
Tal y como ocurre en las lesiones pigmentadas de otras localizaciones, existen una serie de signos clínicos atípicos considerados de «alarma» que hacen necesario descartar un melanoma ungueal1,7,16,26,35,37–39. Las melanoniquias anchas (> 5 mm), heterogéneas (compuestas por bandas de distintos colores), de bordes poco nítidos, de evolución rápida o acompañadas de una distrofia ungueal se consideran altamente sospechosas1,7,9,26,39–41. Asimismo, una melanoniquia de forma triangular (más ancha en la parte proximal que en la distal) implica que la lesión que la produce está creciendo, y también obliga a descartar un melanoma1,7,14,26.
Como se tratará más adelante, el contexto epidemiológico es muy importante en la valoración de las melanoniquias longitudinales1,7,9,24,26,35,39,42. La aparición de una nueva lesión melanocítica en un adulto, en un único dedo, siempre orilla a descartar un melanoma ungueal, independientemente de sus características clínicas1,6,7,14,24,43,44. Por el contrario, dado que el melanoma ungueal es excepcional en la infancia, incluso la presencia de bandas con unas características clínicas muy atípicas o abigarradas se corresponden, en su inmensa mayoría, a lesiones benignas1,6,7,38,43,45–49.
Por todo esto, es de gran utilidad para el patólogo acompañar la biopsia de una fotografía clínica, así como de datos de localización y edad del paciente7,14,46. No obstante, el examen clínico aislado suele ser insuficiente para determinar la naturaleza de una melanoniquia longitudinal y es necesario complementarlo con un estudio histológico1,7,14,17,26,42,50,51.
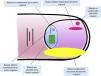
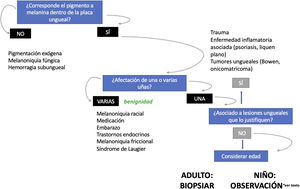
En la figura 5 se propone un algoritmo diagnóstico de las melanoniquias longitudinales en función de sus características clínicas26.
Algoritmo de manejo de las melanoniquias longitudinales (adaptado de Piraccini et al.26) en adultos, la aparición repentina de una nueva banda única de melanoniquia hace necesario descartar un melanoma subungueal. En niños, incluso en presencia de algunos signos clínicos atípicos, se trata con gran probabilidad de una lesión benigna. En presencia de signos o síntomas preocupantes (hemorragia, dolor, cambio rápido o llamativo en el color o en la anchura) algunos autores recomiendan enviar a una unidad de referencia o considerar la biopsia ungueal.
La hiperactivación melanocítica ungueal, también llamada hipermelanosis ungueal, es la causa más frecuente de melanoniquia longitudinal en los adultos (hasta en el 73% de los casos)1,7,14,24,52. Clínicamente, suele tratarse de bandas estrechas (< 5 mm de diámetro) de coloración grisácea o marrón claro7,14,24. La hiperactivación melanocítica se produce por un aumento de la capacidad de síntesis de melanina de los melanocitos ungueales, localizados principalmente a nivel suprabasal1,7,12,15. Aunque puede haber una elevación moderada del número de melanocitos, esta no suele ser llamativa en el examen con hematoxilina-eosina y el principal hallazgo histológico es el incremento de pigmento1,7,9,12,14. En muchas ocasiones, las melanoniquias con una clínica muy marcada y bandas intensamente pigmentadas expresan hallazgos histológicos prácticamente anodinos7. Por otro lado, el aumento de pigmento de la matriz puede dificultar la distinción clara entre melanocitos y queratinocitos con la tinción de hematoxilina-eosina, pero también con tinciones inmunohistoquímicas citoplasmáticas, puesto que tiñen melanosomas que también pueden estar presentes en los queratinocitos7,14,20,24. Como se ha descrito previamente, los marcadores inmunohistoquímicos nucleares permiten una visualización mucho más clara de los melanocitos ungueales7,20,24. Por último, es posible encontrar melanófagos aislados en la dermis superficial de estas lesiones7,14.
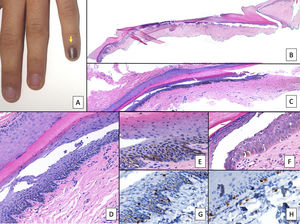
Lentigo unguealEl lentigo ungueal es una lesión compuesta por un incremento del número de melanocitos dispuestos en la capa basal de la epidermis con un patrón lentiginoso y sin formar nidos1,7,9,14,51. También, se ha denominado hiperplasia melanocítica benigna, o mácula melanótica, e incluso, hay autores que consideran al lentigo ungueal y a la hiperactivación melanocítica conjuntamente bajo el término de mácula melanótica15,24,52. Puesto que el término de mácula melanótica se emplea en otras localizaciones cutáneo-mucosas para designar al incremento de pigmento sin aumento del número de melanocitos (lo que en la uña se denominaría hiperactivación melanocítica), muchos autores prefieren no utilizarlo con esta acepción22. La clínica del lentigo ungueal es superponible a la de la hiperactivación melanocítica: suele tratarse de bandas estrechas de color marrón claro o grisáceo1,7,12. Histopatológicamente, se observa una franca elevación en el número de melanocitos matriciales, que muchas veces son dendríticos, así como de la síntesis de pigmento (fig. 6)1,7,14,51. Es importante recordar que la localización suprabasal de melanocitos aislados en el epitelio matricial no se considera un hallazgo patológico1,3,7.
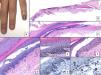
Lentigo ungueal. A) Paciente de 11 años que consultó por melanoniquia del 5° dedo de la mano izquierda. La banda de melanoniquia ocupaba la totalidad de la uña, con pigmentación del pliegue ungueal proximal (flecha: signo de Hutchinson). B) Biopsia longitudinal escisional que muestra la anatomía del aparato ungueal en toda su extensión. C) Corte longitudinal oblicuo en el que se observan (de arriba a abajo) el eponiquio, la lámina ungueal con banda de onicoqueratinización y la matriz. En las capas basales de la matriz se muestra un aumento de pigmentación. D) A mayor detalle (x200), se observa una proliferación melanocítica lentiginosa en los estratos basales de la matriz y abundante pigmento melánico. Hay ascenso suprabasal de algunos melanocitos, junto con múltiples artefactos de fijación. E) Detalle de la matriz (x400) en el que llama la atención el importante aumento de pigmento. F) Detalle del eponiquio (x400) en el que se observa un ligero aumento del número de melanocitos, que no muestran signos de atipia. De nuevo, hay queratinocitos artefactados de aspecto vacuolado. La hiperplasia melanocítica a este nivel es responsable del signo de Hutchinson clínico. G) Detalle de la matriz (x400) con tinción de SOX10, que confirma un discreto aumento del número de melanocitos de forma salpicada en la capa basal, sin formar nidos ni filas. Puede verse un ascenso suprabasal de alguna célula aislada. H) Detalle del eponiquio (x400) con tinción de SOX10, que resalta un ligero aumento del número de melanocitos separados entre sí por queratinocitos normales.
El nevus melanocítico es la lesión melanocítica ungueal más frecuente en la infancia (hasta el 75%)1,7,14,23,45,53. Clínicamente, consiste en una melanoniquia longitudinal más o menos regular1,7,14,43,54. Los nevus melanocíticos, especialmente los congénitos, pueden producir una pigmentación del pliegue ungueal proximal (signo de Hutchinson) sin implicar malignidad1,7,45,54,55. En ocasiones, sobre todo en la infancia, los nevus melanocíticos ungueales pueden tener una presentación clínica atípica, con melanoniquias anchas o irregulares, signo de Hutchinson no asociado con un melanoma, e, incluso, una melanoniquia total7,45,49,54–56.
Histopatológicamente, se observa una proliferación de melanocitos dispuestos en nidos que ocupan los estratos basales del epitelio matricial1,7,15,51,54,56. Debido a la firmeza de la lámina ungueal suprayacente, los nidos pueden «aplastarse» y ser confluentes, hecho que se observa frecuentemente en las biopsias longitudinales7. Puede notarse un ascenso suprabasal de melanocitos aislados, sin que ello coexista con otros rasgos atípicos1,3,7–9,51,56.
Melanoma unguealEl melanoma ungueal es un tumor poco común, pero de diagnóstico tardío frecuente, lo cual motiva, al menos en parte, su mal pronóstico1,7,34,41,42,50,51,57. De hecho, el nivel de invasión al diagnóstico suele ser significativamente mayor al del melanoma de extensión superficial7,8,34,41,42,57. La variedad histopatológica más habitual del melanoma subungueal es el lentiginoso acral8,16,27,42,58–60. El melanoma de extensión superficial y el nodular son menos recurrentes en la uña7,8,12,23,59,60. En números absolutos, el melanoma ungueal tiene una incidencia similar en las distintas etnias, pero la frecuencia baja de otros tipos de melanoma en los pacientes negros y orientales hace que el porcentaje sea mayor en dichas etnias1,3,8,14,58,61–63.
El melanoma ungueal es excepcional en la edad pediátrica (hasta los 16 años), con una edad mediana de presentación de siete años (intervalo: seis meses a 16 años). Además, en muchos de los 21 casos descritos hasta el momento en la literatura, su diagnóstico es controvertido. En varios de ellos, las fotos histológicas que los ilustran son de mala calidad (o incluso inexistentes) y no permiten una evaluación adecuada de la lesión1,29,36,38,40,45,64–69. De los 21 casos, solo cuatro fueron invasores y dos tuvieron una afectación ganglionar. Ninguno de los casos anteriormente descritos presentó metástasis viscerales ni ocasionó la muerte del paciente. Algunos autores defienden que la mayoría de los casos pediátricos diagnosticados como melanoma in situ carecerían del mismo potencial biológico maligno que las lesiones similares en adultos45,46,56. Por todo ello, incluso ante una clínica atípica, debemos considerar que las lesiones melanocíticas malignas son excepcionales en la infancia1,7,26,40,45,48,51,53.
Algunos de los signos de alarma de las melanoniquias longitudinales atípicas ya han sido descritos. El melanoma ungueal ocurre mayoritariamente en el primer dedo de la mano y en el dedo gordo del pie1,7,8,41, por lo que una melanoniquia longitudinal de nueva aparición en un adulto, en cualquiera de estas localizaciones, se considera sospechosa1,9,14,26,51. El signo de Hutchinson, que consiste en la pigmentación del pliegue ungueal proximal y de la cutícula, es un signo clásico de melanoma subungueal1,9,13,14. Sin embargo, muchas otras entidades pueden producir una pigmentación no patológica de la cutícula, entre las que se incluyen los nevus melanocíticos congénitos, el síndrome de Laugier o las pigmentaciones exógenas por fármacos1,7,14,55. En estos casos, se prefiere hablar de signo de Hutchinson no asociado con melanoma1. Se denomina pseudo-Hutchinson a la aparente pigmentación de la cutícula que se produce por la transparencia de la lámina ungueal subyacente1,14. A pesar de todo, la presencia del signo de Hutchinson en las melanoniquias del adulto con otros rasgos atípicos se considera altamente sospechosa1,70,71. Paralelamente, la pigmentación del hiponiquio (que aparece en las fases más avanzadas) vinculada con una melanoniquia longitudinal se corresponde con la extensión de la lesión a la piel acra y su presencia también es sugestiva de un melanoma subungueal1,7,9. Finalmente, es importante recordar que hasta el 25% de los melanomas ungueales pueden ser amelanóticos, presentándose como una distrofia ungueal o un nódulo amelanótico en fases más avanzadas1,7,34.
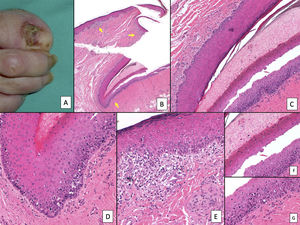
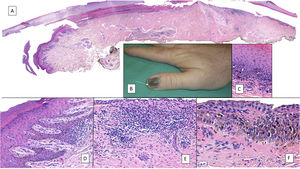
La variedad histopatológica más frecuente de un melanoma subungueal es el melanoma lentiginoso acral y su diagnóstico en fases tempranas puede ser muy difícil3,7,8,44,51,72. Inicialmente, lo único que se aprecia es un aumento del número de melanocitos, que son grandes, de núcleos picnóticos y con rasgos atípicos7,8,33,72. Estos se distribuyen de forma irregular preferentemente en la capa basal de la matriz ungueal o, menos recurrentemente, del lecho7,8,72. Como en el resto de los melanoma acrales, la formación de nidos de melanocitos es tardía dentro de la historia natural del tumor8,9. Los melanocitos neoplásicos son grandes, de núcleos hipercromáticos y con unas dendritas elongadas1,7,8,14,51,72. El ascenso de melanocitos a las capas altas de la matriz, considerado fisiológico en esta localización anatómica, se vuelve mucho más evidente, con una extensión pagetoide desordenada que se puede acompañar de la presencia de melanocitos en la lámina ungueal (fig. 7)7,8,23,51,72. Este es un hallazgo que puede ayudar en el diagnóstico de melanoma y que solo es valorable en biopsias que incluyen la lámina ungueal1,7,11,23. Parece que la presencia de un infiltrado linfocitario en las lesiones melanocíticas subungueales intraepidérmicas es un criterio no desdeñable de malignidad, ya que casi nunca aparece en los nevus melanocíticos subungueales (fig. 8)3,8,9,51. Otros criterios que sugieren un melanoma son la presencia de multinucleación y un aumento significativo de la densidad melanocítica (en contraste con los lentigos subungueales, donde este es solo moderado)33,51. La extensión lentiginosa de melanocitos hacia el eponiquio o el hiponiquio puede constituir, cuando está presente, otra clave diagnóstica útil de melanoma subungueal, ya que es una muestra de su capacidad de invasión de las estructuras circundantes3,72.
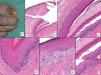
Melanoma subungueal. A) Lesión pigmentada subungueal que genera una importante distrofia ungueal, con destrucción parcial de la lámina. Se observa una evidente pigmentación en el lecho expuesto, en el hiponiquio y en el pliegue ungueal proximal (signo de Hutchinson). B) Panorámica de la biopsia ungueal longitudinal (x4), en la que ya se adivina un aumento de pigmento en la matriz, así como focos dispersos de infiltrado inflamatorio acompañante (flechas). C) A mayor detalle (x100) la matriz ungueal muestra una proliferación lentiginosa de células vacuoladas (melanocitos), con ascenso suprabasal marcado, e incluso, incorporación dentro de la lámina ungueal de algunas células. Esta proliferación lentiginosa afecta también al eponiquio. D) A mayor detalle (x200) se aprecia una proliferación de melanocitos atípicos, con ascenso suprabasal y que ha invadido toda la matriz y se extiende ya hacia el eponiquio. E) Detalle (x200) del pliegue ungueal proximal. La proliferación melanocítica se ha extendido ya hasta la piel proximal al eponiquio. De nuevo, se observa una proliferación lentiginosa de melanocíticos atípicos, con presencia de células atípicas ya en la dermis papilar e infiltrado inflamatorio acompañante. Por tanto, este melanoma es inicialmente invasor. F) Detalle (x200) de ascenso suprabasal de células atípicas, algunas de las cuales se están incluyendo en la lámina ungueal. G) Detalle (x200) de la matriz ungueal: ascensión a capas suprabasales de melanocitos atípicos.
Melanoma subungueal. A) Panorámica que muestra en sentido longitudinal todo el aparato ungueal. Los parches de infiltrado inflamatorio de distribución irregular se aprecian ya en pequeños aumentos en la matriz distal, lecho ungueal y también en el hiponiquio. B) En la imagen clínica, se muestra una melanoniquia irregular y completa de la uña del pulgar derecho. Es de resaltarse la pigmentación puntual del hiponiquio (flecha). C) Detalle de la matriz con melanocitos con atipia evidente (flecha). D) Detalle del hiponiquio con proliferación de melanocitos atípicos en la capa basal e infiltrado linfocitario en la base de la cresta epidérmica. E) Detalle del lecho ungueal con infiltrado linfocitario parcheado por debajo de una capa basal epidérmica con aumento del número de melanocitos. F) Detalle de la matriz ungueal con una proliferación de melanocitos atípicos que apolilla el epitelio ungueal en todo su espesor.
Cuando se hace invasor, el melanoma ungueal muestra unas características similares a las del melanoma invasor de otras localizaciones1,7,9,14.
ConclusionesEl estudio de las lesiones melanocíticas ungueales es complejo y puede suponer un reto tanto para el dermatólogo como para el patólogo. Los datos clínicos y epidemiológicos pueden ser de tanta o más utilidad que los histopatológicos en el diagnóstico. Así, en la edad pediátrica, una lesión melanocítica subungueal atípica es, con una probabilidad elevada, un nevus melanocítico. La presencia del signo de Hutchinson no es sinónimo de melanoma, ya que se ha descrito en muchas entidades benignas, pero su presencia en una melanoniquia del adulto junto con otros rasgos atípicos debe considerarse altamente sospechosa.
Respecto a la histopatología de las lesiones melanocíticas ungueales, conviene destacar que los melanocitos suprabasales son fisiológicos en la matriz. El melanoma subungueal, como el resto de los melanomas acrales, suele mostrar un patrón lentiginoso y solo forma nidos en fases avanzadas. Por último, la interpretación más sencilla de las lesiones melanocíticas subungueales se consigue con una biopsia longitudinal que incluya todo el aparato ungueal.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.