Introducción
La hidrosadenitis supurativa es una enfermedad inflamatoria crónica que cursa clínicamente con brotes de abscesos y nódulos muy dolorosos, malolientes y recurrentes, formación de tractos sinuosos y de tejido cicatricial. Suele afectar principalmente a axilas, ingles, glúteos, regiones perianal e inframamaria (territorios con gran densidad de glándulas apocrinas). Suele aparecer en el transcurso de la pubertad, con un ligero predominio en mujeres. El padecimiento de esta enfermedad se suele asociar a un deterioro en la calidad de vida del paciente, llegando a la frustración, depresión, aislamiento social y dificultad para relacionarse. El tratamiento de esta entidad comprende diversas pautas: generales (reducir peso, dejar de fumar), farmacológicas (antibióticos, isotretinoína, finasteride, prednisona, ciclosporina, etc.), quirúrgicas (incisión y drenaje, cierre por segunda intención, etc.), otras (láser CO2 y radioterapia). En los últimos cinco años se ha demostrado la eficacia del infliximab. Se trata de un anticuerpo monoclonal quimérico que actúa impidiendo la acción pro-inflamatoria del factor de necrosis tumoral alfa (TNF-alfa)1. Ha demostrado su eficacia en diversas entidades dermatológicas, entre las que se incluye la psoriasis2,3. Presentamos tres pacientes con hidrosadenitis supurativa activa de larga evolución y resistente a terapias convencionales tratadas con infliximab.
Pacientes y método
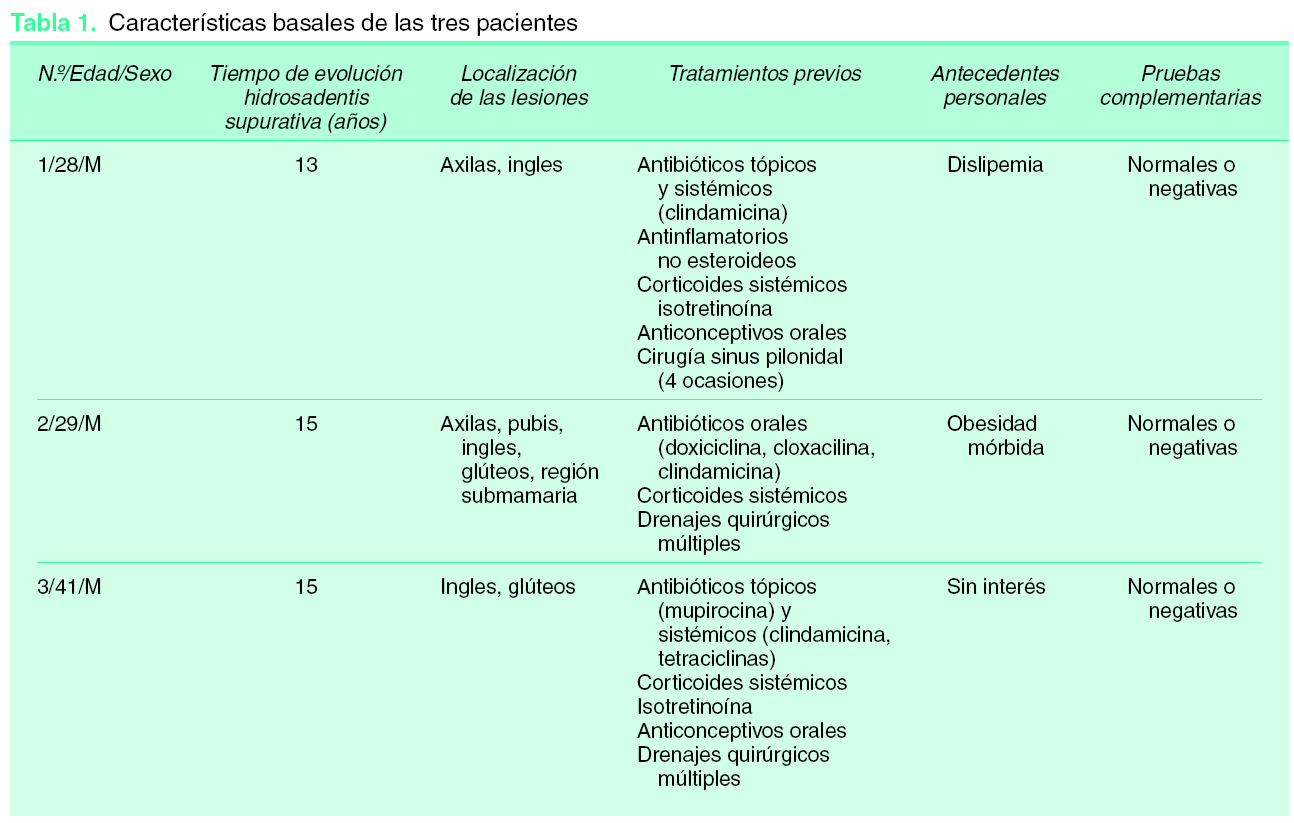
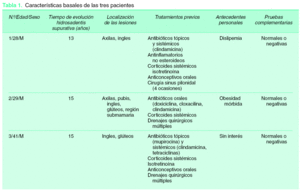
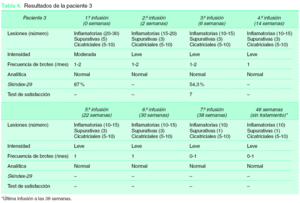
Seleccionamos a tres pacientes con hidrosadenitis supurativa de más de 10 años de evolución, con afectación de al menos dos localizaciones anatómicas y resistente a múltiples tratamientos previos. Sus características basales se exponen en la tabla 1.
Previamente al inicio de tratamiento con infliximab se realizaron una serie de pruebas complementarias que incluían sistemático de sangre, glucosa, urea, creatinina, iones, GOT, GPT, GGT, fosfatasa alcalina, sistemático de orina, anticuerpos antinucleares (ANA), ac anti-ENA, ac. anti-ADNn, serología del virus de la hepatitis B, virus de la hepatitis C, virus de la inmunodeficiencia humana, prueba de la tuberculina y radiografía de tórax.
Se administró infliximab en infusión intravenosa a cada una de las pacientes en dosis de 5 mg/kg/infusión en las semanas 0, 2 y 6 y posteriormente cada 8 semanas. Se mantuvo la misma dosis de tratamiento durante todo el estudio.
Coincidiendo con cada una de las infusiones y para cada una de las pacientes se determinaron los siguientes parámetros:
1.Número, localización y tipo de lesiones (inflamatorias, supurativas, cicatriciales).
2.Intensidad del cuadro (valorada subjetivamente por el médico): leve, moderada, grave.
3.Frecuencia de los brotes (número de brotes al mes).
4.Valoración subjetiva de la gravedad de la enfermedad por el paciente: escala analógica 0-10, siendo 10 el peor estado.
5.Escala analógica de auto-evaluación de calidad de vida global (termómetro Euroqol): 0-100, siendo 100 el mejor estado.
6.Valoración subjetiva del grado de molestias sintomáticas (dolor, prurito, etc.) por el paciente: escala analógica 0-10, siendo 10 el peor estado.
7.Efectos secundarios.
8.Test de calidad de vida dermatológico (Skindex-29): a mayor porcentaje, menor calidad de vida. Es un instrumento de medida de calidad de vida desarrollado por la doctora M.M. Chren en Estados Unidos4, adaptado al español por la doctora M. Jones-Caballero5 y que evalúa tres dimensiones o dominios (emocional, funcional y sintomático) mediante 28 ítems o preguntas.
9.Test de satisfacción global con el tratamiento: escala analógica de 0-10, siendo 10 la máxima satisfacción y 0 la mayor insatisfacción.
La determinación del test de calidad de vida dermatológico sólo fue realizada en la visita basal y coincidiendo con la tercera infusión de infliximab (sexta semana) y la determinación del test de satisfacción dermatológico sólo se llevó a cabo coincidiendo con la tercera infusión de infliximab.
Además, con cada infusión se realizó una determinación analítica que incluía: sistemático de sangre, glucosa, urea, creatinina, iones, GOT, GPT, GGT y fosfatasa alcalina.
Resultados
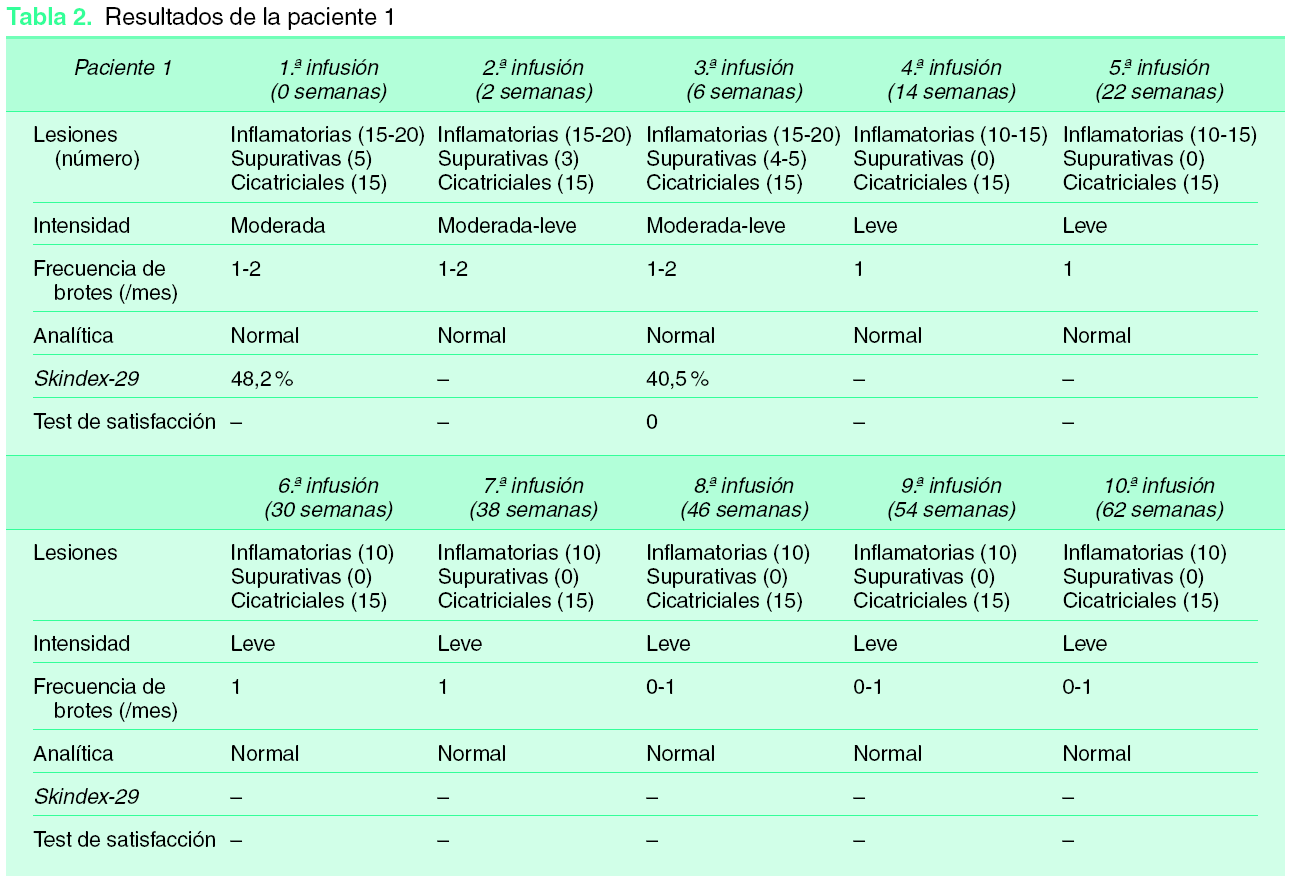
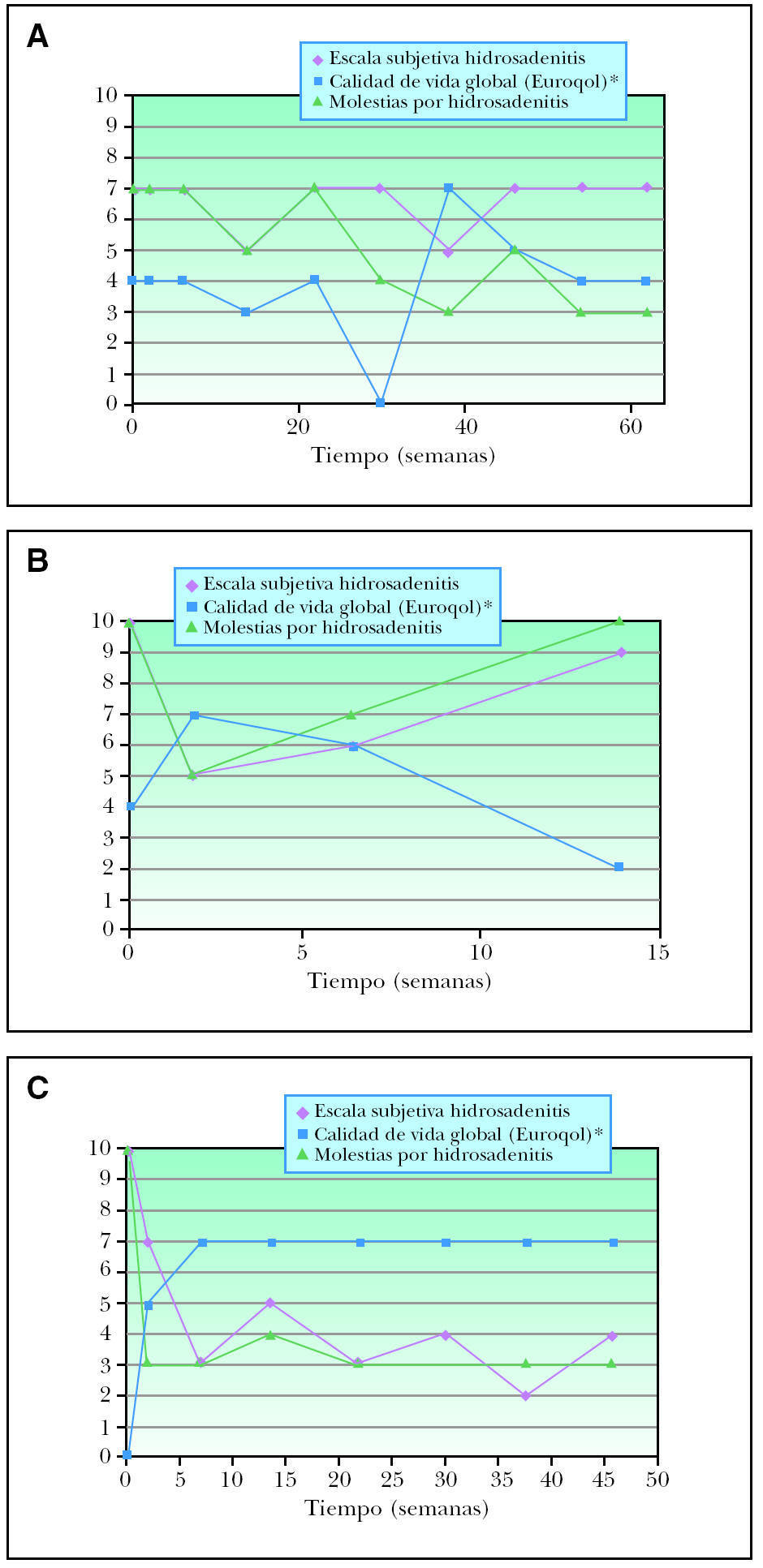
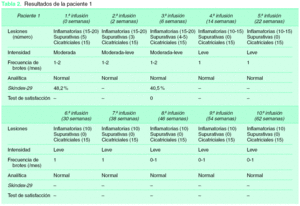
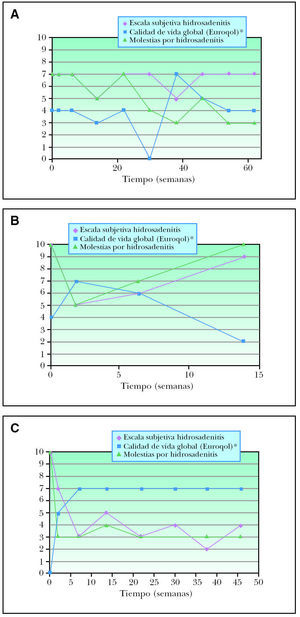
Los resultados para las tres pacientes se encuentran reflejados en las tablas 2, 3 y 4 y en las figuras 1, 2 y 3. Podemos destacar la gran variabilidad que observamos en nuestras pacientes. En primer lugar, en cuanto a la paciente 1, pudimos observar mejoría con disminución en el número de lesiones inflamatorias, supurativas y frecuencia de los brotes y, por tanto, disminución en la intensidad del cuadro. Esta paciente sufrió un brote leve de hidrosadenitis durante las dos últimas infusiones de infliximab, por lo que se interpretó como una disminución de eficacia a lo largo del tiempo. En la figura 2 podemos ver la mejoría clínica de esta paciente con el tratamiento. En cambio, subjetivamente se encontraba de forma similar a como estaba antes del tratamiento (escala subjetiva hidrosadenitis), con la misma calidad de vida (termómetro Euroqol, Skindex-29) pero con menos molestias (escala de molestias por hidrosadenitis). En general, esta paciente no estaba satisfecha con el tratamiento ya que, a pesar de la mejoría objetiva, tenía unas expectativas mayores puestas en él. La paciente presentó ocasionalmente tras las infusiones astenia, cefalea, mareo y náuseas. Las determinaciones analíticas resultaron normales.
Figura 1. Criterios subjetivos de valoración de la hidrosadenitis supurativa. A: paciente 1; B: paciente 2; C: paciente 3. *Escala reducida de forma porcentual a 0-10, ya que la escala original de termómetro euroqol el de 0-100.
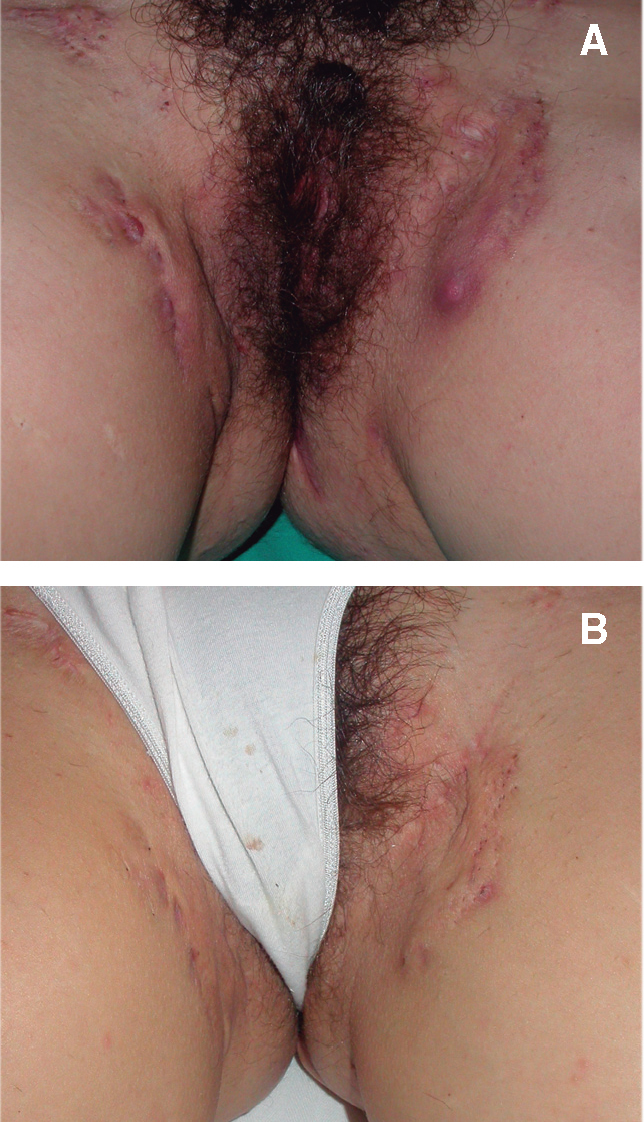
Figura 2. Paciente 1. 2A. Basal. Lesiones en forma de abcesos y nódulos muy inflamatorios y dolorosos a la palpación con trayectos fistulosos ocasionales localizados en ambas ingles. 2B. Tras tratamiento con infliximab durante 54 semanas. Lesiones prácticamente residuales, sin inflamación y no supurativas ni molestas a la palpación.
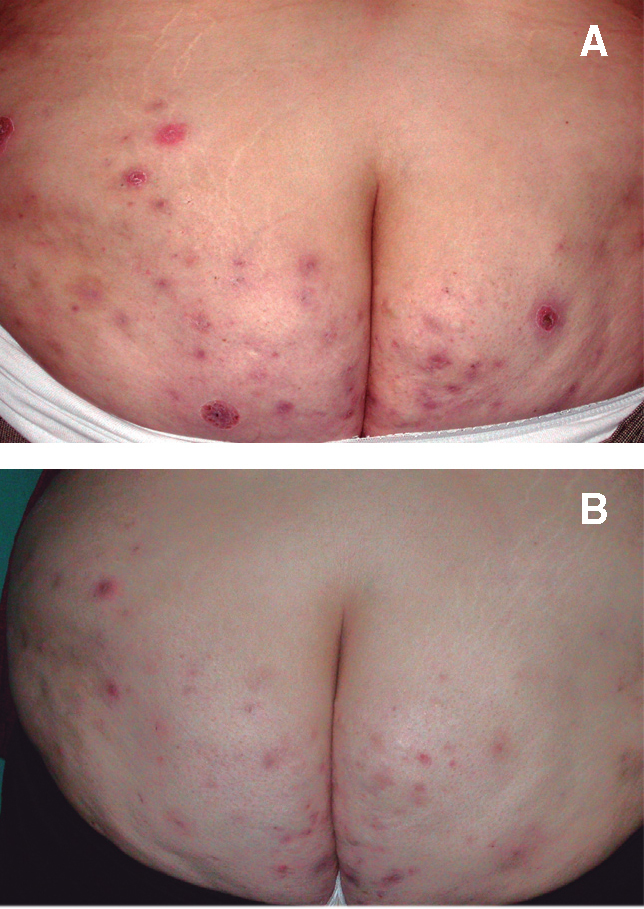
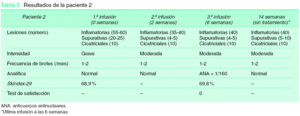
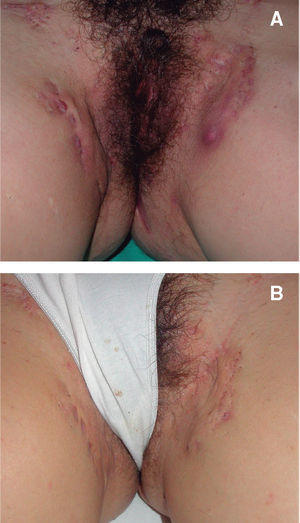
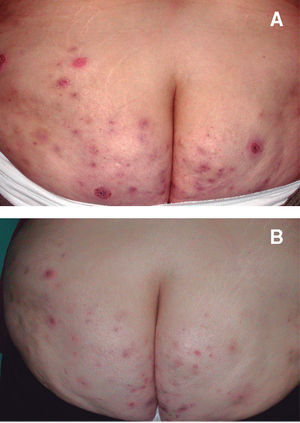
Figura 3. Paciente 2. 3A. Basal. Lesiones nodulares eritematosas inflamatorias de forma diseminada por ambos glúteos. 3B. Después de 14 semanas de tratamiento con infliximab. Aspecto similar de las lesiones, conservando el componente inflamatorio.
La paciente 2 presentaba una enfermedad más grave, con lesiones más generalizadas. Con el tratamiento se consiguió una mejoría objetiva de sus lesiones inflamatorias y de la intensidad del cuadro, aunque en menor medida que en las otras dos pacientes y con igual frecuencia de brotes. En la figura 3 vemos lesiones prácticamente idénticas antes y después del tratamiento. Aproximadamente 2 semanas antes de la cuarta infusión (semana 14) sufrió un brote severo de enfermedad y dado que la paciente iba a ser intervenida en breve de cirugía bariátrica, se decidió de mutuo acuerdo la suspensión del tratamiento. Por todo ello, sus parámetros subjetivos empeoraron, tanto en calidad de vida, valoración de la enfermedad y satisfacción con el tratamiento. Durante el tratamiento empeoró levemente un cuadro de migraña y astenia que presentaba previamente. En una determinación aislada durante la tercera infusión, se observaron unos ANA 1/160 que posteriormente se normalizaron. El resto de los parámetros resultaron normales.
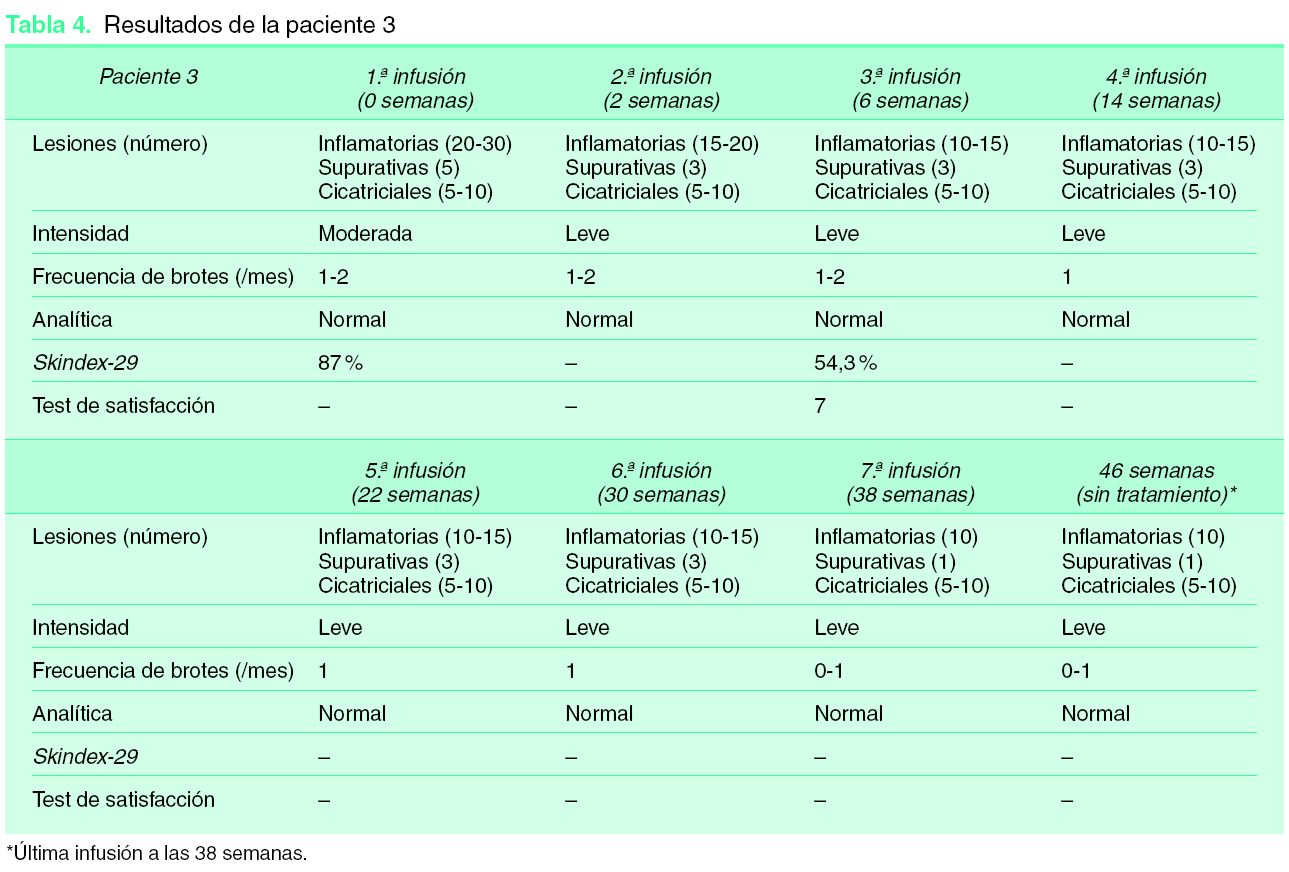
La paciente 3 mejoró con el tratamiento el número de lesiones inflamatorias y supurativas, así como de la intensidad del cuadro y frecuencia de los brotes desde la primera infusión. Esta paciente consideraba que había mejorado notablemente, lo cual se reflejaba en las escalas de valoración subjetiva de hidrosadenitis, de molestias por hidrosadenitis y en las escalas de calidad de vida (Skindex-29, Euroqol). Por todo ello, la paciente se encontraba muy satisfecha con el tratamiento. Durante este sólo presentó una ligera astenia y cefalea ocasionales pero, tras la séptima infusión, presentó un cuadro de artralgias de forma generalizada, principalmente localizadas en tobillos, rodillas, muñecas y dedos de las manos. Consultado con el servicio de Reumatología y hasta descartar su posible implicación con las infusiones de infliximab, se decidió suspender el tratamiento. Las determinaciones analíticas resultaron normales durante todo el tratamiento.
Discusión
El infliximab es un anticuerpo quimérico monoclonal IgG1 que presenta gran afinidad por el TNF-alfa, impidiendo su acción pro-inflamatoria. Actualmente infliximab tiene su indicación aprobada para el tratamiento de la enfermedad de Crohn, artritis reumatoide, espondilitis anquilosante, artritis psoriásica, psoriasis y colitis ulcerosa, pero también ha demostrado su eficacia en otras patologías como la enfermedad injerto contra huésped, enfermedad de Behçet, sarcoidosis, pioderma gangrenoso o hidrosadenitis supurativa. En una revisión de la literatura hemos podido encontrar hasta ocho publicaciones de pacientes con hidrosadenitis supurativa tratada con infliximab6-13. La serie con mayor número de pacientes corresponde a Sullivan TP et al del año 20038 con cinco pacientes, mientras que en el resto se trata de casos individuales. En general, en los artículos publicados, la respuesta al tratamiento es muy buena. Pero, al contrario de lo publicado hasta la actualidad, hemos podido observar en nuestros pacientes que el infliximab no es siempre tan efectivo en el manejo de la hidrosadenitis supurativa. En la literatura ocasionalmente se combina con otros tratamientos o realizan un periodo de seguimiento corto, lo que podría explicar los buenos resultados, en contraposición a los nuestros. Hemos podido constatar cómo, en un gran número de las publicaciones, añaden al tratamiento con infliximab otros inmunosupresores como son azatioprina10-12, corticoides sistémicos8,11, ciclosporina8, metotrexate13 o incluso anticonceptivos orales8 o rifampicina13. En nuestras tres pacientes no realizamos ninguna combinación de tratamientos; sólo fueron tratadas con infliximab, con resultados dispares como hemos podido constatar. También podemos destacar que en las distintas publicaciones, un total de 4 pacientes de los 11 publicados, presenta asociación de su hidrosadenitis supurativa con enfermedad de Crohn. Como ya es bien conocido, la enfermedad de Crohn ofrece muy buena respuesta clínica a infliximab. Por tanto, esa buena respuesta encontrada en la literatura podría deberse en parte a que las lesiones que habían mejorado de forma tan espectacular correspondieran en realidad a lesiones de enfermedad de Crohn. Ninguna de nuestras tres pacientes presentaba asociación de su hidrosadenitis con enfermedad de Crohn.
Por otra parte, el periodo de seguimiento realizado en los pacientes publicados es muy variable, oscilando entre 3 semanas y 2 años, por lo que en los casos de periodo de seguimiento reducido nos impide conocer la respuesta del tratamiento a largo plazo. En nuestra serie, el periodo de seguimiento realizado ha sido de un año como máximo, con una respuesta moderada al tratamiento en el caso de las pacientes 1 y 3.
Por último, en cuanto a los efectos adversos, en la literatura hemos podido constatar como único efecto adverso la aparición de una erupción eritematosa generalizada que se acompañó de disnea durante la segunda infusión de infliximab en el caso publicado por Martínez F et al12. En cuanto a la aparición de un nuevo brote de la enfermedad durante el transcurso del tratamiento, ha sido referido en tres de los cinco pacientes publicados por Sullivan TP et al8. En nuestros casos, sólo una de las pacientes (paciente 3) tuvo posibles efectos secundarios que obligaron a suspender el tratamiento, como fue un cuadro de artralgias generalizadas. Las otras dos pacientes sólo tuvieron reacciones leves a las infusiones (mareo, náuseas, astenia, cefalea). También pudimos observar un nuevo brote de enfermedad que le ocurrió a la paciente 2, quince días antes de la cuarta infusión de infliximab.
A favor de la posibilidad de que TNF-alfa se encuentre implicado en la patogénesis de la hidrosadenitis supurativa8,14,15, disponemos, además, de todas las publicaciones de tratamiento con infliximab, de la publicación de Cusack et al16 en la que seis pacientes con hidrosadenitis supurativa son tratados de forma satisfactoria con etanercept en dosis de 25 mg, 2 veces por semana.
En conclusión, podemos decir que el infliximab constituye un tratamiento moderadamente útil en algunos pacientes y que, posiblemente, el esquema óptimo de dosis y duración del tratamiento están aún por determinar, por lo que estarían justificados posteriores estudios en este sentido.
Conflicto de intereses
Declaramos no tener ningún conflicto de intereses.
Correspondencia:
Javier Pedraz Muñoz.
Servicio de Dermatología.
Hospital Universitario de la Princesa.
Diego de León, 62. 28006 Madrid.
javierpedraz@aedv.es
Aceptado el 8 de febrero de 2007.