La dermatitis atópica (DA) es una enfermedad inflamatoria crónica multifactorial. La dermatitis de contacto alérgica (DCA) y la dermatitis de contacto por proteínas (DCP) son patologías alérgicas que pueden ser comórbidas a la DA y ser causa de algunas de las exacerbaciones. Aunque la DCA tiene una prevalencia similar en pacientes atópicos que en la población general, debemos considerarla una comorbilidad frecuente en la DA por la disrupción de la barrera cutánea. Por ello, se recomienda la realización de pruebas epicutáneas a los pacientes atópicos. Dupilumab podría ser útil para el tratamiento de la DCA mediada por vía Th2 y exacerbar aquellas que ocurren por vía Th1, aunque se precisan más estudios para establecer conclusiones. El mecanismo por el que la exposición a proteínas ambientales produce exacerbaciones en la DA es controvertido, pero es un fenómeno habitual en la práctica clínica diaria. Se recomienda estudio mediante prick test a pacientes con clínica sugestiva y recomendar conductas evitativas ante pacientes sintomáticos y pruebas positivas.
Atopic dermatitis is a chronic inflammatory disease that is multifactorial in nature. Allergic contact dermatitis and protein contact dermatitis are allergic conditions that may occur in the context of atopic dermatitis and be the cause of exacerbations. Although the prevalence of allergic contact dermatitis is similar in atopic patients and the general population, these 2 conditions are frequently associated because atopic inflammation disrupts the skin barrier. Skin tests are therefore recommended in atopic individuals. Dupilumab could be useful for treating allergic contact dermatitis if it is mediated by type 2 helper T cells but could exacerbate inflammation if mediated by TH1 cells: further study is needed before conclusions can be drawn. Although the mechanism by which exposure to environmental proteins exacerbates atopic dermatitis remains under discussion, such exacerbations are routinely seen in clinical practice. Prick testing is recommended in symptomatic atopic dermatitis. When prick-test findings are positive, patients should be advised to avoid the culprit substances.
La dermatitis atópica (DA) es una enfermedad cutánea crónica que combina un defecto de la barrera cutánea con una respuesta inmunológica alterada en individuos genéticamente predispuestos en la que la exposición a agentes ambientales externos juega un papel importante1,2. El deterioro de la barrera cutánea facilita la penetración de agentes microbianos, sustancias irritantes y alérgenos, tanto haptenos como proteínas.
La asociación de DA con dermatitis de contacto irritativa es muy frecuente y comúnmente aceptada. Por otro lado, gran parte de las dermatitis de contacto alérgicas (DCA) se dan en pacientes con dermatitis de contacto irritativa preexistente. Siguiendo esta lógica, los pacientes con DA deberían ser más proclives a presentar DCA. Sin embargo, clásicamente se ha afirmado lo contrario, que la DCA en pacientes atópicos es menos frecuente. Dado que la DCA depende de una respuesta principalmente Th1, se creía que la predominancia de la respuesta Th2 en pacientes atópicos, de alguna manera los «protegía» de la sensibilización a haptenos y explicaba la menor sensibilización3. Sin embargo, en las consultas observamos muchos pacientes con DA que asocian una DCA como complicación.
El papel que juega la alergia a proteínas en los pacientes con determinadas enfermedades atópicas, tales como el asma, la rinitis, la esofagitis eosinofílica y la alergia alimentaria es bien conocido4. También, se acepta la dermatitis de contacto por proteínas (DCP), la cual es más frecuente en pacientes atópicos con eczema crónico de manos y suele ocurrir en ambiente laboral tras exposición a proteínas de origen animal o vegetal. Sin embargo, la implicación de las proteínas en las exacerbaciones de DA o el papel de la inmunoterapia como tratamiento de la DA son temas más controvertidos.
En este artículo pretendemos realizar una actualización que incluye los últimos avances fisiopatogénicos, clínicos y terapéuticos que han permitido comprender mejor esta relación tan compleja entre DA, haptenos y proteínas.
Dermatitis atópica y haptenosLa DA afecta a un 15-20% de niños y un 1-10% de adultos a nivel mundial1,2. Las formas de presentación clínicas son muy variables, pero generalmente incluye el eccema. Las manifestaciones clínicas cambian en función de la edad y puede cursar a brotes o tener una presentación persistente. Está frecuentemente asociada a niveles elevados de inmunoglobulina E (IgE) sérica, historia personal o familiar de reacciones de hipersensibilidad tipo I, rinitis alérgica y asma. El diagnóstico es clínico5 y se han descrito distintos criterios diagnósticos que pueden ser de utilidad en los casos más complicados6.
La DCA es una reacción de hipersensibilidad retardada a alérgenos de contacto, normalmente sustancias de pequeño peso molecular (haptenos) capaces de atravesar la barrera cutánea. Su presentación clínica es en forma de eccema, por lo que la diferenciación entre DA y DCA es difícil7. El estudio histológico no es útil para diferenciarlas, ya que ambos casos presentan un patrón histológico similar. En brotes agudos, encontraremos predominancia de espongiosis y vesiculación, en cambio, en formas crónicas, predominará un patrón de acantosis con hiperqueratosis y menos espongiosis. Las pruebas epicutáneas son el patrón oro para el diagnóstico de DCA8,9 y su realización es imprescindible ante un paciente con eczema crónico en el que pretendemos distinguir si tiene una DA, una DCA o una DA complicada con una DA.
En cuanto a la fisiopatología de la DCA, inicialmente se pensaba que presentaba una polarización inflamatoria predominantemente Th110. Sin embargo, en pacientes sanos se ha observado diversidad en el tipo de polarización inflamatoria tras la sensibilización, con linfocitos efectores productores de citocinas tipo 1 (IFNγ, TNF), tipo 17 (IL-17), tipo 22 (IL-22) y también tipo 2 (IL-4, IL-5, IL-9, IL-13)10. La variabilidad en la polarización parece estar relacionada con el tipo de alérgeno y su capacidad de activar vías específicas de la inmunidad innata, aunque es posible que haya otros factores determinantes que están aún por esclarecer. Por ejemplo, el níquel es un potente inductor de las vías Th1, Th17 y Th22, mientras que las fragancias y las gomas presentan mayor actividad de Th2 con menos participación de Th1 y Th1711.
Prevalencia de DCA en pacientes con DAA pesar de la inicial propuesta relación inversa entre DA y DCA, la coexistencia frecuente de ambas entidades lleva a pensar que podría haber una relación positiva entre ambas entidades. El defecto de función barrera y aumento de pérdida transepidérmica de agua, hace que la DA sea más predisponente a padecer dermatitis de contacto irritativa12, y esta aumenta la probabilidad de penetración de alérgenos13,14.
Clásicamente, se había considerado que los pacientes con DA sufrían menos reacciones de hipersensibilidad tipo IV mediada por linfocitos Th1 debido a su polarización Th2. Esta idea quedaba reforzada por estudios en los se observaba una incapacidad para sensibilizar a los pacientes con DA tras exposiciones repetidas con dinitroclorobenceno (DNCB)15. Recientemente, Newel et al. compararon la respuesta clínica e inmunológica a la sensibilización a DNCB en pacientes sanos y en pacientes atópicos. Observaron que los pacientes sanos tuvieron una mayor respuesta clínica a la exposición a DNCB con una polarización de la respuesta inflamatoria hacia Th1. En cambio, los pacientes con DA presentaron menos respuesta clínica a la exposición a DNCB, con una polarización de la respuesta inflamatoria hacia Th2 y una mayor proporción de IL-10 que los controles16. Es decir, que DNCB sí es capaz de producir sensibilización en los pacientes con DA, pero por vía Th2 y con una expresión clínica de menor intensidad.
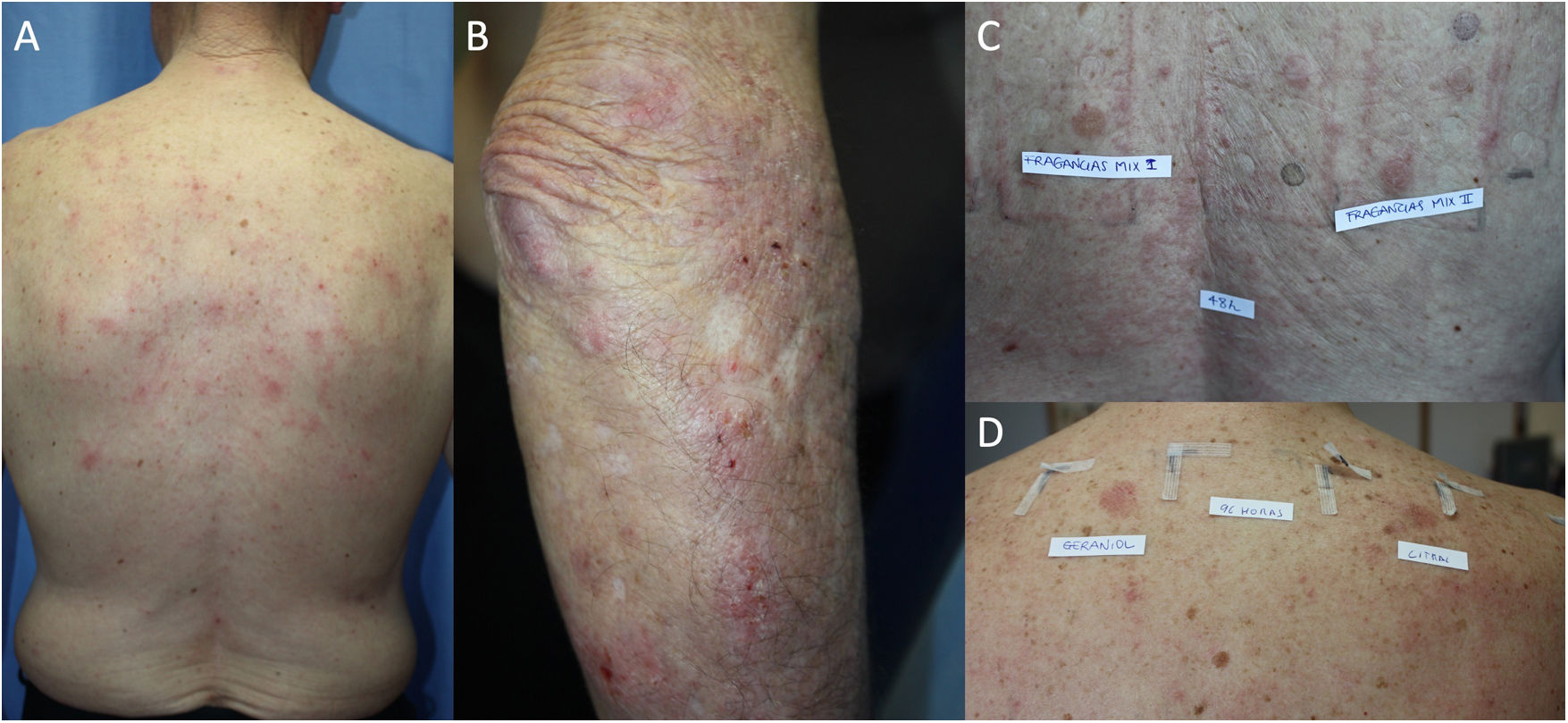
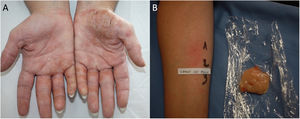
La prevalencia de DCA en pacientes con DA se ha estudiado en diferentes poblaciones mediante estudios retrospectivos que concluyen que los atópicos tienen igual o mayor predisposición a padecer DCA que la población general. En una revisión sistemática se muestra una prevalencia significativamente mayor de DCA a al menos 1 alérgeno en pacientes pediátricos atópicos que en no atópicos (46,6% y 41,7% respectivamente)17. Otra revisión sistemática y metaanálisis que incluye 74 estudios no encontró diferencias estadísticamente significativas en la prevalencia de DCA entre pacientes con y sin DA18. Además, se observó un aumento de la tasa de resultados positivos en pacientes con DA grave, que los autores atribuyen a que son principalmente los pacientes graves los que se derivan a hacer las pruebas18. En otros estudios se ha observado que la prevalencia de DCA es más alta en pacientes con DA leve que DA grave19,20, se postula que este fenómeno es debido a que los pacientes con DA grave tienen un umbral de provocación más alto para la sensibilización por contacto18. Otro dato que apoya la relación positiva entre DA y DCA es que la presencia de polisensibilización (≥3) es más frecuente en pacientes atópicos que en pacientes sanos (28,7% vs. 14,5%, P=0,002)14. La práctica clínica diaria nos demuestra que ambas entidades están asociadas, encontrándonos frecuentemente DA agravadas con DCA (fig. 1).
Varón de 74 años con dermatitis atópica del adulto agravada por alergia de contacto a fragancias. A y B) Eccema en tronco posterior y brazo derecho. C) Resultado de pruebas epicutáneas (batería estándar GEIDAC) a las 48h: mezcla de fragancias I+++y mezcla de fragancias II+++. D) Resultado de pruebas epicutáneas (batería de fragancias) a las 96h: geraniol++, citral++. Tras instaurar conductas evitativas, se logró control parcial de DA.
La realización de pruebas epicutáneas es altamente recomendable en los pacientes con sospecha clínica de DA, en pacientes con una distribución atípica del eccema o un cambio en las áreas afectadas, así como en DA resistentes al tratamiento. En la tabla 1 quedan reflejadas las recomendaciones realizadas por un grupo de expertos en la Reunión de la Sociedad Americana de Dermatitis de Contacto realizada en Denver en 201421.
Cuándo considerar la realización de pruebas epicutáneas en pacientes atópicos
| 1. DA que empeora, cambia de distribución, no responde a tratamiento tópico o emolientes o que rebrota inmediatamente tras suspender el tratamiento tópico |
| 2. Distribución atípica de las lesiones de DA o patrón sugestivo de DCA: patrón predominante en cara y cuello, afectación de manos y pies, afectación predominante de párpados o región perioral/queilitis |
| 3. Eccema de manos resistente a tratamiento en población trabajadora |
| 4. DA de comienzo en el adulto o adolescente sin antecedentes de DA en la infancia |
| 5. Cualquier paciente con DA severa antes de iniciar tratamiento inmunosupresor |
En nuestra opinión, los pacientes con DA, tanto niños como adultos, son candidatos a esta técnica al menos una vez en su vida. Sin embargo, en algunos pacientes con DA grave, o con eccema que afecta espalda y brazos, no se presenta la oportunidad de realizar pruebas epicutáneas en condiciones óptimas. Llevarlas a cabo en contexto de un brote de DA puede disminuir la respuesta o aumentarla (por irritación), dando lugar a resultados falsamente negativos o positivos21. En estos casos, se recomienda hacer las pruebas cuando sea posible, interpretando los resultados con cautela22. En los pacientes bajo tratamiento inmunosupresor también puede verse alterada la lectura de las pruebas, por lo que se recomienda reducir al mínimo posible la dosis de fármaco y realizar lecturas tardías (7-10 días) para evitar falsos negativos21,23.
También debe tenerse en cuenta que los pacientes con DA tienen más tendencia a hacer respuestas irritativas que podrían ser interpretadas como falsos positivos. La oclusión de los parches y el esparadrapo durante 48 h, sobre todo en áreas geográficas cálidas o durante el verano, suele provocar irritación y foliculitis. Además, la concentración utilizada en las baterías estandarizadas para determinados alérgenos, especialmente a metales (cromo y cobalto), fragancias, formaldehido y lanolina, puede provocar irritación en las pieles más sensibles21.
Por otro lado, la respuesta alérgica en los pacientes con DA puede ser más débil y menos duradera. El aumento progresivo de la respuesta a lo largo de los días en las reacciones alérgicas (patrón in crescendo) no está tan presente en pacientes atópicos, por lo que hay que observar detenidamente los resultados positivos, incluso de intensidad débil, en la primera lectura21. Esta respuesta inflamatoria alterada o atenuada en la DA, se cree que puede estar relacionada con diferencias en las vías de activación del sistema inmune innato16. Se ha observado que pacientes con DA y DCA tienen una menor cantidad de células dendríticas (CD1a+, CD1C+) y células de Langerhans (langherina+), lo que podría respaldar la teoría de que los pacientes atópicos tienen una deficiente presentación de antígenos por una falta de células dendríticas en el contexto de una entrada masiva de alérgenos de forma percutánea24. Otra explicación para esta respuesta alterada es la expresión diferencial de las vías implicadas en la sensibilización alérgica. El aumento de las vías inflamatorias Th17 y Th2 en la DA podría resultar en la atenuación de la vía Th1, posiblemente resultando en una disminución de la intensidad de la respuesta alérgica24. Además, la demostración de un aumento de los niveles de quimiocinas antiinflamatorias (como IL-10) también puede tener un papel en esta respuesta alterada24.
En resumen, se recomienda realizar pruebas epicutáneas en los pacientes con DA, pero la elección del momento y la interpretación de las mismas puede ser complicada. En la tabla 2 quedan reflejadas las consideraciones a tener en cuenta cuando realizamos pruebas epicutáneas a estos pacientes21.
Interpretación de las pruebas epicutáneas en pacientes con DA
| 1. Las reacciones irritativas son frecuentes, sobre todo a metales (cromo y cobalto), fragancias, formaldehido y lanolina |
| 2. Productos propios «rinse-off» pueden causar reacciones irritativas, especialmente si no se diluyen adecuadamente |
| 3. El patrón in crescendo entre lecturas no está tan presente en pacientes con DA |
| 4. Aplicar los parches en el transcurso de un brote de DA puede disminuir la respuesta dando lugar a falsos negativos. También hay más riesgo de inducir un aumento de irritación cutánea |
| 5. El tratamiento inmunosupresor puede inducir falsos negativos, por lo que deberían realizarse las pruebas sin el fármaco o a la dosis mínima posible. Si no se puede suspender el fármaco, se recomienda repetir las pruebas más adelante cuando se consiga controlar la enfermedad y suspenderlo |
| 6. Mayor susceptibilidad a los cambios climáticos, en épocas de más calor pueden aumentar las respuestas irritativas |
La mayoría de los alérgenos implicados en la DCA en pacientes atópicos, tanto en niños como en adultos, son sustancias presentes en la medicación tópica que utilizan o en sus productos de higiene o cosméticos44, muchos de ellos etiquetados como hipoalergénicos18,25,26. Los factores de riesgo para desarrollar sensibilización a productos propios son: inicio de DA antes de los 6 meses, IgE elevada y presentar una DA moderada-grave26.
En múltiples estudios se ha identificado una prevalencia aumentada de sensibilización a alérgenos como fragancias, conservantes, plantas, antisépticos, corticoides, antibióticos tópicos, surfactantes, entre otros, en comparación con la población sana26–36. En la tablas 3 y 4 se encuentran representados los alérgenos más frecuentes en adultos y niños con DA26,35,36. El sulfato de níquel es el alérgeno más frecuente en la DA al igual que en la población general, aunque existen estudios que han observado tasas se sensibilización más bajas, más altas o similares que en la población sana18,35,37. En múltiples estudios se ha encontrado un aumento de sensibilización a las lactonas sesquiterpénicas en atópicos pero en la mayoría de las ocasiones es de relevancia desconocida35.
Alérgenos más frecuentes en pacientes adultos con DA
| Sulfato de níquel |
| Mezcla de fragancias I |
| Metilisotiazolinona y metilcloroisotiazolinona |
| Bálsamo del Perú |
| Tiomersal |
| Cloruro de cobalto |
| Dicromato potásico |
| Etilenediamina |
| Parafenilenediamina |
| Formaldehido |
| Sulfato de neomicima |
| Colofonia |
| Mezcla de tiuram |
| Budesonida |
| Mezcla gomas negras |
| Benzocaína |
| 4-tert-Butylphenol |
| Mezcla parabenos |
| Quaternium 15 |
| Mezcla mercapto |
Alérgenos más frecuentes en pacientes pediátricos con DA
| Sulfato de níquel |
| Mezcla de fragancias I |
| Bálsamo del Perú |
| Bacitracina |
| Formaldehido |
| Betaína de cocamidopropyl |
| Propilenglicol |
| Alcoholes de la lana |
| Lanolina |
| Bronopol |
| Sulfato de neomicina |
| Quaternium 15 |
| Colofonia |
| Tixocortil-12-pivalato |
| Metilisotiazolinona y metilcloroisotiazolinona |
| Cobalto |
| Mezcla de fragancias II |
| Dicromato potásico |
| Compositae mix |
| Partenolido |
Se ha observado, que los pacientes atópicos tienen menos tasa de sensibilización a alérgenos potentes (metilcloroisotiazolinona, cobalto y dicromato potásico)27 y en contrapartida tienen más tasa de sensibilización a alérgenos débiles (propilenglicol, eugenol, vainilla, parabenos...) que la población general28. Se cree que los alérgenos débiles son capaces de producir más sensibilización en DA por la disrupción de la barrera cutánea, que favorece la penetración y el desbalance inmunológico28. Los alérgenos potentes son capaces de sensibilizar a pacientes sanos por vía Th1, pero el desbalance inmunológico de la DA parece que induce una «hiporreactividad» con consecuente menor respuesta24,28. Una mayor sensibilización a haptenos por vía Th2 (tales como fragancias y gomas) que por vía Th1 también podría explicar estas diferencias de sensibilización en DA.
Se recomienda incluir en las pruebas epicutáneas, como mínimo, la batería estándar española o europea (TRUE test® puede ser insuficiente) y los productos propios del paciente, tanto de uso personal como tratamientos tópicos21. No es recomendable parchear los productos que se enjuagan (rinse-off) por la irritación que pueden producir5.
Dupilumab: eficacia en el tratamiento de la DCA e influencia sobre las pruebas epicutáneasRecientemente se ha aprobado dupilumab para el tratamiento de la DA moderada a grave38. También se ha empleado para el tratamiento de la DCA con resultados dispares. Una reciente revisión sistemática recoge 47 pacientes con DCA tratada con dupilumab, encontrando 9 respuestas completas, 31 respuestas parciales, 4 ausencias de respuesta y 3 empeoramientos39. Se ha postulado que podría ser útil para el tratamiento de la DCA a alérgenos mediados vía Th2, ya que se han observado mejorías clínicas de DCA a fragancias, gomas, y colorantes textiles, entre otros39–41. En cambio, dupilumab podría empeorar aquellas DCA producidas por alérgenos que actúan vía Th1, habiendo casos descritos con metilisotiazolinona, liberadores de formaldehido y fenilguanidinas42. Otros estudios, no han encontrado diferencias estadísticamente significativas a la respuesta a dupilumab en pacientes atópicos con y sin DCA43,44.
En resumen, existe una importante variabilidad en la respuesta al tratamiento de la DCA con dupilumab, con unos resultados independientes del alérgeno y de la vía Th supuestamente implicada. La variabilidad de resultados hallada en la clínica no puede explicarse solamente por los distintos patrones de inflamación generados por los diferentes alérgenos como han sostenido algunos autores45. La división categórica estricta de los alérgenos en sensibilizantes vía Th1 o Th2 podría ser inadecuada. Es posible que, en la polarización hacia una vía, además de las características del alérgeno, influyan factores del paciente, como denota la mayor tendencia a hacer reacciones Th2-mediadas en pacientes atópicos. Quizá el ambiente inmunológico en el que se produce la sensibilización (dependiendo de si el paciente se encuentra durante un brote de DA o no) pueda influir en la polarización hacia Th1 o Th2. Además, la mejoría de la barrera cutánea propiciada por dupilumab podría mejorar la clínica independientemente de la vía implicada. Dupilumab podría plantearse como opción terapéutica en casos en los que evitar el alérgeno sea imposible y se trate de una dermatitis grave46. Además, debe considerarse en pacientes atópicos con DCA concomitante por su efecto en la enfermedad de base46.
Por otro lado, también se está estudiando si dupilumab podría influir en los resultados de las pruebas epicutáneas. En un estudio se analizaron los resultados de pruebas epicutáneas antes, durante y después del tratamiento con dupilumab. Se observó que de los 144 alérgenos parcheados antes y después, 17 perdieron positividad tras el tratamiento, entre ellos, fragancias y bálsamo del Perú que son alérgenos con una conocida polarización Th239. Por contrapartida, un reciente estudio retrospectivo en el que se realizaron epicutáneas antes y después del tratamiento, obtuvo una persistencia de resultados positivos en el 51,2% (64/125) y una pérdida de resultados positivos solamente en el 10,4% (13/125)43. Entre los alérgenos con pérdida de positividad, se encontraban emulsificantes, fragancias, metales, fotoprotectores, medicamentos, resinas y conservantes. El 73,1% de los resultados positivos a fragancias antes del tratamiento se mantuvieron en las pruebas postratamiento. Los autores concluyeron que dupilumab no parece tener un impacto importante en los resultados de las pruebas43. Sin embargo, obtuvieron resultados no concluyentes en el 38,4% de los casos, por lo que, en nuestra opinión, sigue en duda su capacidad de modificación de los resultados de las pruebas epicutáneas.
Dermatitis atópica y proteínasLas proteínas son un reconocido alérgeno en las reacciones de hipersensibilidad tipo I, cuyas manifestaciones cutáneas son los habones y/o el angioedema. Clásicamente no se relacionaban con las lesiones de eccema, pues por su elevado peso molecular no se creía que fueran capaces de atravesar la barrera cutánea y provocar una respuesta tipo IV. Hace unas décadas, se describió la DCP, una entidad que asocia reacción de hipersensibilidad tipo I y tipo IV y que abre el camino para poder entender cómo las proteínas alimentarias o ambientales juegan un papel en determinadas exacerbaciones de la DA, tanto en niños como en adultos.
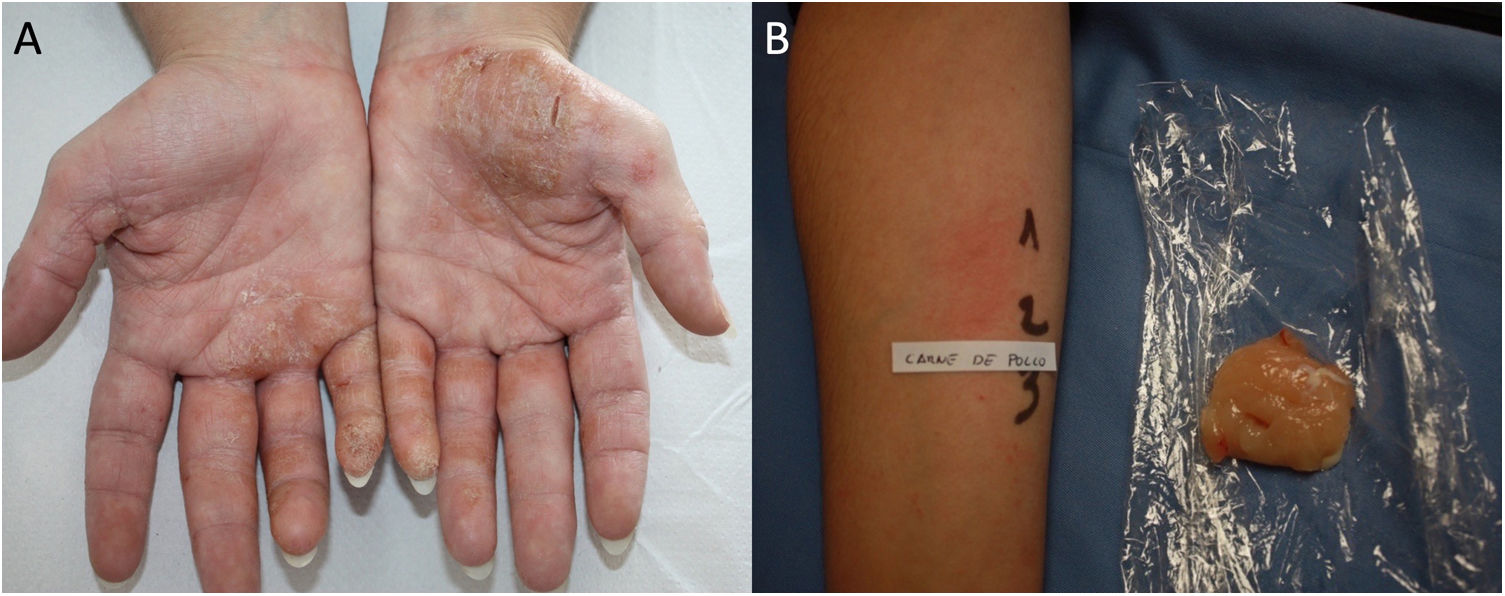
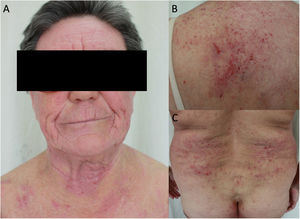
Dermatitis de contacto por proteínasLa DCP es una reacción de hipersensibilidad tipo I y IV. Los pacientes presentan prurito inmediato tras la exposición al alérgeno con posterior desarrollo de lesiones eccematosas. Pueden manifestar lesiones tipo urticaria de contacto y después desarrollar las lesiones eccematosas en la misma localización47. La localización más habitual es en manos y antebrazos, suelen tener un eccema crónico de manos y son, generalmente, pacientes atópicos (fig. 2). La mayoría de los casos son de origen profesional y en contacto con proteínas vegetales o animales (manipuladores de alimentos). Es importante descartar que no tengan sintomatología oral al entrar en contacto con esos alimentos (síndrome de alergia oral) pues podrían sufrir una anafilaxia tras su ingesta48.
Para el diagnóstico de la DCP es necesaria la realización de prick test. La metodología consiste en aplicar una gota de cada alérgeno a estudio en el antebrazo, para posteriormente hacer una punción en la piel con una lanceta. Debe usarse siempre un control positivo con histamina (que debe producir un habón de≥3mm) y un control negativo con suero. La lectura se realiza a los 15 min y una reacción debe considerarse positiva si se obtiene un habón de≥3mm49. La utilización de extractos de alimentos ya preparados suele dar falsos negativos por lo que es recomendable la realización de prick-prick con alimentos frescos22. Es recomendable la realización de lecturas tardías del prick al tratarse de una reacción de hipersensibilidad tipo I y IV.
En nuestra opinión, el término DCP podría emplearse también para las exacerbaciones generalizadas o con patrón aerotransportado de la DA en aquellos pacientes sensibilizados a proteínas (con prick test positivo).
Proteínas y exacerbaciones de DAEn los pacientes con DA, las proteínas son capaces de penetrar en la epidermis a pesar de su gran peso molecular debido al defecto de la función barrera, donde interaccionan con células inflamatorias locales para desencadenar una reacción de hipersensibilidad tipo I y tipo IV50. Las células presentadoras de antígenos, tanto epidérmicas como dérmicas presentan en superficie una alta densidad receptor de la fracción constante de la IgE (FcɛRI) y tras captar las proteínas, migran a los ganglios linfáticos donde inducen respuesta linfocitaria específica Th2 y B, con producción de IgE específica51. Esto explicaría ambas reacciones de hipersensibilidad, y la coexistencia de lesiones urticariformes y eccematosas.
En los pacientes atópicos pediátricos, los alérgenos más frecuentes son los alimentos. Se sensibilizan en los primeros meses de vida durante su introducción en la dieta al penetrar de forma percutánea en la piel en contexto de eccemas periorales52. Por ello es importante instruir, tanto a pediatras como a padres, para tratar el eccema perioral de forma adecuada hasta control completo con corticoides tópicos. Hasta un tercio de niños atópicos reportan empeoramiento de la dermatitis asociado a exposición a alimentos, los más frecuentes son el huevo, la leche y el trigo53. Debe sospecharse DCP a alimentos en pacientes pediátricos con brotes generalizadas o graves de DA desencadenados con exposición alimentaria, por lo que es imprescindible una buena anamnesis con los padres.
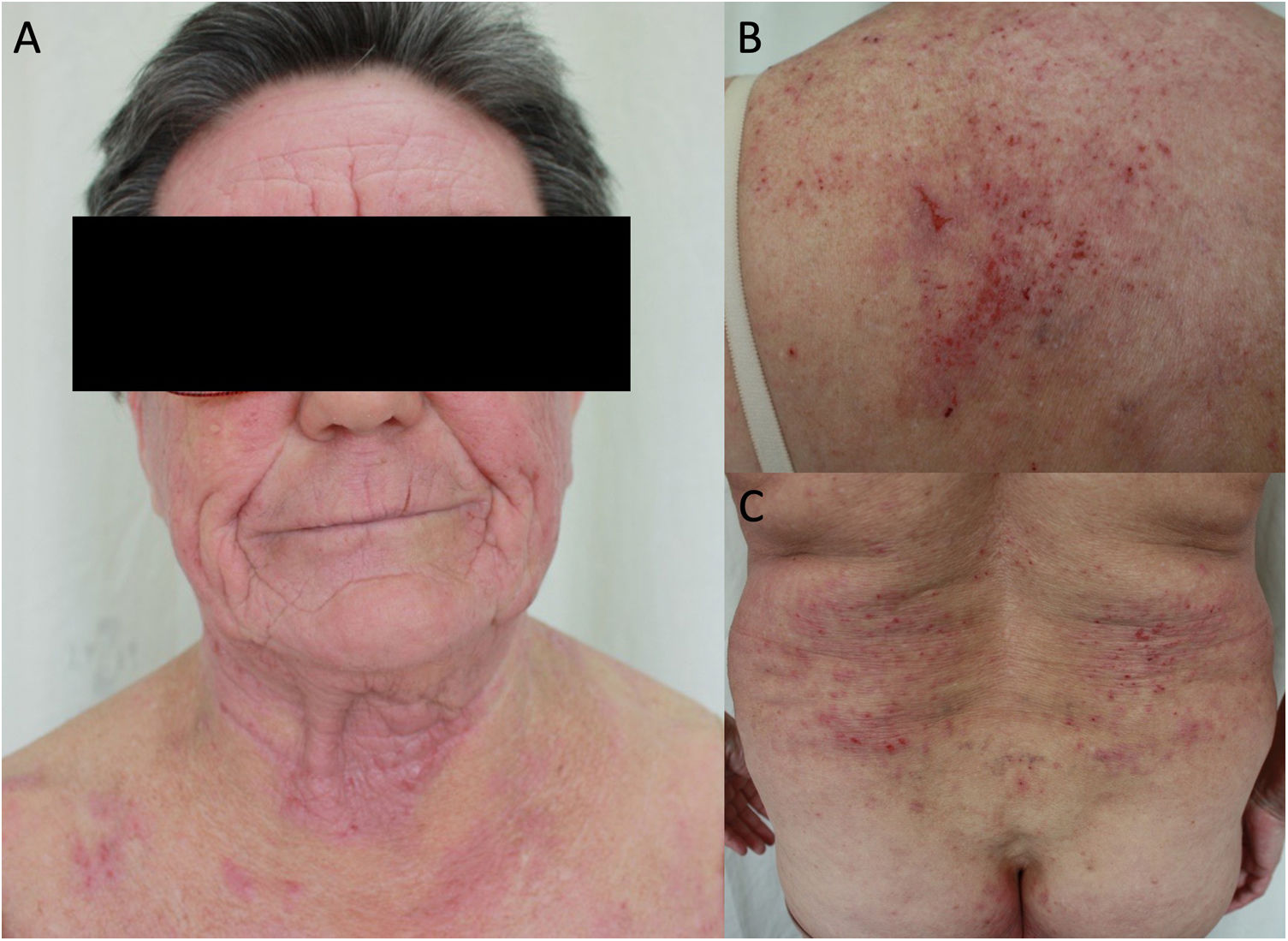
Los aeroalérgenos son más frecuentes en adultos, siendo los más habituales los ácaros del polvo, caspa animal, pólenes y cucarachas50. Estos también son capaces de empeorar la DA a través de su capacidad proteolítica inherente que empeora la alteración de la función barrera (actúan también como irritantes o pseudoalérgenos)50. Debe sospecharse DCP en atópicos adultos que presenten eccemas con un patrón aerotransportado, en áreas como la cara (con afectación de párpados), cuello (con afectación de la región retroauricular) y zonas expuestas de extremidades superiores y flexuras (axilas y fosa antecubital) (fig. 3)22. En adultos, la DCP a alimentos es menos frecuente, aunque algunos alérgenos como la zanahoria, avellanas y apio tienen reacciones cruzadas con aeroalérgenos y pueden desencadenar brotes en pacientes sensibilizados al polen22.
Para el diagnóstico de DCP en pacientes atópicos, se recomienda realizar prick test ante sospecha clínica y no usarlo de forma indiscriminada, estableciendo siempre una relevancia clínica, pues muchos pacientes están sensibilizados a aeroalérgenos y alimentos: sensibilización no es sinónimo de implicación22. El atopy patch test se planteó inicialmente como método diagnósticos útil pero actualmente no forma parte de las recomendaciones en las guías de práctica clínica21,22. Consiste en aplicar de forma epicutánea proteínas como alimentos, ácaros del polvo, caspa animal, o polen seguido de la evaluación de la respuesta eccematosa entre las 24 y 72 h. Es una prueba que no se ha conseguido estandarizar y ofrece dificultades para distinguir entre resultado irritativo y alérgico (especialmente a ácaros del polvo). La determinación de IgE específica en suero también puede ser útil aunque un resultado negativo no excluye el diagnóstico48.
En cuanto al tratamiento, se ha observado que la evitación del alérgeno puede mejorar la clínica, pero no es suficiente para detener las exacerbaciones de DA ya que se trata de una enfermedad multifactorial54. De hecho, solo la mitad de los adultos sensibilizados a 1 o más alimentos experimentan mejoría clínica al eliminarlo de la dieta22. En niños, la eliminación del alimento que causa los brotes de DA puede inducir una mejoría clínica de las lesiones cutáneas pero puede inducir el desarrollo de una alergia IgE mediada55.
La inmunoterapia específica está indicada en el tratamiento de asma alérgica, rinoconjuntivitis alérgica y alergia a veneno de himenópteros. Actualmente no está indicada para el tratamiento de la DA. No se han obtenido resultados satisfactorios para evitar los brotes de DA en pacientes sensibilizados a proteínas22,54, probablemente porque se ha instaurado con el objetivo de evitar todas las exacerbaciones que presenta el paciente, y no únicamente obtener una mejoría parcial de la DA. El principal alérgeno estudiado son los ácaros del polvo56. Los resultados de diferentes ensayos y metaanálisis son muy dispares, concluyendo que la inmunoterapia no tiene suficiente evidencia científica como para recomendarse de forma general para el tratamiento de pacientes atópicos57. Sin embargo, las guías europeas de DA recomiendan considerar la inmunoterapia en pacientes seleccionados: con sensibilización demostrada (prick test o IgE específica en suero) y con brotes de DA desencadenados por exposición al alérgeno (principalmente ácaros del polvo, polen de abedul o gramíneas)57–59. A diferencia de las guías europeas, las americanas no recomiendan la inmunoterapia para el tratamiento de la DA60. Se recomienda esperar a lograr un buen control de la DA para iniciarla. No debería indicarse si el paciente está recibiendo tratamiento inmunosupresor, aunque parece que podría introducirse si el paciente recibe tratamiento con dupilumab o tralokinumab61.
Omalizumab está actualmente aprobado para el tratamiento del asma alérgico, la rinosinusitis crónica con pólipos nasales y la urticaria crónica espontánea62. Su uso en dermatitis atópica no ha demostrado resultados suficientemente satisfactorios63. Sin embargo, actualmente está en vías de investigación su uso para el tratamiento de alergias alimentarias, en las que parece que es eficaz tanto en monoterapia como en combinación con la inmunoterapia oral62,64. Ligelizumab también está en vías de estudio para el tratamiento de la alergia alimentaria65.
ConclusiónLa DA es una enfermedad compleja y multifactorial. La DCA y la DCP son patologías alérgicas que pueden ser comórbidas a la DA y ser causa de algunas de las exacerbaciones. Es importante conocer ambas entidades y el procedimiento diagnóstico para poder evitar los alérgenos desencadenantes y lograr un mejor control de la enfermedad de base. Los nuevos tratamientos para DA dirigidos contra dianas específicas de la vía de Th2 pueden ser útiles para tratar determinadas DCA asociadas, pero también podrían modificar los resultados de las pruebas diagnósticas.
FinanciaciónEl presente artículo no ha recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.