INTRODUCCION
Uno de los principales problemas al que se enfrenta la farmacología clínica es la gran variabilidad interindividual que existe en la respuesta a los medicamentos, tanto en lo referente a la efectividad como a la toxicidad, de forma que diferentes pacientes responden de forma dispar a la misma medicación. Esto es debido a factores genéticos y no genéticos. La expresión de los genes, más que la propia dotación génica, y los polimorfismos existentes en ellos es lo que explica y condiciona, al menos en parte, estas diferencias. La investigación de variables que nos permitan determinar, previamente al inicio de tratamiento con un agente farmacológico, el grado de respuesta debe de ser un objetivo prioritario en la medicina actual. La farmacogenética ha abierto un nuevo horizonte en esta dirección y el dermatólogo no debería ser ajeno a esta situación. A continuación se expone la situación actual de la farmacogenética y las bases en las que se asienta su conocimiento.
GENOMA Y MEDICINA. PROYECTO GENOMA HUMANO
Watson y Crick, hace algo más de 50 años, publicaron la estructura de la molécula de ADN 1. Este hecho supuso un hito en la historia del conocimiento y marcó el inicio de un proceso de descubrimientos en los campos de la Biología y la Medicina. En estos años, en los laboratorios de Biología Molecular y Celular se aprendió a identificar, aislar y manejar los genes que contienen la información para las más variadas estructuras y funciones celulares. También se hicieron grandes avances en asociar alteraciones de genes con el desarrollo de enfermedades, es decir, en la comprensión de las bases moleculares de las enfermedades 2. El punto de partida de la Biomedicina en el siglo xxi es el acceso a la secuencia completa del genoma humano 3.
El genoma es el conjunto de material genético de un organismo (contiene genes y regiones intergénicas) y está constituido por una secuencia de unos tres mil millones de nucleótidos presentes en el ADN. Un gen es un segmento de la secuencia de ADN que codifica un producto, habitualmente una proteína, de función bien definida y que se encuentra localizado en un cromosoma concreto. Los ácidos nucleicos son las moléculas constitutivas del ADN y ARN. La molécula de ácidos nucleicos condiciona la síntesis de proteínas; es, sencillamente, su precursor natural imprescindible. El genoma ha sido un terreno inexplorado hasta hace pocos años. En la década de 1980 los científicos comenzaron a identificar genes cuyas variantes originaban enfermedades, pero ello requería años de trabajo «cartografiando» al detalle las regiones que contenían el gen buscado, para encontrar finalmente al responsable directo de la enfermedad. Algunos investigadores trataron de imaginar formas más sistemáticas de examinar el genoma, y en 1990 una iniciativa de los Institutos Nacionales de la Salud y el Ministerio de Energía de EE.UU. marcó el inicio del Proyecto del Genoma Humano. Este proyecto internacional liderado por EE.UU. se marcó como objetivos 4: a) identificar todos los genes del ADN humano; b) determinar las secuencias de los 3 billones de pares de bases del ADN humano, y c) almacenar esta información en bases de datos.
Con anterioridad a la secuenciación del genoma humano se estimaron unos 100.000 genes, después de la secuenciación este número se redujo a 40.000 genes y actualmente después del refinamiento de la secuencia dicho número se considera alrededor de los 30.000 o menos (número bastante inferior al esperado). Este reducido número es más aparente que real, ya que muchos genes se expresan en diferentes formas, por lo que en lugar de hablar de un gen único, esta misma unidad transcripcional puede dar lugar a 4-5 formas distintas, y entonces tendríamos que hablar de 100.000-150.000 genes funcionales. Además, si consideramos que el producto del gen, la proteína, sufre cambios después de su síntesis, el número de proteínas funcionales en las células puede sobrepasar el millón.
El 14 de abril de 2003 se anunció, por parte del International Genome Project (http://www.genome.gov/), que se había alcanzado el último de los objetivos que era la secuenciación completa del genoma humano y en octubre de 2004 se presentaron los datos al 99 % 5. Todo ello nos ha permitido descubrir los siguientes hallazgos:
1. El genoma es muy semejante entre los diferentes animales.
2. La secuencia de ADN entre dos seres humanos es idéntica en el 99,9 %. La mayor parte de las diferencias se encuentran en regiones que no codifican a proteínas. Es ese 0,1 % de diversidad genética el responsable de la mayoría de las diferencias que existen entre los individuos. Sin embargo, muy pequeñas diferencias en la secuencia del ADN pueden dar lugar a grandes diferencias en la expresión génica. El mismo gen puede tener una expresión muy marcada en un individuo y ser mínimamente o ni siquiera ser expresado en otro.
3. Cada célula de nuestro organismo contiene la misma secuencia de ADN. A pesar de ello, cada gen no se expresa en cada una de las células. Algunos genes básicos se expresan en casi todas o todas las células (por ejemplo, aquellos que codifican la obtención de energía), pero otros sólo se expresan en células muy especializadas (por ejemplo, genes que codifican la síntesis de melanina sólo se expresan en los melanocitos).
4. A pesar de que los genes representan la principal función biológica del genoma, sólo comprenden una fracción pequeña de su extensión. El genoma contiene grandes desiertos. De hecho, sólo el 30 % del genoma contiene genes y la suma de todas las secuencias codificantes de proteína ocupa únicamente el 1,5 % del genoma (existen genes codificantes de proteína y no codificantes).
5. Que se haya completado la secuenciación de nuestro genoma no significa que se conozca su funcionamiento. Aún se ignora la función de la mayoría de los genes.
6. En la actualidad contamos con una identificación de la secuencia del genoma humano muy próxima al 100 %, con un grado de verosimilitud superior al 99 %. Tenemos una base de datos que reúne los más de seis millones de polimorfismos de nucleótidos únicos que, probablemente, sigan aumentando.
Sin duda, la secuenciación del genoma humano es un gran logro que facilitará enormemente el desarrollo de la Biomedicina. Sin embargo, lo más difícil está todavía por hacer: encontrar la función de estos genes (genómica funcional), su asociación con las enfermedades y cómo podemos utilizarlos para prevenir o curar éstas. Éstos son los objetivos de la llamada «era post-genómica». En este sentido, se acercan cambios y nuevas posibilidades. Por todo ello, se dice que estamos saliendo de una era en la que se habla en idioma de dos letras (el 0 y 1 del lenguaje digital de los ordenadores) y entrando en otro de cuatro letras (los cuatro nucleótidos con las bases adenina [A], timina [T], guanina [G] y citosina [C] del ADN).
Estos cambios serán posibles porque al amparo del Proyecto Genoma Humano se están desarrollando una serie de tecnologías, denominadas de alto rendimiento, que por primera vez nos permiten analizar el comportamiento de todos los genes (técnicas genómicas), las proteínas y su relación con los genes (técnicas proteínicas) o metabolitos (técnicas metabolómicas) de una célula o tejido en respuesta a una enfermedad o tratamiento. La ingente cantidad de datos que el uso de estas tecnologías está generando (que constituye el proceso de acumulación de información más rápido en la historia de la humanidad, terabytes) ha requerido el desarrollo de una nueva disciplina, la Bioinformática, para ser capaces de almacenarlos y explotarlos adecuadamente.
La investigación y desarrollo de esta área de la Medicina permitirá avanzar en: a) diagnóstico molecular y pronóstico de las enfermedades; b) desarrollo de fármacos; c) terapia celular e ingeniería genética de tejidos; d) terapia génica y vacunas génicas, y e) individualización de tratamientos (se podrá predecir quién se puede beneficiar de un medicamento y evitar su administración a quién sólo le provoque efectos secundarios indeseables 6,7. Permite identificar los genes responsables de las diferentes respuestas al tratamiento y así desarrollar una medicina personalizada. Es sobre esta área en la que se va a centrar esta Revisión).
GENÉTICA Y RESPUESTA TERAPÉUTICA
Uno de los principales problemas al que se enfrenta la farmacología clínica es la gran variabilidad interindividual que existe en la respuesta a los medicamentos. Se ha pasado del antiguo paradigma de la homogeneidad («todos somos iguales, un fármaco se ajusta a todo tipo de pacientes») al actual de la medicina personalizada. Está claro que diferentes pacientes responden de forma distinta a la misma medicación. Estas diferencias son mayores entre diferentes personas que en una misma persona en momentos distintos o entre gemelos homocigotos 8. La experiencia en la práctica clínica nos revela que la administración de un mismo medicamento a diferentes pacientes a las dosis de prescripción recomendada produce respuestas distintas (eficaz en la mayoría de ellos, sin efecto en otros). Es relevante el hecho de que la gran mayoría de los tratamientos actualmente autorizados no son efectivos en todos los pacientes 9. Y lo mismo sucede con la toxicidad. Todos los medicamentos tienen efectos adversos potenciales que no aparecen en todos los pacientes a los cuales se les administra el fármaco. Además, los que los padecen lo hacen con diferentes intensidades.
¿Cuáles son las causas, los factores determinantes, de la variabilidad entre la población en la respuesta a los fármacos?
Se incluyen:
Factores genéticos
El conocimiento de que la herencia intervenía en la respuesta a fármacos vino a través del descubrimiento de reacciones farmacológicas inesperadas en individuos y en familiares. Todo ello revelaba la existencia de un patrón hereditario 10,11. A pesar de que el efecto de un fármaco conlleva un fenotipo complejo que depende de muchos factores, la herencia tiene una influencia importante en el efecto de un fármaco y la tolerancia de un paciente al mismo. Hoy en día se cree que la genética interviene en el 20-95 % de la variabilidad en la disponibilidad de un fármaco y sus efectos 12. La expresión de los genes, más que la propia dotación génica, y los polimorfismos existentes en ellos es lo que explica y condiciona las diferencias de los individuos en la respuesta a los tratamientos.
Factores no genéticos
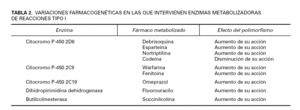
Factores no genéticos muy variados también tienen la capacidad de condicionar la respuesta terapéutica de los individuos (tabla 1). Estos factores varían a lo largo de la vida de la persona, a diferencia de los genéticos que suelen permanecer estables. Será la combinación de unos y otros la que en definitiva marque la eficacia y la toxicidad de un fármaco en un sujeto determinado.
Durante los últimos años se han producido avances sin precedentes en nuestro conocimiento sobre la importancia de los primeros factores, los genéticos, en la determinación de la susceptibilidad personal en el grado de eficacia y tolerancia a los medicamentos, lo que ha permitido el desarrollo de una disciplina en constante progresión, la Farmacogenética.
CONCEPTO DE FARMACOGENÉTICA
La Farmacogenética es el estudio de la respuesta farmacológica del individuo según el genotipo, o dicho de otra manera, el estudio del papel de la herencia en la variación individual de la respuesta farmacológica, tanto en lo que se refiere a eficacia en la respuesta como a efectos adversos 13,14. Aunque generalmente es un término utilizado para referirse al estudio de los genes relacionados con el metabolismo de los fármacos, en la actualidad se extiende también a todos los factores involucrados en su farmacocinética y farmacodinámica (receptores, transportadores, enzimas, canales iónicos, etc.).
Por otra parte, la confluencia de la Farmacogenética y de los rápidos avances en genómica humana ha dado como resultado la Farmacogenómica, que se encarga de comprender las bases genéticas de la enfermedad y así poder definir nuevas dianas terapéuticas o marcadores moleculares que evalúen la eficacia de nuevos fármacos. Su objetivo final es conseguir nuevos y efectivos fármacos para las enfermedades comunes que carecen de tratamiento adecuado en la actualidad. Aunque para muchos autores los términos farmacogenética y farmacogenómica son intercambiables, se trata de conceptos diferentes 15.
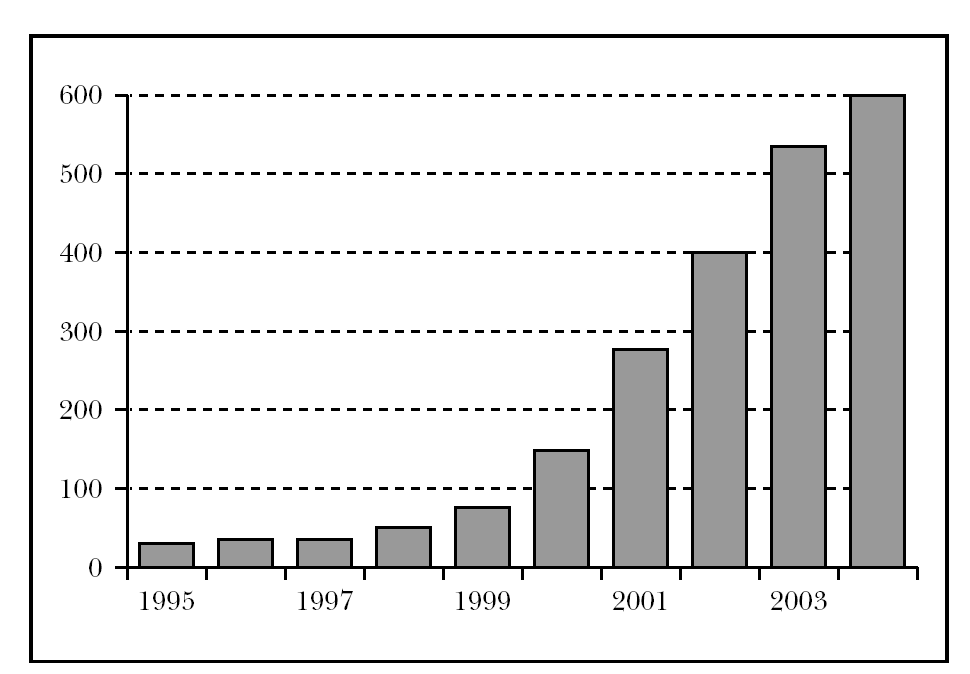
Si bien la Farmacogenética continua siendo una disciplina médica joven, su aplicación en la racionalización y personalización de los tratamientos es ya una realidad que se consolidará en los próximos cinco años. Su importancia creciente viene reflejada por el número de entradas que encontramos en los últimos 10 años al emplear el término pharmacogenetics mediante el sistema PubMed (30 agosto 2005) (http://www. ncbi.njm.nih.gov/entrez/query.fcgi) (fig. 1)
.Fig. 1.--Número de entradas del término pharmacogenetics desde 1995 hasta 2004 mediante PubMed (http://www.ncbi.njm.nih.gov/
entrez/query.fcgi) (agosto 2005).
HISTORIA DE LA FARMACOGENÉTICA
La primera observación escrita relacionada con la Farmacogenética se remonta al año 510 a.C. cuando Pitágoras observó que la ingesta de habas producía en algunos individuos una reacción potencialmente fatal. Con el tiempo se reconoció que se trataba de una anemia hemolítica que aparecía en individuos con deficiencia en la enzima glucosa 6-fosfato deshidrogenasa (G6PDH), siendo el primer informe de la farmacogenética moderna el publicado a principios de 1930 por Snyder sobre la incapacidad para saborear la feniltiourea que presentaba una herencia autonómica recesiva. Pero no fue hasta los años 1950 cuando la Farmacogenética se estableció como campo de estudio al tomar diversos investigadores en consideración que algunas reacciones adversas a medicamentos podían estar causadas por variaciones en la actividad enzimática genéticamente determinadas.
Fue Motulsky en 1957 quien primero documentó el concepto de que los defectos heredados en el metabolismo de fármacos podían explicar las diferencias individuales en la respuesta a medicamentos 16. El que primero propuso el término «farmacogenética» fue Friedrich Vogel en 1959, y en 1962 Kalow escribió la primera monografía sobre el tema 14.
El campo de la Farmacogenética fue estimulado en los años 1970 con hechos como la descripción que Robert Smith hizo en 1977 de la deficiencia en el metabolismo de la debrisoquina, cuando personalmente experimentó una importante hipotensión ortostática tras tomar el medicamento 17. Actualmente se conoce que el defecto correspondiente es debido a la deficiencia de la enzima citocromo P450 2D6. O cuando Vesell et al demostraron que las vidas medias plasmáticas de muchos fármacos eran menos divergentes entre parejas de gemelos monocigotos que entre parejas de gemelos dicigotos 8. Concluyeron que la herencia multifactorial podía determinar el metabolismo farmacológico individual (herencia multigénica).
En el transcurso de los años posteriores se fueron añadiendo ejemplos de respuestas exageradas, desconocidas, o ausencia de efectividad de fármacos como manifestación de patrones hereditarios individuales. Más recientemente, han recibido mucha atención los polimorfismos genéticos comunes del metabolismo de fármacos clínicamente útiles y que involucran a un número considerable de pacientes. Un ejemplo en el orden farmacodinámico es el conocimiento reciente de los receptores farmacológicos, como el beta 2-adrenorreceptor, o los transportadores farmacológicos, como el MDR1, responsable del gen de resistencia a fármacos, que también están sujetos a variación genética.
Las bases genéticas moleculares de estos patrones hereditarios se han empezado a dilucidar a finales de los años 1980 con la clonación y caracterización de numerosos genes humanos incluyendo enzimas metabolizadoras de fármacos, receptores y varios sistemas de transporte (se puede encontrar una lista de polimorfismos genéticos clínicamente relevantes, con influencia en el metabolismo de fármacos y sus efectos en: www.sciencemag.org/feature/data/1044449.shl). En la actualidad la Farmacogenética tiene un gran potencial y está generando grandes expectativas médicas, sociales y financieras.
OBJETIVOS DE LA FARMACOGENÉTICA
Sin duda, el objetivo principal de la Farmacogenética es «optimizar el tratamiento de las enfermedades a nivel individual», ir hacia una «terapia personalizada más segura y eficiente» 18,19. La Farmacogenética puede cambiar la forma de prescribir en la práctica clínica diaria. En lugar de seguir el método actual de «ensayo y error», de manera que los pacientes prueban diferentes dosis de un mismo fármaco y/o diferentes opciones terapéuticas, la farmacogenética permite ayudar al clínico a la hora de:
1. Seleccionar a aquellos pacientes que podrían responder bien o mal a un fármaco determinado antes de que sea prescrito (con el tiempo estarán disponibles perfiles farmacogenéticos para seleccionar a aquellos pacientes que tengan una gran posibilidad de responder positivamente y a aquellos que tengan bajo riesgo de presentar efectos adversos graves).
2. Seleccionar la medicación más adecuada para un determinado paciente.
3. Seleccionar la dosis más adecuada de un fármaco para un determinado paciente (las pruebas de genotipado y fenotipado para predecir los requerimientos de dosis están siendo introducidas cada vez más en el desarrollo preclínico de los medicamentos y en la rutina clínica).
Es decir, seleccionar «el fármaco correcto, a la dosis correcta, para el paciente indicado», determinar a priori la eficacia y tolerancia de los medicamentos para cada paciente. Todo ello permitirá evitar los retrasos en la administración de la terapia efectiva, los riesgos innecesarios de presentar reacciones adversas y los grandes gastos en tratamientos no efectivos (grandes ventajas en términos de coste-efectividad).
Y un paso más allá en el futuro de la Farmacogenética será la identificación de variaciones controladas genéticamente relacionadas con la farmacocinética y farmacodinamia, el estudio de los mecanismos moleculares causantes de estas variaciones, la evaluación de su significación clínica mediante ensayos clínicos prospectivos, el desarrollo de métodos simples de análisis del ADN y ARN para identificar individuos que puedan ser susceptibles a respuestas anormales o infrecuentes, y su integración en la práctica clínica diaria. Quizá llegue un día en que se pueda realizar en todos los pacientes un pasaporte genético que registre los genotipos relevantes, y que permita seleccionar el fármaco adecuado a su dosis óptima de acuerdo al diagnóstico del paciente, sus características y su pasaporte genético específico, estando la medicina del futuro dirigida hacia la prevención y la individualización.
ÁREAS DE ESTUDIO DE LA FARMACOGENÉTICA
Las responsables en gran medida de la variación interindividual en la respuesta a los fármacos, objetivos principales de estudio de la Farmacogenética, son las diferentes secuencias en los genes que codifican 20,21:
Enzimas que metabolizan los fármacos
El metabolismo generalmente convierte fármacos en metabolitos más hidrosolubles y, por tanto, más fácilmente excretables 22. También puede convertir profármacos en productos activos terapéuticamente activos, e incluso puede dar lugar a compuestos más tóxicos. Existen más de 30 familias de enzimas metabolizadoras de fármacos en los humanos 23. Todas tienen variaciones genéticas, muchas de las cuales se traducen en cambios funcionales en las proteínas codificadas. Por ello, un polimorfismo o una marcada diferencia en la expresión génica puede llevar a una disminución en la actividad de la enzima codificada por ese gen que ocasione una gran toxicidad en fármacos con un estrecho índice terapéutico, o una disminución en la eficacia de medicamentos que requieren ser metabolizados para ser activos. Prácticamente cada uno de los pasos en la metabolización de un fármaco es susceptible de variación genética.
Las reacciones metabólicas se clasifican en 22:
Reacciones de fase I (sintéticas): oxidación, reducción e hidrólisis
Se conocen numerosas enzimas que catalizan el metabolismo de fármacos de fase I. El hallazgo, hace aproximadamente 40 años, de que la hidrólisis del relajante muscular succinilcolina por la butirilcolinesterasa estaba genéticamente condicionado constituyó uno de los hitos que marcaron el desarrollo de la Farmacogenética. A partir de este descubrimiento han ido apareciendo numerosos ejemplos de variaciones farmacogenéticas clínicamente relevantes en las que intervienen enzimas metabolizadoras de reacciones de tipo I 13 (tabla 2).
Reacciones de fase II (conjugación): acetilación, glucuronización, sulfatación y mutilación
También son numerosos los ejemplos de variaciones farmacogenéticas clínicamente relevantes en las que intervienen enzimas metabolizadoras de reacciones de tipo II 13. Tal es el caso de la conocida acción de la TPMT (tiopurina S-metiltransferasa) sobre la azatioprina (AZ). La AZ es un antimetabolito de la purina utilizado como inmunosupresor. Es metabolizado, en parte, por S-metilación catalizada por la enzima TPMT. La actividad de la TPMT está afectada por polimorfismo genético, teniendo el 89 % de los caucásicos una actividad elevada (HH), el 9,7 % son heterocigotos y presentan una actividad intermedia (HL), y el 0,9 % tienen una actividad muy baja de TPMT (LL). Se han descrito al menos 100 alelos diferentes de la TPMT asociados con actividad disminuida 24. Un paciente que tenga niveles de actividad bajos o que no tenga actividad de la TPMT (LL) que reciba dosis estándar de AZ presentará concentraciones muy elevadas de su metabolito activo, bien correlacionadas con eficacia terapéutica pero también con el riesgo de padecer mielosupresión, en ocasiones letal. Por ello, el ensayo fenotípico del nivel de actividad de la TPMT en muestras de sangre y, seguidamente, los estudios basados en el ADN han sido los primeros estudios farmacogenéticos utilizados en la práctica clínica. Es un buen ejemplo de la individualización del tratamiento en función de los datos farmacogenéticos, recomendándose el estudio de la TPMT previo a iniciar el tratamiento con AZ. Los pacientes con genotipo de baja actividad para la TPMT tendrán que ser tratados con dosis muy reducidas si se quiere evitar la toxicidad, y en los pacientes con niveles muy altos de actividad la eficacia de la AZ estará disminuida a las dosis habituales. Existen tablas en las que se indican, dependiendo de la actividad de TPMT, las dosis recomendadas de AZT. El análisis del polimorfismo de la TPMT se ha convertido en la primera prueba farmacogenética clínicamente aceptada.
Proteínas transportadoras de fármacos
Existen muchas familias de proteínas transportadoras de fármacos que regulan y por tanto influyen en la absorción de fármacos, su distribución (que se acumulen más o menos en el tejido celular subcutáneo, que atraviesen o no la barrera hematoencefálica, etc.) y la excreción de los mismos y sus metabolitos (por la orina, heces, etc.).
Receptores de fármacos
Numerosos estudios han demostrado que variaciones genéticas pueden influir en la sensibilidad del receptor al fármaco (diana farmacológica) y, por tanto, condicionar la respuesta clínica 25. Se conocen al menos 25 ejemplos de variantes en la secuencia genética con un efecto directo sobre la respuesta a los fármacos. Algunos ejemplos: el gen del receptor beta 2 adrenérgico que afecta a la respuesta de los beta 2 agonistas, el gen de la enzima convertidora de angiotensina (ECA) que afecta a los efectos renoprotectores de los inhibidores de la ECA (IECA), etc.
Proteínas con efecto indirecto sobre la respuesta al tratamiento
Existen polimorfismos en los genes que codifican proteínas que ni son dianas directas de fármacos ni están involucradas en su farmacocinética/farmacodinámica, pero que son capaces de producir una alteración en la respuesta al tratamiento en determinadas situaciones. Por ejemplo, diferencias hereditarias en los factores de la coagulación pueden predisponer a las mujeres que toman anticonceptivos orales a padecer trombosis venosa profunda o trombosis cerebral 26.
OTROS ASPECTOS DE LA FARMACOGENÉTICA
La mayor parte de los rasgos farmacogenéticos que fueron identificados al principio, especialmente en cuanto a polimorfismos se refiere, involucraban a un solo gen (monogénicos) donde hay una alta correlación entre la presencia del gen afectado y la alteración. Una de las razones por las cuales la Farmacogenética se centraba en los genes únicos es porque eran fáciles de estudiar con las técnicas genéticas clásicas y que muchos de ellos eran clínicamente importantes. De hecho, algunos polimorfismos genéticos que afectan a un nucleótido único ya se han asociado con cambios sustanciales en el metabolismo o en el efecto de los medicamentos, y algunos son ahora utilizados para predecir la respuesta clínica 21. Sin embargo, la mayoría de las diferencias entre los individuos en su respuesta a los fármacos son multigénicas (por la acción combinada de numerosos genes que codifican productos muy diversos) y multifactoriales. Esto es debido a que los efectos de los medicamentos están determinados por la interacción de varios productos genéticos que influyen en la farmacocinética y la farmacodinámica de los fármacos (la mayor parte de los fármacos son metabolizados por varias enzimas diferentes, son transportados por varios tipos de proteínas e interaccionan con una o más dianas terapéuticas).
Por otra parte, también conviene tener presente la influencia de las poblaciones en la Farmacogenética. La investigación farmacogenética más temprana examinaba las diferencias entre sujetos individuales, pero en su desarrollo también se ha ocupado de las diferencias genéticas entre las poblaciones 27. Se trata de comprender que todas las variaciones farmacogenéticas estudiadas hasta hoy aparecen con diferentes frecuencias en las distintas subpoblaciones de diferentes orígenes raciales y étnicos. Incluso algunas de las mutaciones en los genes ocurren únicamente en ciertas subpoblaciones étnicas y, por tanto, marcan los orígenes y movimientos de las poblaciones en nuestro planeta. Esta diversidad étnica (geografía del gen) implica que las diferencias poblacionales y el origen étnico tienen que ser considerados en los estudios farmacogenéticos.
Correspondencia:
Esteban Daudén Tello.
Servicio de Dermatología.
Hospital Universitario la Princesa.
Diego de León, 62. 28006 Madrid. España.
estebandauden@medynet.com
Recibido el 3 de septiembre de 2006.Aceptado el 18 de septiembre de 2006.