Introducción
En nuestra piel existen conexiones entre el sistema nervioso, el endocrino y el inmune, en las cuales intervienen la mayoría de las células cutáneas. Estas interacciones, mediadas por neuropéptidos, neurotransmisores, neurotrofinas y neurohormonas, influyen en una gran variedad de funciones fisiológicas y patológicas de la piel; es lo que se ha dado en llamar «biología neurocutánea».
Los neuropéptidos son sustancias endógenas sintetizadas en las células nerviosas y/o células que intervienen en las funciones del sistema nervioso; pero además, se ha demostrado que otras muchas células, no nerviosas, son capaces de producirlos, en concreto en la piel queratinoctios, melanocitos, linfocitos, macrófagos, células de Merckel y células de Langerhans, entre otras. Así, los neuropéptidos más estudiados en la piel son: sustancia P, neurokinina A, neurotensina, péptido relacionado con el gen de la calcitonina (CGRP), neuropéptido Y, somatostatina, β-endorfina, encefalina, pétido atrial natriurético, hormona estimulante de los melanocitos (MSH) y adrenocorticotrofina (ACTH) 1. La mayoría de estos neuropéptidos son capaces de mediar inflamación neurogénica cutánea a través de la inducción de vasodilatación, extravasación plasmática, aumento de citoquinas y moléculas de adhesión. Además, intervienen en la inmunosupresión inducida por la radiación UV, tanto local como sistémica 2.
En cuanto al papel de los neuropéptidos en el melanoma, se ha demostrado inmunorreactividad en melanomas para ACTH, α -MSH, b -endorfina 3, péptido liberador de gastrina 4 y hormona de crecimiento 5, pero ha sido la a -MSH y sus péptidos asociados a la melanocortina los que parecen más implicados en la biología del melanoma. La α -MSH es el péptido melanotrópico natural más potente cuyos efectos biológicos se median a través de su unión al receptor de la melanocortina (MCR), el cual se expresa en muchas células. Posee múltiples funciones que incluyen modular un amplio abanico de estímulos inflamatorios, como citoquinas proinflamatorias, moléculas de adhesión y factores de transcripción inflamatoria. Todo ello le confiere un papel citoprotector de las células cutáneas frente a agresiones exógenas, como la radiación ultravioleta 6. En relación con el melanoma, mientras que algunos estudios le atribuyen un papel potencial de retraso metastático, mediante la reducción de la migración celular y la invasión, otros encuentran que es capaz de disminuir la capacidad del sistema inmune para detectar las células tumorales, lo que favorecería la diseminación tumoral 7.
La galanina es un neuropéptido de 29 a 30 aminoácidos (en humanos) ampliamente distribuido en el sistema nervioso central y periférico, así como en el sistema endocrino. Sus efectos, tanto endógenos como exógenos, están mediados por 3 subtipos de receptores: GALR1, GALR2 y GALR3. Este ubicuo neuropéptido controla numerosas funciones (tabla 1), lo que junto con el hecho de que conserve su secuencia entre especies 8, sugiere que la galanina es un importante mensajero en la comunicación inter e intracelular 9. Existen pocos estudios acerca de la función de este neuropéptido en la piel. En animales de experimentación se ha probado que la galanina inhibe la respuesta inflamatoria cutánea mediante la modulación de la respuesta vascular 10. Por otro lado, se ha demostrado su presencia en algunas estructuras cutáneas, apoyando su papel en la fisiología de la piel 11.
Adicionalmente, la galanina está implicada en determinados tumores malignos. Así, la expresión de galanina y sus receptores es frecuente en gliomas, feocromocitomas, tumores de hipófisis y, sobre todo, neuroblásticos 12. Esta co-expresión apoya el papel de la galanina en la patogénesis de estos tumores por mecanismos autocrinos o paracrinos. Por otro lado, se ha observado que la galanina posee una actividad antiproliferativa e inductora de apoptosis en células de carcinoma de colon y de neuroblastoma 13; de hecho, se ha mostrado útil en el tratamiento del cáncer de colon, en combinación con octreotide y serotonina 14.
No existe ningún trabajo que estudie la expresión de galanina en el melanoma, pese a que si revisamos la literatura encontramos que el receptor humano de la galanina se ha caracterizado farmacológicamente in vitro en células Bowes de melanoma humano, constituyendo esta línea celular la herramienta más relevante para el estudio de dicho receptor 15. En consecuencia, nuestra hipótesis es que la galanina pueda expresarse en tumores melanocitarios, benignos y/o malignos, y dicha expresión guarde relación con otros neuropéptidos presentes especialmente en el melanoma, en concreto con la α -MSH.
El objetivo del presente estudio es, por tanto, determinar la expresión de galanina en melanomas y nevi melanocíticos cutáneos, comparándola con la expresión de α -MSH en los mismos tumores, y relacionándola con determinadas variables clínicas e histológicas con valor pronóstico en el melanoma maligno.
Material y método
Diseño del estudio
Se llevó a cabo un estudio observacional, transversal, retrospectivo sobre la inmunorreactividad al neuropéptido galanina en secciones histológicas de tumores melanocitarios benignos y malignos.
Sujetos del estudio
Se analizaron melanomas cutáneos y nevi melanocíticos diagnosticados en los últimos 5 años en el Hospital San Jorge de Huesca, cuyas piezas histológicas se conservan en el laboratorio del Servicio de Anatomía Patológica de dicho centro. Se excluyeron los melanomas de localización extracutánea.
Partimos de un número total de 72 melanomas. Para el cálculo del tamaño muestral tomamos de otros estudios el porcentaje de melanomas con inmunomarcaje positivo para la α -MSH, que es del 53 % 3. El tamaño de nuestra muestra, con una precisión del 10 % y asumiendo un riesgo del 5 %, fue de 39 melanomas, y comparativamente se tomó un número igual de nevi melanocíticos. Así, en el caso de los melanomas, se tomaron al azar el mismo número de cada uno de los tipos clínicos: melanoma lentigo maligno, nodular, extensión superficial y lentiginoso acral (alrededor de 10 de cada tipo). Debido a que sólo pudimos contar con 2 melanomas lentiginosos acrales se tomaron algunos más de los otros tipos clínicos y dos melanomas sobre nevus para completar la muestra. En el caso de los nevi se incluyeron un número de casos similar al de los melanomas de cada uno de los tipos más frecuentes, elegidos al azar: intradérmicos, de unión, compuestos, displásicos, azules, fusocelulares y congénitos. Finalmente se consideró incluir un pequeño grupo de metástasis cutáneas de melanoma en el estudio.
Las variables recogidas de los pacientes de estudio fueron aquellas que, según la American Joint Committee on Cancer (AJCC) Melanoma Staging Committee, son factores pronósticos estadísticamente significativos de la supervivencia del melanoma: índice de Breslow, nivel de Clark y ulceración como variables histológicas en melanomas, y edad al diagnóstico, sexo y localización de la lesión como variables clínicas en todas las lesiones melanocitarias estudiadas.
Método inmunohistoquímico
El estudio inmunohistoquímico se llevó a cabo en el material fijado en formaldehído e incluido en parafina y sobre secciones de 5 mm de grosor, como se ha descrito previamente 3. Las secciones fueron estudiadas inmunohistoquímicamente con un inmunoteñidor automatizado (TechMate 500; Biotech Solutions, Dako, Glostruf, Denmark) e incubadas en un kit de detección (CheMate, code K4001, Dako) de acuerdo con las instrucciones del fabricante y utilizando AEC (3-amino-9-etilcarbazol) como cromógeno. En todos los casos se realizó recuperación antigénica con olla a presión, como se ha descrito con anterioridad 16. Se emplearon los siguientes anticuerpos: galanina humana (Oxford Biotechnology Ltd, UK), α -MSH humana (Bachem UK, LTD) y anti-Mib1 (Ki-67) (DAKO, Carpenteria, CA, EE.UU.). Se utilizaron secciones representativas examinadas utilizando controles positivos 7,11 y negativos.
La evaluación del marcaje inmunohistoquímico se realiza valorando 10 campos de gran aumento y contando el número de células (citoplasmas en tinciones citoplasmáticas o núcleos en marcadores nucleares) que expresan el antígeno estudiado, independiente de la intensidad del marcaje. Posteriormente se establece el porcentaje de células positivas.
Análisis estadístico
De las variables cualitativas se realizó el cálculo de la distribución de frecuencias y de las variables cuantitativas (salvo del nivel de Breslow) se calculó la media y dos desviaciones estándar.
Dado que el tamaño de la muestra fue superior a 60, asumimos la normalidad para la distribución de la misma. Por tanto, para comparar las medias se utilizaron la prueba de la «t» de Student y el análisis de ANOVA de una vía. La asociación existente entre variables cualitativas se estudió mediante la prueba de Chi cuadrado. La correlación entre dos variables cuantitativas continuas se estableció mediante la prueba de correlación de Pearson. Se consideró que existía significación estadística si p > 0,05. En el análisis de los datos se utilizó el programa SPSS (versión 13.00).
Resultados
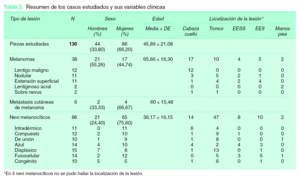
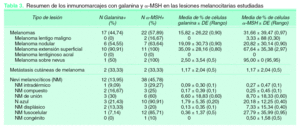
Se estudiaron un total de 130 lesiones de las que 38 eran melanomas cutáneos primarios, 6 metástasis cutáneas de melanoma y 86 nevi melanocíticos. Los 38 melanomas se distribuían de la siguiente manera: 12 lentigos malignos melanomas, 11 melanomas nodulares, 11 melanomas de extensión superficial, dos melanomas lentiginosos acrales y dos melanomas sobre nevus. En cuanto a los nevi melanocíticos 11 eran intradérmicos, 12 compuestos, 10 de unión, 14 azules, 15 displásicos, 14 fusocelulares y 10 congénitos (tabla 2).
Con relación a la edad media de los pacientes estudiados, ésta fue de 46 años (R = 8 a 92), siendo significativamente mayor en el grupo de melanomas (65 años) que en el de los nevi melanocíticos (36 años) (p < 0,001). En referencia a la distribución por sexos, 44 fueron varones (33,8 %) y 86 mujeres (66,2 %), siendo esta diferencia a expensas del predominio de mujeres entre los nevi (21 varones y 65 mujeres) y no en los melanomas y metástasis (23 varones y 21 mujeres); dentro del grupo de nevi melanocíticos, en todos los grupos había un claro predominio de mujeres, salvo en los congénitos y en los displásicos (tabla 2).
Inmunomarcaje con anticuerpos para galanina y α -MSH
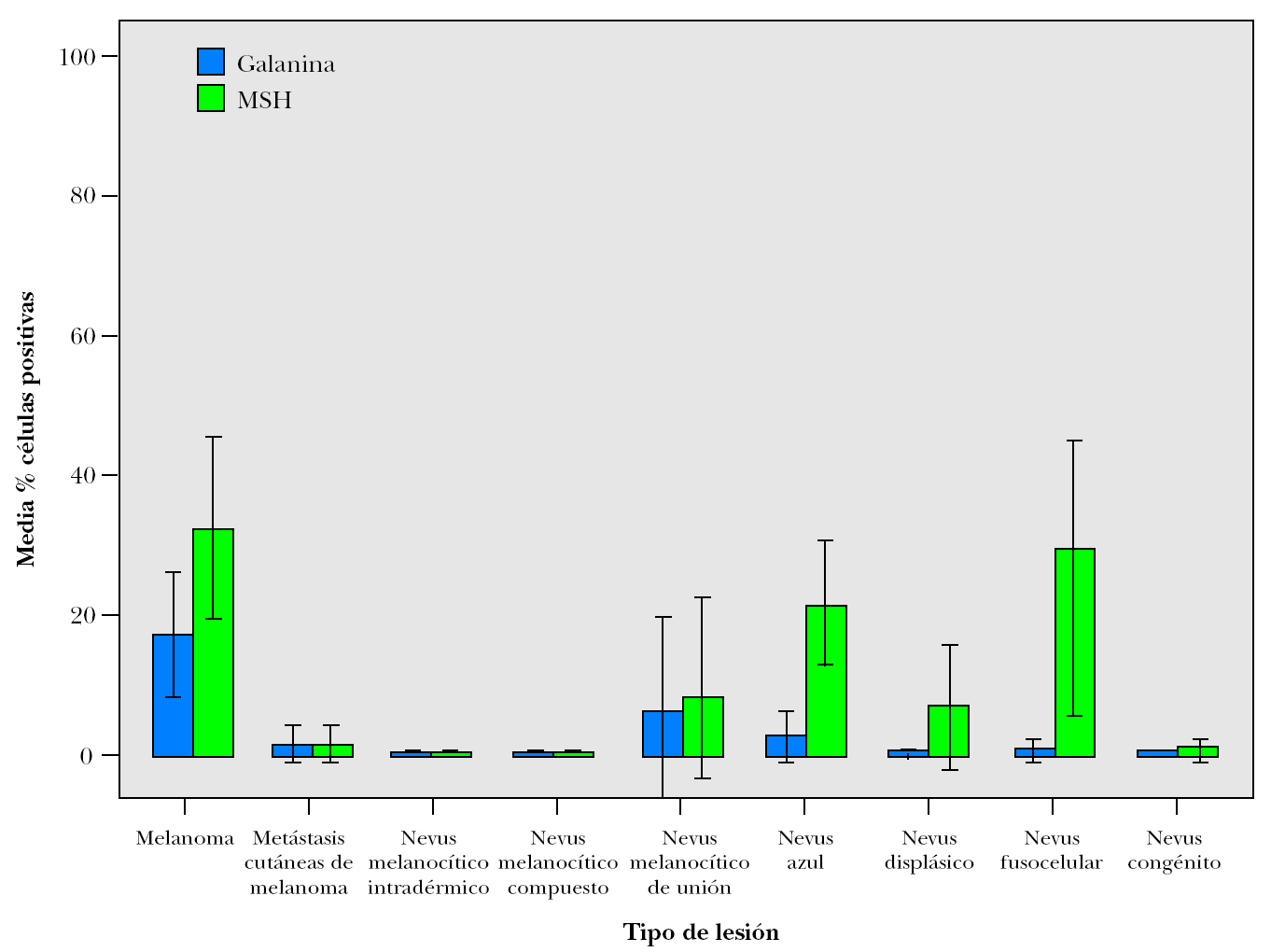
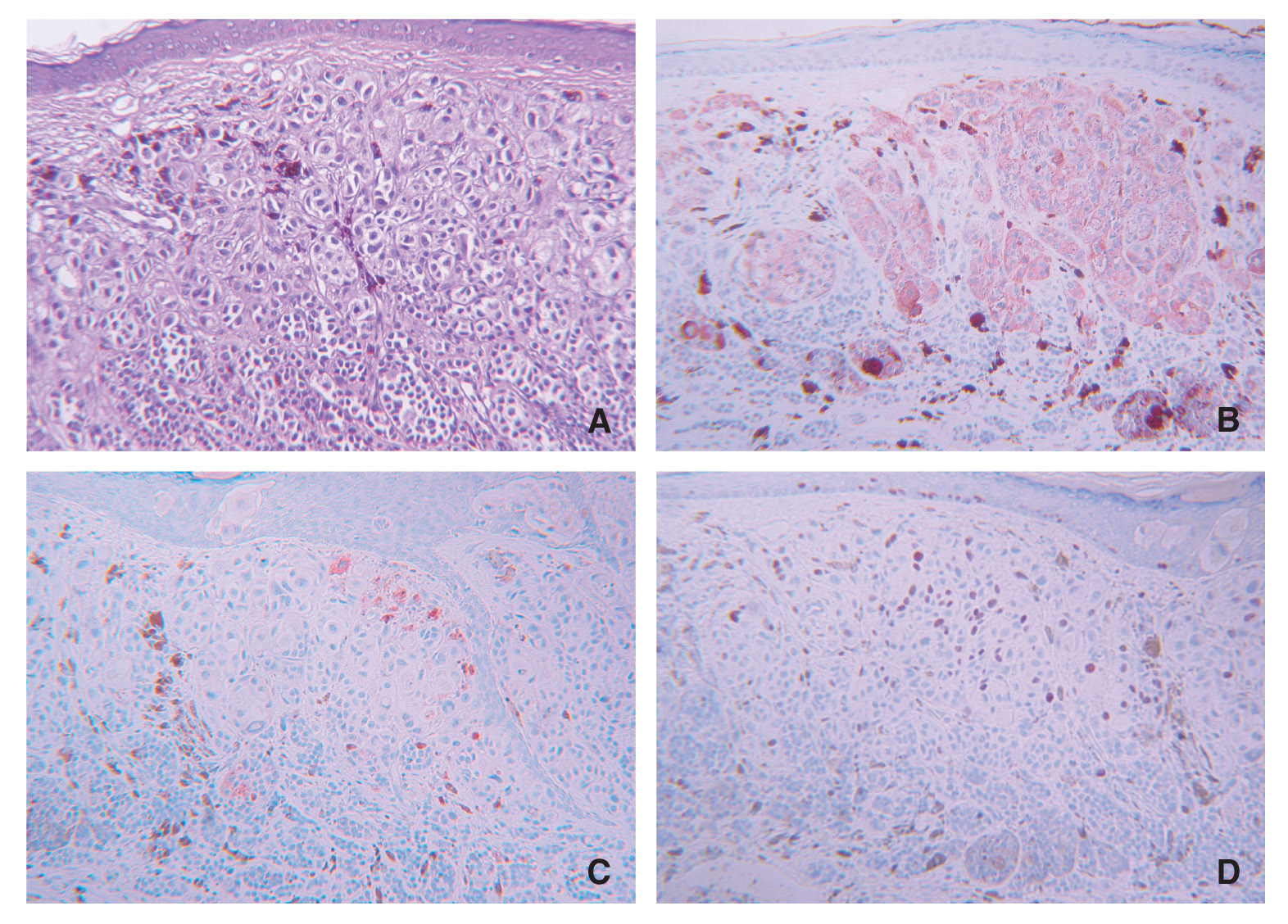
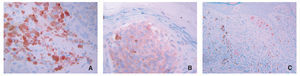
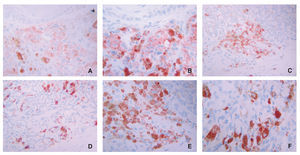
El 23,8 % de las piezas estudiadas (n = 31) mostraron algún tipo de inmunomarcaje para galanina, mientras que este porcentaje fue del 47,7 % de los casos (n = 62) para la α-MSH. Este inmunomarcaje fue citoplasmático en ambos casos, a veces más granular y otras más difuso (fig. 1).
Figura 1.Detalle de inmunomarcajes para (A) galanina, (B) α-MSH y (C) ki-67 en células de melanoma. Obsérvese la diferencia entreel marcaje citoplasmático de los dos primeros y el nuclear del tercero. (A) La galanina muestra en unas células un marcaje granular y en otras más homogéneo.
Tan sólo un 13 % de los nevi melanocíticos mostraron alguna positividad para galanina, que fue muy escasa en la mayoría de los casos, alrededor del 1 % de las células y casi siempre en nidos de células cercanos a la unión dermoepidérmica (tabla 3). Sin embargo, el 45,78 % de los nevi melanocíticos mostraron alguna positividad para α-MSH, especialmente los nevi de unión (60 %), los nevi fusocelulares, positivos el 85,71 % y el 90,91 % de los nevi azules (tabla 3). Pero además, hay que señalar que la media de porcentaje de células con inmunomarcaje positivo para α-MSH fue también considerable tanto en los nevi azules (20,18 ± 12,25 %) como en los fusocelulares (27,79 ± 35,99 %).
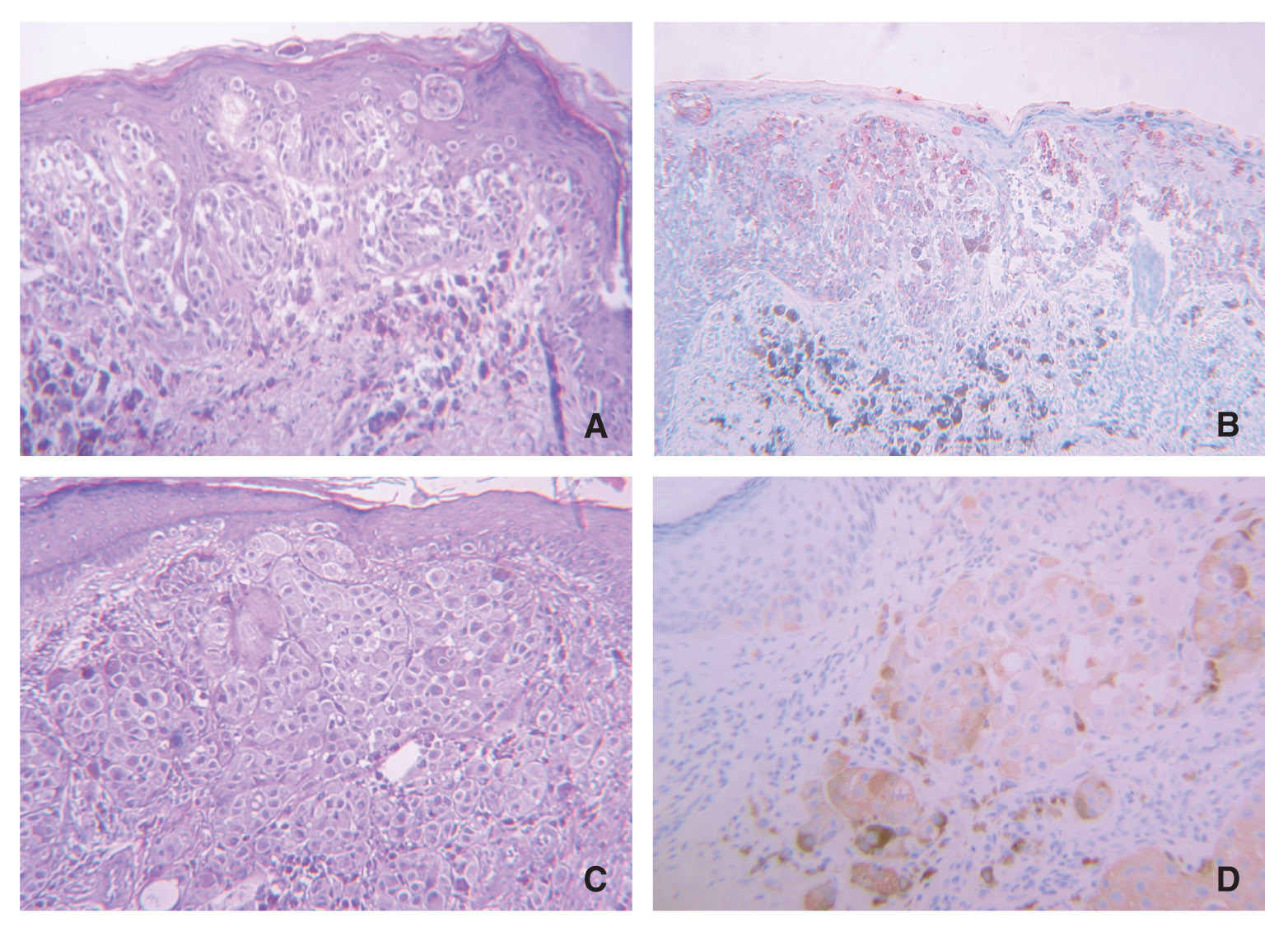
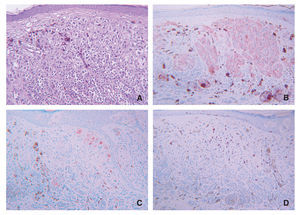
En cuanto a los melanomas, el 90,9 % de los de extensión superficial mostraron alguna positividad para galanina y el 100 % para α -MSH. Los melanomas nodulares también mostraron en su mayoría (54,55 %) alguna positividad para galanina y el 63,64 % para α -MSH. Ningún lentigo maligno fue positivo para galanina, y tan sólo el 16,67 % lo fue para α -MSH. En nuestra casuística sólo hemos podido recoger dos melanomas lentiginosos acrales, que no mostraron positividad para ninguno de los dos neuropéptidos. Se incluyeron dos melanomas sobre nevi, uno de ellos con un 5 % de células positivas para galanina y los dos con un elevado inmunomarcaje para α -MSH (95 % de las células), siendo especialmente interesante el hecho de que sólo las células de melanoma y no las de nevus mostraron positividad (fig. 2).
Figura 2.(A) Imagenhistológica de un melanomasobre nevus; (B) el 95% de las células de melanomamostraron expresión de α-MSH (en rojo) mientras quelas células névicas (en azul)no lo expresaron; (C) escasascélulas mostraron positividadpara galanina (rojo) y (D) positividad paraki-67también en elcomponente de melanoma y no en el névico.
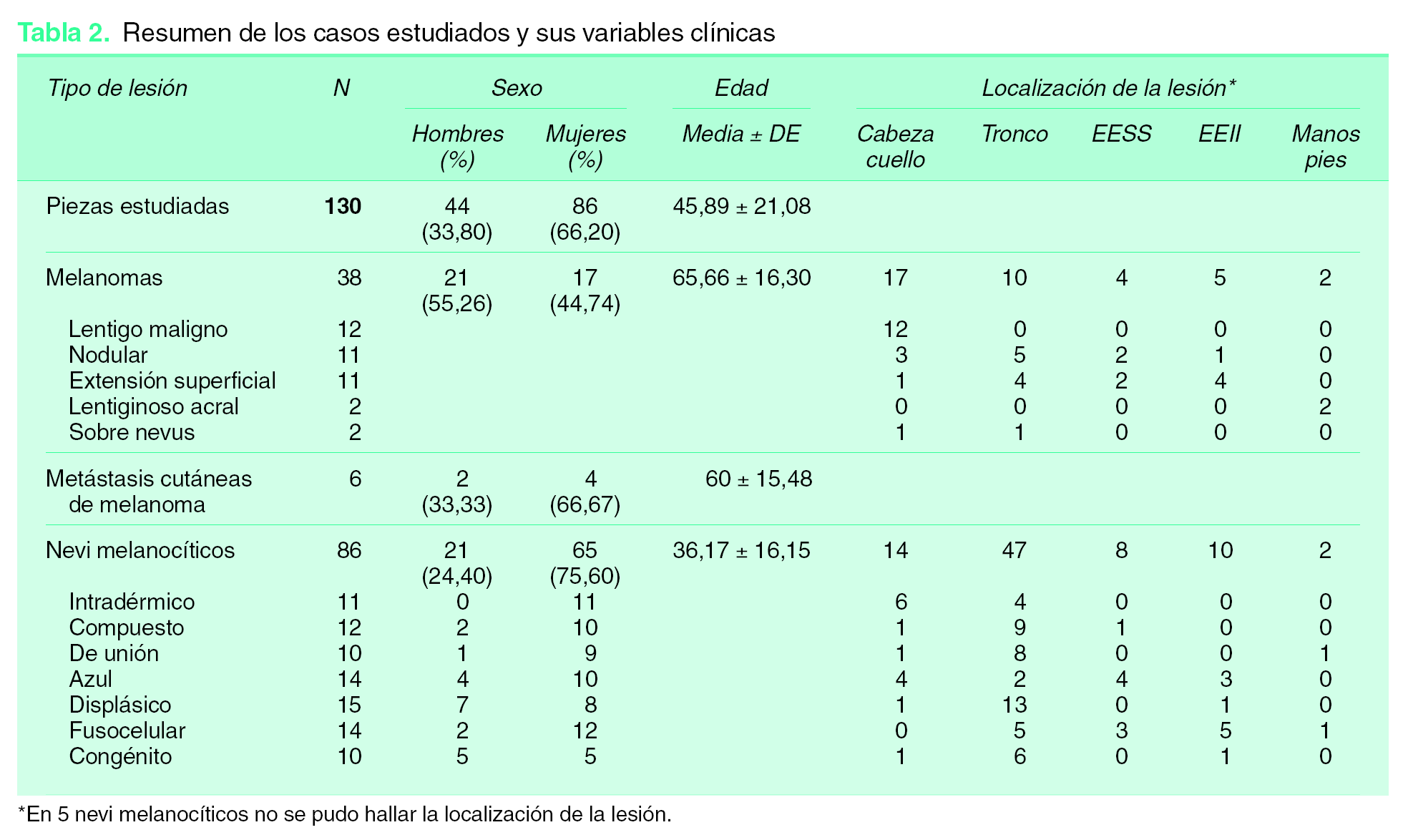
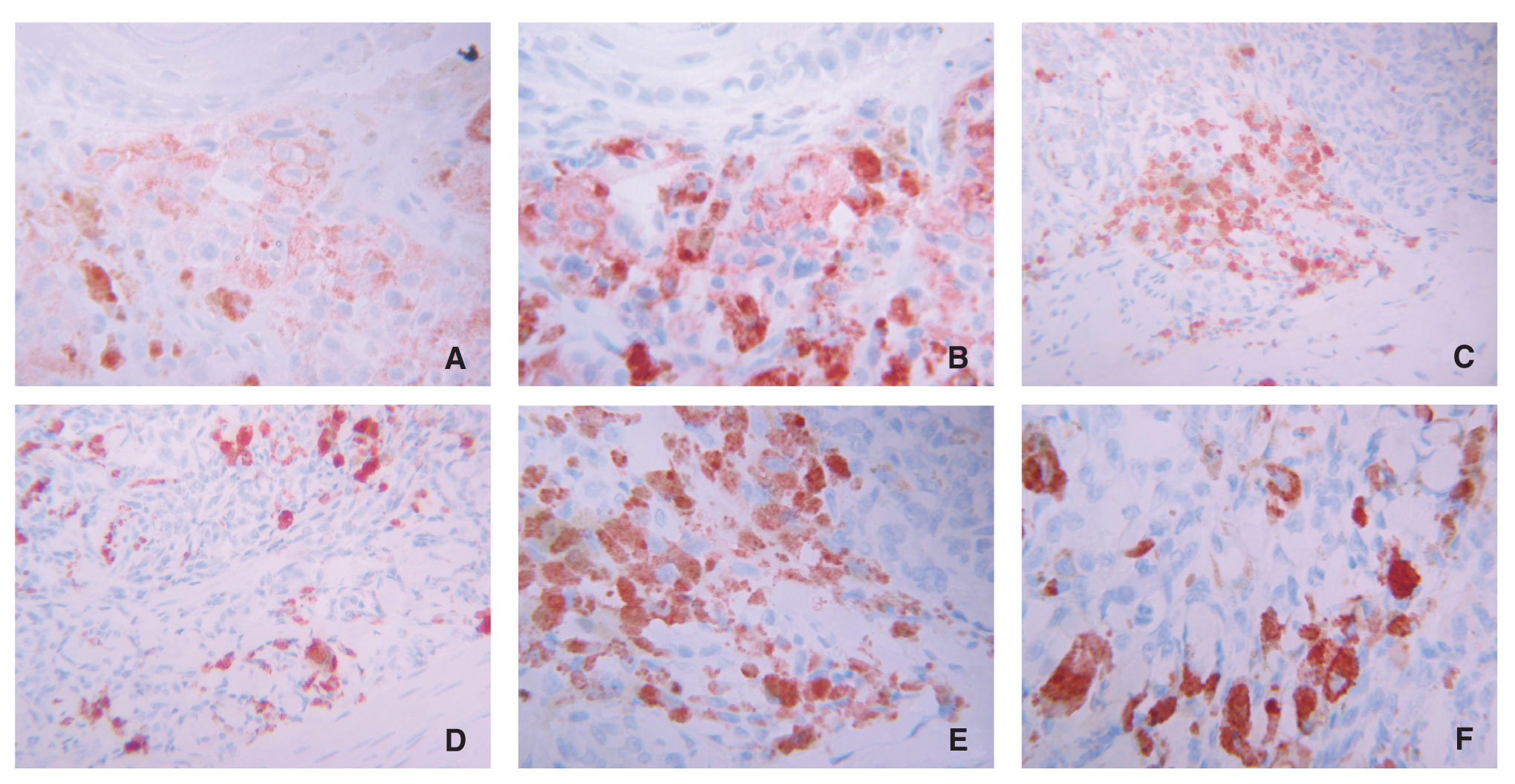
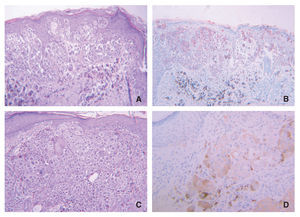
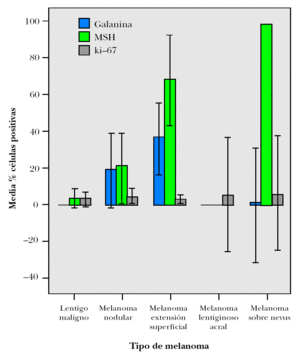
Los melanomas de extensión superficial no sólo fueron los que con mayor frecuencia marcaron para galanina, sino también los que mostraron el mayor porcentaje de células positivas para este neuropéptido (media = 35,09 ± 28,16 %), seguidos de los melanomas nodulares (19,09 ± 30,73 %) (fig. 3). Estos mismos tipos de melanomas mostraron un inmunomarcaje importante para α-MSH, siendo la media de porcentaje de células positivas en los de extensión superficial de 67,64 ± 35,38 % y en los nodulares de 20,82 ± 30,14 % (tabla 3). Hay que precisar que en algunos de nuestros casos llegaron a ser positivas para galanina hasta el 90 % de las células tumorales, y tanto los componentes superficiales de la tumoración como los profundos (fig. 4). En la figura 5 se representan las medias de los porcentajes de células positivas en los distintos tipos de melanomas para ambos neuropéptidos, así como para ki-67, siendo las diferencias entre estas medias estadísticamente significativas tanto para galanina (test ANOVA p = 0,012) como para α -MSH (test ANOVA p < 0,001).
Figura 3.(A) Imagenhistológica de un melanomade extensión superficial;(B)intenso marcaje paragalanina; (C) imagenhistológica de un melanomanodular; (D) mayoría decélulas tumorales positivaspara galanina, tanto su componente superficial como profundo.
Los inmunomarcajes para galanina y α-MSH en las piezas estudiadas, especialmente en los melanomas, muestran similitudes (fig. 4), pero en la mayoría de los casos el porcentaje de las células positivas es mayor para α-MSH que para galanina. Esta impresión histológica la confirmamos mediante la prueba de correlación de Pearson; así, la magnitud de la asociación entre ambas variables fue el 71 % de la máxima posible en el grupo de los melanomas y tan sólo el 34 % en el grupo de nevi melanocíticos.
Figura 4.Inmunomarcaje comparativo de galanina (A, C y E) y α-MSH (B, D y F) muy similares en un melanoma nodular. Tanto las células más superficiales de la tumoración (A y B) como las más profundas (C y D) expresan ambos neuropéptidos; (E y F) detalle de lascaracterísticas de estos inmunomarcajes.
Figura 5. Gráfico de medias de porcentajes de células con inmunomarcajes positivos para galanina, α-MSH y ki-67 en melanomas. Las barras que representan los errores estándar en el melanoma lentiginoso acral y el melanoma sobre nevus son muy amplias, ya que en cada uno de estos grupos se incluyen tan sólo dos casos. Barras de error: IC 95 %.
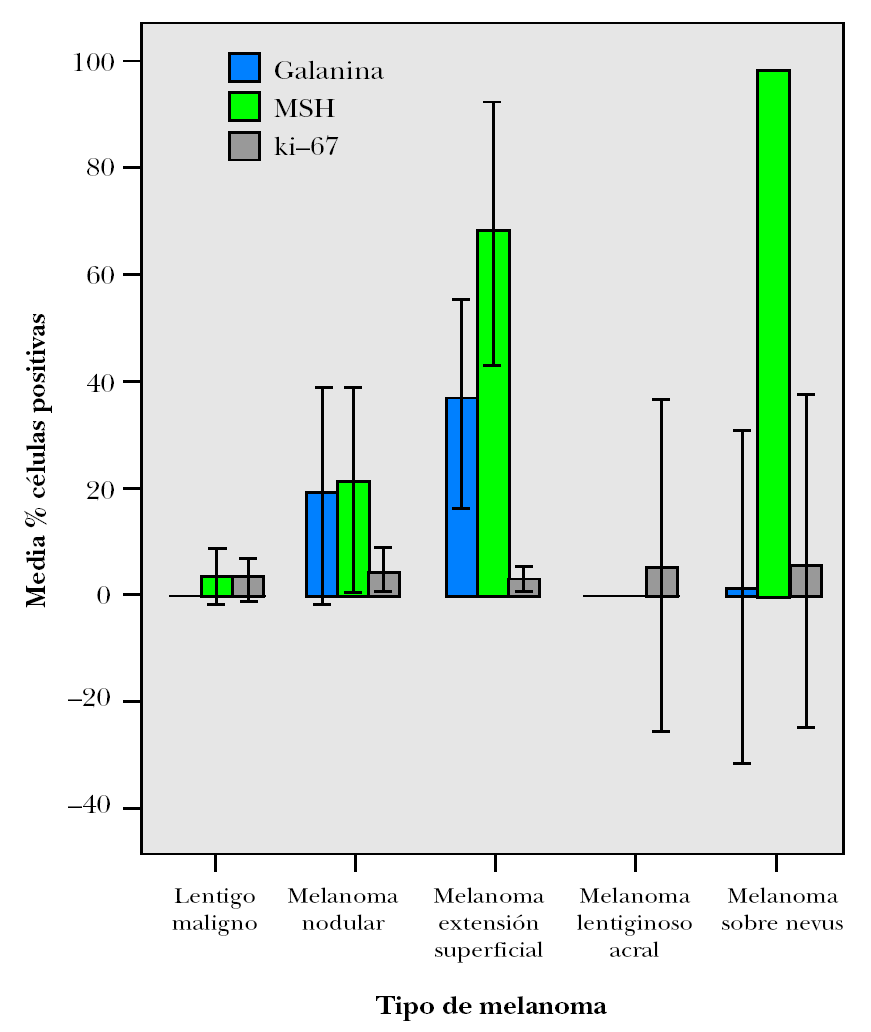
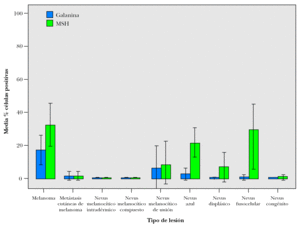
En la figura 6 se representa la media de los porcentajes de células con inmunomarcaje positivo para galanina y α -MSH de los diferentes tipos de lesiones estudiadas, siendo la galanina significativamente superior en los melanomas que en las metástasis cutáneas y los nevi melanocíticos (test ANOVA p = 0,003). De este modo, si distribuimos nuestros casos en dos grupos: melanomas y nevi melanocíticos, encontramos asociación entre los melanomas y el inmunomarcaje con galanina (Chi cuadrado = 13,69 p < 0,001), con una OR de 4,69 (IC 95 %: 1,85 a 12,05), es decir los melanomas tienen 4,69 veces más probabilidades de presentar un inmunomarcaje positivo para galanina que los nevi melanocíticos. Sin embargo, esta asociación no la encontramos con la α -MSH (Chi cuadrado = 0,57; p = 0,45), lo que se explica por el hecho de que los nevus azules y los fusocelulares expresaron de forma muy importante y frecuente este neuropéptido.
Figura 6. Gráfico de medias de porcentajes de células con inmunomarcajes positivos para galanina y α -MSH en lesiones melanocitarias. Barras de error: IC 95 %.
Relación entre la expresión de galanina y α -MSH con variables clínicas
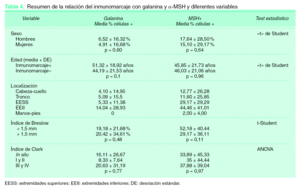
No encontramos diferencias en la media de porcentajes de células positivas para galanina (prueba de la «t» de Student p = 0,60) ni para α -MSH (p = 0,64) según el sexo. Tampoco detectamos diferencias entre la media de la edad del grupo de pacientes cuyas piezas histológicas expresaron galanina y el grupo que no la expresaron (prueba de la «t» de Student p = 0,1) o α-MSH (prueba de la «t» de Student p = 0,96) (tabla 4).
En cuanto a la localización de las lesiones encontramos un inmunomarcaje mayor tanto para galanina como para α -MSH en las localizadas en extremidades inferiores (tabla 4). Sin embargo, realizando un análisis multivariante para predecir el inmunomarcaje positivo con galanina o con a -MSH en los melanomas, en el que se incluyen las variables localización y tipo de melanoma, es esta última la única que muestra una asociación con la expresión de dichos neuropéptidos en melanomas.
Relación entre la expresión de galanina y α -MSH con índice de Breslow y nivel de Clark
Se estudió la relación entre el inmunomarcaje con galanina y α -MSH en los melanomas y la profundidad del mismo (tabla 4). No se encontraron diferencias significativas en las medias del porcentaje de células positivas para galanina según el índice de Breslow (prueba de la «t» de Student p = 0,48). Sin embargo, los melanomas con Breslow menor o igual a 1,5 mm mostraron un mayor porcentaje de células positivas para α -MSH (52,18 ± 40,44 %) que aquellos con Breslow mayor de 1,5 mm (29,17 ± 36,11 %), aunque esta diferencia no fue estadísticamente significativa. No detectamos una relación significativa entre la expresión de galanina o α -MSH y el índice de Clark (test ANOVA galanina [p = 0,77] y a -MSH [p = 0,97]).
Relación entre la expresión de galanina y la proliferación celular mediante anticuerpos anti-Mib1 (ki-67)
En nuestra casuística, el inmunomarcaje para ki-67 fue en general escaso, siendo la media de células marcadas del 5 ± 4,15 % en los melanomas con índice de Breslow inferior o igual a 1,5 mm y de 6 ± 5,77 % en aquellos con Breslow superior a 1,5 mm (prueba de la «t» de Student p = 0,64). Por otro lado, la expresión de ki-67 mostró una baja correlación tanto con la de galanina (coeficiente de correlación de Pearson de 0,27) como con la de α -MSH (coeficiente de correlación de Pearson de 0,31), lo que podemos objetivar en el gráfico de la figura 5.
Discusión
Nuestro trabajo demuestra que algunos melanomas cutáneos, y en concreto los de extensión superficial y los nodulares, expresan galanina en mayor o menor medida, y que dicha expresión presenta una alta correlación con la de α -MSH en estos tumores. Sin embargo, nuestros resultados muestran una mayor especificidad para la galanina, ya que algunos nevi melanocíticos expresan de forma significativa α -MSH, especialmente los azules y los fusocelulares.
La estrecha relación del melanoma con el sistema inmunológico es clara, pero además, algunos neuropéptidos pueden desempeñar un papel relevante en su patogenia, lo que es lógico si consideramos la procedencia embriológica del melanocito: la cresta neural. La galanina ha sido detectada, así como su ARN mensajero (ARNm) en líneas celulares melanoma 12. Sin embargo, no existen publicaciones acerca de la expresión de galanina en tumores melanocitarios.
Según nuestros resultados, la expresión de galanina en lesiones melanocitarias depende del tipo de lesión, siendo significativamente mayor en melanomas que en nevi. Si comparamos dicha expresión con la encontrada por otros autores en otro tipo de tumores observamos que el marcaje siempre es citoplasmático, como en nuestro caso 12. Por otro lado, no encontramos diferencias histológicas entre los melanomas de extensión superficial y los nodulares que expresaron y no expresaron galanina, lo que coincide con lo comunicado en otros trabajos en otros tipos de tumores 17.
Los tumores neuroblásticos son los que tienen un inmunomarcaje más constante para galanina, otros tipos de tumores como feocromocitomas son positivos alrededor del 60 % (62 % los feocromocitomas suprarrenales, 40 % los paragangliomas yugolotimpánicos y 15 % en carotídeos) 12,18, por lo que podemos decir que el porcentaje de nuestros melanomas de extensión superficial (90 %) y nodulares (55 %) que expresaron galanina ha sido muy significativo.
Perel et al 18 encuentran expresión de galanina en todos los tumores neuroblásticos estudiados, sin embargo en metástasis la expresión fue mucho menor 19, similar a nuestra casuística donde las metástasis cutáneas marcaron escasamente para galanina.
En nuestro estudio no hemos hallado relación entre la expresión de galanina y el índice de proliferación celular obtenido mediante inmunomarcaje con ki-67, lo cual está en consonancia con los hallazgos in vitro en células Bowes de melanoma humano, donde la galanina no tuvo ninguna influencia en su tasa de proliferación celular 12,20.
Según nuestros resultados la galanina no guarda relación con ninguno de los marcadores pronósticos clínicos e histológicos de melanoma estudiados. Berger et al tampoco encontraron dicha relación en el caso de tumores neuroblásticos periféricos 21. No obstante, algunos estudios atribuyen un cierto valor de buen pronóstico a la presencia de galanina, en concreto en los adenomas hipofisarios 22. Esto estaría en consonancia con el hecho de que la galanina ha demostrado poseer actividad antiproliferativa e inductora de apoptosis en células de cáncer de colon y de neuroblastoma 13.
Nuestro trabajo encuentra una correlación significativa entre la expresión de galanina y α -MSH en melanomas, lo que hemos demostrado tanto en las imágenes histológicas como desde el punto de vista estadístico. Por otro lado, el porcentaje de nuestros melanomas, que fueron positivos para α -MSH, fue del 57 %, similar al obtenido por otros autores 3. Sin embargo, también hemos detectado un significativo inmunomarcaje con α -MSH en nevus azules y nevus fusocelulares, lo que no ha sido previamente descrito.
De acuerdo con el presente estudio, el inmunomarcaje para galanina y para α -MSH en melanomas depende del tipo del mismo, siendo significativamente superior en los melanomas de extensión superficial y los nodulares. Algunos otros neuropéptidos, como el péptido liberador de gastrina, también se ha encontrado aumentado sólo en algún tipo de melanoma, en concreto en los nodulares 4. En el caso de la α -MSH, Nagahama et al 3 refieren variaciones en el immunomarcaje de los distintos tipos de melanoma (extensión superficial [2/9], nodulares [4/5], lentiginosos acrales [3/11] y no investigan lentigos malignos), diferente a nuestra casuística, pues ellos encuentran una baja expresión de α -MSH en melanomas de extensión superficial. Nos parece interesante nuestro hallazgo en melanomas sobre nevus, donde la α -MSH se expresó en la práctica totalidad de las células de melanoma y no en las névicas, dato no referido previamente en la literatura.
No existen trabajos publicados que relacionen la galanina con la α -MSH. Sin embargo, parece que la expresión de galanina en adenomas hipofisarios, está ligada a la coexpresión de ACTH 12,22, neuropéptido que, al igual que la α -MSH, se deriva de la proopiomelanocortina, y ambos están presentes en melanomas 3. El papel de la α -MSH en el melanoma es todavía controvertido 23. En nuestro trabajo los melanomas con índice Breslow menor o igual a 1,5 mm poseían un mayor porcentaje de células positivas para α -MSH que aquellos con Breslow mayor, lo que podría ir a favor de un cierto potencial de buen pronóstico de este neuropéptido, lo cual es defendido por algunos autores 23.
Intentar establecer el significado de la presencia de galanina en un porcentaje variable de células de determinados tipos histológicos de melanoma es difícil, más cuando el significado de estos diferentes subtipos de melanoma sigue siendo un aspecto controvertido 24. La galanina ha demostrado intervenir en la respuesta inflamatoria cutánea en animales de experimentación 25, ha probado poseer actividad antiproliferativa e inductora de apoptosis en otros tumores 13, y está muy relacionada con el sistema hormonal, como los estrógenos que estimulan de forma importante su secreción 9. La inflamación, la apoptosis y las hormonas, especialmente los estrógenos, han sido relacionados de una u otra forma con el melanoma y podrían ser algunos de los nexos de unión de la galanina con este tumor.
Finalmente, hay que considerar que nuestro estudio tiene limitaciones, como que el número de melanomas lentiginosos acrales y melanomas sobre nevus es bajo. Por otro lado, la muestra de melanomas, aunque representativa del total de los diagnosticados en nuestro hospital en los últimos 5 años, es de 38, por lo que se precisan estudios prospectivos con una mayor cantidad de este tipo de tumores que corroboren estos datos.
En conclusión, nuestro trabajo demuestra, por primera vez, la presencia de galanina en secciones histológicas de melanoma cutáneo. Este hecho constituye la base para investigar el papel de este neuropéptido en dicho tumor, o al menos en algunos tipos del mismo. Corroborar nuestros datos en series más amplias, determinando la existencia de receptores de galanina en los distintos tipos de melanoma, y establecer si la acción de este neuropéptido en las células de melanoma se realiza de forma autocrina o paracrina, suponen las líneas más inmediatas de investigación. El estudio de la relación entre la expresión de galanina, la presencia de apoptosis y la inflamación quizás puedan ayudar a dilucidar el papel de este ubicuo neuropéptido en el melanoma cutáneo.
Conflicto de intereses. Declaramos no tener ningún conflicto de intereses
Correspondencia:
Yolanda Gilaberte.
Sección de Dermatología. Hospital General San Jorge.
Avda. Martínez de Velasco, 34. 22004 Huesca.
Premio Juan de Azúa de la AEDV 2006. Aceptado el 12 de septiembre de 2006.