El melanoma ha adquirido gran protagonismo en las últimas décadas, lo cual se justifica, además de por su agresividad, por el incremento exponencial de su incidencia1 y porque se diagnostica en individuos cada vez más jóvenes2 . Aunque el melanoma sólo representa el 3 % de las neoplasias malignas cutáneas, dicho tumor provoca el 65 % de las muertes por cáncer de piel y el 1,3 % del total de fallecimientos por cáncer en general3 . También resultan inquietantes algunas predicciones que indican que uno de cada 75 sujetos nacidos en el año 2000 desarrollará un melanoma a lo largo de su vida1 .
El comportamiento biológico del melanoma es muy diferente al de otros cánceres de piel. Por ello, en los últimos años se han multiplicado los estudios para conocer mejor el mecanismo de acción y los efectos de los distintos componentes del sistema inmunitario en su defensa frente al melanoma4,5 . Desde un punto de vista clínico, la intervención del sistema inmunitario en la lucha contra el melanoma se apoya en observaciones como los fenómenos de regresión tumoral, la posibilidad de un prolongado intervalo libre de enfermedad entre la exéresis del tumor primario y el eventual desarrollo de metástasis, la existencia de respuestas parciales o completas en pacientes que han recibido inmunoterapia6 ; o el incremento de 2 a 5 veces en la tasa de incidencia de melanoma en pacientes trasplantados con inmunosupresión terapéutica7 .
Las citocinas son polipéptidos solubles encargados, entre otras funciones, de regular las respuestas inmunitarias del organismo. La principal fuente de citocinas son los linfocitos T y los monocitos. Existen dos subtipos de linfocitos T colaboradores (Th) en virtud del patrón de citocinas que producen8 , así el subtipo 1 (Th1) libera interferón gamma (IFN-), interleucina 2 (IL-2), IL-12, IL-15 y factor de necrosis tu-moral (TNF-); y el subtipo 2 (Th2) libera IL-4, IL-5, IL-6, IL-9, IL-10 e IL-13.
Teniendo en cuenta que el melanoma es uno de los tumores más inmunogénicos, también es el arquetipo de tumor donde la intervención sobre el sistema inmunológico podría aplicarse en beneficio del paciente en la práctica clínica. Por ello, en este trabajo nos propusimos investigar si los niveles de distintos tipos de citocinas en suero de pacientes con melanoma se modificaban con la evolución de la enfermedad. Si así fuera, los niveles de dichas citocinas podrían considerarse como marcadores con valor pronóstico en pacientes con melanoma y servirían para identificar aquellos enfermos con mejor capacidad de respuesta a cada tratamiento. Además, la medición de estas citocinas podría ser útil para controlar el efecto de la inmunoterapia u otros tratamientos, con criterios más funcionales y adaptados a cada paciente de manera individualizada, y servir de ayuda para detectar fallos terapéuticos y la necesidad de un tratamiento alternativo. Incluso si los niveles de determinadas citocinas fueran útiles para predecir el pronóstico y la evolución del melanoma, se podría pensar en su aplicación para establecer una clasificación más completa de los enfermos con melanoma, de modo análogo a lo ocurrido con la lactato deshidrogenasa sérica, incluida en la última clasificación del American Joint Committee on Cancer para la estadificación de enfermos con melanoma9 .
Por lo tanto, teniendo en cuenta las consideraciones anteriores, en este trabajo nos propusimos analizar de forma prospectiva la variación en las concentraciones séricas de citocinas representativas de los fenotipos Th1 (IFN- e IL-15) y Th2 (IL-6 e IL-10) en enfermos con melanoma, para valorar si dichos cambios podrían relacionarse con la evolución de la enfermedad. Para valorar dicha evolución se tuvieron en cuenta dos parámetros: la aparición o no de metástasis y la supervivencia a los 30 meses. La elección de dichas citocinas se realizó en función de la facilidad de su detección y a sus funciones en el organismo. En este sentido, el IFN- colabora en la activación y diferenciación de los linfocitos T y B10 , es un potente activador de la capacidad citolítica de los monocitos y las células asesinas naturales (natural killer , NK), y es capaz de inhibir el crecimiento de células de melanoma11 . La IL-15 estimula la proliferación y activación de las células T, B y NK12 . La IL-6 estimula a los linfocitos T y timocitos e induce la maduración del linfocito B hacia la célula plasmática13 . Además, la IL-6 puede actuar como factor inhibidor o estimulador del crecimiento celular, dependiendo de la naturaleza de la célula diana14 . Finalmente, la IL-10 inhibe la proliferación de las células T específicas de antígeno y bloquea la liberación de citocinas proinflamatorias por los macrófagos activados15 . Aunque la IL-10 parece trabajar como un supresor general de las respuestas inmunitaria e inflamatoria, también puede incrementar la actividad de los linfocitos T citotóxicos16 .
MATERIAL Y MÉTODOS
PacientesSe incluyeron en el estudio, previo consentimiento informado, 33 pacientes con melanoma cutáneo primario, procedentes del Servicio de Dermatología del Hospital Universitario Virgen de la Arrixaca. Los criterios de exclusión fueron: melanoma metastásico u otro tipo de cáncer, enfermedades autoinmunes, inflamatorias e infecciosa e inmunodeficiencia o tratamiento inmunosupresor. En todos los casos el tumor primario fue extirpado hasta la fascia muscular, respetándola, con márgenes de piel sana perilesional de 1 a 2 cm. En 10 pacientes se realizó biopsia selectiva del ganglio centinela y en todos ellos se descartó infiltración maligna de dicho ganglio, tras cortes seriados y tinción con hematoxilina-eosina y HMB-45. En 16 pacientes se realizó tratamiento adyuvante con interfe-rón-2b (IFN-2b) subcutáneo a dosis bajas (3 millones de U), 3 veces por semana, durante 12 meses; en 5 casos se suspendió definitivamente el tratamiento entre 3 y 9 meses antes de la fecha prevista por intolerancia al mismo. En 3 casos que desarrollaron metástasis se administró quimioterapia y/o IFN-2b en dosis altas, siempre después de haber extraído la cuarta y última muestra de sangre.
Grupos de estudioLos pacientes se clasificaron en grupos de estudio siguiendo diversos criterios. En cuanto a la aparición de metástasis a lo largo de los 30 meses de seguimiento: no metástasis (grupo NM [no metástasis]); metástasis regionales (grupo MR [metástasis regionales]); metástasis viscerales (grupo MV [metástasis viscerales]). Cuando un mismo enfermo tuvo metástasis regionales y viscerales, se incluyó en el grupo MV. En cuanto a la supervivencia a los 30 meses, vivos frente a fallecidos. Y en cuanto al espesor de Breslow, se simplificó dividiendo en dos grupos: menor o igual a 2 mm frente a mayor de 2 mm.
TABLA 1. ANTICUERPOS MONOCLONALES UTILIZADOS PARA CUANTIFICAR IL-10 E IFN-
Además, se estudiaron el tipo histológico (melanoma de extensión superficial, nodular, lentiginoso acral o lentigo maligno melanoma), la presencia o no de ulceración, la intensidad del infiltrado inflamatorio peritumoral (nulo, escaso o intenso) y la presencia o no de regresión. Y también se tuvo en cuenta la administración o no de IFN-2b durante el periodo de recogida de muestras de sangre.
Muestras de sueroSe obtuvieron semestralmente muestras de sangre periférica hasta conseguir un total de cuatro muestras por paciente. La primera muestra se recogió en el momento de la inclusión en el estudio (muestra basal) y la última a los 18 meses de la inclusión. La sangre se recogía en tubos de vidrio no heparinizados, se mantenía a temperatura ambiente hasta la retracción del coágulo y se centrifugaba durante 10 min a 840 g. Después, el suero era alicuotado en dos tubos y congelado a –70 °C.
Cuantificación de citocinas séricasSe determinaron cuatro tipos de citocinas mediante técnica de enzimoinmunoabsorción ligada a enzimas (ELISA): IFN- e IL-15, como representativas del fenotipo Th1 e IL-6 e IL-10 como representativas del fenotipo Th2. En el caso de la IL-10 y el IFN-, la determinación se realizó usando como anticuerpos de captura, anticuerpos monoclonales purificados antiinterleucinas humanas y, para el revelado, anticuerpos monoclonales biotinilados que reconocían diferentes epítopos de la interleucina correspondiente (tabla 1). Como estándar se utilizó cada interleucina en su forma recombinante obtenida comercialmente. Para el análisis de la IL-6 y la IL-15, se usaron métodos comerciales disponibles en el mercado (tabla 2).
SeguimientoUna vez finalizado el periodo de obtención de muestras, todos los pacientes se mantuvieron en observación clínica durante 12 meses, de modo que el período total de seguimiento fue de 30 meses. Las visitas de seguimiento se realizaron trimestralmente e incluían exploración física completa, hemograma y bioquímica general. Además, anualmente se realizó a los pacientes una radiografía simple de tórax y una ecografía hepática. Dependiendo de la sintomatología del enfermo y de los resultados de las pruebas complementarias habituales, se solicitaron otras técnicas como tomografía computarizada, resonancia magnética, gammagrafía ósea, tránsito gastrointestinal y/o endoscopia digestiva.
Métodos estadísticosPara los niveles de citocinas en los distintos grupos de pacientes se calcularon los parámetros descriptivos: media, error de la media, desviación estándar y varianza. La comparación de los niveles basales de citocinas se llevó a cabo mediante el test de Mann-Whit-ney, prueba no paramétrica para muestras independientes. Por otra parte, el análisis de la evolución de los niveles de citocinas se efectuó aplicando un análisis de varianza de medidas repetidas relativo a un diseño factorial jerarquizado. Cuando dicho análisis de varianza reveló que existían diferencias entre un número de grupos de pacientes superior a dos, como ocurría al estudiar la aparición de metástasis, se empleó la prueba de Bonferroni, que utiliza pruebas t para realizar comparaciones por pares entre las medias de los grupos.
TABLA 2. REACTIVOS USADOS PARA CUANTIFICAR IL-6 E IL-15
RESULTADOS
Datos histológicos del tumor primarioEl espesor medio del total de melanomas era de 2,18 ± 1,75 mm (rango, 0,20-6,70 mm); de ellos, 12 (36,4 %) tenían menos de 1 mm de espesor, 6 (18,2 %) entre 1,01 y 2 mm, 11 (33,2 %) entre 2,01 y 4 mm, y 4 (12,1 %) más de 4 mm. El melanoma de extensión superficial fue el tipo histológico más frecuente (54,5 %), seguido en orden decreciente de frecuencia por el melanoma nodular (27,3 %), el melanoma lentiginoso acral (15,2 %) y el lentigo maligno melanoma (3,0 %). Existía un predominio de las lesiones no ulceradas (81,8 %) sobre las ulceradas (18,2 %) y de las que no presentaban regresión (84,8 %) sobre las que sí (15,2 %).
Desarrollo de metástasisA los 30 meses del inicio del estudio, 9 pacientes habían desarrollado metástasis; tres de ellos sólo regionales (grupo MR) y cinco viscerales (grupo MV). El tiempo medio hasta la aparición de las metástasis viscerales en el grupo MV fue de 14,65 ± 6,30 meses (rango, 6,1-19,7 meses).
SupervivenciaTras 30 meses de seguimiento, 29 pacientes (87,9 %) permanecían vivos y el resto (12,1 %) había fallecido por el melanoma. El tiempo medio hasta el fallecimiento fue de 26,37 ± 2,88 meses (rango, 22,6-29,6 meses).
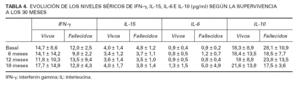
Niveles séricos de citocinasEl nivel basal de citocinas de tipo Th1 (IFN- e IL-15) no varió de manera significativa entre los distintos grupos de pacientes (tablas 3-5). Con respecto a las citocinas de tipo Th2, el nivel basal de IL-6 no difería significativamente entre los diversos grupos de enfermos (tablas 3-5) (fig. 1). En cambio, la IL-10 ba-sal era más alta en el grupo de enfermos que fallecieron que en los supervivientes (p = 0,05) (tabla 4), así como en el grupo de pacientes con metástasis viscerales en comparación con los que sufrieron metástasis regionales (p = 0,01) y con los que no desarrollaron metástasis (p = 0,02) (tabla 5) (fig. 2), si bien no se demostraron cambios significativos en relación con el espesor de Breslow (tabla 3).
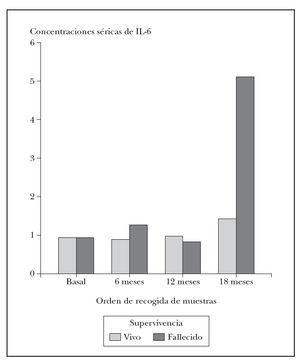
En cuanto a las variaciones a lo largo del tiempo de los niveles de citocinas, al igual que hemos visto con los valores basales, tampoco se demostraron diferencias cuando se comparó la evolución de los niveles de IFN- e IL-15 entre los distintos grupos de estudio (tablas 3-5). Por el contrario, los niveles de IL-6 sí evolucionaron de modo distinto a lo largo del tiempo en el grupo de enfermos que fallecieron, en comparación con los supervivientes (p < 0,01), de modo que en estos últimos las cifras medias de IL-6 permanecieron bastante estables en el tiempo, mientras que en los pacientes que fallecieron se observó un aumento de IL-6 sérica en la última muestra (tabla 4) (fig. 1). Como parecería lógico teniendo en cuenta lo anterior, la IL-6 también aumentó en la última muestra tanto de los pacientes con melanomas de espesor de Breslow superior a 2 mm como en los pacientes del grupo MV, aunque no se llegó a alcanzar significación estadística (tablas 3 y 5). Con respecto a la IL-10, resultó llamativo un descenso progresivo de sus cifras en el grupo de pacientes que fallecieron (p < 0,05) (tabla 4). También resultó significativa la diferente variación experimentada por la IL-10 sérica al comparar los tres grupos NM, MR y MV entre sí (p < 0,01), con un descenso progresivo de IL-10 en el grupo MV, unos niveles estables en el grupo NM y un ascenso en el grupo MR (tabla 5) (fig. 2). Sin embargo, no se observó ninguna relación entre la variación de los niveles séricos de IL-10 y el espesor de Breslow (tabla 3).
TABLA 3. EVOLUCIÓN DE LOS NIVELES SÉRICOS DE IFN-, IL-15, IL-6 E IL-10 (pg/ml) EN RELACIÓN CON EL ESPESOR DE BRESLOW
TABLA 4. EVOLUCIÓN DE LOS NIVELES SÉRICOS DE IFN-, IL-15, IL-6 E IL-10 (pg/ml) SEGÚN LA SUPERVIVENCIA A LOS 30 MESES
TABLA 5. EVOLUCIÓN DE LOS NIVELES SÉRICOS DE IFN-, IL-15, IL-6 E IL-10 (pg/ml) SEGÚN LA APARICIÓN Y TIPO DE METÁSTASIS (GRUPOS NM FRENTE A MR FRENTE A MV)
Tampoco se observó ninguna variación significativa de los niveles séricos de ninguna de las citocinas estudiadas en relación con el tipo histológico de melanoma, con la ulceración, con la intensidad del infiltrado inflamatorio, ni con la regresión del tumor (datos no mostrados).
Con respecto a los posibles efectos del tratamiento con IFN-2b sobre los niveles séricos de las citocinas estudiadas en este trabajo, se realizó un análisis de dichos niveles agrupando las muestras obtenidas cuando cada paciente estaba siendo tratado con IFN-2b y separándolas del resto de muestras. Se compararon los niveles de cada citocina entre las distintas muestras dentro de cada individuo y dentro de cada grupo de pacientes estudiado, y en ningún caso se apreciaron cambios significativos ni tendencia alguna que llamara la atención (datos no mostrados).
Fig. 1.—Evolución de los niveles séricos de IL-6 (pg/ml) en los pacientes agrupados según la supervivencia o no tras 30 meses de seguimiento. En la última muestra se apreció un incremento de IL-6 en el grupo de enfermos que fallecieron posteriormente.
Fig. 2.—Evolución de los niveles séricos de IL-10 (pg/ml) en los distintos grupos de pacientes según la aparición y tipo de metástasis. En la primera muestra, los niveles fueron más altos en los enfermos que desarrollaron metástasis viscerales que en el resto.
DISCUSIÓN
En los últimos años, una gran cantidad de estudios ha ido dirigida a definir las características de la célula tumoral que le permiten escapar a la vigilancia in-munológica17,18 . Sin embargo, la capacidad de rechazar o «tolerar» el tumor también puede depender de la predisposición individual para elaborar respuestas inmunitarias antitumorales eficientes o no19 . A pesar de ello, hasta el momento son más escasos los trabajos encaminados a estudiar la capacidad defensiva antitumoral propia de cada individuo, la cual, probablemente, está modulada por las propias células malignas20 .
Se ha demostrado que la producción de citocinas tiene un papel primordial en el resultado final de la lucha antitumoral por parte del sistema inmunitario21 . La transducción de células tumorales con genes de determinadas citocinas puede conducir al rechazo de dichas células modificadas genéticamente y favorecer la inmunidad sistémica contra células del mismo tumor en caso de un contacto posterior22 . Estos resultados se corroboran clínicamente con la existencia de pacientes que muestran regresión de un melanoma después de administrarles inmunoterapia adyuvante23 .
El estudio de la posible interacción entre los diversos tipos de citocinas y las células de melanoma se ha llevado a cabo por distintos medios. Por una parte, se han publicado trabajos centrados en el estudio de la expresión local del ARN mensajero de citocinas en lesiones de melanoma21,24,25 . Otros autores han determinado las concentraciones de citocinas, como IL-10 o IFN-, en cultivos de células de melanoma26,27 . Los valores séricos o plasmáticos de determinadas citocinas, fundamentalmente las de fenotipo Th2, como la IL-6 o la IL-10, también pueden correlacionarse con la carga tumoral del melanoma y/o con el estadio más
o menos avanzado de dicha enfermedad, es decir, con la aparición de metástasis28-34 .
Se ha demostrado una correlación entre la mayor presencia de citocinas de tipo Th1 y la mayor respuesta inmunitaria frente al melanoma24 . Sin embargo, en la serie de pacientes aquí estudiada no se ha podido demostrar ninguna relación entre los niveles séricos de IFN- e IL-15 y la progresión del melanoma, quizá porque los cambios sistémicos en los niveles de citocinas son más difíciles de demostrar que los cambios locales. No obstante, en nuestra serie se observó una tendencia en los pacientes que fallecieron a presentar niveles medios más bajos de IFN- sérico. También hay que tener en cuenta que existen datos contradictorios con respecto al efecto del IFN- sobre las células de melanoma humano, pues el IFN- puede incrementar la actividad citolítica de las células efectoras de la inmunidad e inhibir directamente el crecimiento de las células de melanoma11 , pero el tratamiento de las células de melanoma con IFN- también puede dar lugar a un fenotipo biológicamente más agresivo de dichas células11 , lo cual puede contribuir a la diseminación tumoral. Por lo tanto, las acciones supuestamente beneficiosas del IFN- podrían compensarse con las potencialmente negativas.
En los pacientes que fallecieron durante el período de seguimiento se observó un incremento significativo de las concentraciones séricas de IL-6 en la última muestra de sangre. De aquí ya se puede intuir que la IL-6 podría influir en la evolución clínica de los pacientes con melanoma. Como hemos visto con el IFN-, en el caso de la IL-6 también existen datos contrapuestos sobre su papel favorecedor o inhibidor de la progresión del melanoma. Así, se ha descrito que la IL-6 se comporta como una citocina inhibidora del crecimiento de las células de melanoma en estadios tempranos de la enfermedad, cuando el melanoma está en la fase de crecimiento radial28 , pues dicha citocina estimula la diferenciación de las células citotóxicas35 e induce la expresión tanto de IL-2R como la producción de IL-2 por las células T activadas36 . Sin embargo, las células procedentes de melanomas más avanzados (en fase de crecimiento vertical y metastásicos) son resistentes al efecto antiproliferativo de la IL-628 . Este comportamiento parece característico de las células de melanoma, neoplasia paradigma de la capacidad de desarrollar resistencia, parcial o completa, a la acción de múltiples citocinas durante la progresión tumoral37 . Además, aunque pueda resultar paradójico, en estadios avanzados de la enfermedad, la IL-6 puede incluso comportarse como un factor estimulante del crecimiento de las células de melanoma37 , fenómeno ya descrito en células de mieloma múltiple38 . De hecho, las células humanas de melanoma pueden producir IL-6 en estadios avanzados de la enfermedad39 . Otro efecto negativo de la IL-6 en altas concentraciones es que inhibe la proliferación de las células T40 y favorece la angiogénesis tumoral41 . Algunos autores han demostrado una correlación positiva entre los niveles séricos de IL-6 en enfermos con melanoma y la carga tumoral31 . Por lo tanto, la elevación de la IL-6 sérica en enfermos con melanoma se correlaciona también con la progresión de la enfermedad y con menores tasas de supervivencia32 , y puede predecir una falta de respuesta a la inmunoterapia31 . Nuestros resultados apoyan que un aumento de la IL-6 sérica se asocia con una mayor mortalidad en los enfermos con melanoma32 . En consecuencia, la medición seriada de las concentraciones séricas de IL-6 podría tener valor predictivo del pronóstico de los pacientes con melanoma y, por lo tanto, ser útil en su seguimiento. Tras un aumento marcado de los niveles de IL-6 sérica se debería estar más alerta ante la posible aparición de metástasis sistémicas. En estos casos podría ser aconsejable acortar el intervalo entre las revisiones médicas o realizar exploraciones complementarias más exhaustivas.
La IL-10 puede funcionar como una citocina supresora de la respuesta inmunitaria e inflamato-15,42,43 , lo cual parece congruente con el aumento de IL-10 sérica, descrito por distintos autores, en pacientes con melanomas metastásicos29,30,33 . Es posible que la IL-10 permita al tumor evitar o disminuir el ataque del sistema inmunitario, mediante un efecto inmunosupresor44 . Las diferencias observadas en los niveles basales de IL-10 sérica en nuestra serie parecen apoyar lo anterior, pues se observó una elevación de la IL-10 sérica en el grupo de pacientes que desarrollaron metástasis viscerales y en los que fallecieron. Sin embargo, no hemos encontrado una explicación al hecho de que, pasado el primer año tras el diagnóstico del melanoma, se igualaron las concentraciones séricas de IL-10 en todos los pacientes independientemente del desarrollo de metástasis. El papel de la IL-10 como reguladora de la respuesta inmunitaria frente al melanoma no es tan simple como pueda parecer. De hecho, el pronóstico más pobre que se ha atribuido a los melanomas que se asocian con niveles séricos elevados de IL-1029,33,45 , no ha sido confirmado por todos los autores. La IL-10 también puede inhibir el crecimiento de las células de melanoma humano, suprimiendo la aparición de metástasis, gracias a su efecto antiangiogénico46 ; además, la IL-10 es capaz de ejercer un efecto antitumoral a través de un mecanismo dependiente de las células NK47 y la administración sistémica de IL-10 puede inducir una respuesta inmunitaria efectiva y específica contra células de melanoma48 . Quizá por todo lo anterior, los pacientes con melanoma que presentan genotipos asociados a baja expresión de IL-10 parecen tener un peor pronóstico que aquellos que tienen más capacidad de secreción de IL-1049 . De hecho, en otras neoplasias, como el mieloma múltiple, los niveles más elevados de IL-10 sérica no sólo no implican una peor evolución, sino que están asociados con un buen pronóstico50 .
Tras estudios controlados, aleatorizados, multicéntricos, realizados a largo plazo, se ha llegado a la conclusión de que las dosis bajas de IFN- no mejoran ni la supervivencia ni el tiempo libre de enfermedad en pacientes con melanoma de alto riesgo51,52 . Por lo tanto, hoy día se considera que el IFN- en dosis bajas no ejerce un efecto clínico objetivable en estos pacientes, al contrario de lo que parece ocurrir con las elevadas dosis53 . Nuestros datos, aunque preliminares, parecen encajar con lo anterior, es decir, que igual que el IFN- a dosis bajas no afecta significativamente el curso del melanoma, tampoco se asocia con cambios significativos en los niveles séricos de IL-15, IFN-, IL-6 ni IL-10.
A modo de resumen, según lo observado en nuestra serie, la determinación de las citocinas de tipo Th2 (IL-6 e IL-10) en el suero de pacientes con melanoma podría ser útil en el seguimiento clínico de estos enfermos y servir como factor predictivo de la mejor o peor evolución de la enfermedad. Además, dicha información sería adicional a la proporcionada por el espesor de Breslow, pues los niveles de dichas citocinas no se asocian significativamente con el grosor tu-moral. Por el contrario, la determinación de los niveles séricos de las citocinas de tipo Th1 (IL-15 e IFN-) no parece de tanta utilidad a la hora de orientar sobre el pronóstico. La IL-10 sérica proporcionaría información pronóstica desde el momento inicial, cercano a la extirpación del tumor, en el sentido de un peor pronóstico para los enfermos con niveles séricos basales de IL-10 elevados. Sin embargo, en las sucesivas muestras, los niveles séricos de IL-10 no son fiel reflejo de la aparición de metástasis. En el caso de la IL-6 sérica, lo que parece más interesante es su determinación se-riada, pues es su aumento desde valores más bajos el que podría servir como marcador de mal pronóstico. En cualquier caso, la realización de medidas repetidas de las concentraciones séricas tanto de IL-6 como de IL-10 en pacientes con melanoma podría tener aplicación en la práctica clínica, aportando información adicional a la del espesor de Breslow para emitir un pronóstico vital. Esta información resultaría más dinámica que el mencionado índice de Breslow y vendría a reflejar una parcela del estado del sistema inmunitario del sujeto portador del melanoma y de la interacción entre el huésped y el tumor. Además debería investigarse si los niveles séricos de IL-6 y/o IL-10 pueden servir para monitorizar el efecto de la inmunoterapia en pacientes con melanoma.
A la vista de estos resultados, sería interesante la continuación del estudio en un mayor número de pacientes con melanoma y su comparación con lo que ocurre en sujetos sanos, de modo que se pueda establecer con más exactitud el carácter de susceptibilidad o protección frente al desarrollo de melanoma que pueden ejercer los distintos niveles de citocinas séricas en el ser humano, especialmente las citocinas de tipo Th2, así como su posible asociación con el mejor o peor pronóstico en enfermos con melanoma.
AGRADECIMIENTOS
Los autores quieren expresar su agradecimiento a José Miguel Alemany y María José Sanchis, ATS ambos del Servicio de Inmunología del Hospital Universitario Virgen de la Arrixaca, por su disponibilidad para realizar las extracciones de sangre periférica a los pacientes aquí estudiados.
Correspondencia:
Jorge A. Martínez-Escribano. Servicio de Dermatología. Hospital Universitario Virgen de la Arrixaca. 30120 El Palmar. Murcia. España. jmescribano@huva.es
Recibido el 15 de julio de 2004. Aceptado el 28 de diciembre de 2004.