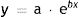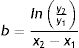La pandemia del coronavirus SARS-CoV-2 ha provocado un confinamiento indefinido. Una posible consecuencia de esta situación es un retraso en los procedimientos asistenciales de las enfermedades oncológicas. El objetivo de este estudio es estimar el hipotético impacto en la supervivencia que tendría el aumento del tamaño tanto para los carcinomas de células escamosas (CCE) como de los melanomas.
Material y métodoEstudio observacional retrospectivo de cohorte multicéntrico. Se desarrolló un modelo de crecimiento exponencial para cada tumor basado en el tiempo de evolución que refiere el paciente.
ResultadosSe incluyeron un total de 200 pacientes con CCE localizados en la cabeza y el cuello y 1.000 pacientes con melanoma cutáneo. Se calculó una curva de crecimiento exponencial para cada tumor y se estimó el tamaño del tumor tras 1, 2 y 3 meses tras el diagnóstico. En la muestra, los CCE mayores de 4cm o >6mm de grosor (definidos como T3) pasaron de 83 (41,5%) en el grupo de estudio real a una estimación del 58,5, 70,5 y 72% tras 1, 2 y 3 meses de retraso quirúrgico estimado, respectivamente. Se estimó una disminución de la supervivencia específica de enfermedad (SEE) de un 6,2, 8,2 y 5,2% a los 2, 5 y 10 años, respectivamente, tras 3 meses de retraso. Para los melanomas ultragruesos (>6mm de Breslow) pasaron del 6,9% en el grupo de estudio al 21,9, 30,2 y 30,2% tras 1, 2 y 3 meses de demora. La SEE a los 5 y 10 años del grupo de estudio descendió un 14,4% en ambos tiempos.
ConclusionesEn ausencia de un adecuado diagnóstico y tratamiento de los pacientes con CCE y melanoma en la actual situación de confinamiento en España, podemos llegar a asistir a un considerable aumento de los casos de CCE y melanomas gruesos y de gran tamaño. Se deben fomentar los esfuerzos para promocionar la autoexploración y facilitar el acceso a los dermatólogos para no aumentar la demora de estos pacientes.
Spain is in a situation of indefinite lockdown due to the ongoing coronavirus disease 2019 (COVID-19) pandemic. One of the consequences of this lockdown is delays in medical and surgical procedures for common diseases. The aim of this study was to model the impact on survival of tumor growth caused by such delays in patients with squamous cell carcinoma (SCC) and melanoma.
Material and methodsMulticenter, retrospective, observational cohort study. We constructed an exponential growth model for both SCC and melanoma to estimate tumor growth between patient-reported onset and surgical excision at different time points.
ResultsData from 200 patients with SCC of the head and neck and 1000 patients with cutaneous melanoma were included. An exponential growth curve was calculated for each tumor type and we estimated tumor size after 1, 2, and 3 months of potential surgical delay. The proportion of patients with T3 SCC (diameter >4cm or thickness >6mm) increased from 41.5% (83 patients) in the initial study group to an estimated 58.5%, 70.5%, and 72% after 1, 2, and 3 months of delay. Disease-specific survival at 2, 5, and 10 years in patients whose surgery was delayed by 3 months decreased by 6.2%, 8.2%, and 5.2%, respectively. The proportion of patients with ultrathick melanoma (>6mm) increased from 6.9% in the initial study group to 21.9%, 30.2%, and 30.2% at 1, 2, and 3 months. Five- and 10-year disease-specific survival both decreased by 14.4% in patients treated after a potential delay of 3 months.
ConclusionsIn the absence of adequate diagnosis and treatment of SCC and melanoma in the current lockdown situation in Spain, we can expect to see to a considerable increase in large and thick SCCs and melanomas. Efforts must be taken to encourage self-examination and facilitate access to dermatologists in order to prevent further delays.
La pandemia del coronavirus SARS-CoV-2, que surgió en Wuhan, China hace varios meses1, ha llevado a un confinamiento a gran escala en muchos países del mundo, incluido España. La incertidumbre sobre la duración de estas medidas nos ha llevado a considerar el potencial impacto de un retraso en el diagnóstico y el tratamiento debido a la paralización de ciertos procedimientos y servicios de salud en el pronóstico de los pacientes con cáncer de piel. En el cáncer de piel es conocida la relación entre la demora diagnóstica y un mayor diámetro de la lesión2. Además, parece que el tamaño al diagnóstico tanto para los carcinomas de células escamosas (CCE)3–5 como para el melanoma6,7 depende no solo de su tiempo de demora, sino también de la tasa de crecimiento.
El objetivo del presente estudio es estimar el tamaño y el grosor de los CCE y el grosor de los melanomas, los 2 tumores cutáneos con una mayor mortalidad8, así como su supervivencia en un escenario de demora en los procedimientos diagnósticos de 1, 2 y 3 meses.
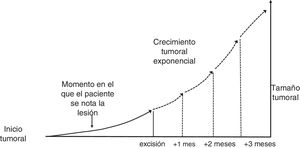
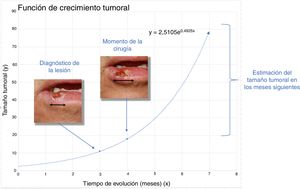
Material y métodoDescripción de la base teórica y casos problemasEl presente estudio se basa en la asunción clásica de un crecimiento exponencial de los tumores (fig. 1)9. Aunque se puede aducir que los tumores crecen en base a una función gompertziana, de tipo sigmoideo, podemos decir que ambos modelos son superponibles cuando el tumor es relativamente pequeño10.
La función exponencial, la cual relaciona la variable dependiente y (tamaño de la lesión) y la variable independiente x (tiempo) se expresa como sigue:
Donde a y b son 2 parámetros ajustables. De ello se deduce que al inicio del crecimiento del tumor (x = 0), a es el tamaño inicial del tumor y=a·e0. El coeficiente b es un coeficiente que determina el crecimiento del tumor, cuanto mayor es b más rápido crece el tumor.
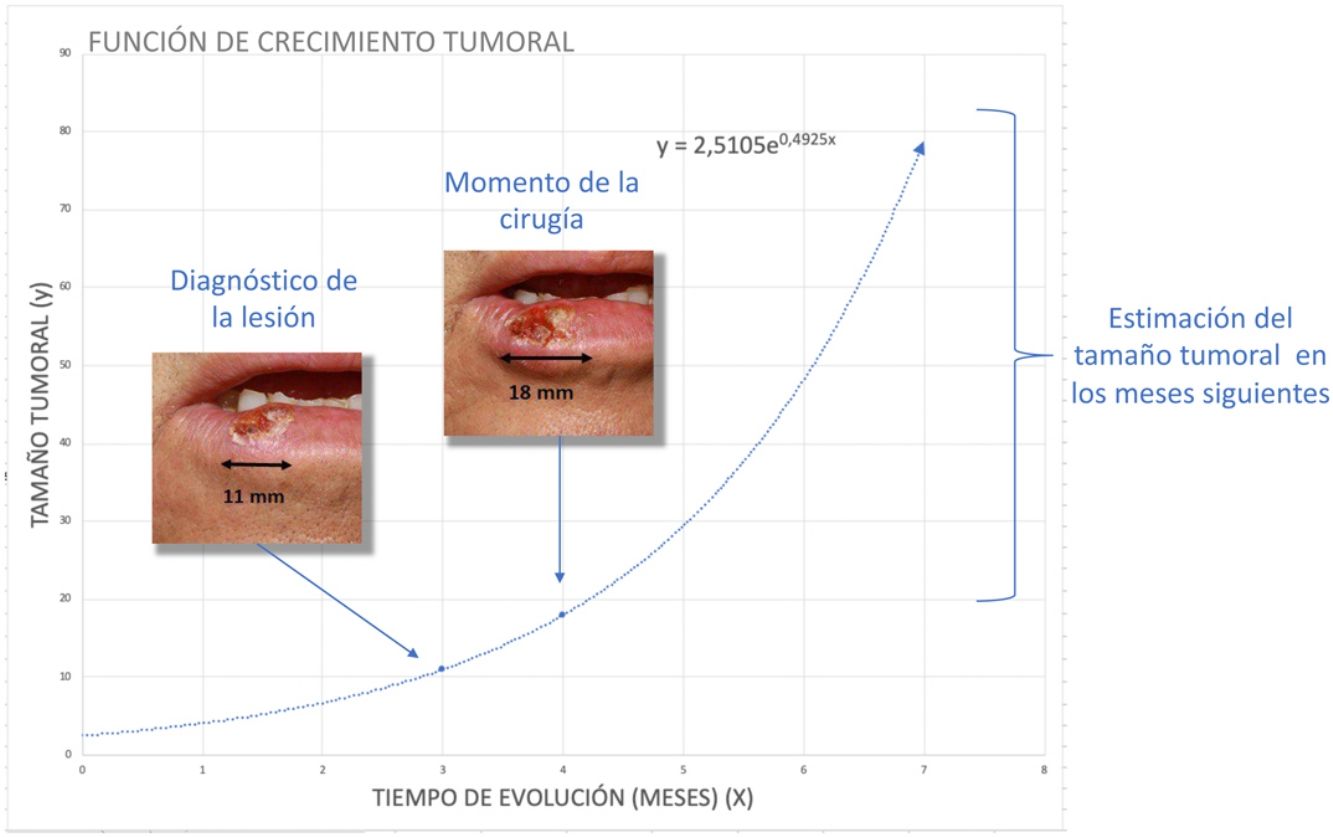
Para el cálculo de la función exponencial de crecimiento tumoral de cada caso se requieren 2 puntos en 2 momentos diferentes en los que se conozcan los valores de x (tiempo) e y (tamaño). Así, el tamaño inicial y1 se define como el tamaño en el que el paciente o su familiar notan la lesión por primera vez mientras que y2 es el tamaño en el momento de la cirugía del tumor. Por otro lado, x1 se consideró el momento en el que se notaron la lesión por primera vez y x2 al momento de la segunda medición, la cirugía del tumor. Debido a que y1 (tamaño de la lesión cuando el paciente o sus familiares notan la lesión por primera vez) es una incertidumbre, se estimó para ambos tumores.
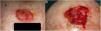
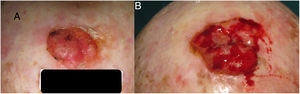
Para el CCE se calculó a partir de los datos obtenidos de una serie de 6 casos en los que sí se tenía registrado el diámetro tumoral en 2 momentos diferentes (fig. 2) (Tabla 1 del material suplementario). Se calculó la función exponencial de crecimiento para cada uno estos casos (fig. 3). El coeficiente a de cada uno de estos casos refleja el diámetro de la lesión en el momento y1, es decir, cuando el paciente se lo notó por primera vez. La media de estas 6 mediciones (a=8,75mm) se utilizó como coeficiente a para la estimación de la función de crecimiento de los CCE del estudio. De igual forma se procedió con el grosor de los carcinomas. De los 6 casos mencionados, se conocía el grosor de 4 casos. Para estimar el grosor del tumor en el momento del diagnóstico (y1) se calculó como una estimación proporcional del diámetro en el momento de la observación inicial calculado anteriormente. De esta forma, la media del grosor medio en el momento del diagnóstico (y1) de los carcinomas se calculó en 1,2mm. Este valor se aplicó al resto de la muestra como coeficiente a para calcular la función exponencial de cada caso del estudio.
Para el melanoma no se disponían de casos con una medición del índice de Breslow en 2 momentos diferentes para hacer una estimación similar al carcinoma. Por lo que se estableció 0,2mm de Breslow como coeficiente a, asumiendo que es un mínimo suficiente en milímetros para que un melanoma que ha comenzado su crecimiento en fase vertical sea notado por el paciente y se consideró como tiempo x2 el transcurrido desde que el paciente notó que tenía la lesión hasta la exéresis.
Una vez determinado el tamaño inicial, el coeficiente b de la función exponencial se obtiene de la siguiente forma:
Una vez obtenido la función exponencial para cada caso se calcula el tamaño y grosor de cada caso para los CCE y el grosor solo para los melanomas para los 3 meses siguientes.
Para ello se escogieron al azar 200 casos de CCE y 1.000 casos de melanoma de las bases de datos respectivas.
La variable resultado principal del estudio fue describir el cambio en el tamaño estimado de los tumores cutáneos tras una demora de 1, 2 y 3 meses. Para tal fin, los datos fueron categorizados en función del tamaño o grosor. De esta forma, para el carcinoma de células escamosas se categorizó de forma similar a la clasificación de la American Joint Committee on Cancer (AJCC) para este tumor11. Se consideró T1 a los tumores ≤2cm, T2 a los tumores entre 2 y 4cm y T3 a los tumores >4cm o bien con un grosor >6mm. Con respecto a los melanomas se categorizaron en 6 grupos, similares al grosor determinado por la AJCC: <0,8, 0,8-1, >1-2, >2-4, >4-6 y >6mm. Estas últimas categorías de tumores gruesos no incluidas en la AJCC fueron consideradas teniendo en cuenta el valor pronóstico de los melanomas ultragruesos de reciente publicación12.
Además, los datos se analizaron de forma estratificada en función del sexo y la edad (≤vs.> de 80 años para los CCE y ≤vs.> de 70 años para el melanoma)12.
Para el otro objetivo del estudio, valorar la supervivencia específica de enfermedad (SEE) de cada categoría del estudio, esta se calculó tanto para el total de la muestra de estudio como para los distintos subgrupos estratificados por sexo y edad, tomando como referencia las curvas de supervivencia de las bases de datos de referencia (proyecto Squamata) para el CCE (n=434) (figs. 1-5 del material suplementario) y base de datos del Instituto Valenciano de Oncología (n=1.637) para el melanoma (figs. 6-10 del material suplementario). Una vez calculada la SEE para ambas bases de datos estratificada por grupos de riesgo como se ha descrito anteriormente, fue utilizada como referencia para ponderar la supervivencia una vez estimados los tamaños y grosores tras 1, 2 y 3 meses de potencial retraso en la cirugía. Para el cálculo y la estimación de las curvas de SEE se utilizó el método de Kaplan-Meier para todo el conjunto de datos de CCE y melanoma, así como estratificada por sexo y edad.
El estudio tiene la aprobación del Comité Ético del Hospital Universitario Reina Sofía Córdoba (Referencia 3958, acta n° 280).
ResultadosCarcinoma de células escamosasCon respecto a los CCE, de los 200 casos incluidos con un tiempo de evolución conocido, aproximadamente la mitad eran tumores de menos de 2cm (52%), solo 13 (6,5%) tenían un tamaño entre 2-4cm y 83 (41,5%) eran tumores de >4cm o >6mm de grosor (tabla 1). Este último grupo aumentó su frecuencia en 58,5, 70,5 y 72% en la estimación para 1, 2 y 3 meses de retraso, respectivamente.
Diámetro tumoral y grosor al diagnóstico tras una estimación de 1, 2 y 3 meses de demora basado en un crecimiento exponencial de 200 carcinomas de células escamosas de la región de la cabeza y cuello de la base de datos Squamata
| Grupo de riesgo | Grupo de estudio, n (%) | Demora diagnóstica de un mes, n (%) | Demora diagnóstica de 2 meses, n (%) | Demora diagnóstica de 3 meses, n (%) |
|---|---|---|---|---|
| ≤2cm de diámetro | 104 (52) | 63 (31,5) | 45 (22,5) | 43 (21,5) |
| >2-4cm de diámetro | 13 (6,5) | 20 (10) | 14 (7) | 13 (6,5) |
| >4cm de diámetro o >6mm de grosor | 83 (41,5) | 117 (58,5) | 141 (70,5) | 144 (72) |
| Supervivencia estimada a los 2 añosa; % | 86,1 | 82,4 | 80,2 | 79,9 |
| Supervivencia estimada a los 5 añosa; % | 80,2 | 75,5 | 72,4 | 72 |
| Supervivencia estimada a los 10 añosa; % | 70,8 | 68,2 | 65,9 | 65,6 |
La SEE del grupo de estudio fue del 86,1, 80,2 y 70,8% a los 2, 5 y 10 años, respectivamente. La estimación de la SEE desciende progresivamente con los meses de retraso llegando a ser del 79,9, 72 y 65,6% a los 2, 5 y 10 años tras 3 meses de retraso, respectivamente.
En el análisis estratificado por sexos, se observaba que el sexo femenino tiene una peor SEE a los 5 (75,2 vs. 83,3%) y 10 (65,3 vs. 77,6%) años con respecto a los varones en el grupo de estudio y, además, va descendiendo con los sucesivos meses de retraso hasta el tercer mes (68,5 vs. 72,6% a los 5 años) (tabla 2).
Diámetro tumoral y grosor al diagnóstico tras una estimación de 1, 2 y 3 meses de demora basado en un crecimiento exponencial de 200 carcinomas de células escamosas de la región de la cabeza y cuello estratificado por sexo de la base de datos Squamata
| Grupo de riesgo | Grupo de estudio | Demora diagnóstica de un mes | Demora diagnóstica de 2 meses | Demora diagnóstica de 3 meses | ||||
|---|---|---|---|---|---|---|---|---|
| Varón, n (%) | Mujer, n (%) | Varón, n (%) | Mujer, n (%) | Varón, n (%) | Mujer, n (%) | Varón, n (%) | Mujer, n (%) | |
| ≤2cm de diámetro | 68 (54) | 36 (48) | 40 (32) | 23 (30,7) | 28 (22,4) | 17 (22,7) | 26 (20,8) | 17 (22,7) |
| >2-4cm de diámetro | 8 (6,4) | 5 (6,7) | 11 (8,8) | 9 (12) | 10 (8) | 4 (5,3) | 10 (8) | 3 (4) |
| >4cm de diámetro o >6mm de grosor | 49 (39,2) | 34 (45,3) | 74 (59,2) | 43 (57,3) | 67 (69,6) | 54 (72) | 89 (71,2) | 55 (73,3) |
| Supervivencia estimada a los 2 añosa; % | 86,2 | 87,1 | 80,8 | 85,4 | 78,4 | 82,6 | 77,8 | 82,3 |
| Supervivencia estimada a los 5 añosa; % | 83,3 | 75,2 | 76,4 | 73,3 | 73,2 | 69 | 72,6 | 68,5 |
| Supervivencia estimada a los 10 añosa; % | 77,6 | 65,3 | 74 | 65,1 | 72,5 | 60,8 | 72 | 60,3 |
Con respecto a la estratificación por edad se observó una peor SEE en los mayores de 80 años con respecto a los menores en todas las franjas de supervivencia. Esta diferencia entre los ≤80 años vs.>80 años es máxima en la SEE a los 5 años con una estimación de 3 meses de retraso (79 vs. 58,7%) (tabla 3).
Diámetro tumoral y grosor al diagnóstico tras una estimación de 1, 2 y 3 meses de demora basado en un crecimiento exponencial de 200 carcinomas de células escamosas de la región de la cabeza y cuello estratificado por edad de la base de datos Squamata
| Grupo de riesgo | Grupo de estudio | Demora diagnóstica de un mes | Demora diagnóstica de 2 meses | Demora diagnóstica de 3 meses | ||||
|---|---|---|---|---|---|---|---|---|
| ≤80, n (%) | >80, n (%) | ≤80, n (%) | >80, n (%) | ≤80, n (%) | >80, n (%) | ≤80, n (%) | >80, n (%) | |
| ≤2cm de diámetro | 67 (59,8) | 37 (42) | 39 (34,8) | 24 (27,3) | 25 (22,3) | 20 (22,7) | 24 (21,4) | 19 (21,6) |
| >2-4cm de diámetro | 3 (2,7) | 10 (11,4) | 14 (12,5) | 6 (6,8) | 12 (10,7) | 2 (2,3) | 10 (8,9) | 3 (3,4) |
| >4cm de diámetro o >6mm de grosor | 42 (37,5) | 41 (46,6) | 59 (52,7) | 58 (65,9) | 75 (67) | 66 (75) | 78 (69,6) | 66 (75) |
| Supervivencia estimada a los 2 añosa; % | 90,9 | 84,9 | 88,8 | 81,6 | 86,5 | 80,4 | 85,9 | 73,5 |
| Supervivencia estimada a los 5 añosa; % | 85,7 | 72,7 | 83 | 66,5 | 79,8 | 63,7 | 79,0 | 58,7 |
| Supervivencia estimada a los 10 añosa; % | 74,8 | 67,3 | 74,8 | 62,9 | 72,6 | 60,8 | 71,8 | 55,9 |
La mayoría de los casos del grupo de estudio eran melanomas finos (29,8% en el grupo <0,8 mm y 10,4% en el grupo 0,8-1 mm), mientras que el grupo de los melanomas gruesos y ultragruesos era el menos numeroso (9,1% en el grupo 4-6 mm y 6,9% en el grupo > 6 mm) (tabla 4). Este último grupo de melanomas ultragruesos era el que experimenta un mayor aumento porcentual tras 1, 2 y 3 meses de retraso (21,9, 30,2 y 30,2%). La SEE a los 5 y 10 años del grupo de estudio es del 85,7 y 79,4%. Se observaba un descenso abrupto de la misma progresivamente con los sucesivos meses de demora, siendo máxima con el tercer mes de demora (71,3 y 65% a los 5 y 10 años, respectivamente).
Grosor tumoral al diagnóstico y grosor estimado tras 1, 2 y 3 meses de demora diagnóstica basado en el crecimiento exponencial de 1.000 melanomas de la base de datos del Instituto Valenciano de Oncología
| Grupo de riesgo | Grupo de estudio, n (%) | Demora diagnóstica de un mes, n (%) | Demora diagnóstica de 2 meses, n (%) | Demora diagnóstica de 3 meses, n (%) |
|---|---|---|---|---|
| <0,8 mm | 298 (29,8) | 253 (25,3) | 220 (22) | 204 (20,4) |
| 0,8-1,0 mm | 104 (10,4) | 65 (6,5) | 57 (5,7) | 48 (4,8) |
| >1,0-2,0 mm | 259 (25,9) | 214 (21,4) | 188 (18,8) | 166 (16,6) |
| >2,0-4,0 mm | 179 (17,9) | 165 (16,5) | 164 (16,4) | 153 (15,3) |
| >4,0-6,0 mm | 91 (9,1) | 84 (8,4) | 69 (6,9) | 75 (7,5) |
| >6,0 mm | 69 (6,9) | 219 (21,9) | 302 (30,2) | 302 (30,2) |
| Supervivencia estimada a los 5 añosa; % | 85,7 | 79,5 | 76,3 | 71,3 |
| Supervivencia estimada a los 10 añosa; % | 79,8 | 73,1 | 69,7 | 65 |
En los datos estratificados por sexo (tabla 5) es destacable que la categoría de melanomas ultragruesos (>6mm) fue algo más frecuente en varones que en mujeres en el grupo de estudio (8 vs. 5,8%) y en el resto de las estimaciones a 1, 2 y 3 meses de demora. Su aumento era muy abrupto desde el primer mes de demora tanto en varones como en mujeres (27 vs. 16,8%) con un porcentaje máximo al tercer mes de demora (41,8 vs. 29%).
Grosor tumoral al diagnóstico y grosor estimado tras 1, 2 y 3 meses de demora diagnóstica basado en el crecimiento exponencial de 1.000 melanomas estratificado por sexo de la base de datos del Instituto Valenciano de Oncología
| Grupo de riesgo | Grupo de estudio | Demora diagnóstica de un mes | Demora diagnóstica de 2 meses | Demora diagnóstica de 3 meses | ||||
|---|---|---|---|---|---|---|---|---|
| Varón, n (%) | Mujer, n (%) | Varón, n (%) | Mujer, n (%) | Varón, n (%) | Mujer, n (%) | Varón, n (%) | Mujer, n (%) | |
| <0,8 mm | 122 (24,4) | 176 (35,2) | 106 (21,2) | 147 (29,4) | 93 (18,6) | 127 (25,4) | 84 (16,8) | 120 (24) |
| 0,8-1,0 mm | 39 (7,8) | 65 (13) | 24 (4,8) | 41 (8,2) | 21 (4,2) | 36 (7,2) | 19 (3,8) | 29 (5,8) |
| >1,0-2,0 mm | 129 (25,8) | 130 (26) | 99 (19,8) | 115 (23) | 91 (18,2) | 97 (19,4) | 77 (15,4) | 89 (17,8) |
| >2,0-4,0 mm | 109 (21,8) | 70 (14) | 81 (16,2) | 84 (16,8) | 74 (14,8) | 90 (18) | 74 (14,8) | 79 (15,8) |
| >4,0-6,0 mm | 61 (12,2) | 30 (6) | 55 (11) | 29 (5,8) | 42 (8,4) | 27 (5,4) | 37 (7,4) | 38 (7,6) |
| >6,0 mm | 40 (8) | 29 (5,8) | 135 (27) | 84 (16,8) | 179 (35,8) | 123 (24,6) | 209 (41,8) | 145 (29) |
| Supervivencia estimada a los 5 añosa; % | 82,8 | 89,2 | 75,7 | 83,5 | 73 | 79,8 | 70,7 | 77,5 |
| Supervivencia estimada a los 10 añosa; % | 76,1 | 83,5 | 68,8 | 77,2 | 66 | 73,2 | 63,6 | 70,9 |
La SSE a los 5 años fue superior en mujeres que en varones en el grupo de estudio (89,2 vs. 82,8%). Dicha supervivencia disminuye en ambos grupos durante los siguientes meses, siendo a los 3 meses de demora del 77,5% en las mujeres vs. 70,7% en los varones.
Finalmente, en la estratificación por edad, en el grupo de estudio, los melanomas gruesos eran más frecuentes en los mayores de 70 años, concretamente los tumores >4-6mm (16,8 vs. 7,2%) mientras que los melanomas ultragruesos eran similares para ambas categorías de edad (5,8 vs. 5%). Esta última categoría de grosor experimentaba un gran aumento con 1, 2 y 3 meses de retraso. En la estimación para 3 meses de retraso, las frecuencias estimadas para estos tumores eran elevadas tanto para los >70 años como para los ≤70 años (52 vs. 31,3%) (tabla 6).
Grosor tumoral al diagnóstico y grosor estimado tras 1, 2 y 3 meses de demora diagnóstica basado en el crecimiento exponencial de 1.000 melanomas estratificado por edad de la base de datos del Instituto Valenciano de Oncología
| Grupo de riesgo | Grupo de estudio | Demora diagnóstica de un mes | Demora diagnóstica de 2 meses | Demora diagnóstica de 3 meses | ||||
|---|---|---|---|---|---|---|---|---|
| ≤70 años, n (%) | >70 años, n (%) | ≤70 años, n (%) | >70 años, n (%) | ≤70 años, n (%) | >70 años, n (%) | ≤70 años, n (%) | >70 años, n (%) | |
| <0,8mm | 265 (33) | 33 (16,8) | 222 (27,6) | 31 (15,8) | 193 (24) | 27 (13,8) | 179 (22,3) | 25 (12,8) |
| 0,8-1,0 mm | 93 (11,6) | 11 (5,6) | 59 (7,3) | 6 (3,1) | 49 (6,1) | 8 (4,1) | 41 (5,1) | 7 (3,6) |
| >1,0-2,0mm | 218 (27,1) | 41 (20,9) | 185 (23) | 29 (14,8) | 166 (20,6) | 22 (11,2) | 146 (18,2) | 20 (10,2) |
| >2,0-4,0mm | 130 (16,2) | 49 (25) | 132 (16,4) | 33 (16,8) | 133 (16,5) | 31 (15,8) | 126 (15,7) | 27 (13,8) |
| >4,0-6,0mm | 58 (7,2) | 33 (16,8) | 57 (7,1) | 27 (13,8) | 53 (6,6) | 16 (8,2) | 60 (7,5) | 15 (7,7) |
| >6,0mm | 40 (5) | 29 (5,8) | 149 (18,5) | 70 (35,7) | 210 (26,1) | 92 (46,9) | 252 (31,3) | 102 (52) |
| Supervivencia estimada a los 5 añosa; % | 88,4 | 86,3 | 81,7 | 81,7 | 78,2 | 78,2 | 75,7 | 75,7 |
| Supervivencia estimada a los 10 añosa; % | 83,5 | 75,6 | 77,1 | 68,3 | 73,9 | 64,5 | 71,6 | 61,9 |
En la SEE, el grupo de >70 años era el que más descenso en la supervivencia mostró, pasando de una SEE a los 5 y 10 años del 86,3 y 75,6% en el grupo de estudio basal a una SEE a los 5 y 10 años del 75,7 y 61,9% en la estimación para 3 meses de retraso.
DiscusiónEl principal hallazgo del presente estudio es que en un hipotético escenario en el que se demore la extirpación de melanomas o CCE, se estima que aumenten de forma considerable la frecuencia de tumores grandes o gruesos con el consiguiente aumento estimado de mortalidad desde el primer mes de demora.
En las últimas semanas, los ciudadanos de nuestro país y de una gran cantidad de países viven confinados en sus casas debido a la pandemia del COVID-19. Se están invirtiendo muchos recursos y tiempo en la formación acerca de esta enfermedad y cómo manejarla durante estas semanas y en el futuro. Sin embargo, se está hablando poco de las posibles consecuencias indirectas que va a suponer la dedicación de la mayor parte de los recursos sanitario para el control de la COVID-19 y, por consiguiente, la desatención de otras enfermedades como las oncológicas. En las últimas semanas diversos gobiernos han decretado que no se atiendan los procesos médicos que puedan ser demorables. Sin embargo, la cirugía oncológica al no ser demorable debería seguir estando activa en el sistema sanitario. Aún así, es posible que se esté asistiendo de una forma alarmante a una disminución en la atención del paciente con procesos graves. En una clínica de medicina oral de Italia han observado este fenómeno con una práctica ausencia de diagnósticos de carcinomas de cavidad oral durante el periodo de la cuarentena13. Otro estudio austriaco ha puesto de manifiesto una disminución de los ingresos hospitalarios habituales de una forma significativa por síndrome coronario agudo en los primeros días del confinamiento por COVID-19, lo que podría traducirse en un aumento de la morbimortalidad por infartos cardiacos en las siguientes semanas14 o bien en carcinoma de próstata15.
En el caso de los tumores cutáneos, puede ser que muchos pacientes pueden interpretar las lesiones cutáneas malignas como perfectamente demorables2, además del miedo que puedan tener muchos pacientes y sus familiares a ser contagiados por acudir a centros sanitarios para su atención.
Es importante mencionar que en estos tiempos sin precedentes de la pandemia por COVID-19, aunque la primera opción de estos pacientes es ofrecerles la cirugía sin demora del tumor primario, la dificultad o falta de equipamiento, personal o camas de UCI disponibles16 puede hacer que algunos casos, sobre todo de CCE de lento crecimiento o tumores finos, se pueda plantear utilizar otras modalidades terapéuticas como, por ejemplo, la radioterapia o el metotrexato intralesional para los CCE17.
Como limitación, el estudio se basa en una estimación matemática de una curva de crecimiento basada en pocos pacientes y, además, en un escenario de demora completa de toda la población, hecho que puede no ajustarse a la realidad ya que algunos pacientes siguen asistiendo al médico o han sido operados durante el confinamiento o bien atendidos por teledermatología. En el caso del melanoma, al fijar en 0,2mm el grosor inicial para realizar la estimación de toda la población es posible que se esté sobreestimando el efecto, ya que para muchos pacientes el grosor es realmente mayor en el momento que se notan la lesión por primera vez. Por otro lado, no se han tenido en cuenta los mismos estadios que la AJCC debido a que no es posible valorar qué pacientes van a tener ulceración, por ejemplo, o bien, en el caso de los CCE, qué pacientes progresarán por tener una invasión perineural u ósea. Las curvas de supervivencias usadas para la ponderación de la supervivencia de las estimaciones no han sido ajustadas con otras variables.
Como fortalezas, aunque son muestras limitadas, la distribución de los melanomas en su grosor es casi idéntica a la descrita en el Registro Nacional de Melanomas18. En el caso de los CEE la distribución de los mismos presenta más tumores gruesos que series importantes publicadas19 lo que lleva aparejado también curvas de supervivencia peores, probablemente por el hecho de que se incluyen en el estudio casos con afectación ósea u otros factores de mal pronóstico.
ConclusionesEl presente estudio muestra que, si se descuida el diagnóstico y el tratamiento de los pacientes con CCE y melanoma en la actual situación de confinamiento en España, podemos llegar a asistir a un considerable aumento de los casos con estadios más avanzados con respecto al periodo preconfinamiento y, como consecuencia, de los gastos sanitarios9.
En nuestro país se diagnostican aproximadamente 300 melanomas y 1.500 CCE cada mes10, si esto lo extrapolamos a los diferentes países con la misma situación de limitación de la movilidad ciudadana debido a la pandemia e incluso con mayores tasas de incidencia de estos tumores, la situación podría tener serias consecuencias.
Por tanto, es razonable fomentar lo antes posible los esfuerzos para promocionar la autoexploración y facilitar el acceso a los dermatólogos, por ejemplo, a través de la teledermatología, como una forma de evitar la demora en el diagnóstico y el tratamiento de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste estudio ha sido financiado parcialmente por una beca concedida por la Fundación Piel Sana de la Academia Española de Dermatología y Venereología. J.C. se encuentra parcialmente financiado por el proyecto PI18/00587 (Instituto de Salud Carlos III (ISCIII), cofinanciación FEDER.
Agradecemos la ayuda de Inmaculada Morales Villagrás y Mónica Moya Pareja por su asesoramiento matemático. Además, se agradece igualmente a Miguel Ángel Descalzo-Gallego por su asesoramiento estadístico.