Una erupción liquenoide (EL) plantea un verdadero desafío diagnóstico por su parecido clínico e histológico al liquen plano. Los inductores son variados, siendo frecuentes los fármacos (ELIF), en particular en una época caracterizada por la irrupción de los tratamientos biológicos o dirigidos. Presentamos el caso de una erupción liquenoide inducida por alirocumab, un inhibidor de proproteína convertasa subtilisina/kexina tipo 9 (PCSK-9) usado como tratamiento para dislipidemia, fármaco raramente asociado a reacciones adversas cutáneas locales y excepcionalmente a urticaria o vasculitis.
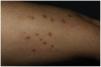
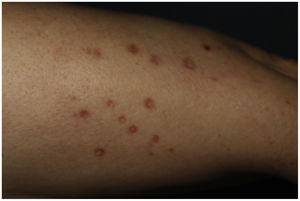
Una mujer de 61 años con antecedente de dislipidemia mixta e intolerancia a estatinas, en tratamiento con alirocumab subcutáneo hace 18 meses; consultó por una erupción muy pruriginosa en extremidades de 2 meses de evolución. En la exploración encontramos en piernas y antebrazos, pápulas poligonales eritemato-violáceas y brillantes de hasta 1cm con estrías de Wickham (fig. 1). No presentó lesiones en mucosas.
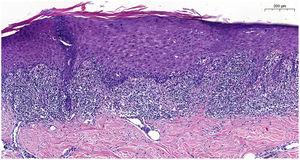
La analítica sanguínea mostró triglicéridos de 358mg/dl (< 150) y LDL de 215mg/dl (< 130). El resto del estudio incluyendo hemograma, bioquímica, autoanticuerpos resultó normal y negativo para virus hepatotropos. El estudio dermatopatológico evidenció dermatitis de interfase liquenoide, algunos queratinocitos necróticos y degeneración vacuolar de la basal (fig. 2). Con todos estos datos se llegó al diagnóstico de ELIF asociada a alirocumab.
Se realizó tratamiento sistémico con prednisona durante 15 días asociando betametasona tópica, sin suspender alirocumab, logrando remisión completa a las 3 semanas, mantenida durante 14 meses de seguimiento.
Alirocumab es un anticuerpo monoclonal IgG1 contra la PCSK-9, que inhibe su unión al receptor de LDL, aumentando así el número de receptores disponibles para eliminar LDL y reduciendo sus niveles plasmáticos1. Está autorizado su uso por la Agencia Europea de Medicamentos (EMA) para hipercolesterolemia primaria y dislipidemia mixta como complemento a la dieta mediante inyecciones subcutáneas. Recientemente se ha propuesto la existencia de una correlación entre niveles de expresión cutánea/sérica de PCSK-9, riesgo cardiovascular y gravedad en enfermedades como psoriasis y lupus, transformándola en una potencial diana terapéutica2. Se han reportado efectos adversos como eritema o dolor en el sitio de punción y excepcionalmente eccema numular, urticaria y vasculitis por hipersensibilidad1,3.
Las ELIF son reacciones cutáneas que aparecen generalmente semanas o meses después del inicio de un tratamiento. Existe incertidumbre sobre su fisiopatología. Clínica e histopatológicamente son prácticamente idénticas al liquen plano, por lo que para su diagnóstico es primordial la asociación de una anamnesis sugestiva —con relación temporal plausible—, examen físico, histología y evolución compatibles4. Algunos aspectos de este caso que apoyan el diagnóstico de una ELIF es el respeto de mucosas, la distribución simétrica en áreas fotoexpuestas, y la hiperpigmentación residual5.
La lista de fármacos —y vacunas— asociadas a ELIF es larga e independiente de su vía de administración, incluye enalapril, amlodipino, betabloqueantes, diuréticos, antimaláricos, imatinib, AINE e inmunoglobulinas, siendo de particular interés la existencia de casos asociados a simvastatina y a fármacos de origen biológico como infliximab, etanercept, pembrolizumab y nivolumab6,7. Una búsqueda en las bases de datos de Medline, Cochrane y Epistemonikos con las palabras clave alirocumab y erupción liquenoide o liquen plano en idiomas inglés y español no mostró casos previos publicados.
Hemos utilizado como herramienta la escala de probabilidad de Naranjo, que evalúa la probabilidad de que exista asociación entre una reacción adversa y un fármaco8, y que mostró una «probable» asociación entre alirocumab y la ELIF.
La heterogeneidad entre los distintos grupos farmacológicos descritos, dosis y vías de administración de los posibles desencadenantes de ELIF, hacen sospechar reacciones adversas idiosincráticas, probablemente inmunomediadas, que explicarían la respuesta consistente a corticoterapia tanto en este como en otros casos9.
En conclusión, presentamos un caso de erupción liquenoide probablemente asociada al uso de alirocumab, asociación no descrita hasta ahora.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.