Risankizumab es un anticuerpo monoclonal humanizado que se dirige a la subunidad p19 de IL-23, recientemente aprobado para el tratamiento de la psoriasis en placas moderada a grave. Actualmente faltan datos del mundo real basados en una muestra representativa de pacientes.
ObjetivoEvaluar la eficacia y la seguridad a medio y a largo plazo del risankizumab en pacientes con psoriasis moderada a grave en la práctica clínica habitual.
MétodosEstudio retrospectivo y multicéntrico realizado en pacientes consecutivos con psoriasis que recibieron tratamiento con risankizumab desde abril de 2020 hasta noviembre de 2022. El criterio de valoración principal fue la proporción de pacientes que alcanzaron una mejora en el Índice de Área y Severidad de la Psoriasis (Psoriasis Area and Severity Index [PASI]) del 100% (PASI100) en la semana 52.
ResultadosSe incluyeron en el estudio un total de 510 pacientes, 198 (38,8%) mujeres y 312 (61,2%) hombres. La edad media fue de 51,7±14,4 años, y 227 (44,5%) sujetos eran obesos (índice de masa corporal [IMC]>30kg/m2). La puntuación media del PASI basal fue de 11,4±7,2. La proporción de pacientes que alcanzaron PASI100 en la semana 52 fue del 67,0%. A lo largo del seguimiento del estudio, el 21%, el 50,0%, el 59,0% y el 66% de los pacientes alcanzaron un PASI100 en las semanas 4, 16, 24 y 40, respectivamente. La proporción de pacientes que alcanzaron un PASI≤2 fue mayor en el grupo con un IMC≤30kg/m2 en la semana 4 (p=0,04), la semana 16 (p=0,001) y la semana 52 (p=0,002). Una proporción estadísticamente significativa mayor de pacientes alcanzó un PASI100 en el grupo sin tratamiento previo en la semana 16 y a la semana 52 (p=0,001 en cada una, respectivamente). En la semana 16, una proporción significativamente menor de sujetos alcanzó un PASI100 en el grupo con artropatía psoriásica (p=0,04). Entre la muestra total del estudio, 22 (4,3%) pacientes reportaron algún tipo de evento adverso y 20 (3,9%) abandonaron o se retiraron del tratamiento.
ConclusionesRisankizumab fue un tratamiento efectivo y seguro para pacientes con psoriasis moderada a grave en la práctica clínica.
Risankizumab – a humanized monoclonal antibody that targets the p19 subunit of IL-23 – has been recently approved to treat moderate-to-severe plaque psoriasis. Real-world data based on a representative pool of patients are currently lacking.
ObjectiveTo assess the mid- and long-term safety and efficacy profile of risankizumab in patients with moderate-to-severe psoriasis in the routine clinical practice.
MethodsThis was a retrospective and multicenter study of consecutive psoriatic patients on risankizumab from April 2020 through November 2022. The primary endpoint was the number of patients who achieved a 100% improvement in their Psoriasis Area and Severity Index (PASI) (PASI100) on week 52.
ResultsA total of 510 patients, 198 (38.8%) women and 312 (61.2%) men were included in the study. The mean age was 51.7±14.4 years. A total of 227 (44.5%) study participants were obese (body mass index [BMI] >30kg/m2). The mean baseline PASI score was 11.4±7.2, and the rate of patients who achieved PASI100 on week 52, 67.0%. Throughout the study follow-up, 21%, 50.0%, 59.0%, and 66% of the patients achieved PASI100 on weeks 4, 16, 24, and 40, respectively. The number of patients who achieved a PASI ≤2 was greater in the group with a BMI ≤30kg/m2 on weeks 4 (P=.04), 16 (P=.001), and 52 (P=.002). A statistically significantly greater number of patients achieved PASI100 in the treatment-naïve group on weeks 16 and 52 (P=.001 each, respectively). On week 16 a significantly lower number of participants achieved PASI100 in the group with psoriatic arthropathy (P=.04). Among the overall study sample, 22 (4.3%) patients reported some type of adverse event and 20 (3.9%) discontinued treatment.
ConclusionsRisankizumab proved to be a safe and effective therapy for patients with moderate-to-severe psoriasis in the routine clinical practice.
La psoriasis es una enfermedad cutánea crónica, inflamatoria inmunomediada y multifactorial descrita en todo el mundo, que puede afectar a personas de cualquier edad, y que supone una carga de enfermedad considerable tanto para los individuos como para los sistemas sanitarios1–3.
Determinar la gravedad de la enfermedad es una cuestión importante pero difícil y que requiere una evaluación combinada de factores clínicos y de aquellos referidos por el paciente4,5. El Índice de Área y Gravedad de la Psoriasis (PASI, por sus siglas en inglés) se considera actualmente el patrón de oro para evaluar la psoriasis con afectación extensa4,6. Otra herramienta objetiva para evaluar la gravedad de la psoriasis es el área de superficie corporal (BSA, por sus siglas en inglés)5,7.
Aunque hasta la fecha la psoriasis no tiene cura, actualmente se dispone de diferentes opciones terapéuticas destinadas a minimizar su impacto y prevenir las diversas morbilidades asociadas2,3.
Los fármacos biológicos han cambiado radicalmente el paradigma terapéutico de la psoriasis8,9. Estos han demostrado ser más eficaces que las terapias convencionales para tratar la psoriasis tanto leve como grave8–10. Los fármacos biológicos se clasifican en función de su diana en: inhibidores del factor de necrosis tumoral (anti-TNF), inhibidores de la interleucina (IL)-12/23, inhibidores de la IL-17, inhibidores del receptor de la IL-17 e inhibidores de la IL-238,9.
Entre los diversos tratamientos biológicos disponibles en la actualidad, el risankizumab (un anticuerpo monoclonal humanizado dirigido contra la subunidad p19 de la IL-23)11 fue aprobado en 2019 por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y la Agencia Europea del Medicamento (EMA) para tratar la psoriasis en placas de moderada a grave12.
El perfil de seguridad y eficacia del risankizumab en pacientes con psoriasis de moderada a grave se evaluó previamente en cuatro ensayos clínicos aleatorizados multicéntricos (UltIMMa-1, UltIMMa-2, IMMHANCE e IMMVENT)13–15. Los resultados de estos ensayos clínicos también confirman el buen perfil de seguridad y eficacia del risankizumab en pacientes con psoriasis de moderada a grave13–15.
A pesar de los buenos resultados observados en estos 4 ensayos clínicos aleatorizados, sus muestras no son representativas de la práctica clínica habitual, que es mucho más heterogénea.
La seguridad y eficacia del risankizumab en condiciones de práctica clínica habitual ya se evaluó en un grupo de pacientes con psoriasis de mayor complejidad16–20. En este grupo de pacientes el risankizumab demostró una mejoría rápida de los signos clínicos y alivió los síntomas en estas cohortes de pacientes con psoriasis de moderada a grave16–20.
Debido a la escasez de evidencia, es necesario evaluar los resultados clínicos del risankizumab en la práctica clínica habitual.
El objetivo del presente artículo fue evaluar la seguridad y eficacia a medio y largo plazo del risankizumab en pacientes con psoriasis moderada-grave en la práctica clínica habitual, así como el impacto de distintos factores en los resultados del tratamiento.
MétodosDiseño del estudioSe trata de un estudio retrospectivo, multicéntrico, observacional y no intervencionista de pacientes, incluidos de manera consecutiva, con el diagnóstico de psoriasis en tratamiento con risankizumab desde abril de 2020 hasta noviembre de 2022.
El protocolo del estudio fue aprobado por el comité de investigación y ética del Hospital de Manises, que consideró innecesario solicitar previamente el consentimiento informado por escrito del paciente.
El protocolo del estudio cumplió con los principios establecidos en la Declaración de Helsinki y las Guías de Buena Práctica Clínica/Consejo Internacional de Armonización.
ParticipantesPacientes de ≥18 años con diagnóstico clínico de psoriasis en tratamiento con risankizumab desde abril de 2020 hasta noviembre de 2022.
ResultadosEl criterio de valoración primario fue el número de pacientes que alcanzaron un PASI del 100% (PASI100) en la semana 52.
Los resultados secundarios incluyeron la puntuación PASI media en la semana 52, el número de pacientes que alcanzaron PASI100 en las semanas 4, 16, 24 y 40, y la incidencia de acontecimientos adversos.
Además, se evaluó el impacto de distintos factores, como la obesidad [definida según la clasificación de la Organización Mundial de la Salud como un índice de masa corporal (IMC) >30kg/m2]21, la presencia de artritis psoriásica, el estado de tratamiento previo (“nave” frente a previamente tratado) y el uso previo de fármacos biológicos.
Análisis estadísticoSe realizó un análisis estadístico estándar con el programa estadístico SPSS versión 28 (IBM SPSS Statistics, IL, Estados Unidos).
Se utilizaron estadísticas descriptivas (porcentaje) y media±desviación estándar (DE), según procediera.
Se comprobó la normalidad de los datos mediante la prueba de Shapiro-Wilk.
Se utilizó la prueba ANOVA unidireccional para evaluar las diferencias entre grupos.
Las variables categóricas se compararon mediante la prueba de la ji al cuadrado y la prueba exacta de Fisher, según fuera necesario.
Los valores de p<0,05 se consideraron estadísticamente significativos.
ResultadosDatos demográficos basales y características clínicasUn total de 510 pacientes, 198 (38,8%) mujeres y 312 (61,2%) hombres fueron incluidos en el estudio. La edad media era de 51,7±14,4 años y 227 (44,5%) participantes en el estudio eran obesos (IMC >30kg/m2).
De la población total del estudio, 476 (93,3%) fueron diagnosticados de psoriasis vulgar.
La evolución media de la enfermedad fue de 21,0±13,7 años, y la puntuación PASI media, de 11,4±7,2 puntos.
Un total de 396 pacientes (77,6%) habían estado previamente en tratamiento sistémico convencional y 418 (81,9%) en terapias biológicas.
Tabla 1 La ilustra las principales características clínicas y demográficas de la muestra del estudio.
Características demográficas y clínicas basales
| Variable | n=510 |
|---|---|
| Edad, años | |
| Media | 51,7±14,4 |
| Sexo, n (%) | |
| Mujer | 198 (38,8) |
| Hombre | 312 (61,2) |
| IMC, n (%) | |
| Media, kg/m2 | 30,2±12,7 |
| >25 a ≤30kg/m2 | 312 (61,2) |
| >30 a ≤40kg/m2 | 182 (35,7) |
| >40kg/m2 | 45 (8,8) |
| Comorbilidades, n (%)* | |
| Artropatía psoriasica | 68 (13,3) |
| DM | 123 (24,1) |
| HTA | 148 (29,0) |
| Dislipidemia | 221 (43,3) |
| HGNA | 131 (25,6) |
| MACE | 43 (8,4) |
| Transtornos mentales** | 146 (28,6) |
| Antecedente de cancer | 48 (9,4) |
| ITL, n (%) | |
| Con QT profiláctica | 51 (10,0) |
| Sin QT profiláctica | 27 (5,2) |
| Tiempo de evolución, años | |
| Media | 21,0±13,7 |
| Diagnóstico (%) | |
| Psoriasis vulgar | 476 (93,3) |
| Afectación en localizaciones especiales, n (%) | |
| Cabello/cuero cabelludo | 203 (39,8) |
| Palma/planta del pie | 58 (11,3) |
| PASI | |
| Media | 11,4±7,2 |
| BSA | |
| Media | 17,4±12,9 |
| DLQIa | |
| Media | 11,6±7,2 |
| Tratamiento TCP, n (%) | |
| Si | 396 (77,6) |
| No | 114 (23,4) |
| Último tratamiento realizado, n (%) | |
| Adalimumab | 148 (29,0) |
| Ustekizumab | 112 (22,0) |
| Secukinumab | 82 (16,1) |
| Ixekizumab | 56 (11,0) |
| Gusekumab | 40 (7,9) |
| Etanercept | 23 (4,5) |
| Brodalumab | 14 (2,8) |
| Certolizumab | 6 (1,2) |
| Infiximab | 6 (1,2) |
| Binekizumab | 1 (0,2) |
| Tratamientos biológicos previos, n (%) | |
| Si | 418 (81,9) |
| No | 92 (18,1) |
| NTBP, n (%) | |
| 1 | 193 (37,8) |
| 2 | 89 (19,4) |
| 3 | 53 (10,4) |
| 4 | 21 (4,1) |
| ≥5 | 18 (3,5) |
DM: diabetes mellitus; HTA: hipertensión arterial; MACE: eventos adversos cardiovasculares mayores; HGNA: hígado graso no alcohólico; ITL: infección tuberculosa latente; QT: quimioterapia; PASI: “Psoriasis Area and Severity Index”; BSA: Superficie corporal (“Body Surface Area”); DLQI: “Dermatology Life Quality Index”; TCP: tratamiento convencional previo; NTBP: número de tratamientos biológicos previos.
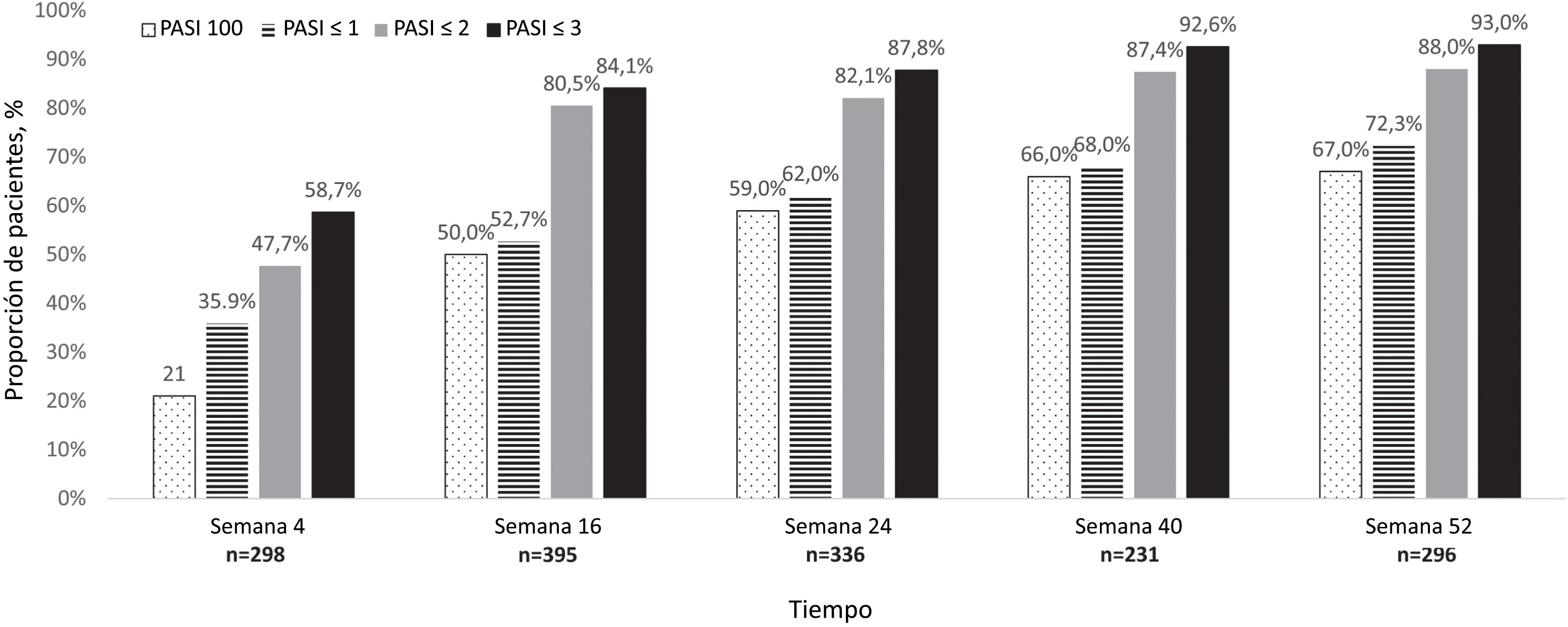
El porcentaje de pacientes que alcanzaron PASI100 en la semana 52 fue del 67,0% (Fig. 1).
Un total del 21%, 50,0%, 59,0% y 66% de los pacientes alcanzaron PASI100 en las semanas 4, 16, 24 y 40, respectivamente, durante el seguimiento.
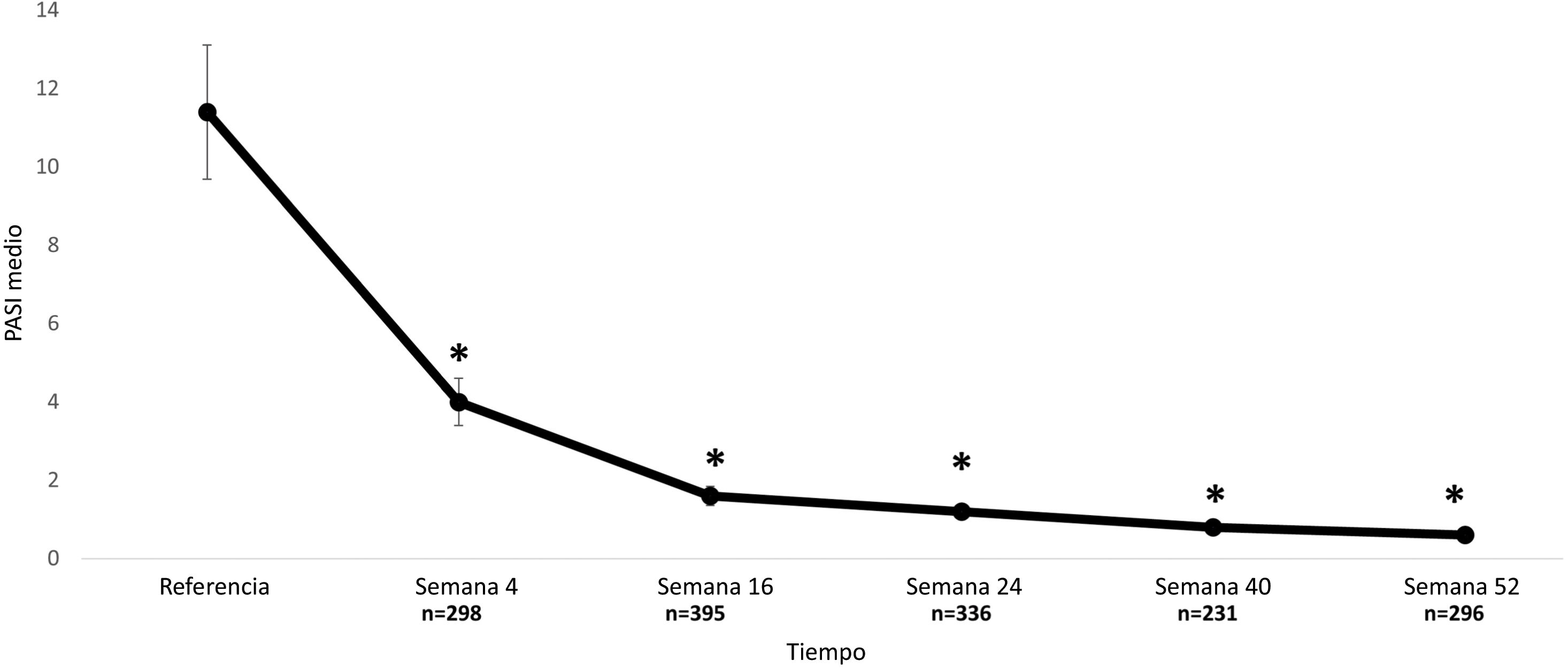
La puntuación PASI media descendió significativamente de 11,4±7,2 al inicio a 4,0±5,0; 1,6±3,5, 1,2±3,1, 0,8±2,0, y 0,6±1,7 en las semanas 4, 16, 24, 40 y 52, respectivamente; P=,001 cada uno, respectivamente (Fig. 2).
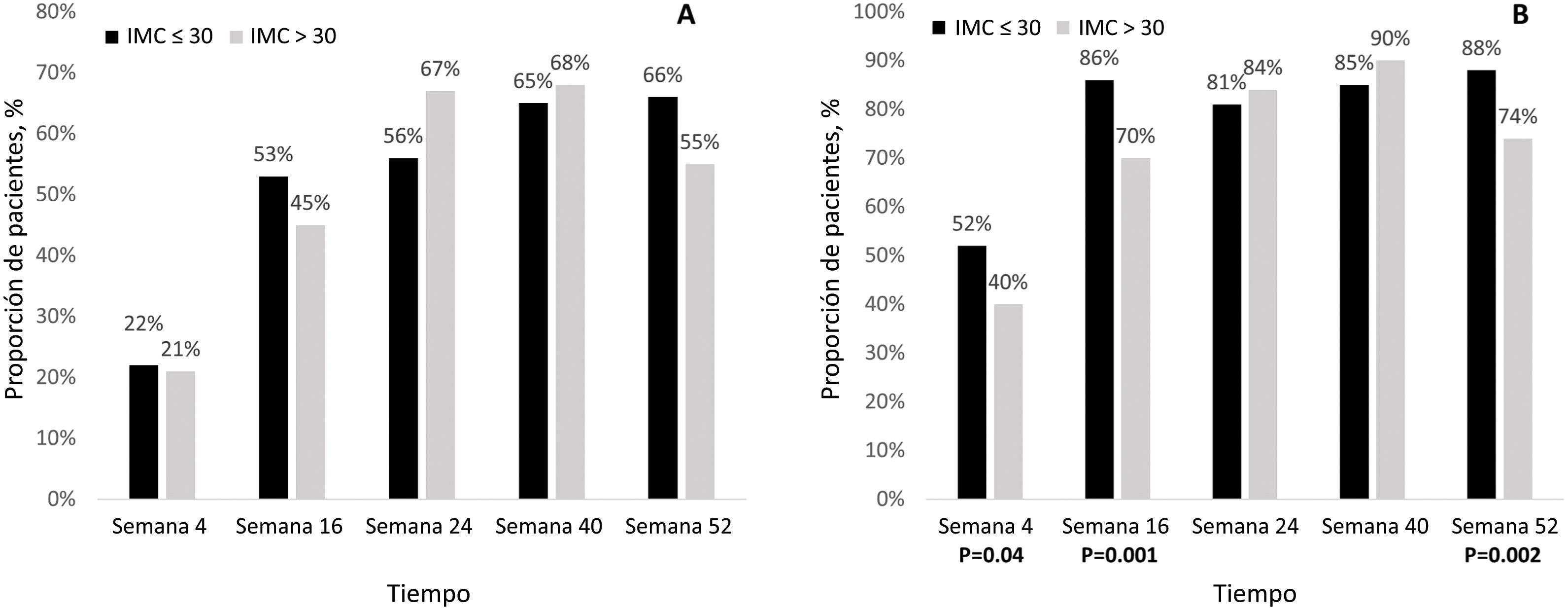
Factores asociados con el PASIÍndice de masa corporalPara evaluar el efecto de la obesidad en los resultados clínicos, la población del estudio se clasificó en dos grupos en función de su IMC: obesos (IMC >30kg/m2) y no obesos (IMC ≤30kg/m2)22.
Aunque el número de sujetos que alcanzaron un PASI100 en el seguimiento fue similar en ambos grupos (Fig. 3A), un número estadísticamente significativo mayor de pacientes alcanzó un PASI ≤2 en la semana 2 (P=,04), en la semana 16 (P=,001) y en la semana 52 (P=,002) en el grupo con un IMC ≤30kg/m2 (Fig. 3B).
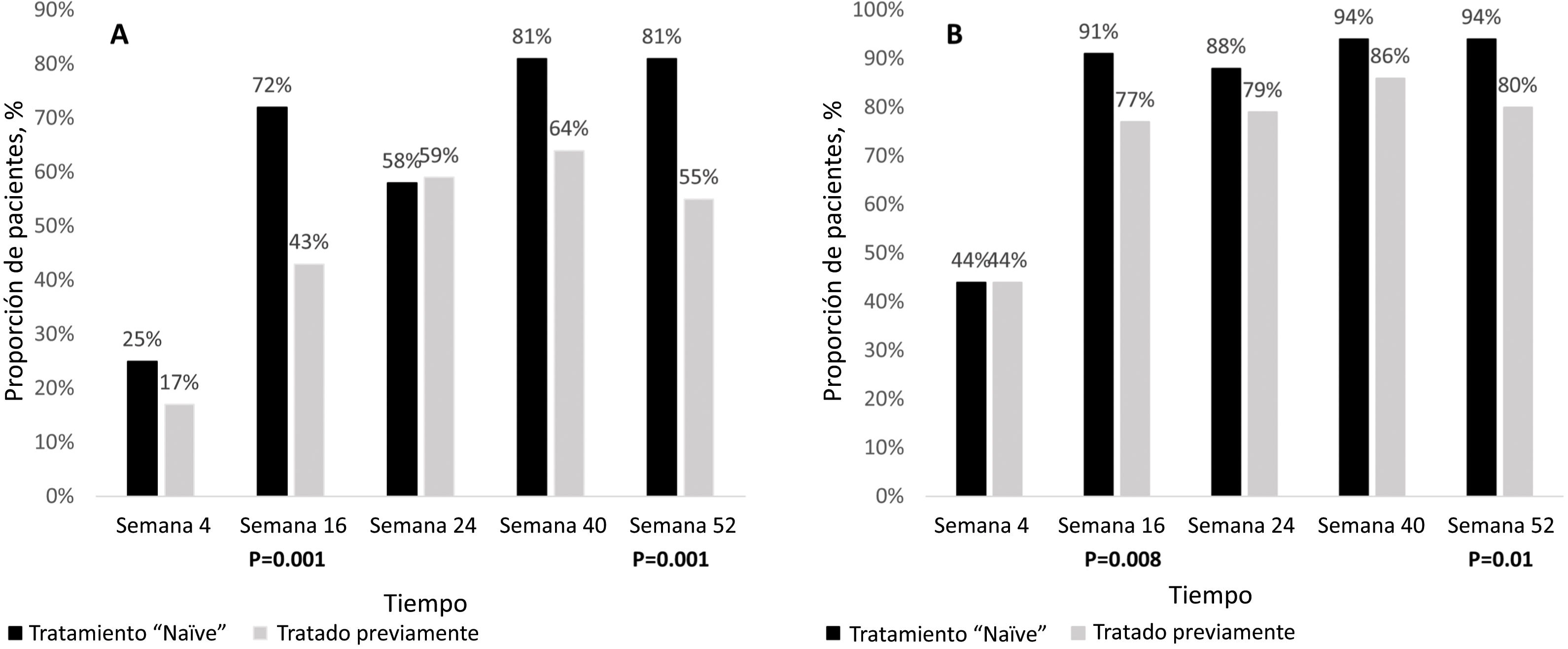
Estado del tratamiento (no tratados frente a tratados previamente).Un número estadísticamente significativo de pacientes alcanzó un PASI100 en el grupo sin tratamiento en las semanas 16 y 52 (P=,001 cada una, respectivamente) (Fig. 4A).
Del mismo modo, un número significativamente mayor de pacientes alcanzó una puntuación PASI <2 en el grupo sin tratamiento en las semanas 16 y 52 (P=,008 y P=,01, respectivamente) (Fig. 4B).
Artropatía psoriásicaLa muestra del estudio se clasificó en dos grupos: pacientes con y sin artropatía psoriásica.
Un número significativamente mayor de participantes alcanzó un PASI100 en el grupo sin artropatía psoriásica en la semana 16 (P=,04) (Figura S1A, datos suplementarios).
En cuanto a los participantes que alcanzaron una puntuación PASI <2, el número fue significativamente mayor en el grupo sin artropatía psoriásica en las semanas 4 (P=,03), 16 (P=,001) y 24 (P=,04) (Figura S1B, datos suplementarios).
Terapia biológicaLa muestra del estudio se categorizó en función del tipo de terapia biológica recibida en pacientes previamente en tratamiento con anti-TNF, anti-IL-12/-23, anti-IL-17 o anti-IL-23.
La puntuación PASI basal media fue significativamente inferior en los cuatro grupos en todos los periodos de tiempo medidos, sin que se registraran diferencias estadísticamente significativas entre ellos (Figura S2, datos suplementarios).
La figura S3 del ilustra el número de pacientes que alcanzaron un PASI100 o un PASI <2 en función de los tratamientos biológicos previos recibidos.
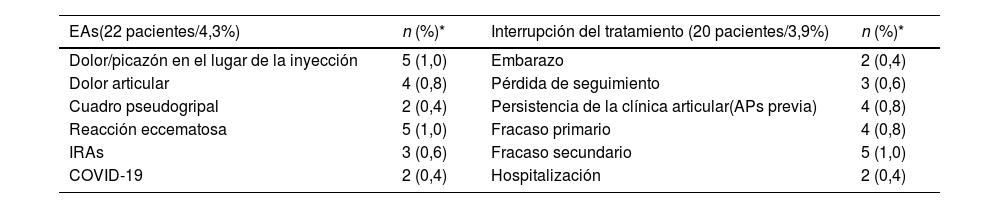
SeguridadEntre la muestra global del estudio, 22 (4,3%) pacientes notificaron algún tipo de acontecimiento adverso y 20 (3,9%) interrumpieron el tratamiento (Tabla 2). Los acontecimientos adversos notificados con mayor frecuencia fueron el dolor/picazón en el lugar de la inyección y las reacciones eccematosas (5/22 cada uno, respectivamente) (Tabla 2). En cuanto a los pacientes que interrumpieron el tratamiento, los motivos más frecuentes fueron el fracaso secundario (5/20) y la persistencia de la clínica articular (artropatía psoriásica previa) y el fracaso primario (5/20 cada uno, respectivamente) (Tabla 2).
Incidencia de acontecimientos adversos a lo largo del seguimiento del estudio
| EAs(22 pacientes/4,3%) | n (%)* | Interrupción del tratamiento (20 pacientes/3,9%) | n (%)* |
|---|---|---|---|
| Dolor/picazón en el lugar de la inyección | 5 (1,0) | Embarazo | 2 (0,4) |
| Dolor articular | 4 (0,8) | Pérdida de seguimiento | 3 (0,6) |
| Cuadro pseudogripal | 2 (0,4) | Persistencia de la clínica articular(APs previa) | 4 (0,8) |
| Reacción eccematosa | 5 (1,0) | Fracaso primario | 4 (0,8) |
| IRAs | 3 (0,6) | Fracaso secundario | 5 (1,0) |
| COVID-19 | 2 (0,4) | Hospitalización | 2 (0,4) |
IRAs: infecciones del tracto respiratorio superior; COVID-19: enfermedad por coronavirus 2019; APs: artropatía psoriásica.
Los nuevos avances en el conocimiento de la patogenia de la enfermedad psoriásica, en particular el papel crucial del eje IL-17/-2323,24, han conducido al desarrollo de nuevas herramientas terapéuticas de acción selectiva que han permitido alcanzar resultados significativos en términos de eficacia, con un perfil de seguridad también óptimo9–20.
El número considerable de fármacos biológicos disponibles en la actualidad8,9 hace que los estudios en un entorno de práctica clínica habitual sean necesarios para que los médicos puedan individualizar los enfoques en cada paciente25.
Según datos publicados en 2001, en España la prevalencia de la psoriasis era del 1,4%26. Sin embargo, la llegada de las terapias biológicas ha desencadenado cambios significativos en el paradigma terapéutico, ya que presentan un mejor perfil de seguridad y eficacia frente a los tratamientos previos8,9. El uso generalizado y la aceptación de estas nuevas opciones terapéuticas han propiciado una mejor y mayor información sobre la psoriasis, lo que ha supuesto, en consecuencia, un aumento de su prevalencia. De hecho, según los últimos datos publicados hasta la fecha, la prevalencia de la psoriasis en España se estimaba en un 2,3%27.
Este estudio retrospectivo y multicéntrico realizado sobre una cohorte española de 510 pacientes con psoriasis moderada-grave, evaluó el perfil de seguridad y la eficacia del risankizumab en un periodo de seguimiento de 52 semanas.
Según los resultados del presente estudio, risankizumab redujo significativamente la puntuación PASI basal en todos los periodos de tiempo medidos. Además, en la semana 52, el 67%, el 72,3%, el 88% y el 93% de los pacientes alcanzaron una puntuación PASI=0 (PASI100), ≤1, ≤2 y ≤3, respectivamente.
En función de diversos factores, la eficacia del risankizumab fue mayor en los pacientes con IMC <30kg/m2, los pacientes no tratados y los pacientes sin artropatía psoriásica. Además, en pacientes previamente tratados con biológicos, el risankizumab demostró una eficacia similar con independencia de los biológicos administrados previamente.
Estos resultados fueron coherentes con los comunicados por los ensayos clínicos aleatorizados13–15. Es difícil realizar una comparación directa entre nuestros resultados y los de los ensayos clínicos, ya que existen diferencias en algunos de los parámetros basales. Por ejemplo, en comparación con los ensayos clínicos UltIMMa-1, UltIMMa-2, IMMHANCE e IMMVENT13–15, las puntuaciones PASI y BSA fueron inferiores en nuestro estudio, mientras que los pacientes de nuestro estudio habían recibido muchos más tratamientos previos13–15.
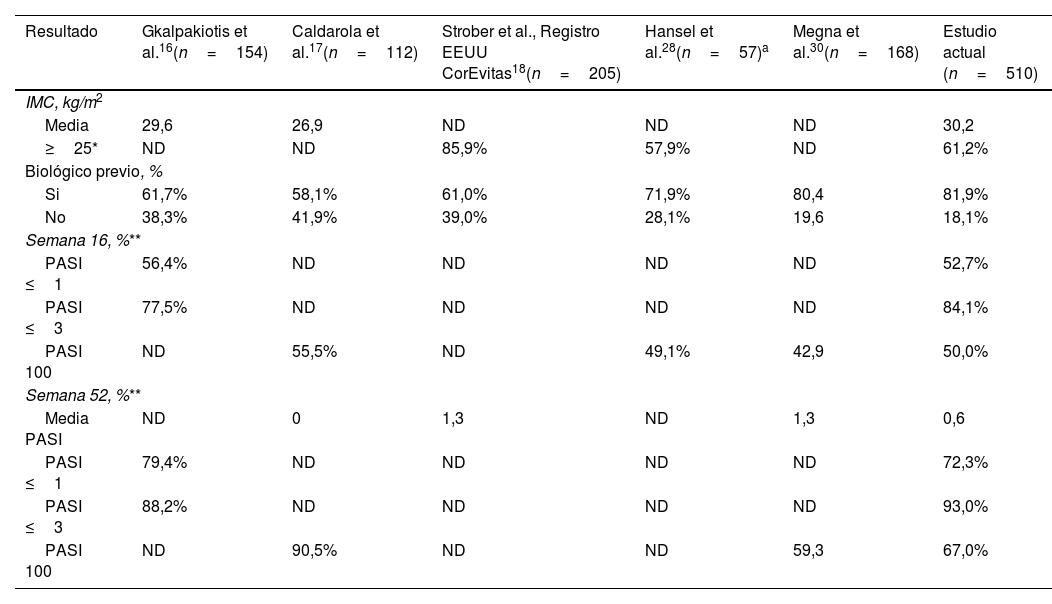
En cuanto a la comparación del estudio actual con los de estudios más amplios del mundo real (Tabla 3), los resultados clínicos fueron similares, aunque un mayor número de nuestros pacientes habían sido tratados previamente con otros biológicos.
Comparación de los resultados clínicos entre el estudio actual y las evidencias disponibles
| Resultado | Gkalpakiotis et al.16(n=154) | Caldarola et al.17(n=112) | Strober et al., Registro EEUU CorEvitas18(n=205) | Hansel et al.28(n=57)a | Megna et al.30(n=168) | Estudio actual (n=510) |
|---|---|---|---|---|---|---|
| IMC, kg/m2 | ||||||
| Media | 29,6 | 26,9 | ND | ND | ND | 30,2 |
| ≥25* | ND | ND | 85,9% | 57,9% | ND | 61,2% |
| Biológico previo, % | ||||||
| Si | 61,7% | 58,1% | 61,0% | 71,9% | 80,4 | 81,9% |
| No | 38,3% | 41,9% | 39,0% | 28,1% | 19,6 | 18,1% |
| Semana 16, %** | ||||||
| PASI ≤1 | 56,4% | ND | ND | ND | ND | 52,7% |
| PASI ≤3 | 77,5% | ND | ND | ND | ND | 84,1% |
| PASI 100 | ND | 55,5% | ND | 49,1% | 42,9 | 50,0% |
| Semana 52, %** | ||||||
| Media PASI | ND | 0 | 1,3 | ND | 1,3 | 0,6 |
| PASI ≤1 | 79,4% | ND | ND | ND | ND | 72,3% |
| PASI ≤3 | 88,2% | ND | ND | ND | ND | 93,0% |
| PASI 100 | ND | 90,5% | ND | ND | 59,3 | 67,0% |
IMC: índice de masa corporal; PASI: “Psoriasis Area and Severity Index”; ND: No disponible.
Además, en comparación con Gkalpakiotis et al.16 y Caldarola et al17, nuestra cohorte tiene un IMC mayor, lo que a la vista de nuestros resultados podría repercutir negativamente en los resultados. En un estudio multicéntrico y en condiciones reales, Hansel et al.21,28 evaluaron el perfil de seguridad y eficacia del risankizumab durante un periodo de 16-28 y 52 semanas21 en pacientes con psoriasis. Al igual que en los estudios anteriores, los resultados de nuestro estudio fueron similares a los comunicados por Hansel et al.21,28.
En cuanto a la repercusión del IMC en los resultados clínicos, nuestro estudio coincide con los de Hansel et al.28 y Borroni et al.29, que señalaron que un IMC más elevado repercutía negativamente en la eficacia de risankizumab. Por el contrario, los resultados del presente estudio difieren de los comunicados por Gkalpakiotis et al.16, Caldarola et al.17 y Megna et al.30, que observaron que el IMC no afectaba a la eficacia a corto y largo plazo del risankizumab.
En el presente estudio, la presencia de artropatía psoriásica afectó negativamente a la eficacia del risankizumab. Aunque no se notificaron diferencias significativas en el número de pacientes que alcanzaron el PASI100 en la semana 52 entre los pacientes con o sin artropatía psoriásica, en la semana 16, muchos más pacientes sin artropatía psoriásica alcanzaron el PASI100.
El perfil de seguridad y eficacia de risankizumab en pacientes con artritis psoriásica se evaluó en un ensayo de fase 2 a doble ciego y con dosis variables31. Los resultados de este estudio revelaron que el número de pacientes que alcanzaron un PASI100, entre los tratados con risankizumab, osciló entre el 33,3% y el 5,6%, dependiendo de la dosis asignada31.
En cuanto a la seguridad, en este estudio no se observaron acontecimientos adversos inesperados. La incidencia y el tipo de acontecimientos adversos fueron coherentes con las pruebas disponibles en la actualidad13–21,29–31.
Las principales limitaciones del presente estudio son su diseño retrospectivo y la falta de un grupo de control.
Por lo que sabemos, el punto fuerte de este estudio es su tamaño muestral -la mayor serie hasta la fecha (n=510)- de pacientes con psoriasis en tratamiento con risankizumab en la práctica clínica habitual. Su otra fortaleza es el carácter multicéntrico que tiene, en el cual se incluyeron pacientes de diferentes partes de España.
ConclusionesLos resultados de este estudio confirmaron el buen perfil de seguridad y eficacia del risankizumab en la práctica clínica habitual. Dichos resultados al parecer se vieron afectados por el IMC (los pacientes obesos obtuvieron peores resultados), la presencia de artropatía psoriásica y los tratamientos previos. No obstante, en estos grupos de pacientes con características desfavorables los índices de eficacia fueron bastante buenos. El perfil de seguridad también fue muy bueno, sin que se notificaran acontecimientos adversos inesperados.
Se necesitan nuevos estudios prospectivos, multicéntricos y controlados en la vida real para evaluar el perfil de seguridad y eficacia de estas terapias biológicas.
FinanciaciónEl servicio de redacción médica ha contado con el apoyo del Grupo de Trabajo de Psoriasis de la AEDV.
Conflictos de interesesAntonio Martorell declaró haber recibido honorarios por consultoría/ponencia, y/o gastos de viaje, y/o haber participado en ensayos clínicos patrocinados por AbbVie, Almirall, Amgen, Boehringer-Ingelheim, Celgene, Gebro, Janssen, LEO Pharma, Lilly, Novartis, Pfizer, Sandoz, Sanofi y UCB.
Alvaro González-Cantero ha participado como IP/SI y/o ponente invitado, y/o asesor para Almirall, Janssen, Abbvie, UCB, Boehringer-Ingelheim, Lilly, Novartis, Amgen, BMS y Sandoz.
Eva Vilarrasa declaró haber sido consultora y/o haber recibido honorarios como ponente, y/o gastos de viaje, y/o haber participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Boehringer-Ingelheim, Bristol-Meyers Squibb, Celgene, Gebro, Isdin, Janssen, LEO Pharma, Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Sandoz, Sanofi, y UCB.
Pablo de la Cueva declaró haber participado como asesor, y/o investigador, y/o ponente para las siguientes compañías farmacéuticas: Abbvie, Almirall, BMS, Boehringer-Ingelheim, Celgene, Janssen Cilag, LEO Pharma, Lilly, MSD, Novartis, Novo Nordisk, Pfizer, Roche, Sanofi y UCB.
Fernando Gallardo declara haber recibido honorarios como ponente y consultor por su participación en cursos, congresos y/o proyectos de investigación organizados por Janssen, Abbvie, UCB, Amgen, Bristol, Lilly, Novartis, Almirall y Leo Pharma.
José Manuel Carrascosa ha participado como IP/SI y/o ponente invitado, y/o asesor para Almirall, Janssen, Abbvie, UCB, Boehringer-Ingelheim, Lilly, Novartis, Amgen, BMS, y Sandoz.
Los demás autores declararon no tener ningún conflicto de intereses.
Los servicios de redacción médica y asistente editorial han sido proporcionados por Ciencia y Deporte S.L.