La intervención local de la rosácea se utiliza generalmente para aliviar los síntomas locales. Sin embargo, hasta ahora, pocos artículos han analizado sistemáticamente la eficacia de los medicamentos locales en su tratamiento. El objetivo de este estudio es investigar la eficacia de los medicamentos locales de uso común. Para obtener la información adecuada de la literatura relevante recuperamos 4 bases de datos. La eficacia se evalúa mediante la evaluación general del investigador, la evaluación del eritema del clínico, la autoevaluación del paciente y la autoevaluación de la escala de enrojecimiento facial por rosácea del sujeto. También se registraron eventos adversos y tolerancia cutánea durante el tratamiento. Según los 21 ensayos aleatorizados controlados incluidos, hay 6 fármacos tópicos: minociclina, ivermectina, ácido azelaico, metronidazol, bromonidina e hidroximetazolina. Estos medicamentos tienen una buena tolerancia y seguridad. La ivermectina es más eficaz que el ácido azelaico y el metronidazol. Según el estudio incluido, el ácido azelaico es mejor que el metronidazol. La minociclina puede mejorar eficazmente los síntomas de la rosácea. Tanto la bromonidina como la hidroximetazolina tienen un efecto significativo en la reducción del enrojecimiento facial.
Topical interventions for rosacea are often used to relieve local symptoms. However, currently, there are few articles to systematically analyze the efficacy profile of topical drugs for rosacea. This study aimed to investigate the efficacy profile of widely used topical drugs. To acquire appropriate information from related literature, we looked into 4 databases. Efficacy was appraised with the Investigator Global Assessment, Clinician's Erythema Assessment, Patient's Self-Assessment and Subject Self-Assessment of Rosacea Facial Redness scales. Treatment-emergent adverse events and dermal tolerability were also recorded. According to 21 randomized controlled trials included, a total of 6 topical drugs including minocycline, ivermectin, azelaic acid, metronidazole, brimonidine and oxymetazoline were reported. These drugs are well-tolerated and safe. Ivermectin is more effective than azelaic acid and metronidazole. Azelaic acid has a better efficacy profile than metronidazole according to included studies. Minocycline turned out to be effective improving the symptoms of rosacea. Brimonidine and oxymetazoline both have significant effects on reducing facial redness.
La rosácea es una enfermedad cutánea inflamatoria crónica frecuente que produce rubor, enrojecimiento, pápulas eritematosas y pústulas en la cara1 y puede afectar en cierta medida a la calidad de vida y la salud mental de los pacientes. La rosácea se suele clasificar en 4 subtipos principales en función de sus características morfológicas: eritematotelangiectásica, papulopustulosa, fimatosa y ocular2. Sin embargo, la patogenia exacta de la rosácea sigue sin estar clara y los signos clínicos de los distintos pacientes son complejos. Existe un gran número de pacientes que padecen rosácea. En 2018 Gether et al. informaron de que aproximadamente el 5,46% de la población adulta estaba afectada por rosácea según la información publicada3.
Actualmente, existen varias opciones de tratamiento para la rosácea, incluidas las intervenciones tópicas (por ejemplo, el gel de metronidazol y el gel de ácido azelaico) y sistemáticas (por ejemplo, antibióticos orales e isotretinoína) y terapia basada en láser o luz. Aunque se ha informado de que la luz de colorante pulsada y la luz pulsada intensa tienen un efecto similar en la reducción del eritema facial de la rosácea4, aún se necesitan más estudios. Los fármacos tópicos son el tratamiento de primera línea para la rosácea de leve a moderada1. Para aliviar la rosácea papulopustulosa de leve a moderada debe considerarse un tratamiento sistemático o una terapia combinada5.
Los fármacos tópicos se utilizan a menudo para aliviar los síntomas locales y han ganado más atención. Existen muchos tipos de fármacos tópicos que han demostrado su eficacia para tratar la rosácea. Sin embargo, hasta ahora pocos artículos han analizado sistemáticamente el perfil de eficacia de dichos fármacos. Nuestra investigación intentó actualizar la información sobre el efecto curativo de varios fármacos tópicos para la rosácea. Basándonos en estudios anteriores, nos propusimos evaluar el perfil de eficacia de los fármacos tópicos para la rosácea analizando los estudios existentes y comparando la tasa de incidencia de las reacciones adversas.
Material y métodosFuentes de datos y búsquedasDos redactores realizaron una búsqueda independiente hasta el 2 de diciembre de 2024. Utilizando las frases de búsqueda «rosacea AND topical», se buscó en 4 bases de datos diferentes: PubMed, Embase, Web of Science y la Cochrane Library. La búsqueda no estuvo restringida por el idioma.
Criterios de inclusión y exclusiónLos criterios de inclusión de los estudios fueron los siguientes: 1) para los estudios: solo ensayos controlados aleatorizads (ECA); 2) para los sujetos: diagnóstico clínico de rosácea establecido mediante anamnesis y exploración física compatibles; 3) para el grupo experimental: se utilizaron fármacos tópicos para tratar a los individuos del grupo experimental. No hay limitaciones en cuanto al tratamiento del grupo de control. Los criterios de exclusión fueron los siguientes: 1) comentarios, revisiones, cartas, informes de casos o resúmenes de actas de congresos; 2) estudios repetitivos; 3) artículos carentes de datos relevantes; y 4) artículos en los que no participaran seres humanos.
Medidas de los resultadosLos puntos terminales primarios para evaluar el perfil de eficacia fueron la proporción y el número de individuos que alcanzaron el «éxito» (definido como IGA≤1 en un sistema de 5 puntos e IGA≤2 en un sistema de 7 puntos), la proporción y el número de individuos que alcanzaron una disminución de 2 grados o más con respecto al valor basal, tanto en el CEA como en el PSA en el último tratamiento registrado, la proporción y el número de individuos que alcanzaron una disminución de 2 grados o más con respecto al valor basal tanto en el CEA como en el PSA en el último tratamiento registrado. Además, los indicadores de resultados secundarios registrados en el estudio fueron los acontecimientos adversos emergentes del tratamiento (EAET) y la tolerancia cutánea.
Extracción de datos y evaluación de la calidadLas bases de datos fueron examinadas de forma independiente por 2 redactores diferentes utilizando los criterios de inclusión y exclusión. Se recurrió al arbitraje de un tercer autor para resolver alguna controversia. Se extrajeron del artículo el autor, el año de publicación, el país, las intervenciones, el número y el porcentaje de pacientes que lograron el éxito del IGA, el número y el porcentaje de pacientes que observaron una disminución de uno o más grados con respecto al valor inicial en el CEA y el PSA, el número y el porcentaje de pacientes que observaron una disminución de uno o más grados con respecto al valor inicial en el CEA y el PSA, los EAET y la tolerabilidad cutánea. El riesgo de sesgo de cada estudio se evaluó utilizando como guía las normas del Manual Cochrane para Revisores (Cochrane Reviewers’ Handbook).
Análisis y síntesis de datosSe sintetizaron los datos mediante el programa informático Review Manager (RevMan 5.3.5) para realizar el metaanálisis. Se extrajeron datos binarios de cada estudio para 2 grupos con el fin de evaluar el perfil de eficacia de varios fármacos locales ampliamente utilizados. Además, se elaboró una tabla de clasificación para determinar el riesgo relativo (RR, IC 95%) y obtener una estimación global agregada. Se utilizaron las pruebas estadísticas de I2 y la Chi-cuadrado para comprobar la heterogeneidad entre los estudios. Los valores de I2<50% muestran una heterogeneidad baja, entre 50% y 75%, una heterogeneidad sustancial y>75%, una heterogeneidad alta. Para la prueba Chi-cuadrado el valor p de la correlación estadística representa la significación estadística de la heterogeneidad. En presencia de heterogeneidad significativa (I2>50%) se utilizó un modelo de efectos aleatorios con fines analíticos. En caso contrario, se utilizó el modelo de efectos fijos.
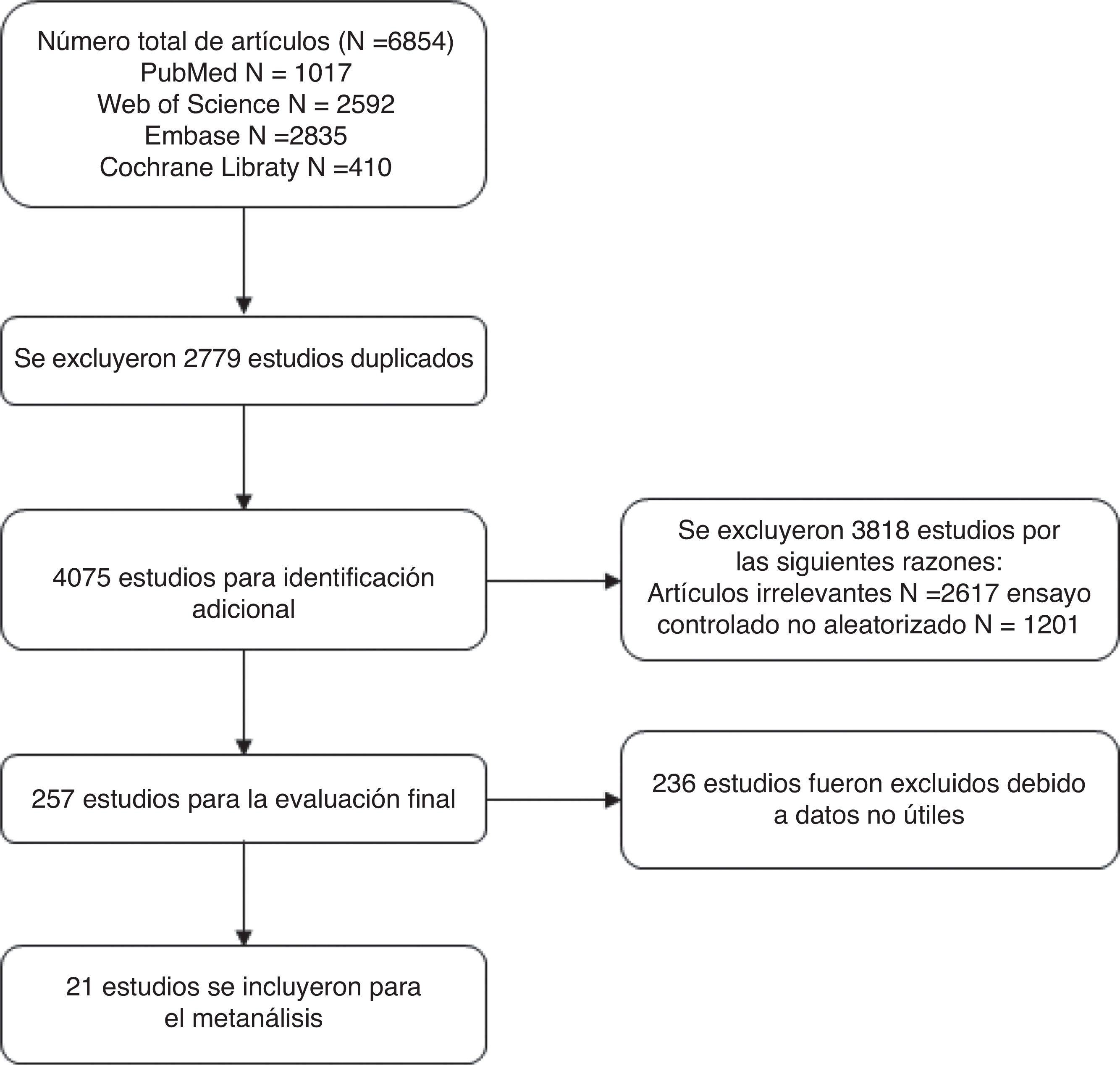
ResultadosBúsqueda bibliográficaUtilizando los términos de búsqueda encontramos un total de 6.854 artículos. Tras eliminar los duplicados quedaron 4.075 artículos. Tras examinar los títulos y resúmenes de estos artículos se eliminaron 2.819 artículos no relacionados y se excluyeron 999 artículos como ensayos controlados no aleatorios. Finalmente, tras excluir 257 artículos que no tenían datos útiles, se incluyeron en el metaanálisis un total de 21 artículos. La figura 1 muestra el proceso de cribado de la literatura.
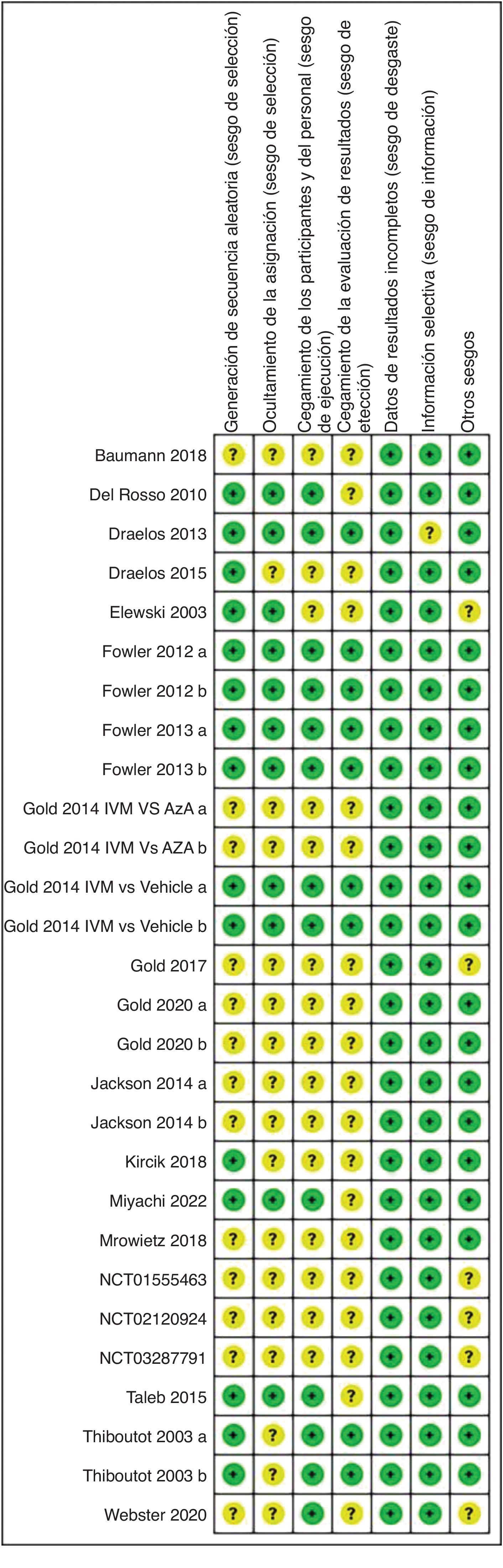
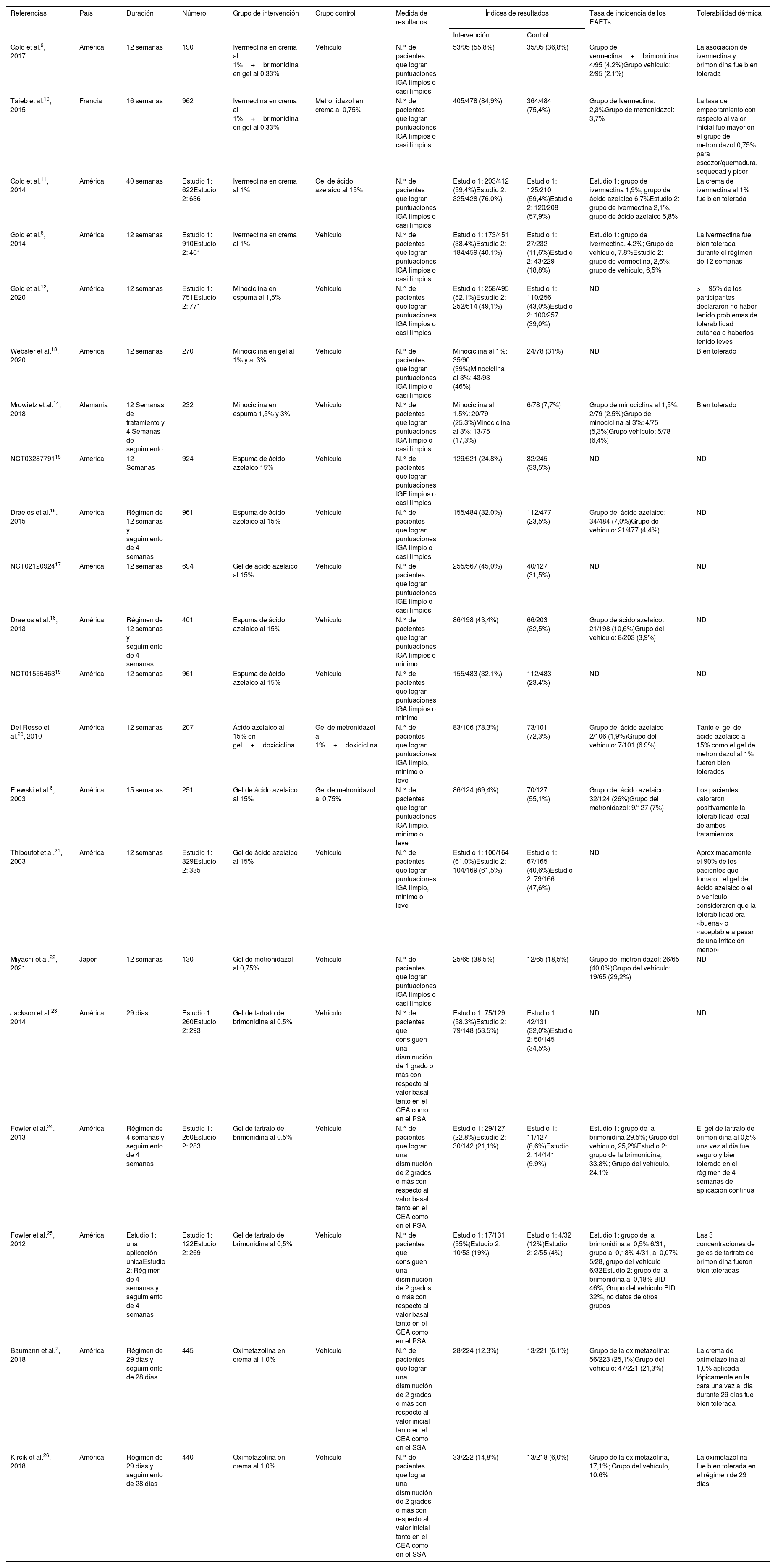
Características de los estudios y evaluación del riesgo de sesgoLos 21 artículos incluidos en el metaanálisis están en inglés. Estos artículos procedían de 4 países diferentes (18 de Estados Unidos, uno de Francia, uno de Japón y otro de Alemania). En la tabla 1 se muestran más detalles. En la figura 2 se muestra un resumen del riesgo de sesgo. Seis estudios tenían un riesgo de sesgo bajo, mientras que se consideró que los otros 22 estudios tenían un riesgo de sesgo poco claro.
Características de los estudios incluidos
| Referencias | País | Duración | Número | Grupo de intervención | Grupo control | Medida de resultados | Índices de resultados | Tasa de incidencia de los EAETs | Tolerabilidad dérmica | |
|---|---|---|---|---|---|---|---|---|---|---|
| Intervención | Control | |||||||||
| Gold et al.9, 2017 | América | 12 semanas | 190 | Ivermectina en crema al 1%+brimonidina en gel al 0,33% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpios o casi limpios | 53/95 (55,8%) | 35/95 (36,8%) | Grupo de vermectina+brimonidina: 4/95 (4,2%)Grupo vehículo: 2/95 (2,1%) | La asociación de ivermectina y brimonidina fue bien tolerada |
| Taieb et al.10, 2015 | Francia | 16 semanas | 962 | Ivermectina en crema al 1%+brimonidina en gel al 0,33% | Metronidazol en crema al 0,75% | N.° de pacientes que logran puntuaciones IGA limpios o casi limpios | 405/478 (84,9%) | 364/484 (75,4%) | Grupo de Ivermectina: 2,3%Grupo de metronidazol: 3,7% | La tasa de empeoramiento con respecto al valor inicial fue mayor en el grupo de metronidazol 0,75% para escozor/quemadura, sequedad y picor |
| Gold et al.11, 2014 | América | 40 semanas | Estudio 1: 622Estudio 2: 636 | Ivermectina en crema al 1% | Gel de ácido azelaico al 15% | N.° de pacientes que logran puntuaciones IGA limpios o casi limpios | Estudio 1: 293/412 (59,4%)Estudio 2: 325/428 (76,0%) | Estudio 1: 125/210 (59,4%)Estudio 2: 120/208 (57,9%) | Estudio 1: grupo de ivermectina 1,9%, grupo de ácido azelaico 6,7%Estudio 2: grupo de ivermectina 2,1%, grupo de ácido azelaico 5,8% | La crema de ivermectina al 1% fue bien tolerada |
| Gold et al.6, 2014 | América | 12 semanas | Estudio 1: 910Estudio 2: 461 | Ivermectina en crema al 1% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpios o casi limpios | Estudio 1: 173/451 (38,4%)Estudio 2: 184/459 (40,1%) | Estudio 1: 27/232 (11,6%)Estudio 2: 43/229 (18,8%) | Estudio 1: grupo de ivermectina, 4,2%; Grupo de vehículo, 7,8%Estudio 2: grupo de vermectina, 2,6%; grupo de vehículo, 6,5% | La ivermectina fue bien tolerada durante el régimen de 12 semanas |
| Gold et al.12, 2020 | América | 12 semanas | Estudio 1: 751Estudio 2: 771 | Minociclina en espuma al 1,5% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpios o casi limpios | Estudio 1: 258/495 (52,1%)Estudio 2: 252/514 (49,1%) | Estudio 1: 110/256 (43,0%)Estudio 2: 100/257 (39,0%) | ND | >95% de los participantes declararon no haber tenido problemas de tolerabilidad cutánea o haberlos tenido leves |
| Webster et al.13, 2020 | America | 12 semanas | 270 | Minociclina en gel al 1% y al 3% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpio o casi limpios | Minociclina al 1%: 35/90 (39%)Minociclina al 3%: 43/93 (46%) | 24/78 (31%) | ND | Bien tolerado |
| Mrowietz et al.14, 2018 | Alemania | 12 Semanas de tratamiento y 4 Semanas de seguimiento | 232 | Minociclina en espuma 1,5% y 3% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpio o casi limpios | Minociclina al 1,5%: 20/79 (25,3%)Minociclina al 3%: 13/75 (17,3%) | 6/78 (7,7%) | Grupo de minociclina al 1,5%: 2/79 (2,5%)Grupo de minociclina al 3%: 4/75 (5,3%)Grupo vehículo: 5/78 (6,4%) | Bien tolerado |
| NCT0328779115 | America | 12 Semanas | 924 | Espuma de ácido azelaico 15% | Vehículo | N.° de pacientes que logran puntuaciones IGE limpios o casi limpios | 129/521 (24,8%) | 82/245 (33,5%) | ND | ND |
| Draelos et al.16, 2015 | America | Régimen de 12 semanas y seguimiento de 4 semanas | 961 | Espuma de ácido azelaico al 15% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpio o casi limpios | 155/484 (32,0%) | 112/477 (23,5%) | Grupo del ácido azelaico: 34/484 (7,0%)Grupo de vehículo: 21/477 (4,4%) | ND |
| NCT0212092417 | América | 12 semanas | 694 | Gel de ácido azelaico al 15% | Vehículo | N.° de pacientes que logran puntuaciones IGE limpio o casi limpios | 255/567 (45,0%) | 40/127 (31,5%) | ND | ND |
| Draelos et al.18, 2013 | América | Régimen de 12 semanas y seguimiento de 4 semanas | 401 | Espuma de ácido azelaico al 15% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpios o mínimo | 86/198 (43,4%) | 66/203 (32,5%) | Grupo de ácido azelaico: 21/198 (10,6%)Grupo del vehículo: 8/203 (3,9%) | ND |
| NCT0155546319 | América | 12 semanas | 961 | Espuma de ácido azelaico al 15% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpios o mínimo | 155/483 (32,1%) | 112/483 (23.4%) | ND | ND |
| Del Rosso et al.20, 2010 | América | 12 semanas | 207 | Ácido azelaico al 15% en gel+doxiciclina | Gel de metronidazol al 1%+doxiciclina | N.° de pacientes que logran puntuaciones IGA limpio, mínimo o leve | 83/106 (78,3%) | 73/101 (72,3%) | Grupo del ácido azelaico 2/106 (1,9%)Grupo del vehículo: 7/101 (6.9%) | Tanto el gel de ácido azelaico al 15% como el gel de metronidazol al 1% fueron bien tolerados |
| Elewski et al.8, 2003 | América | 15 semanas | 251 | Gel de ácido azelaico al 15% | Gel de metronidazol al 0,75% | N.° de pacientes que logran puntuaciones IGA limpio, mínimo o leve | 86/124 (69,4%) | 70/127 (55,1%) | Grupo del ácido azelaico: 32/124 (26%)Grupo del metronidazol: 9/127 (7%) | Los pacientes valoraron positivamente la tolerabilidad local de ambos tratamientos. |
| Thiboutot et al.21, 2003 | América | 12 semanas | Estudio 1: 329Estudio 2: 335 | Gel de ácido azelaico al 15% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpio, mínimo o leve | Estudio 1: 100/164 (61,0%)Estudio 2: 104/169 (61,5%) | Estudio 1: 67/165 (40,6%)Estudio 2: 79/166 (47,6%) | ND | Aproximadamente el 90% de los pacientes que tomaron el gel de ácido azelaico o el o vehículo consideraron que la tolerabilidad era «buena» o «aceptable a pesar de una irritación menor» |
| Miyachi et al.22, 2021 | Japon | 12 semanas | 130 | Gel de metronidazol al 0,75% | Vehículo | N.° de pacientes que logran puntuaciones IGA limpios o casi limpios | 25/65 (38,5%) | 12/65 (18,5%) | Grupo del metronidazol: 26/65 (40,0%)Grupo del vehículo: 19/65 (29,2%) | ND |
| Jackson et al.23, 2014 | América | 29 días | Estudio 1: 260Estudio 2: 293 | Gel de tartrato de brimonidina al 0,5% | Vehículo | N.° de pacientes que consiguen una disminución de 1 grado o más con respecto al valor basal tanto en el CEA como en el PSA | Estudio 1: 75/129 (58,3%)Estudio 2: 79/148 (53,5%) | Estudio 1: 42/131 (32,0%)Estudio 2: 50/145 (34,5%) | ND | ND |
| Fowler et al.24, 2013 | América | Régimen de 4 semanas y seguimiento de 4 semanas | Estudio 1: 260Estudio 2: 283 | Gel de tartrato de brimonidina al 0,5% | Vehículo | N.° de pacientes que logran una disminución de 2 grados o más con respecto al valor basal tanto en el CEA como en el PSA | Estudio 1: 29/127 (22,8%)Estudio 2: 30/142 (21,1%) | Estudio 1: 11/127 (8,6%)Estudio 2: 14/141 (9,9%) | Estudio 1: grupo de la brimonidina 29,5%; Grupo del vehículo, 25,2%Estudio 2: grupo de la brimonidina, 33,8%; Grupo del vehículo, 24,1% | El gel de tartrato de brimonidina al 0,5% una vez al día fue seguro y bien tolerado en el régimen de 4 semanas de aplicación continua |
| Fowler et al.25, 2012 | América | Estudio 1: una aplicación únicaEstudio 2: Régimen de 4 semanas y seguimiento de 4 semanas | Estudio 1: 122Estudio 2: 269 | Gel de tartrato de brimonidina al 0,5% | Vehículo | N.° de pacientes que consiguen una disminución de 2 grados o más con respecto al valor basal tanto en el CEA como en el PSA | Estudio 1: 17/131 (55%)Estudio 2: 10/53 (19%) | Estudio 1: 4/32 (12%)Estudio 2: 2/55 (4%) | Estudio 1: grupo de la brimonidina al 0,5% 6/31, grupo al 0,18% 4/31, al 0,07% 5/28, grupo del vehículo 6/32Estudio 2: grupo de la brimonidina al 0,18% BID 46%, Grupo del vehículo BID 32%, no datos de otros grupos | Las 3 concentraciones de geles de tartrato de brimonidina fueron bien toleradas |
| Baumann et al.7, 2018 | América | Régimen de 29 días y seguimiento de 28 días | 445 | Oximetazolina en crema al 1,0% | Vehículo | N.° de pacientes que logran una disminución de 2 grados o más con respecto al valor inicial tanto en el CEA como en el SSA | 28/224 (12,3%) | 13/221 (6,1%) | Grupo de la oximetazolina: 56/223 (25,1%)Grupo del vehículo: 47/221 (21,3%) | La crema de oximetazolina al 1,0% aplicada tópicamente en la cara una vez al día durante 29 días fue bien tolerada |
| Kircik et al.26, 2018 | América | Régimen de 29 días y seguimiento de 28 días | 440 | Oximetazolina en crema al 1,0% | Vehículo | N.° de pacientes que logran una disminución de 2 grados o más con respecto al valor inicial tanto en el CEA como en el SSA | 33/222 (14,8%) | 13/218 (6,0%) | Grupo de la oximetazolina, 17,1%; Grupo del vehículo, 10.6% | La oximetazolina fue bien tolerada en el régimen de 29 días |
IGE: evaluación global del investigador (igual que IGA); ND: no disponible.
Según los artículos incluidos se identificaron 6 fármacos tópicos para la rosácea, cuyo perfil de eficacia puede analizarse, entre ellos la ivermectina, la minociclina, el ácido azelaico, el metronidazol, la brimonidina y la oximetazolina. Los resultados del metaanálisis y del diagrama de bosque se muestran en las siguientes figuras.
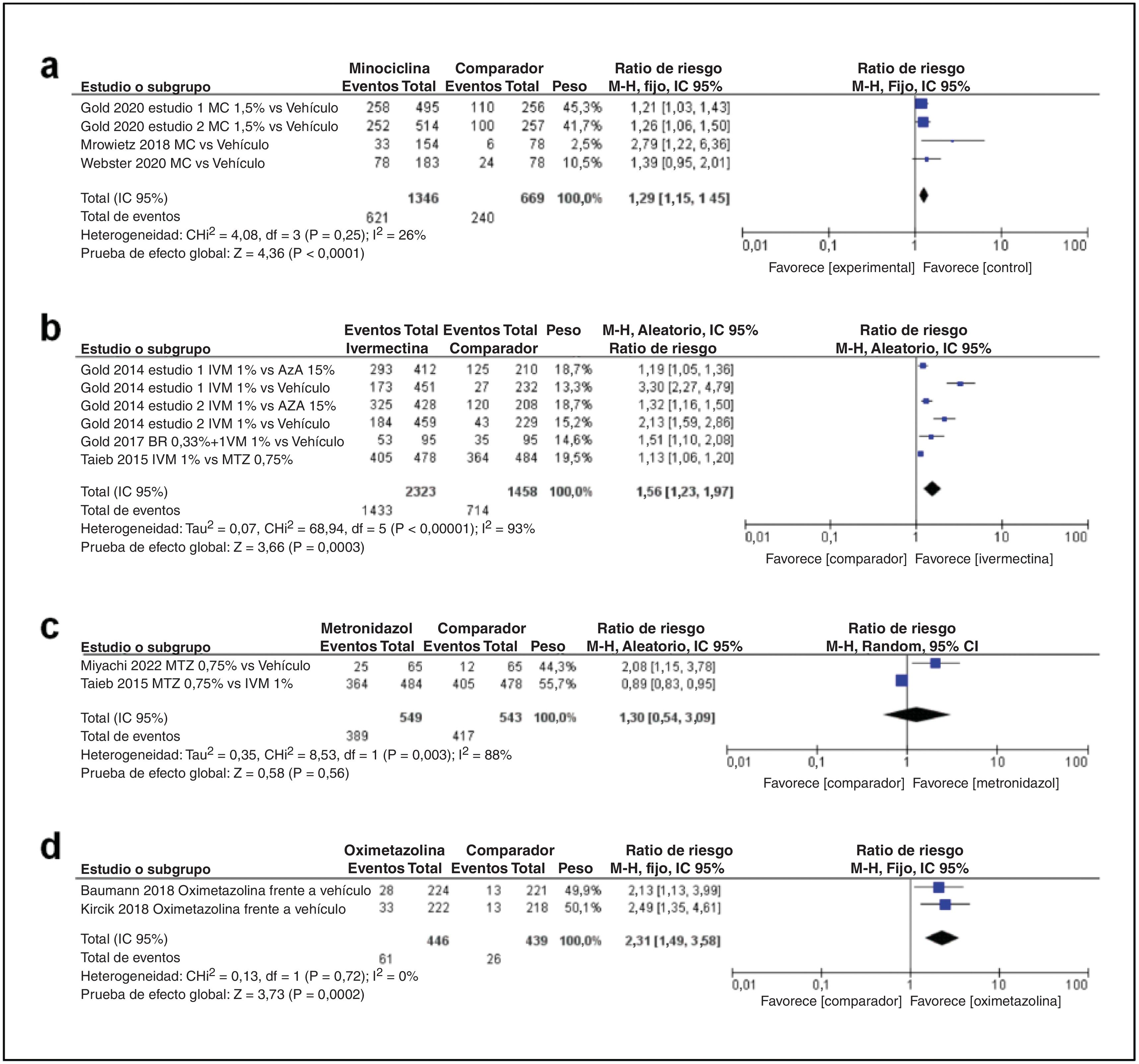
En primer lugar, con respecto al perfil de eficacia de la minociclina, como se muestra en la fig. 3A, se incluyeron un total de 4 estudios. Hubo una diferencia estadísticamente significativa entre el grupo de minociclina y los vehículos (DM 1,29; IC 95%: 1,15-1,45; p<0,00001).
En segundo lugar, respecto al perfil de eficacia de la ivermectina, como se muestra en la fig. 3b, se incluyeron un total de 4 estudios. Hubo una diferencia estadísticamente significativa entre el grupo de ivermectina y el comparador (DM 1,56; IC 95%: 1,23-1,97; p=0,0003).
En tercer lugar, en cuanto al perfil de eficacia del metronidazol, como se muestra en la fig. 3c, se incluyeron un total de 2 estudios. El metaanálisis estimó que no había diferencias estadísticamente significativas en la tasa de participantes que alcanzaban el «éxito» de la IGA (IGA≤1) entre el grupo de metronidazol al 0,75% y el grupo de comparación (DM 1,30; IC 95%: 0,54-3,09; p=0,56).
En cuarto lugar, en cuanto al perfil de eficacia de la oximetazolina, como se muestra en la fig. 3d, se incluyeron un total de 2 estudios. La oximetazolina mostró una diferencia estadísticamente significativa en la tasa de participantes que lograron una disminución de 2 grados o más con respecto al valor basal tanto en el CEA como en el SSA (DM 2,31; IC 95%: 1,49-3,58; p=0,0002).
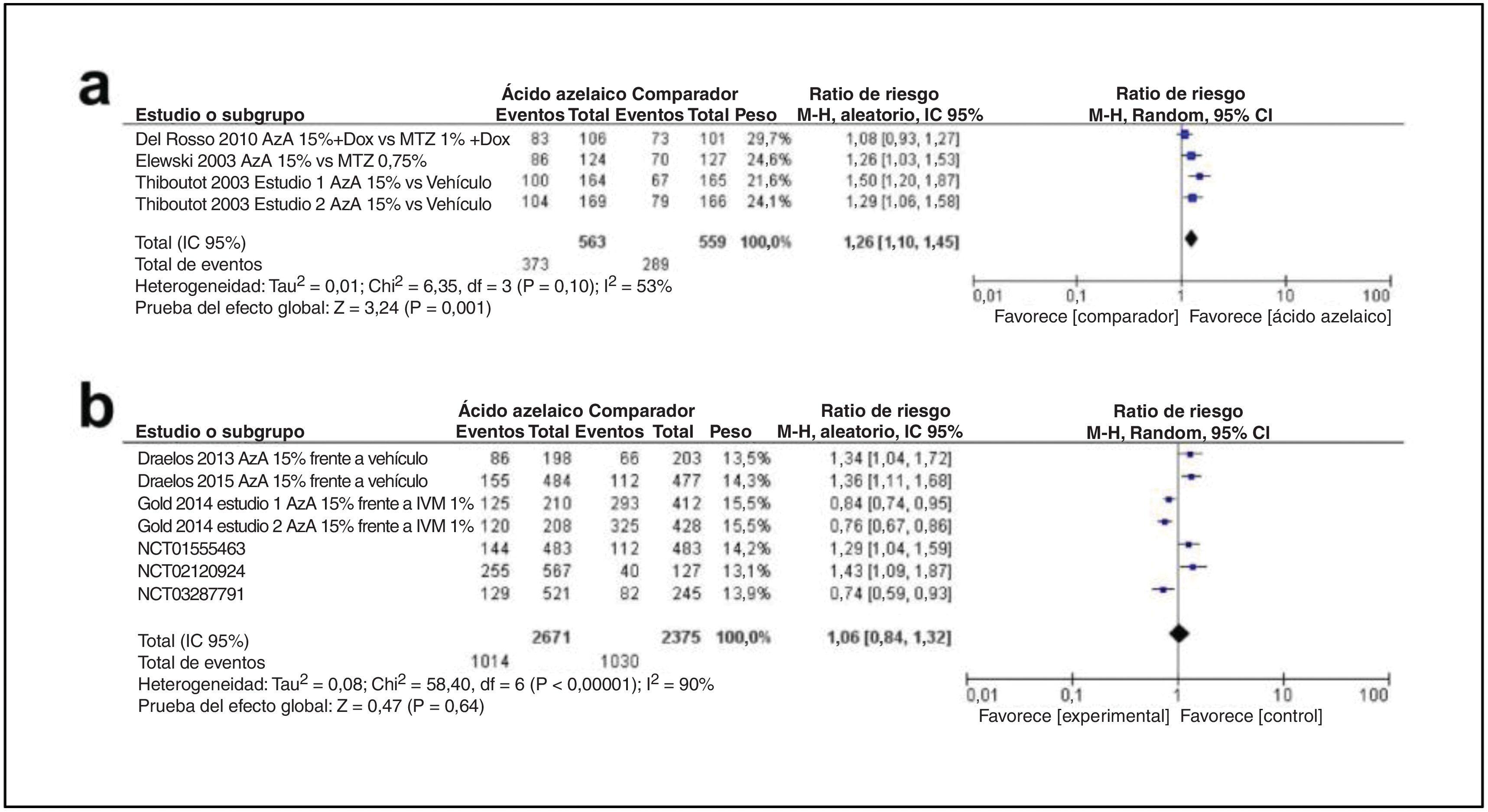
En quinto lugar, en relación con el perfil de eficacia del ácido azelaico, se incluyó un total de 9 estudios. En estos artículos había 2 tipos de métodos de puntuación. Un total de 3 artículos aplicaron un sistema de puntuación estático de 7 puntos, como se menciona en la tabla 2, de 0 (limpio) a 6 (grave). En este sistema el «éxito» se definió como IGA≤2 (limpio, mínimo y leve). Como se muestra en la fig. 4a, la tasa de éxito fue mayor en el grupo del ácido azelaico al 15% (DM 1,26; IC 95%: 1,10-1,45; p=0,001). Un total de 6 estudios utilizaron el IGA como se menciona en la tabla 3. Como se muestra en la fig. 4b, no hubo diferencias estadísticamente significativas entre el ácido azelaico y el comparador (DM: 1,06; IC 95%: 0,84-1,32; p=0,64).
IGA (0-6)8
| Puntuación numérica | Definición | Descripción |
|---|---|---|
| 0 | Limpia | Casi sin rosácea, sin eritema o eritema residual; pueden existir telangiectasias en grado leve a moderado |
| 1 | Mínimo | Raras pápulas y/o pústulas, eritema de residual a leve, pueden existir telangiectasias en grado leve a moderado |
| 2 | Leve | Pocas pápulas y/o pústulas, eritema leve, pueden existir telangiectasias en grado leve a moderado |
| 3 | Leve a moderada | Número evidente de pápulas y/o pústulas, eritema de leve a moderado, pueden existir telangiectasias en grado leve a moderado |
| 4 | Moderada | Número evidente de pápulas y/o pústulas, eritema moderado, pueden existir telangiectasias en grado leve a moderado |
| 5 | Moderada a grave | Numerosas pápulas y/o pústulas, esporádicamente con lesiones inflamatorias, eritema moderado, pueden existir telangiectasias en grado moderado |
| 6 | Grave | Numerosas pápulas y/o pústulas, esporádicamente con zonas de fusión de lesiones inflamatorias, eritema de moderado a grave, pueden existir telangiectasias de grado moderado a grave |
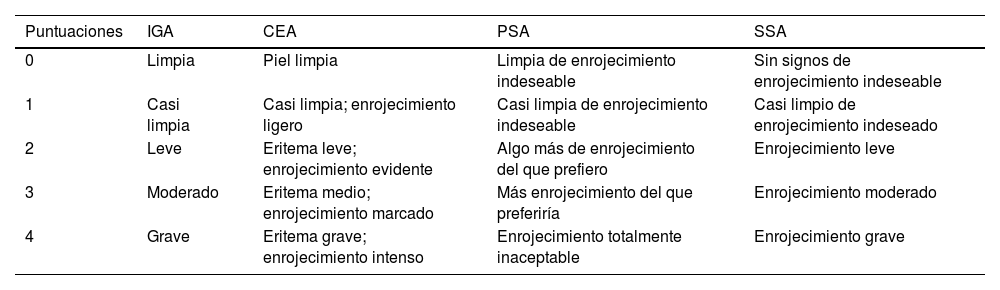
Escalas de evaluación global del investigador (IGA) (0-4), evaluación del eritema por el clínico (CEA), autoevaluación del paciente (PSA) y autoevaluación del enrojecimiento facial de la rosácea por el sujeto (SSA)6,7
| Puntuaciones | IGA | CEA | PSA | SSA |
|---|---|---|---|---|
| 0 | Limpia | Piel limpia | Limpia de enrojecimiento indeseable | Sin signos de enrojecimiento indeseable |
| 1 | Casi limpia | Casi limpia; enrojecimiento ligero | Casi limpia de enrojecimiento indeseable | Casi limpio de enrojecimiento indeseado |
| 2 | Leve | Eritema leve; enrojecimiento evidente | Algo más de enrojecimiento del que prefiero | Enrojecimiento leve |
| 3 | Moderado | Eritema medio; enrojecimiento marcado | Más enrojecimiento del que preferiría | Enrojecimiento moderado |
| 4 | Grave | Eritema grave; enrojecimiento intenso | Enrojecimiento totalmente inaceptable | Enrojecimiento grave |
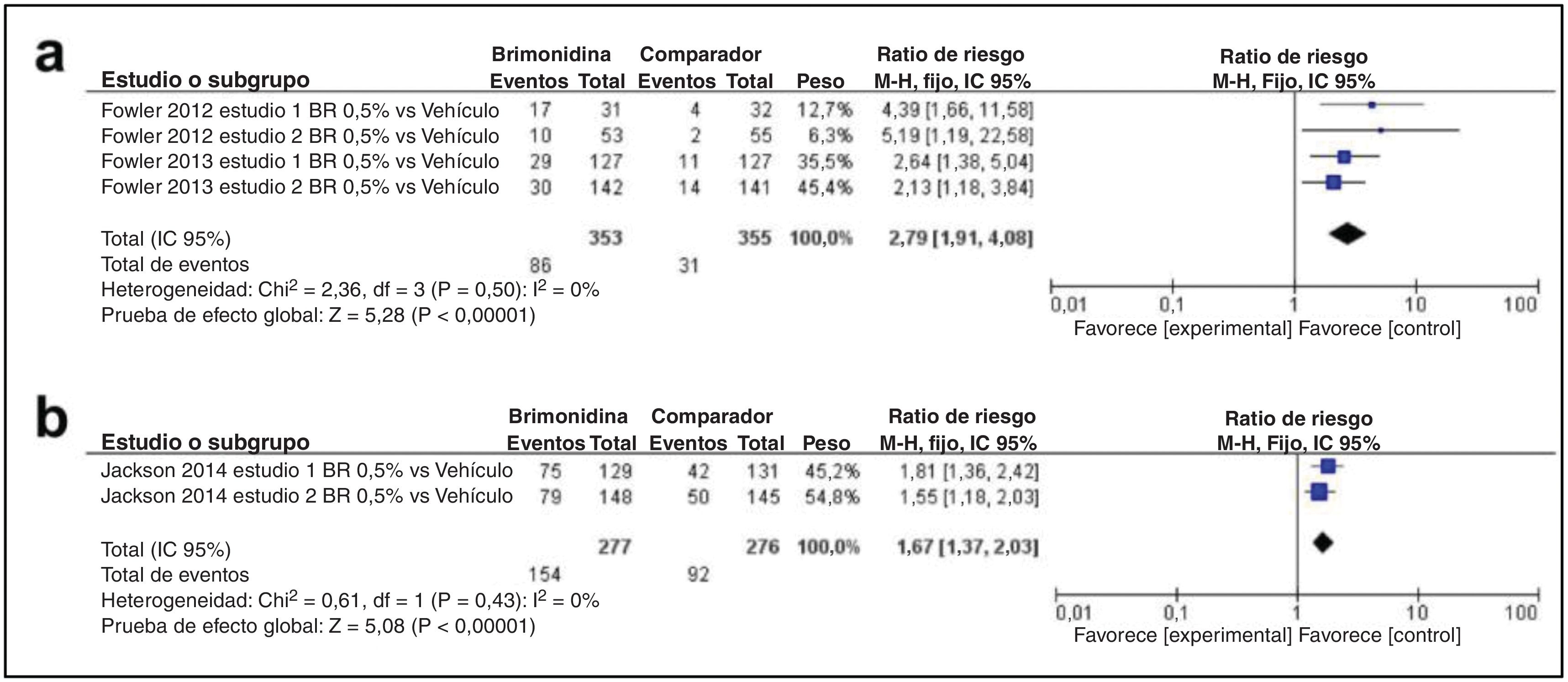
En sexto lugar, con respecto al perfil de eficacia de la brimonidina, como se muestra en la fig. 5a, se incluyeron un total de 2 estudios. La tasa de pacientes que lograron una disminución de 2 grados o más con respecto al valor basal tanto en el CEA como en el PSA fue mayor en el grupo de brimonidina y hubo significación entre los 2 grupos (DM, 2,79; IC 95%: 1,91-4,08; p<0,00001). La figura 5b ilustra un artículo sobre la tasa de pacientes que lograron una mejoría de 1 grado, tanto en el CEA como en el PSA como resultado de la eficacia. También hubo significación entre los 2 grupos (DM, 1,67; IC 95%: 1,37-2,03; p<0,00001).
DiscusiónLa rosácea es una enfermedad inflamatoria de la piel caracterizada por una disfunción inmunitaria y un trastorno neurovascular. Aunque los médicos pueden aliviar los síntomas de los pacientes eligiendo diferentes intervenciones potenciales, la rosácea es difícil de curar27.
En el cribado de los ECA relacionados se comunicaron diversos criterios de valoración de la eficacia. En nuestro estudio, utilizamos el IGA, el IGE, el CEA, el PSA y el SSA para cuantificar los perfiles de eficacia. El IGA se basó en la gravedad de las lesiones inflamatorias (pápulas y pústulas) y el eritema, y los criterios de puntuación del IGE fueron los mismos que los del IGA. El CEA y el PSA fueron los sistemas de puntuación del eritema de clínicos y pacientes, respectivamente. El SSA era similar al PSA porque ambos se basan en las sensaciones de los pacientes. Las 4 escalas eran relativamente sencillas y claras, por lo que decidimos tomarlas como medida de los índices de resultados. Aunque muchos ECA relacionados se centraron en el cambio del recuento de lesiones inflamatorias, no se dispuso de resultados de datos unificados para el análisis. Dado que algunos estudios utilizaron diferentes normas de gradación del eritema, decidimos excluirlos.
Entre los fármacos estudiados en este artículo la minociclina, la ivermectina y el metronidazol son antibióticos. La minociclina es una tetraciclina semisintética de segunda generación y amplio espectro que ha demostrado tener propiedades antibacterianas y antiinflamatorias28. La minociclina solía ser un tratamiento sistemático para la rosácea, pero la terapia oral puede provocar efectos secundarios generales, como efectos secundarios gastrointestinales29. Su uso tópico es relativamente nuevo. Sin embargo, se ha informado de que la aplicación tópica de minociclina proporciona una mayor concentración y durabilidad del fármaco en la piel frente a la administración oral30. La minociclina puede eliminar eficazmente los patógenos externos que causan infecciones superficiales, especialmente los causados por bacterias Gram-positivas31,32. En los 3 estudios incluidos12–14 la minociclina es segura y bien tolerada en pacientes con rosácea papulopustulosa.
El metronidazol se ha utilizado para tratar la rosácea durante muchos años y se ha documentado su perfil de seguridad33. Narayanan et al. llegaron a la siguiente conclusión a partir de un experimento con modelos de lípidos cutáneos: el metronidazol ejerce un efecto antioxidante a través de 2 vías diferentes: reduciendo la producción de especies reactivas de oxígeno (ROS) en los tejidos e inactivando los ROS existentes34. Esta es probablemente la razón principal de la eficacia clínica del metronidazol. El metronidazol tópico se utiliza para tratar las lesiones inflamatorias relacionadas con la rosácea. En comparación con el vehículo, el metronidazol tiene un mejor efecto terapéutico en la rosácea, aunque su perfil de eficacia es inferior al de la ivermectina y el ácido azelaico, según los resultados. Estudios anteriores también han demostrado que el metronidazol es eficaz para reducir el eritema, las pápulas y las pústulas35–39.
En cuanto a la ivermectina es un fármaco del tipo de la avermectina que ejerce efectos antiinflamatorios mediante la inhibición de la producción de citocinas inflamatorias y la regulación al alza de la citocina antiinflamatoria IL-106,40. También se ha informado de que la ivermectina ejerce un efecto antiparasitario41. En 2020 se publicó un estudio sobre el perfil de eficacia de la ivermectina, cuyos resultados fueron los mismos que los nuestros42. En los últimos 2 años no han aparecido nuevos ensayos controlados aleatorizados con resultados para evaluar el perfil de eficacia de la ivermectina tópica. La ivermectina se tolera bien entre los pacientes de los estudios incluidos y parece ser más eficaz que el metronidazol y el ácido azelaico. Además, un régimen a largo plazo de 52 semanas de ivermectina demostró ser seguro y eficaz11. Sin embargo, en los ensayos clínicos la ivermectina solo se ha utilizado en la rosácea papulopustular de moderada a grave y principalmente en pacientes de raza caucásica, lo que limita la universalidad de los datos43.
Los mecanismos farmacológicos del ácido azelaico se han investigado en muchos estudios, como la inhibición de la supervivencia y viabilidad microbianas, la regulación de la diferenciación epidérmica y la acción inhibidora sobre la generación o liberación de ROS en los neutrófilos44–46. El perfil de eficacia del ácido azelaico en el tratamiento de la rosácea puede deberse a la inhibición de la catelicidina y la calicreína 5, factores que se considera que desempeñan papeles fundamentales en la fisiopatología de la rosácea47. En nuestro metaanálisis el ácido azelaico demostró tener un efecto significativo frente a los excipientes. Además, el ácido azelaico siempre se tolera bien y constituye una opción de tratamiento factible para los pacientes con rosácea.
Los agonistas tópicos de los receptores adrenérgicos α han sido reconocidos como una opción de tratamiento de la rosácea con eritema facial persistente24,48,49. La brimonidina tiene una alta afinidad por los adrenoceptores α2 y la oximetazolina es un agonista selectivo de los receptores adrenérgicos α1. Estos 2 agentes se unen a los receptores específicos de los músculos lisos que rodean los vasos, lo que provoca vasoconstricción48,50. Por lo tanto, estos 2 fármacos son adecuados para tratar el eritema facial. En los resultados de nuestro análisis la brimonidina y la oximetazolina demostraron ser más eficaces que el vehículo. El uso combinado de brimonidina más ivermectina también aumenta la tasa de éxito del tratamiento9. Dado que el número de ECA sobre la brimonidina y la oximetazolina es insuficiente, esperamos que se realicen más investigaciones sobre el perfil de eficacia de los 2 fármacos.
Aunque nuestro metaanálisis ofreció una visión general de los fármacos tópicos para la rosácea, aún presenta algunas limitaciones. En primer lugar, la mayoría de los estudios incluidos se realizaron en América, por lo que no se cuenta con datos experimentales de otras poblaciones, especialmente de población asiática. Las diferencias en la prevalencia y gravedad de la enfermedad entre poblaciones de distintas regiones pueden alterar los resultados del análisis. En segundo lugar, el número de estudios incluidos sobre varios fármacos fue limitado. Ensayos clínicos a mayor escala serían más convincentes. En tercer lugar, dado que la mayoría de los estudios probaron fármacos tópicos en pacientes con rosácea de moderada (IGA=3) a grave (IGA=4), no pudimos evaluar el perfil de eficacia de los pacientes leves (IGA=2). Los ECA con la mejora del eritema como indicador de resultado también incluyeron participantes con eritema de moderado a grave. Siguen siendo necesarios más estudios realizados con pacientes con una afectación leve. En cuarto lugar, se realizaron escasas comparaciones entre el perfil de eficacia de múltiples fármacos, aunque se dieron más ensayos de comparación entre diferentes fármacos y vehículos. Por lo tanto, se necesitan más estudios prospectivos y de alta calidad para verificar el perfil de eficacia de múltiples fármacos tópicos en la rosácea.
ConclusionesEste metaanálisis analizó el perfil de eficacia de 6 fármacos tópicos para el tratamiento de la rosácea, entre ellos la minociclina, la ivermectina, el ácido azelaico, el metronidazol, la brimonidina y la oximetazolina. El perfil de eficacia de estos fármacos demostró ser superior al de los vehículos. Todos estos fármacos son bien tolerados y seguros. Entre ellos, la ivermectina demostró ser más eficaz que el ácido azelaico y el metronidazol. El ácido azelaico tiene un perfil de eficacia mejor que el metronidazol según los estudios incluidos. La minociclina resultó eficaz para mejorar los síntomas de la rosácea. Tanto la brimonidina como la oximetazolina tuvieron un efecto significativo en la reducción del enrojecimiento facial. También hay ciertas perspectivas de la aplicación de combinaciones de fármacos. En el futuro se esperan estudios de mayor escala y duración.
AutoríaXingyue Gao: redacción-revisión y edición, redacción del borrador original, visualización, validación, supervisión, software, recursos, administración del proyecto, metodología, investigación, análisis formal, curación de datos y conceptualización. Wenzhong Xiang: redacción-revisión y edición, adquisición de fondos. Todos los autores leyeron y aprobaron la versión final del manuscrito.
Aprobación éticaEste artículo se basa en estudios realizados previamente y no contiene nuevos estudios con participantes humanos o animales realizados por ninguno de los autores.
FinanciaciónEste estudio contó con el apoyo de Hangzhou health science and technology key project (n.° 20220054). Este trabajo contó con el apoyo de Hangzhou medical key discipline construction project (No. [37]21-3) y Proyecto de apoyo al desarrollo de la industria biomédica y sanitaria de Hangzhou (2021WJCY159).
Conflicto de interesesNinguno.