Los fármacos biológicos inhibidores del factor de necrosis tumoral (TNF) alfa son usados para tratar diferentes enfermedades inflamatorias. A pesar de su adecuado perfil de seguridad, se han descrito reacciones paradójicas asociadas a estos tratamientos.
Material y métodoSe ha realizado una revisión retrospectiva de los pacientes en tratamiento con un anti-TNF que hubiesen presentado una reacción paradójica con afectación cutánea visitados en el Servicio de Dermatología del Hospital Universitari Parc Taulí de Sabadell.
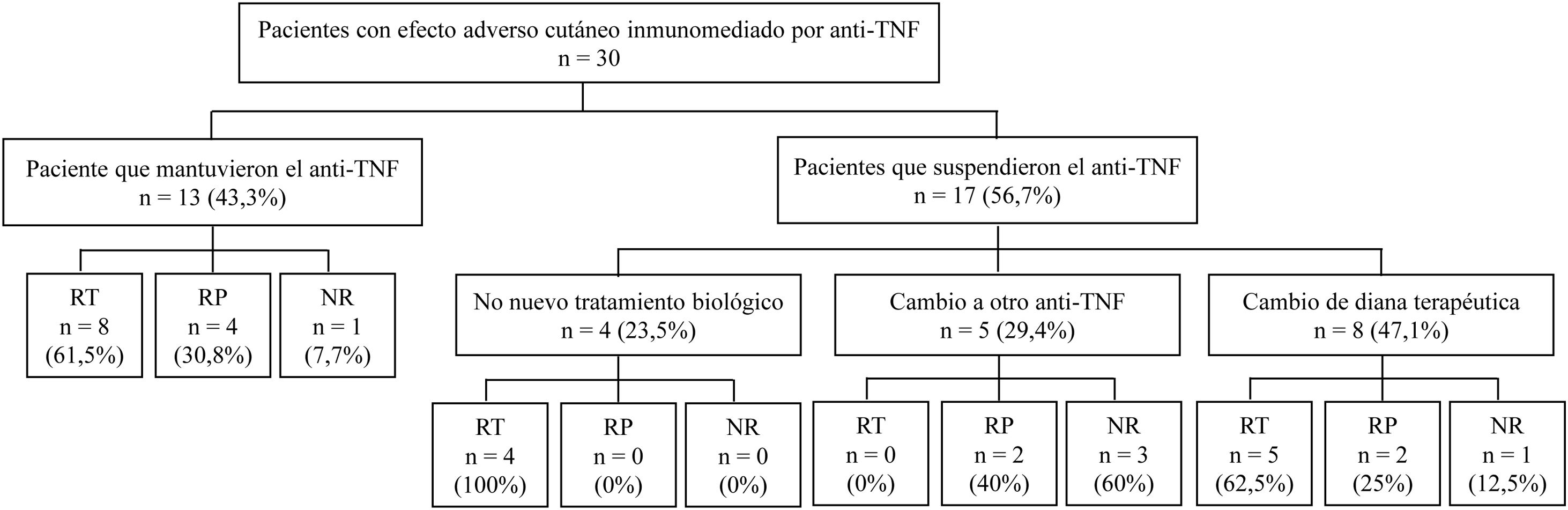
ResultadosRegistramos 30 pacientes en tratamiento con un anti-TNF que desarrollaron un efecto adverso cutáneo inmunomediado en forma de psoriasis (90%), alopecia (6,7%) o dermatitis neutrofílica (3,3%). Adalimumab fue el fármaco más implicado (56,7%), seguido de infliximab (40%). La morfología de la reacción psoriasiforme más descrita es la generalizada en placas (62,9%), seguida de la pustulosis palmo-plantar (37%). El 43,3% de los pacientes mantuvieron el anti-TNF, y de ellos el 92,3% obtuvieron una resolución total y parcial. De los 5 pacientes que iniciaron otro anti-TNF, ninguno obtuvo una resolución total. De los 8 pacientes que cambiaron a un tratamiento biológico diferente al anti-TNF, el 62,5% obtuvieron una resolución total o parcial.
DiscusiónLa aparición de una reacción paradójica no siempre obliga al cambio de tratamiento biológico, puesto que se ha observado la resolución de las lesiones cutáneas con un tratamiento tópico y/o sistémico adicional en más de la mitad de los pacientes, sin necesidad de suspender el anti-TNF. Si la afectación es grave, se debe plantear el cambio de tratamiento biológico, siendo más eficaz iniciar un fármaco dirigido a una diana terapéutica distinta al anti-TNF.
Tumor necrosis factor α (TNF) inhibitors are used to treat different inflammatory diseases. Although these biologics have an adequate safety profile, they have been associated with paradoxical reactions.
Material and methodsRetrospective review of patients on TNF inhibitor therapy who developed a paradoxical skin reaction and were seen at the dermatology department of Hospital Universitari Parc Taulí in Sabadell, Spain.
ResultsWe collected data on 30 patients under treatment with a TNF inhibitor who developed an immune-mediated skin reaction in the form of psoriasis (90%), alopecia (6.7%), or neutrophilic dermatitis (3.3%). The most common drugs involved were adalimumab (56.7%) and infliximab (40%). Psoriasiform reactions mostly manifested as generalized plaques (62.9%) or palmoplantar pustulosis (37%). Thirteen patients (43.3%) continued on the same TNF inhibitor and 12 of them (92.3%) achieved partial or complete resolution of lesions. Five patients were switched to a different TNF inhibitor, but none of them achieved complete resolution. Eight patients were switched to a biologic with a different target, and 5 of them (62.5%) achieved partial or complete resolution.
ConclusionsParadoxical reactions during TNF inhibitor therapy do not always require a change of treatment. In our series, the addition of a topical and/or systemic treatment resolved the skin lesions in more than half of the patients, and switching to a drug with a different target was more effective. A change of strategy should be contemplated in more serious cases.
Los inhibidores del factor de necrosis tumoral (TNF) alfa son usados para tratar diferentes enfermedades inflamatorias, como la enfermedad inflamatoria intestinal, la psoriasis, la hidrosadenitis supurativa, las artritis y las espondiloartritis, entre otras. A pesar de tener un buen perfil de seguridad, se han descrito diversos efectos adversos, siendo frecuente la afectación cutánea en forma de reacción en el punto de inyección, infección cutánea o efecto adverso cutáneo inmunomediado (EACI). Algunos de los efectos adversos cutáneos inmunomediados descritos son: psoriasis, liquen plano, lupus eritematoso sistémico o lupus inducido por fármacos, hidrosadenitis supurativa, penfigoide ampolloso, vasculitis, sarcoidosis cutánea, vitíligo y erupción acneiforme, entre otras1-5. Cuando estas enfermedades inmunomediadas responden a ese mismo agente biológico se las denomina reacciones paradójicas (RP), definidas como el debut o el empeoramiento de una de las enfermedades que se trata con estos medicamentos3-8. El espectro de las RP secundarias al tratamiento con anti-TNF es muy variable, aunque la afectación cutánea en forma de reacción psoriasiforme es la más descrita4.
La interrupción del fármaco o el cambio a otro tratamiento biológico conducen a la resolución de las lesiones cutáneas en la mayoría de los casos, pero en ocasiones también se puede conseguir un buen control con tratamientos adicionales, lo que permite mantener el tratamiento con el anti-TNF (fig. 1).
Todavía no se ha establecido una explicación fisiopatológica para este tipo de reacciones, ni se han propuesto guías terapéuticas para un abordaje adecuado de estos pacientes.
El objetivo de este estudio fue revisar de forma retrospectiva las características clínicas, la evolución y el tratamiento de los pacientes visitados en nuestro centro que desarrollaron un EACI secundario al tratamiento con un anti-TNF.
Material y métodoRealizamos un estudio descriptivo retrospectivo de todos los pacientes en tratamiento con un anti-TNF que hubiesen presentado un EACI visitados en el Servicio de Dermatología del Hospital Universitari Parc Taulí de Sabadell desde enero de 2006 hasta diciembre de 2022, utilizando el registro de una base de datos del servicio de Digestivo, Reumatología y Dermatología de nuestro centro.
Se recopilaron las siguientes características de cada paciente: sexo, edad, antecedentes personales y familiares de psoriasis, enfermedad de base por la que recibía el anti-TNF (enfermedad de Crohn, colitis ulcerosa, hidrosadenitis supurativa, espondilitis anquilosante y osteomielitis crónica multifocal recurrente), tratamiento biológico utilizado en el momento del EACI (adalimumab, infliximab y golimumab), tratamientos que el paciente había realizado previamente y/o concomitantemente, tiempo de latencia desde la introducción del anti-TNF hasta la aparición del EACI, tipo de EACI (psoriasis, alopecia y dermatosis neutrofílica), morfología del EACI, confirmación histológica, tratamiento adicional del EACI (tópico y sistémico), suspensión del anti-TNF, nuevo tratamiento biológico y resolución de las lesiones cutáneas (resolución total, parcial o no resolución). La morfología de las reacciones psoriasiformes se clasificaron en 6tipos: generalizada en placas, pustulosis palmo-plantar, invertida, del cuero cabelludo, en gotas y eritrodérmica. Los tipos de reacciones psoriasiformes no eran mutuamente excluyentes, por lo que en un mismo paciente podían diagnosticarse múltiples formas clínicas de reacción.
Los datos fueron recopilados en tablas para el análisis de datos utilizando el programa SPSS. Posteriormente se realizó un análisis descriptivo con mediana y rango para las variables cuantitativas y con frecuencias para las variables cualitativas.
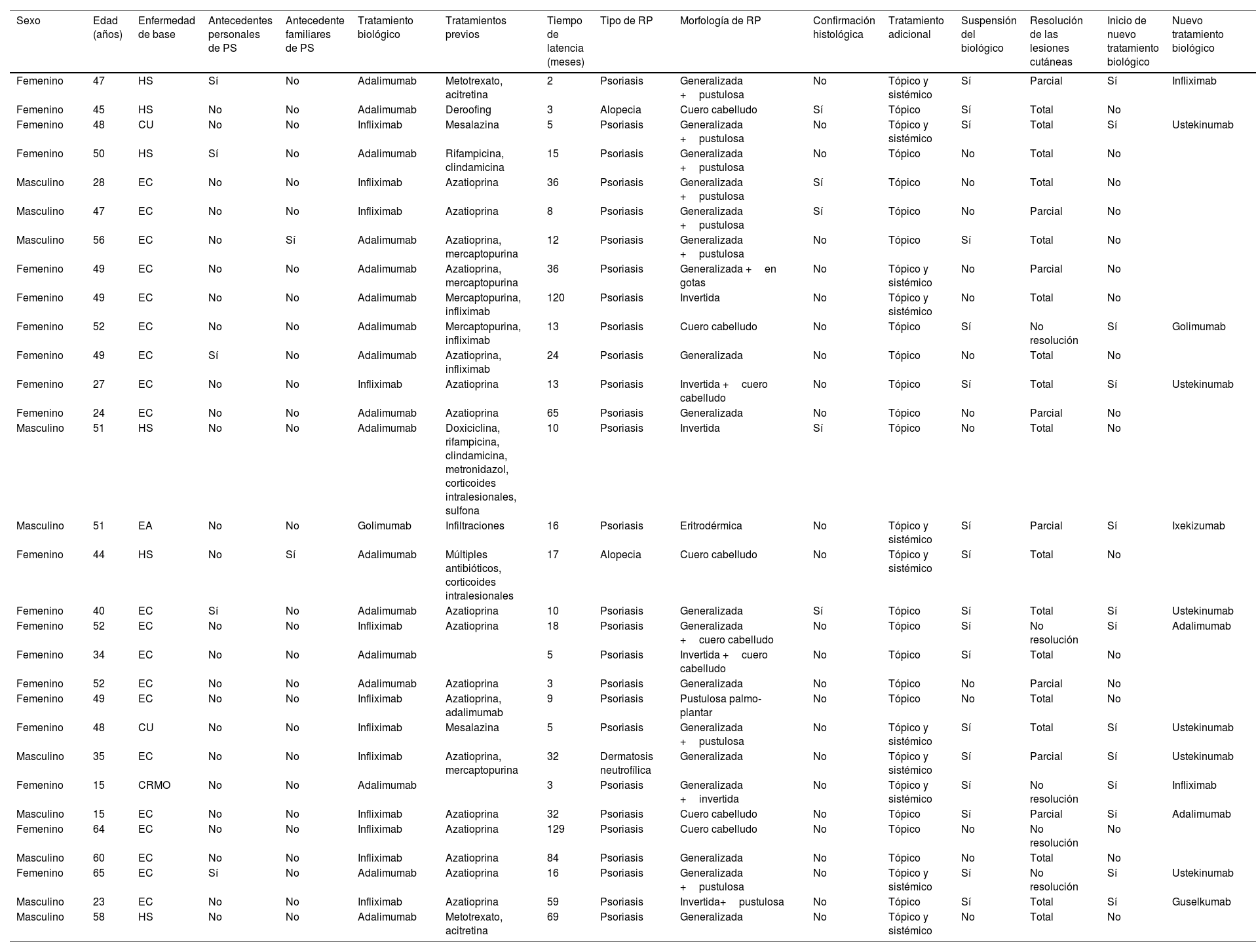
ResultadosSe incluyeron 30 pacientes (tabla 1), de los cuales 20 (66,7%) eran mujeres y 10 (33,3%) hombres. El rango de edad varía de los 15 a los 65años, con una mediana de 49años. Cinco (16,7%) pacientes presentaban antecedentes personales de psoriasis y 2 (6,7%), antecedentes familiares de psoriasis.
Datos de los pacientes de nuestra serie que presentaron un efecto adverso cutáneo inmunomediado por anti-TNF
| Sexo | Edad (años) | Enfermedad de base | Antecedentes personales de PS | Antecedente familiares de PS | Tratamiento biológico | Tratamientos previos | Tiempo de latencia (meses) | Tipo de RP | Morfología de RP | Confirmación histológica | Tratamiento adicional | Suspensión del biológico | Resolución de las lesiones cutáneas | Inicio de nuevo tratamiento biológico | Nuevo tratamiento biológico |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Femenino | 47 | HS | Sí | No | Adalimumab | Metotrexato, acitretina | 2 | Psoriasis | Generalizada +pustulosa | No | Tópico y sistémico | Sí | Parcial | Sí | Infliximab |
| Femenino | 45 | HS | No | No | Adalimumab | Deroofing | 3 | Alopecia | Cuero cabelludo | Sí | Tópico | Sí | Total | No | |
| Femenino | 48 | CU | No | No | Infliximab | Mesalazina | 5 | Psoriasis | Generalizada +pustulosa | No | Tópico y sistémico | Sí | Total | Sí | Ustekinumab |
| Femenino | 50 | HS | Sí | No | Adalimumab | Rifampicina, clindamicina | 15 | Psoriasis | Generalizada +pustulosa | No | Tópico | No | Total | No | |
| Masculino | 28 | EC | No | No | Infliximab | Azatioprina | 36 | Psoriasis | Generalizada +pustulosa | Sí | Tópico | No | Total | No | |
| Masculino | 47 | EC | No | No | Infliximab | Azatioprina | 8 | Psoriasis | Generalizada +pustulosa | Sí | Tópico | No | Parcial | No | |
| Masculino | 56 | EC | No | Sí | Adalimumab | Azatioprina, mercaptopurina | 12 | Psoriasis | Generalizada +pustulosa | No | Tópico | Sí | Total | No | |
| Femenino | 49 | EC | No | No | Adalimumab | Azatioprina, mercaptopurina | 36 | Psoriasis | Generalizada +en gotas | No | Tópico y sistémico | No | Parcial | No | |
| Femenino | 49 | EC | No | No | Adalimumab | Mercaptopurina, infliximab | 120 | Psoriasis | Invertida | No | Tópico y sistémico | No | Total | No | |
| Femenino | 52 | EC | No | No | Adalimumab | Mercaptopurina, infliximab | 13 | Psoriasis | Cuero cabelludo | No | Tópico | Sí | No resolución | Sí | Golimumab |
| Femenino | 49 | EC | Sí | No | Adalimumab | Azatioprina, infliximab | 24 | Psoriasis | Generalizada | No | Tópico | No | Total | No | |
| Femenino | 27 | EC | No | No | Infliximab | Azatioprina | 13 | Psoriasis | Invertida +cuero cabelludo | No | Tópico | Sí | Total | Sí | Ustekinumab |
| Femenino | 24 | EC | No | No | Adalimumab | Azatioprina | 65 | Psoriasis | Generalizada | No | Tópico | No | Parcial | No | |
| Masculino | 51 | HS | No | No | Adalimumab | Doxiciclina, rifampicina, clindamicina, metronidazol, corticoides intralesionales, sulfona | 10 | Psoriasis | Invertida | Sí | Tópico | No | Total | No | |
| Masculino | 51 | EA | No | No | Golimumab | Infiltraciones | 16 | Psoriasis | Eritrodérmica | No | Tópico y sistémico | Sí | Parcial | Sí | Ixekizumab |
| Femenino | 44 | HS | No | Sí | Adalimumab | Múltiples antibióticos, corticoides intralesionales | 17 | Alopecia | Cuero cabelludo | No | Tópico y sistémico | Sí | Total | No | |
| Femenino | 40 | EC | Sí | No | Adalimumab | Azatioprina | 10 | Psoriasis | Generalizada | Sí | Tópico | Sí | Total | Sí | Ustekinumab |
| Femenino | 52 | EC | No | No | Infliximab | Azatioprina | 18 | Psoriasis | Generalizada +cuero cabelludo | No | Tópico | Sí | No resolución | Sí | Adalimumab |
| Femenino | 34 | EC | No | No | Adalimumab | 5 | Psoriasis | Invertida +cuero cabelludo | No | Tópico | Sí | Total | No | ||
| Femenino | 52 | EC | No | No | Adalimumab | Azatioprina | 3 | Psoriasis | Generalizada | No | Tópico | No | Parcial | No | |
| Femenino | 49 | EC | No | No | Infliximab | Azatioprina, adalimumab | 9 | Psoriasis | Pustulosa palmo-plantar | No | Tópico | No | Total | No | |
| Femenino | 48 | CU | No | No | Infliximab | Mesalazina | 5 | Psoriasis | Generalizada +pustulosa | No | Tópico y sistémico | Sí | Total | Sí | Ustekinumab |
| Masculino | 35 | EC | No | No | Infliximab | Azatioprina, mercaptopurina | 32 | Dermatosis neutrofílica | Generalizada | No | Tópico y sistémico | Sí | Parcial | Sí | Ustekinumab |
| Femenino | 15 | CRMO | No | No | Adalimumab | 3 | Psoriasis | Generalizada +invertida | No | Tópico y sistémico | Sí | No resolución | Sí | Infliximab | |
| Masculino | 15 | EC | No | No | Infliximab | Azatioprina | 32 | Psoriasis | Cuero cabelludo | No | Tópico | Sí | Parcial | Sí | Adalimumab |
| Femenino | 64 | EC | No | No | Infliximab | Azatioprina | 129 | Psoriasis | Cuero cabelludo | No | Tópico | No | No resolución | No | |
| Masculino | 60 | EC | No | No | Infliximab | Azatioprina | 84 | Psoriasis | Generalizada | No | Tópico | No | Total | No | |
| Femenino | 65 | EC | Sí | No | Adalimumab | Azatioprina | 16 | Psoriasis | Generalizada +pustulosa | No | Tópico y sistémico | Sí | No resolución | Sí | Ustekinumab |
| Masculino | 23 | EC | No | No | Infliximab | Azatioprina | 59 | Psoriasis | Invertida+pustulosa | No | Tópico | Sí | Total | Sí | Guselkumab |
| Masculino | 58 | HS | No | No | Adalimumab | Metotrexato, acitretina | 69 | Psoriasis | Generalizada | No | Tópico y sistémico | No | Total | No |
CRMO: osteomielitis crónica multifocal recurrente; CU: colitis ulcerosa; EA: espondilitis anquilosante; EC: enfermedad de Crohn; HS: hidrosadenitis; PS: psoriasis; RP: reacción paradójica.
La enfermedad de base por la que recibían tratamiento con anti-TNF era la enfermedad de Crohn en 20 (66,7%), la colitis ulcerosa en 2 (6,7%), la hidrosadenitis supurativa en 6 (20%), la espondilitis anquilosante en uno (3,3%) y la osteomielitis crónica multifocal recurrente (CRMO) en un caso (3,3%).
La mayoría de los pacientes habían realizado tratamiento inmunosupresor previo (metotrexato, azatioprina, corticoides, entre otros). No se ha observado que los tratamientos previos hayan influido en la aparición del EACI.
En nuestra revisión, tres fármacos se han visto implicados en la aparición de un EACI: adalimumab se ha asociado a la aparición de 17 casos (56,7%), seguido de infliximab en 12 (40%) y de golimumab en uno (3,3%).
La forma de presentación del EACI más frecuente es la reacción paradójica psoriasiforme en 27 (90%) pacientes. La morfología de la reacción psoriasiforme es variable. Se ha descrito psoriasis generalizada en placas en 17 casos (62,9%), pustulosis palmo-plantar en 10 (37%), psoriasis invertida en 6 (22,2%), psoriasis del cuero cabelludo en 6 (22,2%), psoriasis en gotas en uno (3,7%) y psoriasis eritrodérmica en uno (3,7%). En la mayoría de los casos había coexistencia en dos o más formas de presentación de reacción psoriasiforme, sobre todo la combinación de placas generalizada con pustulosis palmo-plantar (tabla 1).
Otros efectos adversos cutáneos inmunomediados registrados en la revisión de pacientes son la alopecia en 2 casos (6,7%) —en forma de alopecia areata en un paciente y en forma de alopecia neutrofílica inflamatoria en otro paciente— y la dermatitis neutrofílica en uno (3,3%) —en forma de pustulosis exantemática aguda generalizada—.
El período de latencia desde el inicio del tratamiento biológico hasta la aparición del EACI es muy variable, con una mediana de 15,5meses y rango de 2 a 129meses.
Se realizó una biopsia de las lesiones cutáneas en 6 pacientes. Los hallazgos histopatológicos confirmaron el diagnóstico de psoriasis en 4, de alopecia neutrofílica en uno y de dermatitis neutrofílica en otro caso. No se observaron diferencias histológicas entre la psoriasis paradójica y la psoriasis espontánea.
Se inició tratamiento adicional con corticoides tópicos en todos los pacientes, de los cuales 11 (36,7%) lo combinaron con tratamiento sistémico (metotrexato, acitretina y/o fototerapia).
A criterio del médico, se mantuvo el tratamiento con anti-TNF en 13 casos (43,3%); 8 de ellos (61,5%) presentaron una resolución total; 4 (30,8%), una resolución parcial, y uno (7,7%) no mejoró.
El médico responsable decidió suspender el anti-TNF en 17 pacientes (56,7%) por el EACI. De ellos, 4 no iniciaron otro tratamiento biológico y todos presentaron una resolución total de las lesiones cutáneas tras la suspensión. Los 13 pacientes restantes iniciaron otro tratamiento biológico. Cinco iniciaron un anti-TNF distinto: infliximab (n=2), adalimumab (n=2) y golimumab (n=1). De ellos, ninguno obtuvo resolución total, 2 (40%) obtuvieron resolución parcial y 3 (60%) no obtuvieron mejoría cutánea. Ocho pacientes iniciaron un tratamiento biológico dirigido a dianas terapéuticas diferentes al anti-TNF. De los 6 pacientes que iniciaron ustekinumab, 4 (66,6%) obtuvieron una resolución total, uno (16,7%) obtuvo una resolución parcial y uno (16,7%) no obtuvo respuesta; este último paciente tenía antecedentes personales de psoriasis. Un paciente inició ixekizumab con resolución parcial y otro paciente inició guselkumab con resolución total (tabla 1).
DiscusiónDesde el año 2004, en el que se describió el primer caso de RP asociada al tratamiento con infliximab en un paciente con enfermedad de Crohn, muchos estudios han descrito la aparición de RP con anti-TNF9. Se ha observado el desarrollo de RP de tipo psoriasiforme entre el 2% y el 5% de los pacientes que reciben tratamiento con anti-TNF10. Sin embargo, Almutairi et al.9 describen una incidencia de hasta el 10,9% en pacientes con enfermedad inflamatoria intestinal, la mayoría de los cuales están afectados por enfermedad de Crohn11.
Otros posibles efectos adversos cutáneos inmunomediados descritos tanto en nuestra revisión como en otros estudios son la alopecia y la dermatitis neutrofílica3,4.
También se ha descrito el empeoramiento de la psoriasis o el cambio en su morfología como una forma de RP4,5,11, pero en nuestra serie no hemos incluido pacientes en tratamiento con un anti-TNF por la psoriasis como enfermedad de base y que hubiesen presentado una RP.
Las características demográficas de nuestros pacientes son comparables con las observadas en otros estudios3,6,11,12. La mayoría de los pacientes que presentan un EACI son mujeres, hecho que puede estar en relación con la epidemiología de las enfermedades inflamatorias de base, ya que son más prevalentes en el sexo femenino. Tampoco se han observado diferencias en cuanto a la edad, y la mayoría de los pacientes no tenían antecedentes personales ni familiares de psoriasis.
El tiempo de aparición de los EACI es muy variable, por lo que no se puede establecer un período de latencia determinado6,9. Tampoco se ha establecido relación entre los EACI y los tratamientos que habían realizado previamente o de forma concomitante al anti-TNF para su enfermedad de base3.
En esta revisión se han descrito EACI con adalimumab, infliximab y golimumab, siendo el primero el más implicado. Sin embargo, en otros estudios se ha observado que el fármaco implicado con mayor frecuencia es el infliximab. La mayor implicación de adalimumab puede explicarse por un mayor uso de este fármaco en la práctica clínica habitual de nuestro centro. También se han descrito EACI con otros anti-TNF, como el etanercept y el certolizumab, fármacos que no hemos registrado en nuestra revisión3,5,6,9,11,13.
En cuanto a la morfología de los EACI, al igual que en nuestros hallazgos, destaca claramente la afectación cutánea en forma de reacción psoriasiforme, con predominio de la forma de placas generalizadas (62,9%), seguida de la pustulosa palmo-plantar (37%), lo que coincide con otras series6,9,11. La revisión sistemática de Brown et al.12 también describe la morfología en placas (44,8%) como la más frecuente, seguida de la forma pustulosa palmo-plantar (36,3%). Aun así, también se han descrito casos de psoriasis invertida, en gotas, eritrodérmica o con afectación del cuero cabelludo. No obstante, en la mayoría de los casos se pueden observar morfologías concomitantes en un mismo paciente, como observamos en nuestra serie5,6,9,11.
En nuestra revisión observamos que la actitud del médico ha sido, en la mayoría de los casos, la de no realizar biopsia de las lesiones cutáneas, probablemente debido a que en la literatura previa se describe que no hay diferencias histológicas entre la psoriasis paradójica y la psoriasis espontánea, como también hemos observado. Aun así, Munera-Campos et al.3 comentan que la presencia de eosinófilos o de células plasmáticas irían a favor de un desarrollo inducido por fármacos. Nosotros pensamos que la biopsia cutánea no aporta información adicional para el diagnóstico de RP de tipo psoriasiforme ni cambia la decisión terapéutica. En ese caso, solo estaría justificada si se presentase una morfología no psoriasiforme o si hubiese dudas en el diagnóstico.
En nuestra revisión se observa que el 92,3% de los pacientes que mantuvieron el tratamiento biológico presentaron una resolución total o parcial con el tratamiento tópico y/o sistémico asociado, sin necesidad de suspender el anti-TNF. En los que se suspendió el anti-TNF sin iniciar otro biológico, la totalidad de los pacientes presentaron una resolución total, por lo que sugerimos no precipitarse en la suspensión precoz del anti-TNF y mantenerlo en caso de reacciones cutáneas leves y tolerables, especialmente cuando haya un buen control de la enfermedad de base para la que se indicó el tratamiento biológico3,10,11.
El cambio a otro anti-TNF es posible, pero no hemos observado resolución total en ninguno de los casos, y hasta el 60% no mejoró con el nuevo tratamiento. Estos datos coinciden con la revisión de Puig5, quien describe una recurrencia de las lesiones psoriasiformes en el 50-100% de pacientes tratados con un segundo anti-TNF.
Alternativamente, con el cambio a un fármaco con un mecanismo de acción distinto se ha descrito una resolución total en hasta el 62,5% de los pacientes, por lo que, si el médico decide suspender el tratamiento e iniciar otro tratamiento biológico, es recomendable iniciar uno con diana terapéutica distinta al anti-TNF3,9,11.
Tal y como describen Wu y Smogorzewski8, el cambio a ustekinumab sería una opción segura y eficaz. En nuestra revisión, aunque se dispone de una muestra pequeña, no se han observado diferencias en el porcentaje de resolución total entre el grupo que mantuvo el anti-TNF y el grupo que cambió a ustekinumab (61,5% vs 66,6%). Además, el porcentaje de resolución parcial en aquellos que mantuvieron el anti-TNF es más elevado respecto a los que cambiaron a ustekinumab (30,8% vs 16,7%). Este factor podría explicarse por la tendencia del médico a mantener el anti-TNF en aquellos pacientes con reacciones cutáneas leves, por lo que podría considerarse que la carga de enfermedad cutánea es menor en este grupo, condicionando una mejor respuesta al tratamiento tópico y/o sistémico adicional.
Sin embargo, todavía no hay guías terapéuticas para el abordaje de los EACI asociados a tratamiento biológico, y al mismo tiempo hay discrepancias en la necesidad de discontinuar o no el fármaco para obtener una resolución de las lesiones6, por lo que, de momento, el abordaje terapéutico se realiza de forma individualizada.
Las limitaciones de esta revisión son que la recogida de datos se ha realizado en un único centro, que se trata de un estudio descriptivo y retrospectivo y que el tamaño de la muestra analizada es pequeño. Además, no se han recogido pacientes en tratamiento con anti-TNF por artritis reumatoide, quizá porque los reumatólogos de nuestro centro no han hecho un registro de los EACI o porque, por su experiencia, las tratan sin derivarlas a las consultas de dermatología. Otra de las limitaciones sería que no se ha registrado la gravedad de las lesiones cutáneas, que en el caso de las RP psoriasiformes se hubiesen podido usar las escalas PASI, BSA y PGA, aunque su uso es difícil por la morfología atípica de este tipo de reacciones.
En conclusión, los EACI son reacciones cutáneas conocidas del tratamiento con anti-TNF. Nuestros datos describen que un alto porcentaje de los pacientes que tuvieron un EACI presentaron una resolución completa o parcial de las lesiones cutáneas añadiendo un tratamiento adicional, sin necesidad de suspender el anti-TNF. Aun así, es importante valorar la gravedad de las lesiones para decidir la actitud terapéutica más adecuada. En caso de hacer un cambio de tratamiento biológico, se observa que es más eficaz cambiar a fármacos dirigidos a una diana terapéutica diferente.
Debido a las regulaciones administrativas que fomentan el uso de biosimilares del anti-TNF, se ha observado un incremento del uso de estos fármacos, por lo que es esperable un aumento en la incidencia de casos de EACI. De este modo, es recomendable la vigilancia continua de los pacientes en tratamiento con anti-TNF para detectar los posibles EACI, ya que pueden manifestarse en cualquier momento del tratamiento.
En resumen, podemos concluir que la discontinuación del tratamiento con anti-TNF solo debería considerarse en casos de EACI graves, en los resistentes al tratamiento adicional o cuando se vea muy afectada la calidad de vida.
Conflicto de interesesEl Dr. Miquel Ribera ha recibido ayudas y pagos relacionados con investigación,asesorías y formación de las siguientes compañías: AbbVie, Almirall, Amgen, Gebro Pharma, Janssen, LEO Pharma, Eli Lilly, Novartis, Pfizer, Pierre-Fabre, Sandoz, SKB y UCB. El Dr. Romaní ha participado en ensayos clínicos, conferencias y comités asesores con los siguientes laboratorios farmacéuticos: AbbVie, Almirall, Boehringuer-Ingelheim, Janssen, LEO Pharma, Lilly, Novartis, Sanofi y UCB.