La cirugía dermatológica asocia un riesgo de complicaciones muy bajo. No existe un protocolo universalmente aceptado sobre las recomendaciones de curas poscirugía dermatológica. En esta revisión narrativa, discutimos la evidencia sobre productos y procedimientos para el cuidado de la herida quirúrgica. En general, encontramos escasos estudios y en muchas ocasiones, falta de diferencias estadísticamente significativas, posiblemente dada la baja tasa de complicaciones. Discutimos la evidencia sobre cuándo iniciar las curas y su frecuencia, el tipo de ungüento a aplicar, los antisépticos y el tipo de apósito a utilizar. Pese a los escasos estudios sobre las curas tras cirugía dermatológica, existe evidencia suficiente para desaconsejar la utilización de antibióticos tópicos profilácticos. También analizamos la evidencia publicada sobre el cuidado de la herida quirúrgica en situaciones especiales, como son los injertos cutáneos, las zonas dadoras de injertos cutáneos de espesor parcial, los xenoinjertos/biomembranas y las heridas quirúrgicas en las piernas.
Dermatologic surgery is associated with a very low risk of complications. There is no widely accepted, evidence-based protocol with recommendations for postoperative wound care after dermatologic surgery. In this narrative review, we will be discussing the evidence on surgical wound care products and procedures. Overall, we found relatively few studies and, in many cases, a lack of statistically significant differences, possibly because of the low rate of complications. We’ll be discussing the evidence on when we should initiate wound care procedures and their frequency, the type of ointment and antiseptics that should be applied, and the type of dressings that should be used. Despite the very few studies available on postoperative wound care following dermatologic surgery, there is sufficient evidence as to not recommend the use of prophylactic topical antibiotics. We also analyze the currently available evidence on surgical wound care in special situations, such as management of skin grafts, partial skin graft donor sites, xenografts/biomembranes, and surgical wounds to the legs.
La cirugía dermatológica presenta una baja tasa de complicaciones1, con tasas de infección de herida quirúrgica (IHQ) de entre el 0,7 y el 4,0%, incluso sin antibióticos profilácticos, ni preparación preoperatoria del sitio quirúrgico o utilizando guantes no estériles2,3. Además, las IHQ son en general leves y de tratamiento simple2.
El proceso fisiológico de cicatrización de las heridas es complejo, intervienen neutrófilos, macrófagos, fibroblastos y queratinocitos, y consta de varias fases: inflamatoria, proliferativa y de remodelación (tabla 1). En los últimos años, algunos estudios han sugerido que el microbioma cutáneo tendría también un papel importante en el proceso de cicatrización4. El cuidado de la herida poscirugía dermatológica es un tema controvertido, y no existe un protocolo universalmente aceptado. Múltiples estudios muestran una amplia variabilidad en las indicaciones, ya sea en los antisépticos a utilizar, uso de antibióticos tópicos, tipo de apósitos y frecuencia de las curas, entre otros5.
Proceso fisiológico de curación de heridas
| Fases comunes en las heridas55 | Hemostasia e inflamación precoz (los primeros 4-6 días).Quimiotaxis y activación macrofágica (a partir de las 48-96h).Fase proliferativa: reepitelización, angiogénesis y granulación (días 4 al 14).Maduración y remodelación (día 8 al 1 año). | El vaso sanguíneo lesionado se contrae y el endotelio y las plaquetas cercanas activan la cascada de coagulación. El coágulo libera citoquinas y factores de crecimiento que inician la respuesta inflamatoria.El coágulo reclutará neutrófilos, que liberarán sustancias proteolíticas que degradarán bacterias y exceso de tejido. El cúmulo de mediadores inflamatorios activarán los macrófagos, los cuales participarán en el inicio de la angiogénesis.La epitelización es estimulada inicialmente por los fibroblastos y se produce desde el epitelio de los bordes hacia el interior de la herida.El factor de crecimiento vascular endotelial (VEGF, principalmente secretado por queratinocitos en respuesta a la hipoxia) estimula la neoformación de vasos capilares. La hipoxia en las células endoteliales promueve la secreción de óxido nitroso, el cual produce vasodilatación.Los fibroblastos migran a la herida, se activan y sintetizan colágeno, proliferan y se transforman en miofibroblastos (que producirán contracción de la herida).Inicialmente, la matriz se compone principalmente de fibrina y fibronectina. A continuación, los fibroblastos sintetizan una matriz provisional y desorganizada de glicosaminoglicanos, proteoglicanos y otras proteínas. Finalmente, esta matriz temporal es reemplazada por una matriz más fuerte y organizada, formada por colágeno. |
| Fases particulares de los injertos cutáneos | Fase de imbibición plasmática (primeras 24-48h).Inosculación (48-72h).Neovascularización y fenómeno puente de flujo sanguíneo entre el lecho y el injerto (hasta 4-7 días).Reepitelización (desde el 4.°-8.° día hasta varias semanas después). | Se fija el injerto al lecho receptor, permitiéndole absorber el exudado y mantenerse hidratado y nutrido durante la fase avascular.Anastomosis entre el lecho receptor y los vasos de la dermis del injerto. |
El objetivo de este trabajo es revisar los procedimientos y los productos indicados en el cuidado de la herida poscirugía dermatológica, y discutir la evidencia que los avala.
MétodosRealizamos una revisión narrativa de la literatura, buscando en agosto del 2023 en Pubmed y Google Scholar los términos en español e inglés: «cirugía dermatológica»; «curas»; «cuidado de herida quirúrgica»; «injerto de piel»; «cierre directo»; «cierre por segunda intención»; «biomembrana»; «antibióticos tópicos»; «petrolatum»; «vaselina». Se incluyeron estudios clínicos prospectivos y retrospectivos, ensayos clínicos, revisiones sistemáticas y metaanálisis. Se seleccionaron los artículos según su relevancia. Se excluyeron reportes de casos clínicos aislados.
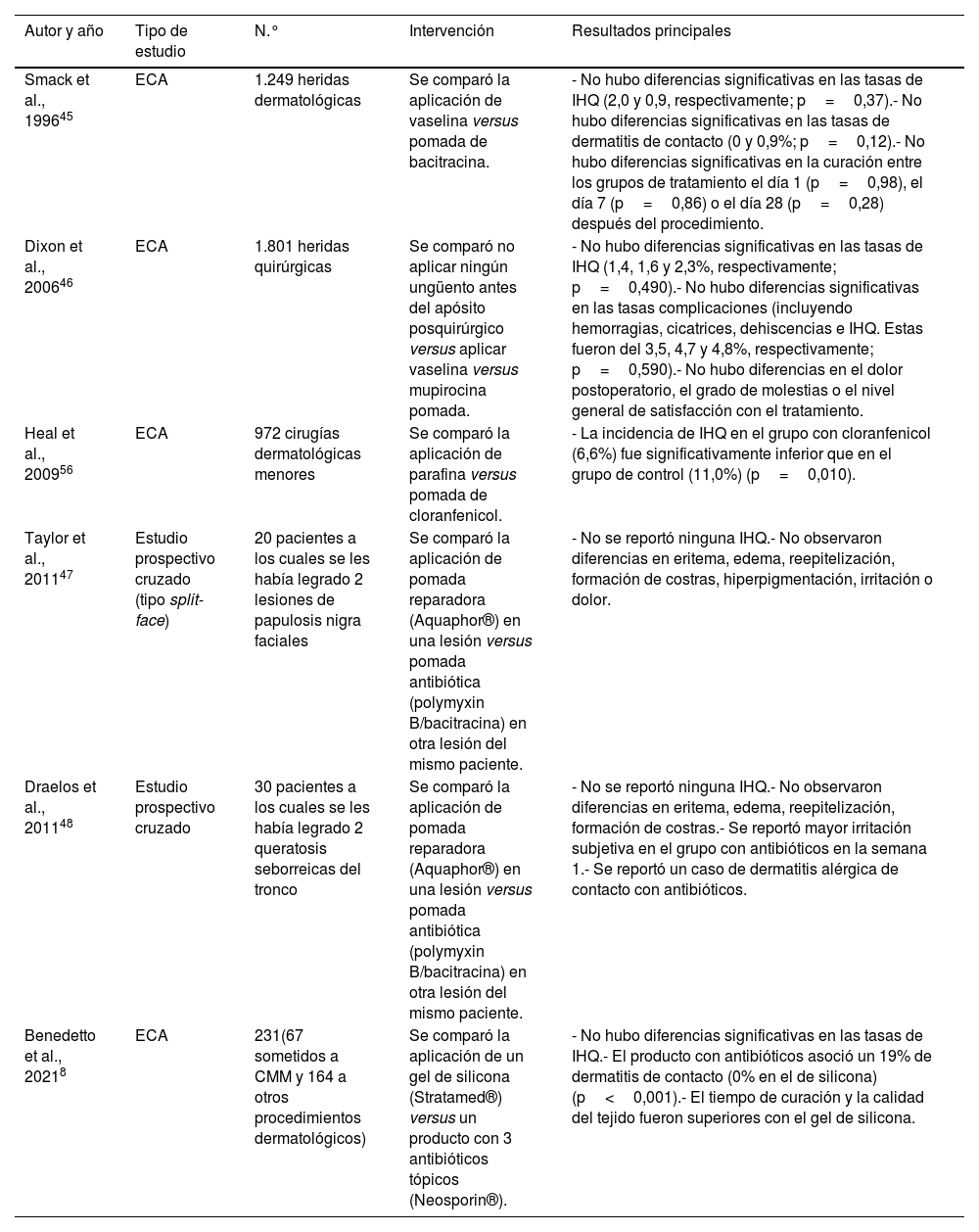
ResultadosHumectantes y antibióticos tópicosUna revisión sistemática y metaanálisis que incluyó 4 ensayos clínicos (EC) aleatorizados (ECA) con un total de 4.170 extirpaciones, evaluó las tasas de IHQ tras cirugía dermatológica comparando la utilización de antibióticos tópicos versus vaselina o parafina, sin encontrar diferencias significativas2. Un metaanálisis reciente tampoco encontró diferencias en las tasas de IHQ en cirugía dermatológica, oftalmológica, ortopédica y cardiotorácica6. Previamente, una revisión de la base Cochrane7 había concluido que el uso de antibióticos tópicos podría reducir el riesgo de IHQ respecto a no usarlos o a utilizar antisépticos, pero se incluyeron además de procedimientos dermatológicos, apendicectomías, cesáreas, cirugía traumatológica y cardiotorácica. Un ECA en 231 pacientes intervenidos de cirugía dermatológica (no incluido en las revisiones sistemáticas previas), evaluó la aplicación de un gel de silicona tópica versus un ungüento con 3 antibióticos (bacitracina, neomicina y polimixina B). Se reportó una similar incidencia de IHQ. El riesgo de dermatitis de contacto fue significativamente superior en el grupo con antibióticos tópicos (19%), que en el grupo con silicona (0%)8 (tabla 2).
Estudios prospectivos que evalúan el uso de antibióticos tópicos en la tasa de infección de la herida posprocedimientos dermatológicos
| Autor y año | Tipo de estudio | N.° | Intervención | Resultados principales |
|---|---|---|---|---|
| Smack et al., 199645 | ECA | 1.249 heridas dermatológicas | Se comparó la aplicación de vaselina versus pomada de bacitracina. | - No hubo diferencias significativas en las tasas de IHQ (2,0 y 0,9, respectivamente; p=0,37).- No hubo diferencias significativas en las tasas de dermatitis de contacto (0 y 0,9%; p=0,12).- No hubo diferencias significativas en la curación entre los grupos de tratamiento el día 1 (p=0,98), el día 7 (p=0,86) o el día 28 (p=0,28) después del procedimiento. |
| Dixon et al., 200646 | ECA | 1.801 heridas quirúrgicas | Se comparó no aplicar ningún ungüento antes del apósito posquirúrgico versus aplicar vaselina versus mupirocina pomada. | - No hubo diferencias significativas en las tasas de IHQ (1,4, 1,6 y 2,3%, respectivamente; p=0,490).- No hubo diferencias significativas en las tasas complicaciones (incluyendo hemorragias, cicatrices, dehiscencias e IHQ. Estas fueron del 3,5, 4,7 y 4,8%, respectivamente; p=0,590).- No hubo diferencias en el dolor postoperatorio, el grado de molestias o el nivel general de satisfacción con el tratamiento. |
| Heal et al., 200956 | ECA | 972 cirugías dermatológicas menores | Se comparó la aplicación de parafina versus pomada de cloranfenicol. | - La incidencia de IHQ en el grupo con cloranfenicol (6,6%) fue significativamente inferior que en el grupo de control (11,0%) (p=0,010). |
| Taylor et al., 201147 | Estudio prospectivo cruzado (tipo split-face) | 20 pacientes a los cuales se les había legrado 2 lesiones de papulosis nigra faciales | Se comparó la aplicación de pomada reparadora (Aquaphor®) en una lesión versus pomada antibiótica (polymyxin B/bacitracina) en otra lesión del mismo paciente. | - No se reportó ninguna IHQ.- No observaron diferencias en eritema, edema, reepitelización, formación de costras, hiperpigmentación, irritación o dolor. |
| Draelos et al., 201148 | Estudio prospectivo cruzado | 30 pacientes a los cuales se les había legrado 2 queratosis seborreicas del tronco | Se comparó la aplicación de pomada reparadora (Aquaphor®) en una lesión versus pomada antibiótica (polymyxin B/bacitracina) en otra lesión del mismo paciente. | - No se reportó ninguna IHQ.- No observaron diferencias en eritema, edema, reepitelización, formación de costras.- Se reportó mayor irritación subjetiva en el grupo con antibióticos en la semana 1.- Se reportó un caso de dermatitis alérgica de contacto con antibióticos. |
| Benedetto et al., 20218 | ECA | 231(67 sometidos a CMM y 164 a otros procedimientos dermatológicos) | Se comparó la aplicación de un gel de silicona (Stratamed®) versus un producto con 3 antibióticos tópicos (Neosporin®). | - No hubo diferencias significativas en las tasas de IHQ.- El producto con antibióticos asoció un 19% de dermatitis de contacto (0% en el de silicona) (p<0,001).- El tiempo de curación y la calidad del tejido fueron superiores con el gel de silicona. |
CMM: cirugía micrográfica de Mohs; ECA: ensayo clínico aleatorizado; IHQ: infección de la herida quirúrgica; N.°: número.
Un estudio prospectivo comparó en 76 pacientes sometidos a cirugía de Mohs, la aplicación de vaselina, versus un ungüento reparador (Aquaphor®), versus ningún ungüento. Observaron una mayor incidencia de costras en el grupo sin ungüento, y mayor incidencia de eritema e inflamación en el grupo con ungüento reparador. Ambas diferencias fueron significativas9.
Inicio y frecuencia de las curasGeneralmente se recomienda mantener la herida cubierta durante las primeras 48h. Sin embargo, un ECA multicéntrico (n=857) evaluó en pacientes sometidos a cirugía dermatológica el riesgo de IHQ entre la retirada precoz del apósito y baño con agua y jabón a las 12h poscirugía, versus la tardía a las 48h, no encontrando diferencias significativas en la tasa de IHQ10.
Una encuesta realizada a 64 pacientes sometidos a cirugía de Mohs, reportó que los apósitos hidrocoloides aplicados durante una media de 6,4 días sin destapar, se asociaba a mayor comodidad, mejor aspecto de la cicatriz, y mayor satisfacción que las curas convencionales diarias. Complicaciones como infecciones, fiebre y dolor fueron similares en ambos grupos11. Asimismo, estudios realizados en pacientes sometidos a cirugía dermatológica en las piernas, donde se realizaban curas cada semana (utilizando vendajes compresivos y óxido de cinc), no mostraron una mayor tasa de IHQ que las curas convencionales diarias12.
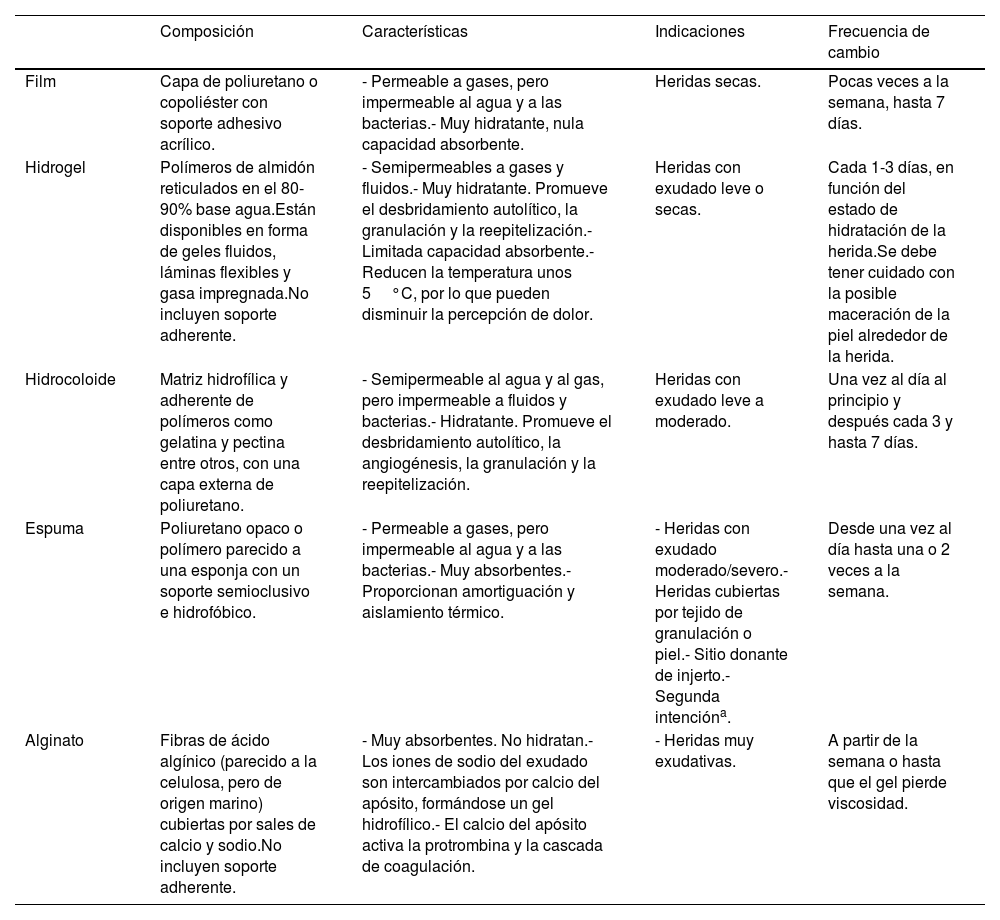
ApósitosTradicionalmente se han utilizado gasas, vendas y algodón para la cobertura de heridas posquirúrgicas. Más recientemente se han desarrollado apósitos avanzados como: películas interfases, espumas, hidrogeles, hidrocoloides y alginatos (tabla 3). La frecuencia de cambio depende del tipo de apósito, pero el objetivo de su uso es poder espaciar las curas13. Un estudio prospectivo que incluyó 226 heridas de pequeño tamaño con cierre por segunda intención, como afeitados (shaves) y punch de 3mm, mostró que el uso de apósitos oclusivos avanzados se asociaba a una reducción del tiempo de reepitelización y del dolor, respecto a los tradicionales14. Además, como ya se ha mencionado, el apósito hidrocoloide mantenido alrededor de una semana fue preferido por los pacientes frente a las curas convencionales diarias11.
Tipos de apósitos avanzados
| Composición | Características | Indicaciones | Frecuencia de cambio | |
|---|---|---|---|---|
| Film | Capa de poliuretano o copoliéster con soporte adhesivo acrílico. | - Permeable a gases, pero impermeable al agua y a las bacterias.- Muy hidratante, nula capacidad absorbente. | Heridas secas. | Pocas veces a la semana, hasta 7 días. |
| Hidrogel | Polímeros de almidón reticulados en el 80-90% base agua.Están disponibles en forma de geles fluidos, láminas flexibles y gasa impregnada.No incluyen soporte adherente. | - Semipermeables a gases y fluidos.- Muy hidratante. Promueve el desbridamiento autolítico, la granulación y la reepitelización.- Limitada capacidad absorbente.- Reducen la temperatura unos 5°C, por lo que pueden disminuir la percepción de dolor. | Heridas con exudado leve o secas. | Cada 1-3 días, en función del estado de hidratación de la herida.Se debe tener cuidado con la posible maceración de la piel alrededor de la herida. |
| Hidrocoloide | Matriz hidrofílica y adherente de polímeros como gelatina y pectina entre otros, con una capa externa de poliuretano. | - Semipermeable al agua y al gas, pero impermeable a fluidos y bacterias.- Hidratante. Promueve el desbridamiento autolítico, la angiogénesis, la granulación y la reepitelización. | Heridas con exudado leve a moderado. | Una vez al día al principio y después cada 3 y hasta 7 días. |
| Espuma | Poliuretano opaco o polímero parecido a una esponja con un soporte semioclusivo e hidrofóbico. | - Permeable a gases, pero impermeable al agua y a las bacterias.- Muy absorbentes.- Proporcionan amortiguación y aislamiento térmico. | - Heridas con exudado moderado/severo.- Heridas cubiertas por tejido de granulación o piel.- Sitio donante de injerto.- Segunda intencióna. | Desde una vez al día hasta una o 2 veces a la semana. |
| Alginato | Fibras de ácido algínico (parecido a la celulosa, pero de origen marino) cubiertas por sales de calcio y sodio.No incluyen soporte adherente. | - Muy absorbentes. No hidratan.- Los iones de sodio del exudado son intercambiados por calcio del apósito, formándose un gel hidrofílico.- El calcio del apósito activa la protrombina y la cascada de coagulación. | - Heridas muy exudativas. | A partir de la semana o hasta que el gel pierde viscosidad. |
No hemos encontrado estudios que comparen el uso de antisépticos o detergentes como jabón, povidona yodada, peróxido de hidrógeno, clorhexidina y solución alcohólica, entre otros, para la cura de heridas quirúrgicas dermatológicas.
Se ha sostenido durante años que la povidona yodada podría ser tóxica in vitro para los fibroblastos y queratinocitos15, pero no se ha demostrado un retraso de la cicatrización16-19. Una revisión sistemática describió que el yodo era superior a otros agentes antisépticos (como crema de sulfadiazina de plata) y a apósitos no antisépticos en disminuir la carga bacteriana, y no se asoció a alteración de la cicatrización, ni a prolongación del tiempo de curación20.
Terapia de presión negativaLa terapia con presión negativa (TPN) puede ser útil en el manejo de heridas, y presentaría diversas ventajas (tabla 4). En heridas quirúrgicas con cierre primario no ha demostrado una utilidad significativa21. Encontramos solo un estudio en cirugía dermatológica: un ECA en 49 pacientes con injertos en las piernas postextirpación de cáncer cutáneo, que comparó las tasas de éxito del injerto con TPN versus vendaje más reposo. No se reportan diferencias significativas entre ambos grupos a las 6 ni a las 12 semanas de seguimiento22. Sin embargo, un metaanálisis que incluyó 10 ECA con 488 pacientes con injertos cutáneo de espesor parcial (ICEP) por distintas indicaciones (quemaduras, heridas traumáticas, heridas crónicas en piernas y exéresis oncológicas en piernas), describió diferencias significativas en el porcentaje de injerto viable, además de reducción del tiempo (9,18 días versus 12,5 días en el grupo control) y menor riesgo de reintervención con TPN23. Resultados similares se reportaron en un metaanálisis previo que incluía 5 estudios de cohortes y 7 ECA (653 pacientes en total)24.
Mecanismo de acción y ventajas potenciales de la terapia con presión negativa en el cuidado de la herida posquirúrgica
| Mecanismo de acción57 | Ventajas potenciales en el cuidado de la herida posquirúrgica58 |
|---|---|
| - Aumenta el flujo capilar- Promueve el tejido de granulación- Disminuye la carga bacteriana- Mantiene un ambiente húmedo- Extrae el exudado sobrante- Fomenta la contracción de la herida | - Reduce las fuerzas de cizallamiento- Restringe la formación de seroma y hematoma- Puede incrementar la comodidad del paciente- Puede disminuir el tiempo de epitelización |
Respecto a la combinación de TPN con xenoinjertos (biomembranas), un ECA con 36 pacientes con heridas con hueso o tendón expuestos, comparó la aplicación de la biomembrana Integra® versus la biomembrana en combinación con TPN. Observaron resultados significativamente superiores con TPN, y en menor tiempo (p<0,001)25.
Situaciones especialesCuidado de la herida quirúrgica con injerto cutáneoTradicionalmente, se ha empleado como técnica de refuerzo el apósito compresivo suturado tie-over bolster dressing (ACS). Se han descrito múltiples alternativas (tabla 5), destacando la cobertura no reforzada, especialmente en injertos de hasta 5,5cm, con resultados comparables al ACS. Como ventajas destacan ahorro de tiempo quirúrgico y mayor comodidad para el paciente26-29. Se cubre el injerto con un apósito no adhesivo, con o sin otro apósito de contacto no adhesivo o una gasa impregnada enrollada sobre el injerto. Se puede fijar con bandas estériles, venda elástica o apósito adhesivo.
Técnicas de fijación de los injertos cutáneos y materiales en contacto con el injerto
| Técnica de fijación | Material en contacto con el injerto |
|---|---|
| - Apósito compresivo suturado (ACS)- Sutura continua de refuerzo59- Refuerzo con Telfa® y grapas26- Refuerzo con espuma de poliuretano60,61- Cobertura no reforzada7-9- Suturas de hilvanado colchoneras62- Sutura «en sándwich» para defectos del ala nasal63 | - Gasas impregnadas con vaselina63- Gasas impregnadas con antibióticos o con povidona yodada19- Gasas impregnadas de tribromofenato de bismuto (XeroformTM)29- Apósitos de contacto no adhesivo (MepitelTM)7-9- Gomaespuma60- Esponjas60 |
No hemos encontrado estudios que comparen directamente los resultados entre distintos materiales, ni entre tipos de curas tras la cobertura con injertos cutáneos en cirugía dermatológica.
Heridas de la zona dadora de injerto cutáneoUna revisión sistemática que incluyó 35 estudios que comparaban distintas modalidades de curas en la zona dadora de ICEP, la mayoría comparando la cura seca (con gasas) versus apósitos avanzados, reportó un mejor control del dolor y una cicatrización más rápida en el segundo grupo30. Dos revisiones sistemáticas previas arrojaron resultados similares31,32. Un ECA multicéntrico con 288 pacientes con defectos de sitio dador de injerto, principalmente del muslo y >10cm2, comparó apósitos de alginato, películas (films), gasas, hidrocoloides, hidrofibra® y silicona. Observaron que el tiempo de reepitelización con apósitos hidrocoloides fue 7 días menor que con otros apósitos. La tasa de IHQ con gasas fue el doble que con otros apósitos (riesgo relativo: 2,38; IC: 1,14-4,99)33.
Heridas cubiertas con xenoinjertos dérmicosLas biomembranas o xenoinjertos dérmicos se utilizan para cubrir defectos complejos. Promueven la neovascularización del lecho que posteriormente facilitará la reepitelización por segunda intención, la cobertura con injertos cutáneos o con colgajos. Este proceso normalmente tarda 14-21 días. La biomembrana debe mantenerse cubierta por una capa protectora externa, normalmente de silicona. No hemos encontrado estudios clínicos sobre el tipo de curas a realizar durante este periodo. Las marcas comerciales recomiendan una cobertura oclusiva con antimicrobianos durante los primeros 5-7 días, similar a un injerto cutáneo. Se desaconseja el contacto del injerto con agentes de desbridamiento enzimáticos como colagenasa34.
Heridas quirúrgicas con cierre por segunda intenciónLas heridas con cierre por segunda intención (HCSI) poscirugía dermatológica no se asocian a un mayor riesgo de IHQ que el cierre directo, según los resultados de una reciente revisión sistemática35. En una extensa revisión de Cochrane (14 centros, n=886), se sugiere una disminución del riesgo de IHQ en HCSI con antibióticos tópicos. Sin embargo, los estudios incluidos eran de pequeño tamaño y con dispares tipos de heridas (postamputación del pie diabético, cirugía de seno pilonidal y de hemorroides, abscesos, complicaciones poscesárea y colostomías)36.
Una revisión sistemática incluyó 13 ECA que comparaban diferentes coberturas (gasas, espuma, polvos, alginato e hidrocoloide) en HCSI. Las heridas incluidas eran de exéresis de quistes pilonidales, complicaciones posquirúrgicas abdominales y amputaciones en piernas. En general, los pacientes presentaron mayor dolor y menor satisfacción con el uso de gasas. El apósito de espuma pareciera ser superior a la gasa convencional, en términos de satisfacción del paciente, reducción del dolor y de cuidados de enfermería37.
Heridas quirúrgicas en las piernasMúltiples estudios han descrito una mayor tasa de complicaciones tras cirugía dermatológica bajo la rodilla38 (tabla 6). Recientemente, un estudio retrospectivo que incluyó 23.121 extirpaciones en cirugía dermatológica mostró que esta localización se asociaba a mayor riesgo de IHQ (odds ratio [OR]: 1,908; IC: 1,126-3,235), y a mayores tasas de dehiscencia (OR: 4,037; IC: 2,654-6,140), la cual se incrementaba notoriamente, si además el paciente tenía ≥80 años (OR: 9,632; IC: 5,635-16,464)1.
Factores asociados a mayor riesgo de infección de la herida quirúrgica
| Características de la herida | Características del paciente | Localización de la herida | Complejidad de la cirugía |
|---|---|---|---|
| - Contaminación bacteriana- Pelo alrededor- Extensa enfermedad inflamatoria cutánea | - Diabetes- Obesidad- Hábito tabáquico- Insuficiencia renal crónica- Portador de S. aureus nasal | - Por debajo de la rodilla- Ingles- Genitales- Nariz- Oreja | - Duración prolongada- Realización de colgajos- Utilización de injertos- Cicatriz más larga |
Los estudios sobre las curas poscirugía dermatológica en las piernas son escasos. Hemos encontrado 2 estudios retrospectivos en los cuales se ha utilizado óxido de cinc junto a compresión. Un estudio reciente (n=80) evaluó el tiempo hasta la curación completa de la herida quirúrgica con cierre primario en individuos sujetos a extirpación de lesiones cutáneas en las piernas. Compararon un grupo con curas convencionales (gasas y apósitos no adherentes) versus otro grupo con gasas impregnadas en óxido de cinc y compresión con un vendaje elástico (se realizaba el cambio de vendaje semanalmente). A los 19 días, el 66% de los pacientes del primer grupo y el 92% del grupo con óxido de cinc más compresión habían alcanzado la curación completa (p<0,001). El 14% del grupo con curas convencionales presentó complicaciones, mientras que ningún individuo con óxido de cinc más compresión las tuvo12. Resultados similares se encontraron en un pequeño ensayo clínico (n=10) en pacientes con heridas posquirúrgicas dejadas por segunda intención, utilizando la bota de Unna (un vendaje con vendas impregnadas de óxido de cinc). El vendaje se cambiaba semanalmente39.
En cuanto al rol de la compresión, una reciente revisión sistemática de la literatura40 encontró 2 estudios que evaluaban su rol en las curas poscirugía dermatológica: el ensayo clínico previamente comentado que utilizó la bota de Unna39, y un estudio retrospectivo (n=366) que reveló que la compresión pre y posquirúrgica se asociaba a una menor tasa de complicaciones (OR: 0,67), pero sin alcanzar una diferencia estadísticamente significativa41.
DiscusiónEn general, la evidencia sobre las curas tras cirugía dermatológica es limitada. Algunas recomendaciones provienen de otras especialidades, las cuales realizan procedimientos que pueden tener tasas de complicaciones superiores, con lo cual estas recomendaciones pueden no ser extrapolables.
Hemos encontrado una amplia variabilidad de recomendaciones posquirúrgicas entre dermatólogos. Un estudio analizó 169 protocolos de curas de 119 centros, la mayoría estadounidenses. El 84% recomendaba la aplicación de productos a base de vaselina, específicamente vaselina (75%) y Aquaphor® (43%). El 43% indicaba antibióticos tópicos, mientras que el 24% lo desaconsejaba5. Una encuesta reciente con 196 dermatólogos cirujanos mostró que el 95% indicaba algún antiséptico para el cuidado de la herida quirúrgica, mayoritariamente aseo con agua y jabón (65%), seguido de otros antisépticos no especificados, agua oxigenada, ácido acético y clorhexidina42.
El apósito ideal debería ser hemostático; protector contra infecciones; inmovilizador; húmedo, y absorbente del exudado sobrante. Los estudios comparativos de gasas versus apósitos avanzados provienen principalmente de cirugía general y de heridas crónicas o traumáticas. En general, no se han demostrado diferencias en el tiempo de curación, resultado estético, ni IHQ13,43. En dermatología, la evidencia es limitada, aunque podrían ser más cómodos para el paciente y requerir menor cantidad de curas11, pero con coste más elevado.
Dermatología es una de las especialidades que más prescribe antibióticos44. El uso de antibióticos tópicos profilácticos no estaría indicado en heridas quirúrgicas dermatológicas limpias7,8,45-48. Además de no ser beneficiosos, su uso puede relacionarse con resistencias bacterianas y desarrollo de eccema alérgico de contacto8. Incluso se ha observado necrosis de la herida con el uso de mupirocina46. En general, en su lugar son preferibles la vaselina o la silicona tópica2,6,8,49.
En HCSI e injertos cutáneos, pese a la falta de evidencia, podría utilizarse un emoliente como vaselina y una cobertura oclusiva o semioclusiva, para evitar la desecación e infección50. Habitualmente, se recomienda que los injertos cutáneos permanezcan cubiertos hasta los 5-7 días. Una vez retirado el apósito, se sugiere mantener la herida hidratada y limpia. Una encuesta a 294 cirujanos de Mohs reveló que la mayoría indicaba para las curas vaselina o Aquaphor® (64 y 38%, respectivamente), y que más del 85% no cambiaba esta indicación en HCSI o injertos51.
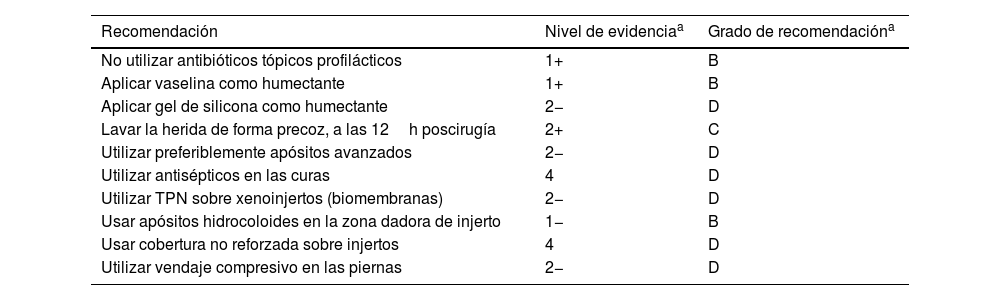
En heridas posquirúrgicas bajo la rodilla, parece ser una buena opción la combinación de óxido de cinc y vendaje compresivo. La compresión está ampliamente recomendada en el manejo de las úlceras venosas en esta localización, aunque su evidencia en heridas quirúrgicas es escasa12. En un estudio reciente, solo el 7,5% de los pacientes con heridas quirúrgicas dermatológicas bajo la rodilla recibieron compresión postoperatoria52. La tabla 7 resume recomendaciones y su nivel de evidencia, en el manejo de la herida tras cirugía dermatológica.
Recomendaciones a considerar en el manejo de la herida tras cirugía dermatológica
| Recomendación | Nivel de evidenciaa | Grado de recomendacióna |
|---|---|---|
| No utilizar antibióticos tópicos profilácticos | 1+ | B |
| Aplicar vaselina como humectante | 1+ | B |
| Aplicar gel de silicona como humectante | 2− | D |
| Lavar la herida de forma precoz, a las 12h poscirugía | 2+ | C |
| Utilizar preferiblemente apósitos avanzados | 2− | D |
| Utilizar antisépticos en las curas | 4 | D |
| Utilizar TPN sobre xenoinjertos (biomembranas) | 2− | D |
| Usar apósitos hidrocoloides en la zona dadora de injerto | 1− | B |
| Usar cobertura no reforzada sobre injertos | 4 | D |
| Utilizar vendaje compresivo en las piernas | 2− | D |
TPN: terapia de presión negativa.
En general, los pacientes siguen las instrucciones de curas tras cirugía dermatológica. Sin embargo, una considerable proporción de pacientes, especialmente de edad avanzada, presentan dificultades para comprenderlas, subrayando la necesidad de explicarlas adecuadamente y adaptadas a su realidad social53,54.
LimitacionesEsta revisión está limitada por ser una revisión narrativa y no sistemática de la literatura. Los estudios incluidos son metodológicamente heterogéneos y en muchos casos, no existen estudios comparativos entre los diversos agentes/procedimientos. Así mismo, los ensayos clínicos sobre el tema son escasos.
ConclusionesExiste una importante variabilidad en las recomendaciones del cuidado de la herida posquirúrgica en dermatología. La evidencia sobre la superioridad de los distintos agentes y técnicas es, en la mayoría de casos, limitada. Sin embargo, existe evidencia suficiente para desaconsejar el uso de antibióticos tópicos profilácticos. La utilización de vaselina o gel de silicona ofrece resultados similares, con menores tasas de complicaciones. Los apósitos avanzados pueden ser más cómodos que los convencionales al poderse espaciar su recambio, aunque sin superioridad en cuanto a tiempo de curación e incidencia de IHQ. En cuanto a las HCSI, los apósitos de espuma parecieran ser superiores a las gasas convencionales. Se requieren estudios prospectivos comparativos para poder entregar recomendaciones basadas en la evidencia.
FinanciaciónLos autores declaran no haber recibido financiación para la realización de este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.