Las células madre son células que se caracterizan por su capacidad para autorrenovarse y diferenciarse hacia células de todos los linajes que constituyen su tejido de origen. El descubrimiento de las células madre en un organismo adulto, y la descripción de los marcadores que han permitido aislar de forma específica estas células, han abierto nuevas perspectivas y nuevos horizontes en la investigación biomédica y también nuevas esperanzas en el tratamiento de muchas enfermedades. En este artículo se revisan de forma detallada las principales características de las células madre que dan origen a las distintas células de la piel humana, incluyendo las células madre epidérmicas, mesenquimales y melanocíticas, y sus potenciales implicaciones y aplicaciones en las enfermedades cutáneas. La primera parte de este artículo revisa las células madre epidérmicas, con sus principales características y sus potenciales aplicaciones en dermatología.
Stem cells are characterized by their ability to self-renew and differentiate into the different cell lineages of their tissue of origin. The discovery of stem cells in adult tissues, together with the description of specific markers for their isolation, has opened up new lines of investigation, expanding the horizons of biomedical research and raising new hope in the treatment of many diseases.
In this article, we review in detail the main characteristics of the stem cells that produce the specialized cells of the skin (epidermal, mesenchymal, and melanocyte stem cells) and their potential implications and applications in diseases affecting the skin.
Part I deals with the principal characteristics and potential applications of epidermal stem cells in dermatology.
Las células madre se definen por 2 características fundamentales: 1) su capacidad de autorrenovarse; y 2) dar lugar a células diferenciadas de todos los linajes celulares que constituyen su tejido de origen1. En la edad adulta se han identificado células madre en distintos órganos, incluyendo la piel, el intestino, el músculo, el sistema hematopoyético e incluso en el cerebro humano2. Estas células son las responsables de mantener la homeostasis del tejido donde se localizan y también de reparar el daño cuando este se produce.
El descubrimiento de las células madre en un organismo adulto y la descripción de los marcadores que han permitido aislar de forma específica estas células han abierto nuevas perspectivas y nuevos horizontes en la investigación biomédica, y también nuevas esperanzas en el tratamiento de muchas enfermedades. En este sentido, las células madre epidérmicas son especialmente atractivas, debido a su número relativamente elevado, y también por su accesibilidad y relativa facilidad en su obtención. En la primera parte de esta revisión hemos intentado sintetizar los principales hallazgos de los estudios de investigación básica en el campo de las células madre epidérmicas, y a continuación discutimos sus potenciales aplicaciones en la dermatología clínica.
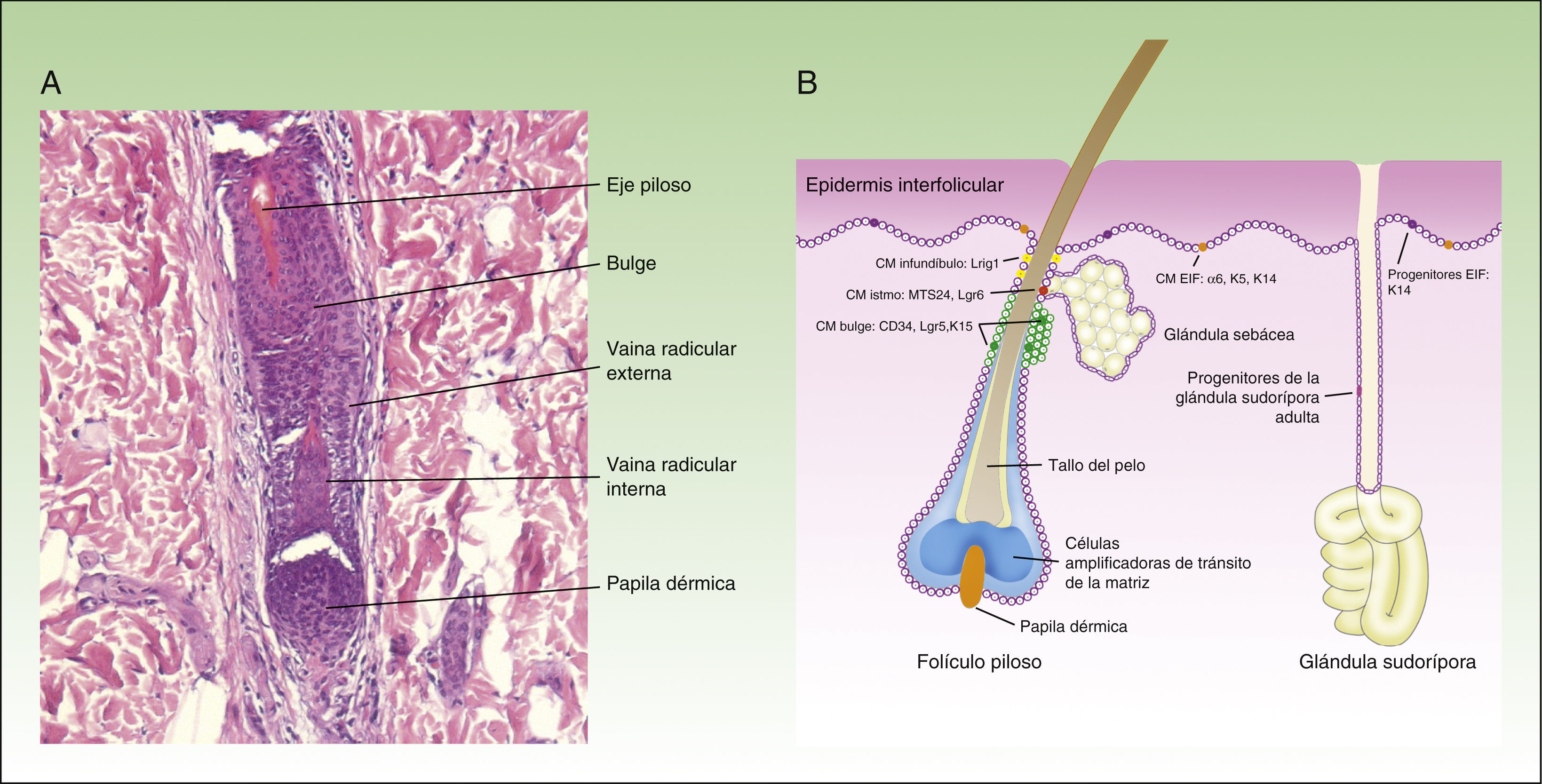
Distintas poblaciones de las células madre en la epidermisEn la capa basal de la epidermis interfolicular coexisten 2 tipos de progenitores: las células madre α6+CD34–, caracterizadas por su división lenta (4-6 veces al año) y una vida larga, y las células progenitoras de la capa basal K14+Inv+3, también posiblemente Axin2+4, caracterizadas por su división más rápida (una vez por semana) y vida más corta, ya que después de un número determinado de divisiones estas células experimentan diferenciación terminal hacia los queratinocitos diferenciados, perdiendo su capacidad de división. La tabla 1 resume las principales características de los marcadores.
Resumen de las principales características de los marcadores de las células madre epidérmicas de distintos compartimentos
| Marcador | Nombre completo | Células que lo expresan | Patrón de expresión |
|---|---|---|---|
| α6 | Integrina α6 | CM de la epidermis interfolicular | Membrana |
| Axin2 | Axin-like proteína | ¿Progenitores de la epidermis interfolicular? | Citoplasmático |
| CD34 | CD34 | CM del bulge | Membrana |
| Inv | Involucrina | Progenitores de la epidermis interfolicular | Citoplasmático |
| K5 | Queratina 5 | CM de la epidermis interfolicular | Citoplasmático |
| K14 | Queratina 14 | CM y progenitores de la epidermis interfolicular | Citoplasmático |
| K15 | Queratina 15 | CM del bulge | Citoplasmático |
| Lgr5 | Leucine-rich repeat-containing G-protein-coupled receptor 5 | CM del bulge | Citoplasmático |
| Lgr6 | Leucine-rich repeat-containing G-protein-coupled receptor 6 | CM del istmo | Citoplasmático/membrana |
| Lrig5 | Leucine-rich repeats e immunoglobulin-like domain protein 1 | CM del infundíbulo | Citoplasmático |
| MTS24 | MTS24 | CM del istmo | Membrana |
CM: células madre.
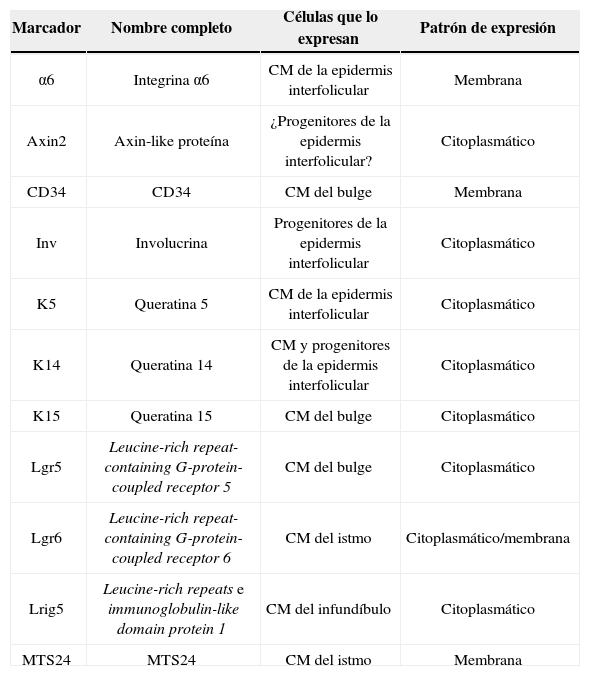
El folículo piloso evoluciona en 3 fases: anágena o fase de crecimiento (que dura en promedio 3 años), catágena o fase de involución (que dura varias semanas) y telógena o fase de reposo (que dura varios meses). Las células madre responsables de la regeneración del folículo piloso durante la fase anágena se localizan en el bulge (parte inferior de la porción permanente del folículo piloso) y se caracterizan por la expresión de los marcadores CD34, Lgr5 y K15. Estas son células multipotentes5, ya que tienen la capacidad de diferenciarse en todas las líneas celulares que componen la unidad pilosebácea. Durante la fase anágena las células madre del bulge darán lugar a las llamadas células amplificadoras de tránsito, que se localizan en el bulbo del folículo piloso y que proliferan rápidamente de forma transitoria antes de embarcarse en 7 programas de diferenciación, que finalmente darán lugar al folículo piloso maduro. Cuando las células de la matriz agotan su capacidad proliferativa, el crecimiento del pelo se detiene y el folículo entra en la fase catágena6, que lleva a la degeneración de los 2/3 inferiores del folículo, mientras que la zona del bulge permanece intacta.
En la parte inferior del folículo piloso se encuentra el bulbo piloso, que corresponde a la progenie comprometida de las células madre del bulge, y que apoya sobre la papila dérmica. La papila dérmica contiene fibroblastos dérmicos especializados, fibras nerviosas y un bucle capilar, y desempeña un papel fundamental en el desarrollo del folículo piloso y en el control del ciclo del pelo en la edad adulta7. Las células de la papila dérmica tienen la capacidad de diferenciarse hacia linajes neuronales y mesodérmicos8,9. En un estudio reciente, Rahmani et al. eliminaron las células madre de la papila dérmica y observaron un retraso en la regeneración del folículo piloso, y una alteración en la especificación del tipo del pelo, sugiriendo que la papila dérmica ejerce un papel fundamental en la restauración del crecimiento del pelo después del daño, de la enfermedad o en el proceso del envejecimiento10.
Al menos otros 3 tipos de células madre epiteliales han sido identificadas recientemente: las localizadas en las glándulas sebáceas, en el infundíbulo y en las glándulas sudoríparas. Las glándulas sebáceas son mantenidas por células madre unipotentes Lgr6+, que se originan a partir de los progenitores Blimp1+11. Además, las células madre del istmo expresan el marcador MTS23412 y, si se trasplantan a un ratón inmunodeficiente, sorprendentemente son capaces de dar lugar a las líneas celulares epidérmica, folicular y sebácea, lo que sugiere que puede tratarse de células multipotentes13. Las células madre del infundíbulo se caracterizan por expresar el marcador Lrig1, son multipotentes14 y se piensa que también pueden contribuir a la homeostasis de las glándulas sebáceas15. Por último, y aunque tradicionalmente se consideraba que las glándulas sudoríparas son quiescentes en la edad adulta, un estudio publicado recientemente sugiere la existencia de 4 tipos diferentes de progenitores en el epitelio de la glándula sudorípara16. La figura 1 muestra una microfotografía del folículo piloso (fig. 1A) y un esquema de los diferentes compartimientos en el epitelio de la piel y la localización de las células madre, así como un resumen de sus marcadores (fig. 1B).
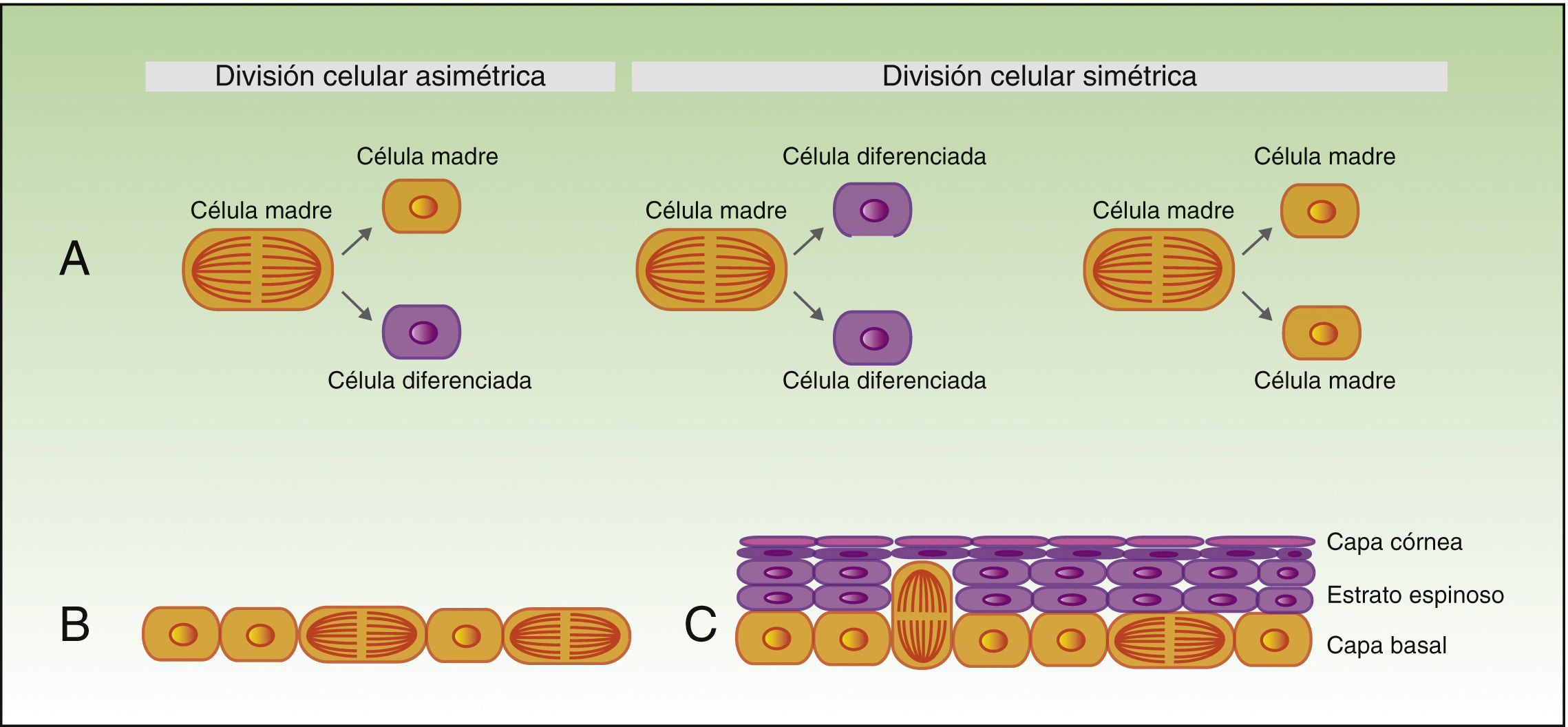
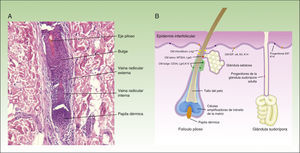
Autorrenovación de las células madreTal y como veníamos comentando, las células madre tienen capacidad para dar lugar a células diferenciadas, pero también tienen que autorrenovarse para mantener un pool constante de células madre, pudiéndose dividir de forma simétrica o asimétrica. Así, durante el proceso de división asimétrica, una célula madre da lugar a una célula hija con fenotipo original, y a otra célula hija que estará destinada a diferenciarse. Por otro lado, en la división simétrica una célula madre da lugar a 2 células hijas idénticas, ambas con el fenotipo diferenciado o poco diferenciado (fig. 2A).
Autorrenovación de las células madre.
La figura 2A muestra el concepto de la división celular simétrica y asimétrica.
Durante el desarrollo embrionario (B) la mayoría de las divisiones son simétricas, y el eje de la división es paralelo a la membrana basal, lo que asegura aumento de la superficie del embrión durante el crecimiento. Durante la estratificación del epitelio, que se produce en la morfogénesis y en la edad adulta (C), la mayoría de las divisiones son asimétricas. Durante la división asimétrica el eje puede ser perpendicular a la mebrana basal (al dividirse, una célula hija al perder el contacto con las integrinas y los factores de crecimiento que secreta la membrana basal sufre el fenómeno de diferenciación, y la segunda célula hija al permanecer en contacto con la membrana basal mantiene sus características de célula madre), pero también puede ser paralelo a la membrana basal (en este caso la diferenciación de una de las células hijas se induce por otro mecanismo).
Durante el desarrollo embrionario, la mayor parte de las divisiones de las células basales son simétricas y paralelas al eje de la membrana basal (fig. 2B), lo que permite el crecimiento de la superficie del embrión y mantiene el epitelio en una sola capa. En cambio, durante la estratificación del epitelio, alrededor del 70% de las divisiones son asimétricas (fig. 2C)6,17, lo que permite el desarrollo de las células suprabasales y el establecimiento de la barrera cutánea durante el desarrollo y la homeostasis epidérmica en la edad adulta.
Papel de las células madre epidérmicas en la homeostasis cutánea y en la cicatrizaciónHomeostasis es el proceso fisiológico por el que el número de células en los órganos con capacidad de regeneración se mantiene constante. En la homeostasis cutánea las células madre de cada compartimento son las responsables de reemplazar a las células diferenciadas que mueren en el mismo. Sin embargo, durante el proceso evolutivo, las células madre han adquirido la capacidad de participar en la reparación de los compartimentos vecinos en el caso de que las células madre de estos estén dañadas.
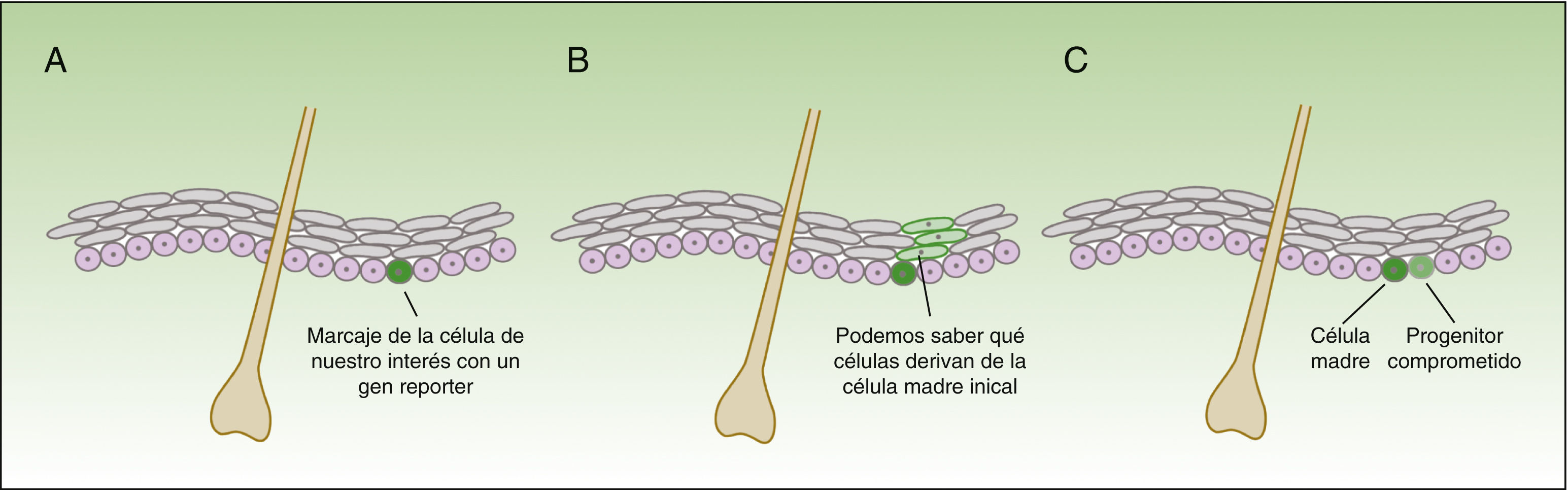
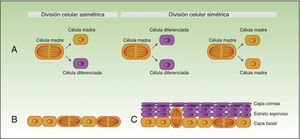
La forma en la que las células madre responden al daño varía drásticamente, dependiendo no solo del compartimento en el que se localizan, sino también de la proximidad a la herida18. La técnica de in vivo lineage tracing nos ofrece información funcional de gran valor sobre el comportamiento de las células madre en la homeostasis y durante la reparación tisular, puesto que permite seguir en el tiempo la evolución de las células en su ambiente natural (fig. 3).
Concepto de lineage tracing.
La figura 3 muestra un esquema de la información que nos permite obtener los experimentos de lineage tracing. Consiste en introducir un gen reporter asociado al marcador de las células que nos interesa (A), obteniendo señal fluoresente en el subgrupo de células de nuestro interés. Todas las células hijas de las células marcadas también tendrán la señal fluorescente (B), pero la intensidad de la señal irá disminuyendo conforme las células se van dividiendo. De esta forma, por un lado, nos permite identificar las células que descienden de las células inicialmente marcadas, y por otro lado, valorar la velocidad de división (las células que a lo largo del tiempo mantienen la señal fluorescente intensa serán las células quiescentes que se dividen muy lentamente —las células madre—), mientras que aquellas células que van perdiendo la intensidad del color son progenitores comprometidos (C).
Durante la reparación del daño de la epidermis interfolicular se produce un reclutamiento masivo de las células madre interfoliculares al área de la herida, pudiendo observarse clones derivados de estas células migrando desde la periferia de la herida hacia el centro, persistiendo allí durante mucho tiempo tras la cicatrización3. Sin embargo, el número de células Inv+ (progenitores de vida corta) que migran hacía la zona dañada es mucho menor, los clones son mucho más pequeños y 35 días después del daño la mayoría de los mismos desaparece3. Es decir, parece que los progenitores de vida corta son los responsables de mantener la homeostasis de la epidermis en condiciones normales, mientras que las células madre, que normalmente se encuentran en estado quiescente, se activan al producirse una agresión (herida o administración de un fármaco)19.
Además, tanto las células madre del bulge como del infundíbulo pueden migrar hacia la epidermis en respuesta a una herida, y participar en la reparación del daño. De forma sorprendente, y por mecanismos todavía no bien conocidos, cuando estas células migran hacia la epidermis pierden sus marcadores específicos de folículo piloso, y adoptan un fenotipo más similar al de las células madre de la epidermis interfolicular. Sin embrago, una vez en la epidermis, no persisten mucho tiempo y desaparecen poco tiempo después de la reparación del daño20,21.
Otro fenómeno de gran interés, que se observó al eliminar mediante láser las células madre de un compartimento específico de la epidermis, fue que los nichos vacíos eran capaces de reclutar células diferenciadas normales de dicho compartimento e inducir su proliferación y desdiferenciación hacia un estado similar al de las células madre22,23.
Células madre epidérmicas como célula de origen del cáncer de piel no melanomaLa identificación de las células que dan el origen al cáncer sigue siendo un reto en la mayoría de los tumores malignos. Teóricamente, dichas células adquieren las primeras alteraciones genéticas o epigenéticas que culminan en la iniciación del proceso maligno24. Parece lógico pensar, que por sus características (la capacidad para autorrenovarse durante un período de tiempo prolongado) las células madre tienen un riesgo incrementado de acumulación de las mutaciones oncogénicas, y por tanto podrían ser las células en las que se inicia el cáncer25,26.
Utilizando ratones modificados genéticamente mediante el sistema inducible CreER-LoxP (CreER hace referencia a la enzima Cre-recombinasa asociada al receptor de estrógenos [ER], de tal modo que la administración de tamoxifeno induce la recombinación de Cre, con la consiguiente activación o deleción del gen de nuestro interés) se ha demostrado que en el caso del carcinoma basocelular la activación de la mutación SmoM2 en las células madre del bulge o en las células de amplificación de tránsito del folículo piloso no inducía la formación del tumor. De hecho, los autores demostraron que el 90% de los carcinomas basocelulares superficiales tienen su origen en las células madre de la epidermis interfolicular, y el restante 10% se origina en el infundíbulo27,28.
En el caso del carcinoma espinocelular de ratón, la expresión de la mutación KRas en las células madre del bulge y en la epidermis interfolicular, pero no en las células amplificadoras de tránsito, induce la formación de tumores benignos, pero para la progresión hacia carcinoma es necesaria la combinación de la mutación KRAS y la deleción de gen supresor de tumores p5329.
Potenciales aplicaciones de las células madre en dermatología clínicaQuemadurasPara el tratamiento de las quemaduras cutáneas extensas se ha utilizado con éxito la epidermis generada in vitro a partir de las células madre epidérmicas autólogas, procedentes de una biopsia de la piel no dañada del paciente30. La biopsia de piel se disocia con tripsina31 y se aislan las células madre epidérmicas. Estas a continuación se expanden sobre una base de fibroblastos irradiados, que secretan matriz extracelular y factores de crecimiento, convirtiendo el ambiente en particularmente adecuado para la proliferación de los queratinocitos32, que se mantienen en cultivo hasta la formación de epitelio estratificado que puede ser utilizado para cubrir la herida. Sin embargo, esta técnica tiene 2 principales inconvenientes: el primero es el tiempo que requiere la expansión in vitro de los queratinocitos, y la segunda es el elevado coste del procedimiento33.
Es interesante destacar que la piel obtenida por este método no tiene anejos (folículos pilosos ni glándulas sudoríparas). En una quemadura de tercer grado la desaparición del los folículos pilosos se debe no solo a la destrucción de las células madre multipotentes del folículo, sino también a la destrucción de la dermis (la papila dérmica). Así, para poder lograr la regeneración de los folículos pilosos se debe trasplantar, junto con los queratinocitos, las células de la papila dérmica34. En un estudio publicado recientemente los autores lograron trasplantar las células humanas de la papila dérmica en un ratón nude (inmunodeficiente y sin pelo), y describieron la regeneración de los folículos pilosos35. Para conseguir un color de piel similar al original del paciente, un grupo de investigadores suizos ha añadido melanocitos aislados de la biopsia cutánea al cultivo de los queratinocitos, consiguiendo resultados favorables, tanto en pacientes con fototipos claros como oscuros36.
Como alternativa al trasplante de láminas de queratinocitos cultivados sobre base de fibroblastos irradiados, se ha utilizado cultivo de queratinocitos sobre una base de fibroblastos humanos embebidos en una matriz de plasma, que permite restaurar tanto el compartimento epidérmico como el dérmico37. En 24-26 días de cultivo los autores consiguieron una expansión 1.000 veces la zona de cultivo, y trasplantaron con éxito la piel artificial obtenida de 2 pacientes con quemaduras graves. Investigadores de la Universidad de Granada han utilizado biomateriales de fibrina-agarosa como base para generar sustitutos de piel a partir de fibroblastos y queratinocitos humanos. La piel artificial obtenida se trasplantó en el ratón nude y se tomaron muestras para análisis histológico y con microscopia electrónica a los 10, 20, 30 y 40 días, demostrando que la estructura de la piel obtenida mediante ingeniería tisular era muy similar a la de la piel normal del ratón38.
Dos estudios en modelo murino publicados recientemente plantean una alternativa al método tradicionalmente utilizado. Así, la estimulación de las células madre del bulge del folículo piloso en quemaduras de tercer grado en el ratón mediante alfa-defensina-5 humana derivada del intestino aceleró la cicatrización de la herida y, de forma llamativa, indujo la regeneración del pelo39. De forma similar, el trasplante de las células madre Lgr6+ aisladas mediante fluorescence-activated cell sorting administradas por medio de inyecciones en el lugar de la herida promueve la reepitelización, crecimiento del pelo y angiogénesis40.
Corrección terapéutica del genoma de las células madre epidérmicas en enfermedades genéticasEn los últimos años el coste de la secuenciación génica se ha reducido de forma significativa, y como consecuencia se ha producido un incremento exponencial del volumen de datos sobre el genoma humano en diferentes contextos y enfermedades. Estos avances de conocimiento han generado enormes expectativas sobre sus potenciales aplicaciones terapéuticas en enfermedades genéticas. Aunque la terapia génica todavía no se aplica en la práctica clínica diaria de los dermatólogos, en los últimos años se han hecho grandes y prometedores avances en este campo.
Hasta la fecha las 2 tecnologías genéticas terapéuticas más poderosas son la terapia génica, que permite el reestablecimiento de la función perdida de un gen determinado mediante la expresión de un transgén que se incorpora en el genoma mediante vectores víricos41, y los ARN de interferencia, que permiten suprimir la expresión del gen defectivo mediante la inhibición del ARN mensajero42. En los últimos años, además, se han desarrollado nuevas tecnologías con un potencial prometedor para el futuro de la terapia génica, basadas en el uso de las nucleasas programables, que son capaces de editar el genoma de las células o tejidos enfermos, resultando en la eliminación o corrección de las mutaciones perjudiciales o en la inserción de las mutaciones protectoras43–46.
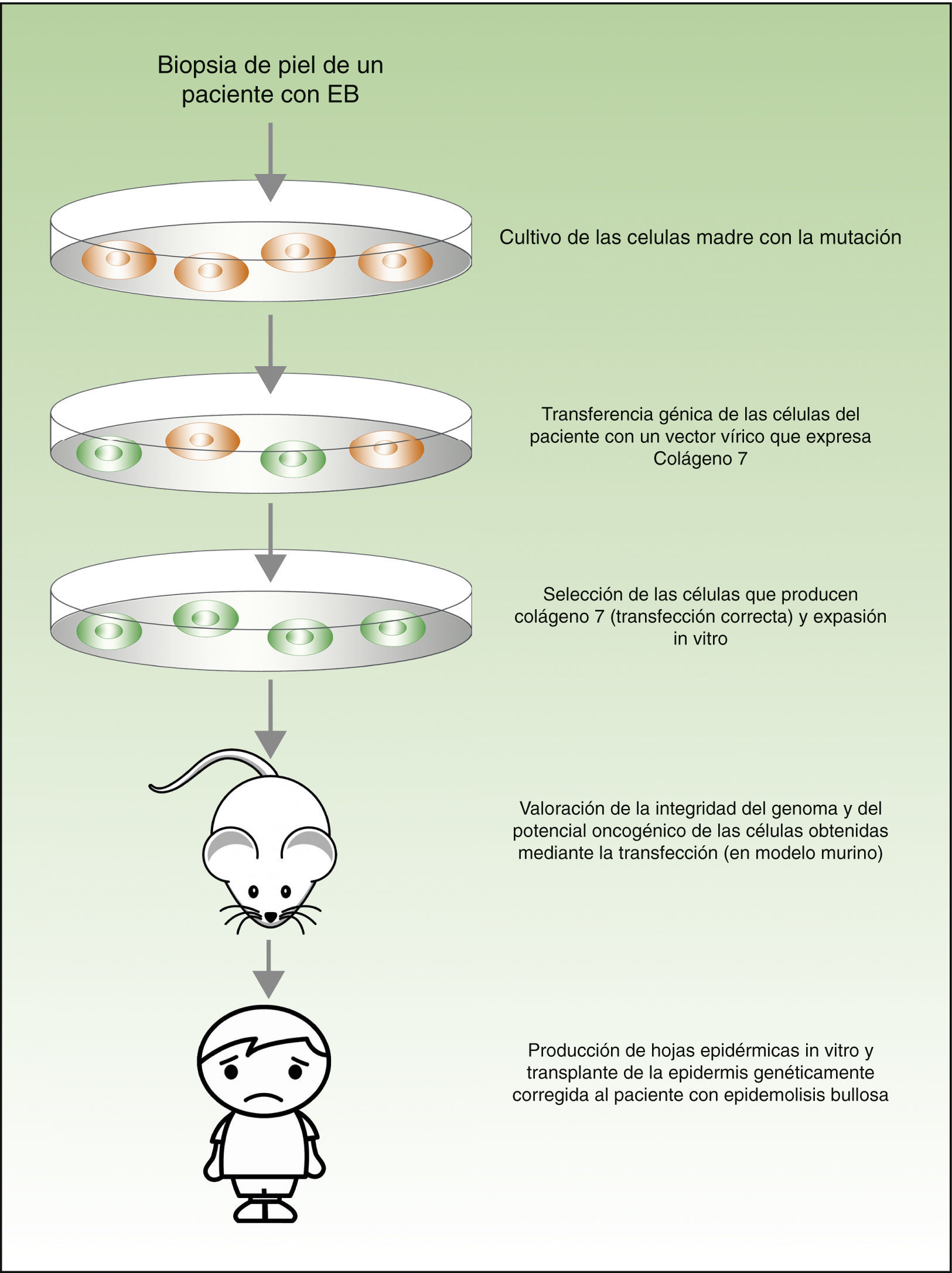
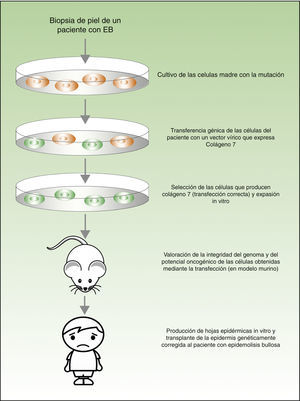
Desde el punto de vista teórico, para el tratamiento de las enfermedades genéticas de la piel existirían 2 posibilidades (fig. 4). La terapia ex-vivo consistiría en extraer las células madre epidérmicas con alteración genética (como por ejemplo el déficit de la laminina 547 o del colágeno 748 en el caso de los pacientes con la epidermólisis bullosa) de la biopsia cutánea, corregir la mutación in vitro mediante transferencia génica, seleccionar las células en las que la transferencia se ha realizado con éxito y el defecto se ha corregido, y volver a trasplantar los queratinocitos en la piel del paciente. En un estudio publicado recientemente, antes de volver a trasplantar las células madre epidérmicas corregidas a los pacientes con epidermólisis bullosa, los autores evaluaron la integridad del genoma y también el potencial oncogénico de dichas las células, demostrando que se trata de un procedimiento seguro (al tratarse de una transfección mediante vectores virales, una de las mayores preocupaciones e inconvenientes es la posible mutagénesis)49,50. La terapia in vivo consistiría en hacer llegar los vectores víricos o nucleasas programables directamente a las células afectadas en su entorno natural, mediante inyección intravenosa del fármaco o en el mismo órgano. Este abordaje presenta varias dificultades técnicas y de seguridad, que no vamos a discutir en esta revisión, pero que han impedido su utilización en los pacientes con enfermedades dermatológicas con alteraciones genéticas.
Conclusiones y perspectivas futurasLas características de las células madre de autorrenovarse y para dar origen a diferentes tipos celulares, junto con el desarrollo asombroso de la bioingeniería, plantean un horizonte de posibilidades apasionante. Las células madre epidérmicas tienen un atractivo especial, por su número relativamente elevado, proporcional a la superficie corporal, y su accesibilidad. Aunque de momento se trate de técnicas complejas y con un coste elevado, es probable que en los próximos años los conocimientos sobre la biología de las células madre, así como la seguridad de las técnicas utilizadas, se incrementen, permitiendo que su aplicación se generalice en medicina, y en dermatología en particular.
FinanciaciónEl trabajo de I. Pastushenko ha sido financiado por la beca Télévie.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores de esta revisión quieren agradecer a Kostiantyn Kokoriev (Kiev, Ucrania) la realización de los esquemas y a Jesús Vera (Servicio de Anatomía Patológica, Hospital San Jorge, Huesca) la imagen histopatológica del folículo piloso.