La dermatitis atópica (DA) es un trastorno cutáneo crónico e inflamatorio que afecta a todos los grupos de edad, pero especialmente a los niños. Esta revisión sistemática proporciona una visión general de la carga de la enfermedad en la población pediátrica con DA en España. La evidencia recopilada de 11 estudios observacionales publicados en los últimos 10 años presenta las características más comunes de los pacientes, la carga de la enfermedad, los resultados reportados por los pacientes, el uso de recursos y los patrones de tratamiento más frecuentes. La carga de la DA se extiende más allá de los síntomas físicos, con comorbilidades asociadas como el asma, el deterioro de la calidad de vida relacionada con la salud y trastornos de salud mental, particularmente en los casos graves. Los tratamientos tradicionales, principalmente los corticosteroides tópicos, enfrentan desafíos de adherencia y eficacia. A pesar de las prometedoras innovaciones terapéuticas y la disponibilidad de terapias biológicas, su uso permanece limitado en población pediátrica. Los resultados de la presente revisión resaltan la escasa evidencia científica sobre la carga económica de la DA pediátrica, así como la evidencia humanística más actualizada de la enfermedad. Asimismo, se hace patente la necesidad de una atención personalizada e intervenciones terapéuticas innovadoras para abordar los desafíos multifacéticos de la DA pediátrica en España.
Atopic dermatitis (AD) is a chronic, inflammatory skin disease affecting all age groups, particularly children. This systematic review provides an overview of the humanistic and economic disease burden in the pediatric population with AD in Spain. The evidence, collected from 11 observational studies published over the past 10 years, exhibits the most common characteristics of the patients, disease burden, patient-reported outcomes, use of resources, and treatment patterns. The burden of AD extends beyond physical symptoms, with associated comorbidities such as asthma and impaired health-related quality of life and mental health disorders, particularly in severe cases. Traditional therapies, primarily topical corticosteroids, face adherence and efficacy challenges. Despite promising innovative treatments and available biological therapies, their use is still limited in the pediatric population. The findings of the present review highlight the scarce scientific evidence on the economic burden of pediatric AD, as well as the most updated humanistic evidence on this disease. At the same time, the need for individualized care and innovative therapeutic interventions to address the multifaceted challenges of pediatric AD in Spain is evident.
La dermatitis atópica (DA) es un trastorno cutáneo prevalente, crónico, recidivante e inflamatorio de etiología multifactorial que se caracteriza por prurito intenso y lesiones cutáneas1. La DA es una enfermedad global que afecta a individuos de todos los grupos de edad2. La prevalencia de la DA entre la población pediátrica es notablemente alta, con estimaciones que indican que entre el 15 y el 30% de los niños parecen estar afectados por esta enfermedad3–5 frente a una prevalencia ligeramente inferior entre la población adulta que oscila entre el 7 y el 14%2. La prevalencia de la DA entre los niños españoles sigue sin estar clara debido a la falta de estudios exhaustivos y específicos por edad y a la escasez de datos disponibles1.
La DA en los pacientes pediátricos se asocia a menudo con una serie de comorbilidades, incluyendo otras enfermedades como el asma o la rinitis alérgica1. Además, es probable que los trastornos psiquiátricos y psicológicos sean más prevalentes en esta población. De hecho, existen pruebas de una mayor incidencia de problemas mentales, como el trastorno por déficit de atención con hiperactividad (TDAH) y la depresión, que también pueden manifestarse como ideación suicida entre estos pacientes1,6,7.
La presencia de estas comorbilidades, junto con síntomas de la DA como el prurito intenso, deteriora significativamente la calidad de vida relacionada con la salud (HRQoL, del inglés «health-related quality of life»), especialmente en los casos graves6,8.
Debido a la heterogeneidad de la enfermedad, las comorbilidades, la complejidad del tratamiento y las diferencias entre los sistemas sanitarios nacionales o regionales, el tratamiento de la DA en la población pediátrica sigue siendo un reto9. Los regímenes con pautas cortas de corticosteroides tópicos son el tratamiento prescrito con mayor frecuencia10. Sin embargo, la adherencia a estos tratamientos convencionales suele ser baja11, y su eficacia en los casos graves también es limitada12,13. Afortunadamente, en los últimos años han aparecido tratamientos innovadores y muy eficaces, como es el caso de los fármacos biológicos y los inhibidores de la Janus quinasa (JAK). Sin embargo, su uso en niños sigue estando restringido en algunos casos10. De hecho, la considerable carga humana de esta enfermedad en los pacientes con DA de moderada a grave sugiere un posible infratratamiento en este grupo, con aún escasa evidencia disponible acerca de nuevas terapias, resultados informados por los pacientes (PRO), gravedad y deterioro de la DA14. Por otra parte, la DA representa una carga económica sustancial para el sistema sanitario, así como para los pacientes y sus cuidadores14. El coste directo total se estimó en casi 2.700€ por paciente y año14. Como era de esperar, la gravedad de la enfermedad tuvo un impacto directo en el coste, y los casos graves dieron lugar a costes más elevados14. En concreto, en comparación con los pacientes con DA leve y moderada, la DA grave presentó costes directos totales significativamente más elevados (1,51€ [DE: 854] y 1.984€ [DE: 2093] frente a 5.377€ [DE: 3,518]; p<0,001, respectivamente).
No se dispone de información completa y actualizada sobre la carga humana y económica asociada a los niños con DA en España. Esta revisión sistemática pretende ofrecer una visión general basada en la evidencia más reciente de la práctica clínica habitual española.
MétodosSe realizó una revisión sistemática de estudios observacionales acerca de la carga humana y económica asociada a los pacientes pediátricos con DA en los últimos 10 años (desde marzo de 2013 hasta marzo de 2023) siguiendo las recomendaciones establecidas por los «Preferred Reporting Items of Systematic Reviews and Meta-analysis» (PRISMA)15.
Fuentes de datos y estrategia de búsquedaSe realizaron búsquedas en las bases de datos internacionales PubMed/MEDLINE, Cochrane Library, Medicina en Español (MEDES) e Índice Bibliográfico Español en Ciencias de la Salud (IBECS) para identificar publicaciones relevantes para la revisión. Además, se realizaron búsquedas manuales en la «literatura gris» (Google y Google Scholar) para identificar documentos como artículos no indexados y resúmenes de congresos publicados en los últimos 3 años en los principales congresos nacionales y europeos organizados por las siguientes sociedades médicas: Academia Española de Dermatología y Venereología (AEDV), Sociedad Española de Alergología e Inmunología Clínica (SEAIC), «European Academy of Dermatology and Venereology» (EADV), «American Academy of Dermatology» (AAD) y «Society for Pediatric Dermatology» (SDP).
Las diferentes bases de datos se buscaron utilizando términos de texto libre y «medical subject headings» (MeSH), combinados con los conectores booleanos «OR» y «AND». La lista de términos y la estrategia de búsqueda se detallan en la tabla S1 de los datos suplementarios.
Selección de estudiosDos revisores examinaron de forma independiente todos los artículos identificados en 2 niveles (niveles 1 y 2). El nivel 1 consistió en un cribado amplio basado en los títulos y/o resúmenes de los artículos, según estuvieran disponibles. En el nivel 2, 2 revisores examinaron de forma independiente el texto completo de los artículos y aplicaron los criterios de inclusión/exclusión. En ambos niveles, las discrepancias se resolvieron por consenso o con la participación de un tercer miembro del equipo.
Criterios de elegibilidadFueron elegibles los estudios observacionales realizados en España que incluyeran población pediátrica (<18 años) con diagnóstico confirmado de DA por dermatólogos/médicos publicados en inglés o español desde marzo de 2013 hasta marzo de 2023. Los estudios realizados fuera de España se incluyeron cuando se aportaron datos específicos de la población española. En la tabla S2 de los datos suplementarios se enumeran los criterios de inclusión y exclusión.
Extracción de datos y evaluación de la calidadLa extracción de los datos incluyó datos sobre la epidemiología de la enfermedad (prevalencia e incidencia), características de los pacientes (demográficas, comorbilidades), patrones de uso del tratamiento, PROs, impacto de la enfermedad en la CVRS, adherencia, uso de recursos sanitarios y costes asociados. Se utilizó un formulario estandarizado de extracción de datos para extraer los datos de los artículos seleccionados.
La calidad de los estudios incluidos fue evaluada por 2 revisores independientes utilizando la declaración «Strengthening the Reporting of Observational Studies in Epidemiology» (STROBE)16, resolviendo las discrepancias por consenso.
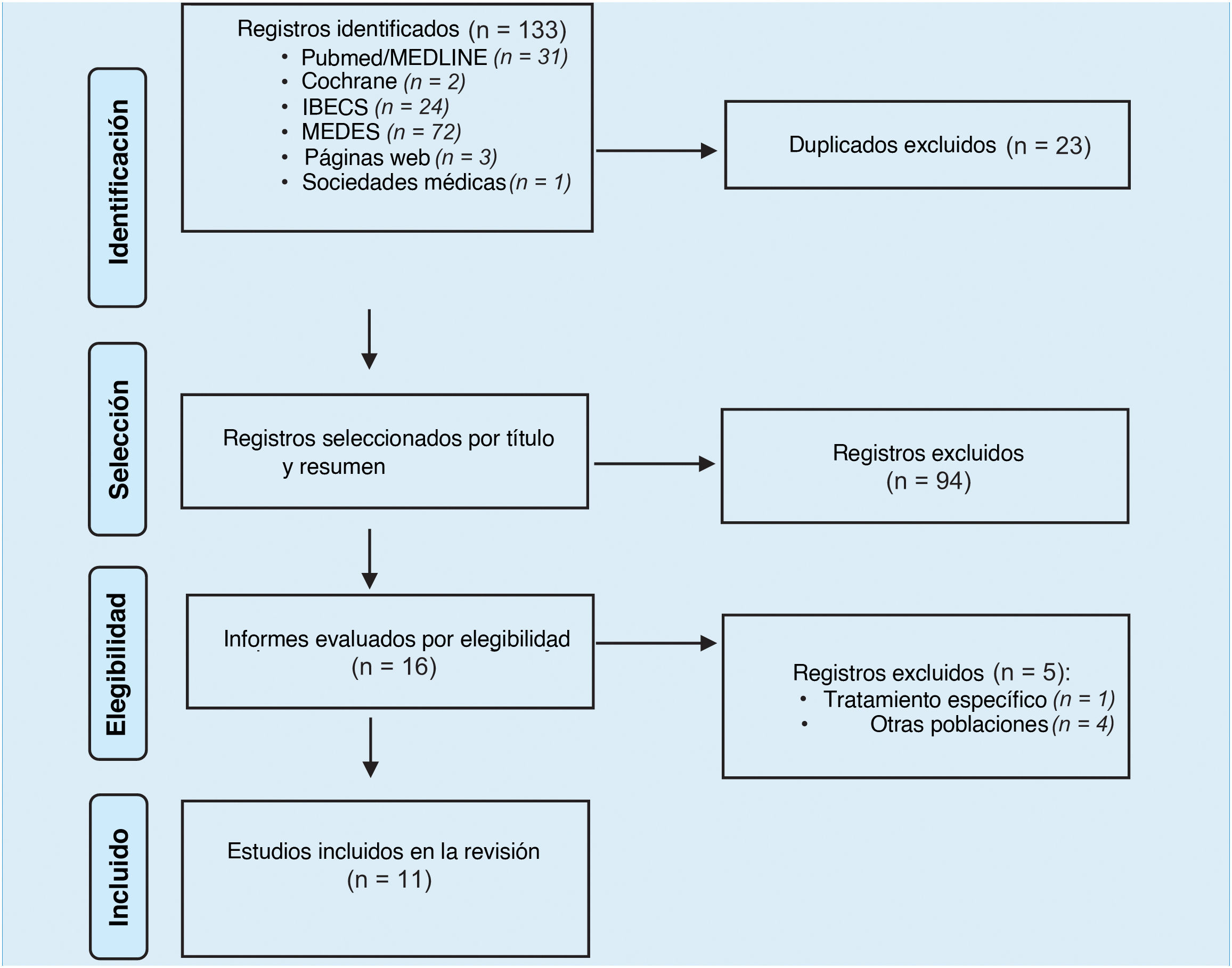
ResultadosSe identificaron inicialmente 133 informes (fig. 1). Tras eliminar los duplicados y aplicar los criterios de inclusión establecidos, se incluyeron en la síntesis 11 publicaciones (10 artículos a texto completo y un resumen de congreso).
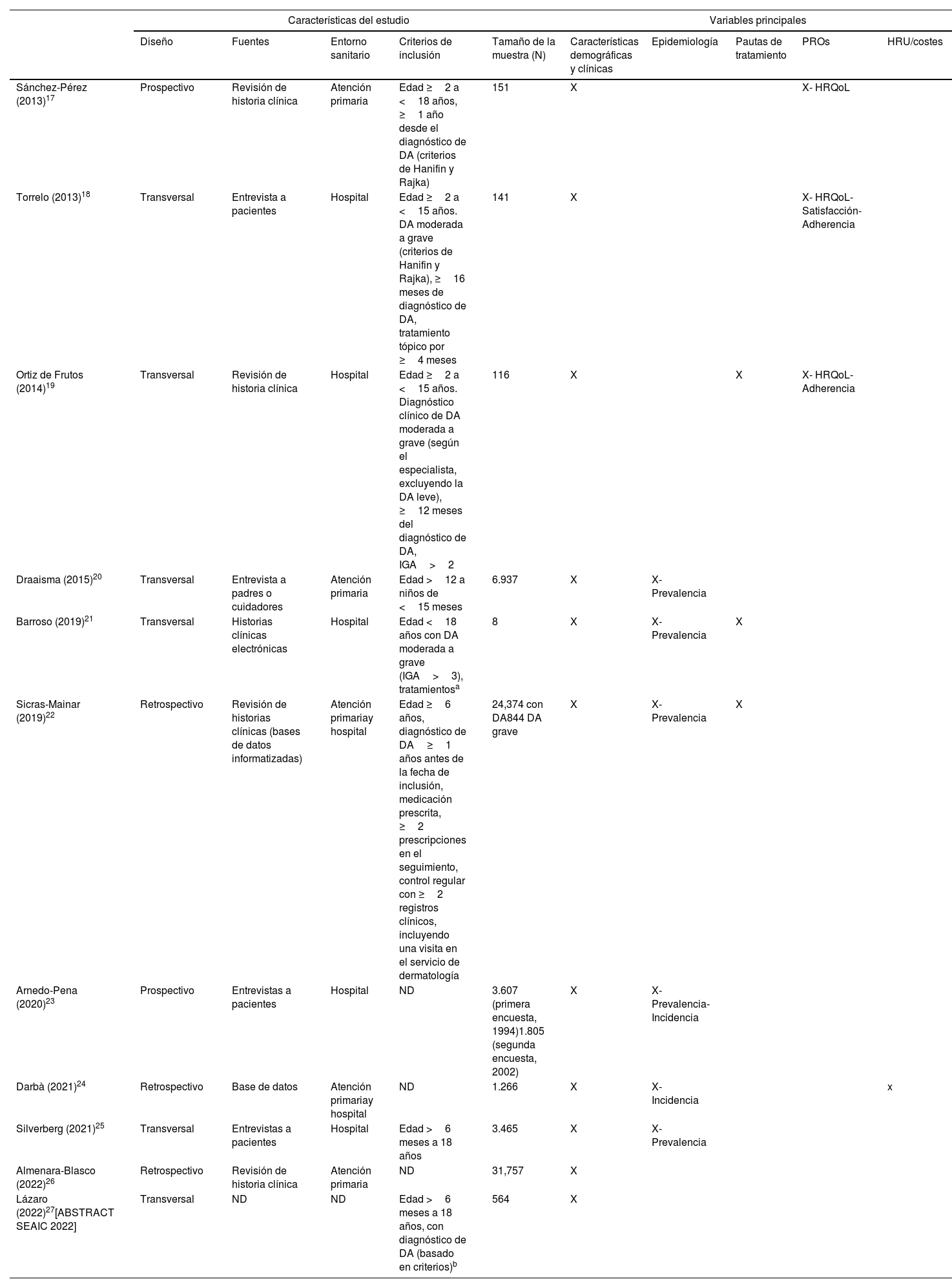
Las principales características de los artículos seleccionados se resumen en la tabla 1. En cuanto al diseño del estudio, el 54,5% (n=6) de los estudios fueron transversales, el 27,3% (n=3) retrospectivos y el 18,2% (n=2) prospectivos. Los criterios de inclusión fueron heterogéneos en cuanto a rango de edad, tiempo desde el diagnóstico, criterios diagnósticos, gravedad y pautas de tratamiento. La fuente de información incluyó la revisión de historias clínicas o bases de datos en el 54,5% (n=6) de los informes, mientras que en el 36,4% (n=4) de las publicaciones, la información se recuperó mediante entrevistas realizadas a los pacientes o a sus padres/cuidadores. El 27,3% (n=3) de los estudios se realizaron en centros sanitarios de atención primaria, el 45,5% (n=5) en centros sanitarios hospitalarios y el 18,2% (n=2) en ambos.
Características principales de las publicaciones seleccionadas
| Características del estudio | Variables principales | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Diseño | Fuentes | Entorno sanitario | Criterios de inclusión | Tamaño de la muestra (N) | Características demográficas y clínicas | Epidemiología | Pautas de tratamiento | PROs | HRU/costes | |
| Sánchez-Pérez (2013)17 | Prospectivo | Revisión de historia clínica | Atención primaria | Edad ≥2 a <18 años, ≥1 año desde el diagnóstico de DA (criterios de Hanifin y Rajka) | 151 | X | X- HRQoL | |||
| Torrelo (2013)18 | Transversal | Entrevista a pacientes | Hospital | Edad ≥2 a <15 años. DA moderada a grave (criterios de Hanifin y Rajka), ≥16 meses de diagnóstico de DA, tratamiento tópico por ≥4 meses | 141 | X | X- HRQoL- Satisfacción- Adherencia | |||
| Ortiz de Frutos (2014)19 | Transversal | Revisión de historia clínica | Hospital | Edad ≥2 a <15 años. Diagnóstico clínico de DA moderada a grave (según el especialista, excluyendo la DA leve), ≥12 meses del diagnóstico de DA, IGA>2 | 116 | X | X | X- HRQoL- Adherencia | ||
| Draaisma (2015)20 | Transversal | Entrevista a padres o cuidadores | Atención primaria | Edad >12 a niños de <15 meses | 6.937 | X | X- Prevalencia | |||
| Barroso (2019)21 | Transversal | Historias clínicas electrónicas | Hospital | Edad <18 años con DA moderada a grave (IGA>3), tratamientosa | 8 | X | X- Prevalencia | X | ||
| Sicras-Mainar (2019)22 | Retrospectivo | Revisión de historias clínicas (bases de datos informatizadas) | Atención primariay hospital | Edad ≥6 años, diagnóstico de DA≥1 años antes de la fecha de inclusión, medicación prescrita, ≥2 prescripciones en el seguimiento, control regular con ≥2 registros clínicos, incluyendo una visita en el servicio de dermatología | 24,374 con DA844 DA grave | X | X- Prevalencia | X | ||
| Arnedo-Pena (2020)23 | Prospectivo | Entrevistas a pacientes | Hospital | ND | 3.607 (primera encuesta, 1994)1.805 (segunda encuesta, 2002) | X | X- Prevalencia- Incidencia | |||
| Darbà (2021)24 | Retrospectivo | Base de datos | Atención primariay hospital | ND | 1.266 | X | X- Incidencia | x | ||
| Silverberg (2021)25 | Transversal | Entrevistas a pacientes | Hospital | Edad >6 meses a 18 años | 3.465 | X | X- Prevalencia | |||
| Almenara-Blasco (2022)26 | Retrospectivo | Revisión de historia clínica | Atención primaria | ND | 31,757 | X | ||||
| Lázaro (2022)27[ABSTRACT SEAIC 2022] | Transversal | ND | ND | Edad >6 meses a 18 años, con diagnóstico de DA (basado en criterios)b | 564 | X | ||||
DA: dermatitis atópica; HRQoL: calidad de vida relacionada con la salud («health-related quality of life»); ND: no disponible; PROs: resultados informados por los pacientes («patient-reported outcomes»); X marca las variables informadas en cada estudio.
≥Uno de los siguientes tratamientos: inmunosupresores (p. ej., ciclosporina, metotrexato fuera de ficha técnica, azatioprina fuera de ficha técnica, micofenolato de mofetil fuera de ficha técnica), fármacos biológicos (incluyendo omalizumab fuera de ficha técnica y ustekinumab fuera de ficha técnica, dupilumab), corticosteroides sistémicos y/u otros fármacos (p. ej., inmunoglobulinas fuera de ficha técnica, apremilast fuera de ficha técnica, fototerapia UVB).
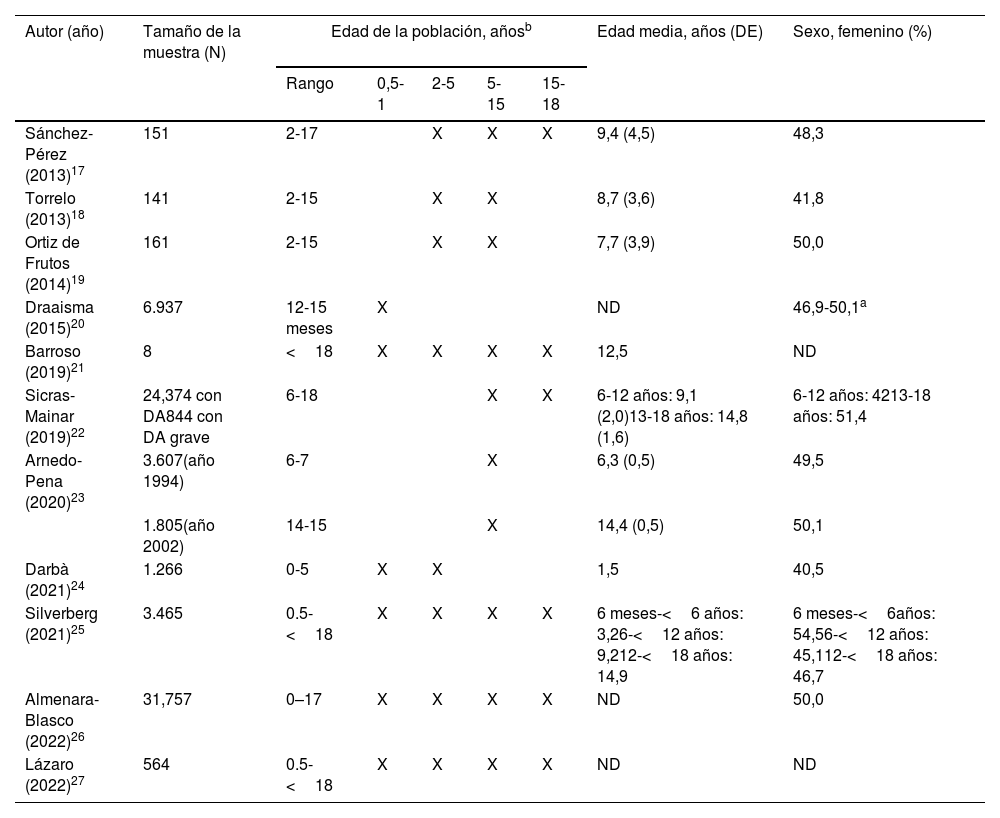
Los detalles sobre la edad y el sexo de la población se detallan en la tabla 2. Cuatro estudios21,25–27 incluyeron un amplio espectro de edades, desde lactantes de 6 meses hasta los pacientes menores de 18 años. Por el contrario, 2 estudios20,23 se centraron en un rango de edad más estrecho, de 12 a 15 meses, y de 6 a 7/14 a 15 años, respectivamente. En general, el grupo de edad con mayor representación fue el de 2 a 15 años. En cuanto al sexo, la proporción varón/mujer fue similar, variando la representación femenina desde el 42 hasta el 54,5% según los diferentes estudios y rangos de edad.
Resumen de los datos relativos a la edad y el sexo de la población
| Autor (año) | Tamaño de la muestra (N) | Edad de la población, añosb | Edad media, años (DE) | Sexo, femenino (%) | ||||
|---|---|---|---|---|---|---|---|---|
| Rango | 0,5-1 | 2-5 | 5-15 | 15-18 | ||||
| Sánchez-Pérez (2013)17 | 151 | 2-17 | X | X | X | 9,4 (4,5) | 48,3 | |
| Torrelo (2013)18 | 141 | 2-15 | X | X | 8,7 (3,6) | 41,8 | ||
| Ortiz de Frutos (2014)19 | 161 | 2-15 | X | X | 7,7 (3,9) | 50,0 | ||
| Draaisma (2015)20 | 6.937 | 12-15 meses | X | ND | 46,9-50,1a | |||
| Barroso (2019)21 | 8 | <18 | X | X | X | X | 12,5 | ND |
| Sicras-Mainar (2019)22 | 24,374 con DA844 con DA grave | 6-18 | X | X | 6-12 años: 9,1 (2,0)13-18 años: 14,8 (1,6) | 6-12 años: 4213-18 años: 51,4 | ||
| Arnedo-Pena (2020)23 | 3.607(año 1994) | 6-7 | X | 6,3 (0,5) | 49,5 | |||
| 1.805(año 2002) | 14-15 | X | 14,4 (0,5) | 50,1 | ||||
| Darbà (2021)24 | 1.266 | 0-5 | X | X | 1,5 | 40,5 | ||
| Silverberg (2021)25 | 3.465 | 0.5-<18 | X | X | X | X | 6 meses-<6 años: 3,26-<12 años: 9,212-<18 años: 14,9 | 6 meses-<6años: 54,56-<12 años: 45,112-<18 años: 46,7 |
| Almenara-Blasco (2022)26 | 31,757 | 0–17 | X | X | X | X | ND | 50,0 |
| Lázaro (2022)27 | 564 | 0.5-<18 | X | X | X | X | ND | ND |
DA: dermatitis atópica; DE: desviación estándar; ND: no disponible; X marca el rango de edad registrado.
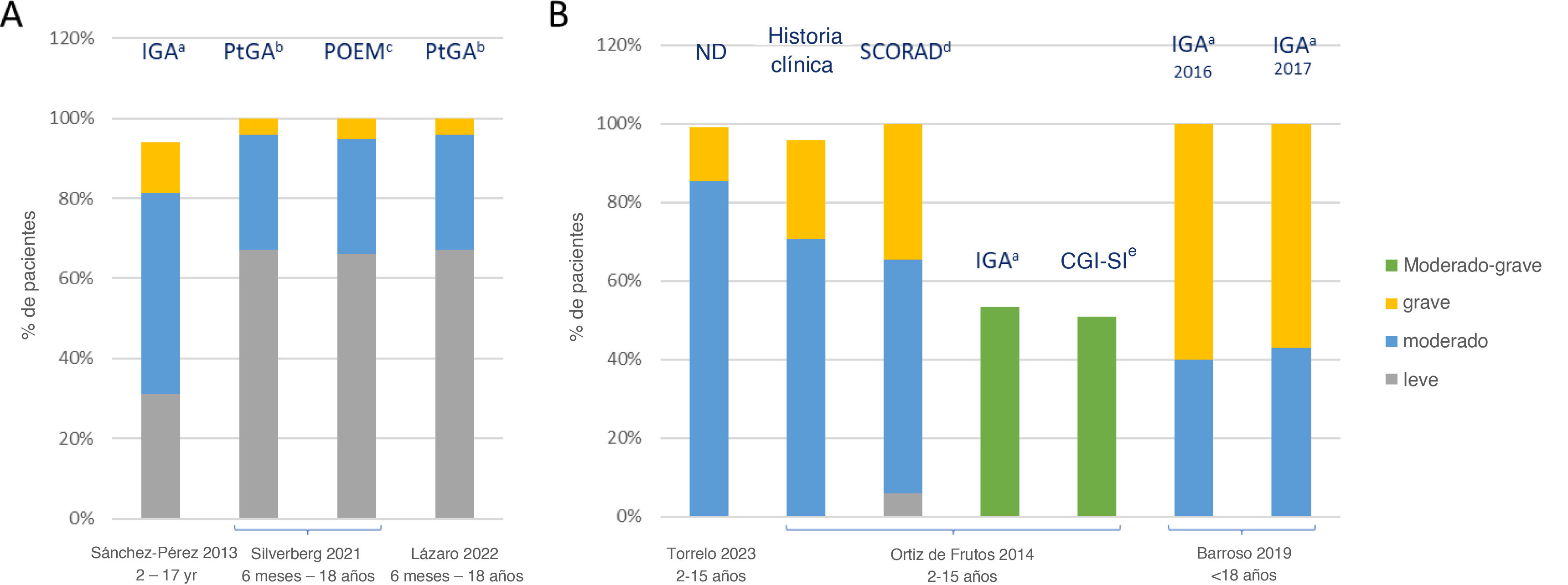
Seis estudios17,21,25,27 evaluaron la gravedad de la DA utilizando diferentes herramientas, incluyendo «Investigator's Global Assessment» (IGA) (n=3)17,19,21, la escala «SCORing Atopic Dermatitis» (SCORAD) (n=1)19, la escala «Clinical Global Impressions - Severity of Illness» (CGI-SI) (n=1)19, la «Patient Global Assessment» (PtGA) (n=2)25,27, la «Patient-Oriented Eczema Measure» (POEM) (n=1)25 y la perspectiva del médico18 (fig. 2).
Gravedad de la DA. A) Estudios que incluyen los pacientes leves, moderados y graves medidos con IGA, PtGA y POEM. B) Estudios restringidos a los pacientes de moderados a graves medidos con SCORAD, IGA, CGI-SI, IGA e historia clínica. ND: no disponible; el aIGA tiene 6 categorías de respuesta, y su puntuación oscila entre 0 (sin enfermedad, sin signos inflamatorios de DA) y 5 (enfermedad muy grave, con eritema intenso y pápula/infiltración intensa con costras/exudación). Barroso et al. variaron la gravedad de 0 a 4, considerando las puntuaciones de 3 como DA moderada y las puntuaciones de 4 como DA grave; bPatient Global Assessment (PtGA), que pregunta: «Por favor, marque la respuesta que mejor describa la gravedad de su eczema o el de su hijo durante la última semana», con respuestas de limpio, leve, moderado o grave; cPatient-Oriented Eczema Measure (POEM), con una puntuación total que oscila entre 0 (menor gravedad) y 28 (mayor gravedad); las agrupaciones de gravedad se han definido como grupos de 0-7 que indican DA leve, 8-16 DA moderada y >16 DA grave; dSCORAD tiene en cuenta la extensión y la intensidad de las lesiones, así como los síntomas (prurito y pérdida de sueño) que provoca; extensión (A): la superficie corporal se divide en 4 segmentos (cabeza y cuello, tronco, extremidades superiores e inferiores) a los que se asigna un porcentaje en función de la extensión representada; intensidad (B); eLa escala de impresión clínica global - la escala de gravedad (CGI-S) es una valiosa herramienta utilizada por los clínicos para evaluar la gravedad de la enfermedad de un paciente frente a su experiencia pasada con diagnósticos similares. Consiste en calificar el estado actual del paciente en una escala de 7 puntos, que refleja distintos niveles de gravedad de la enfermedad: (1) normal, no enfermo, (2) al límite de estar mentalmente enfermo, (3) levemente enfermo, (4) moderadamente enfermo, (5) marcadamente enfermo, (6) gravemente enfermo y (7) extremadamente enfermo.
Tres estudios se centraron en los pacientes con DA de moderada a grave18,19,21, mientras que los otros 3 estudios incluyeron los pacientes de todas las severidades de DA17,25,27. En estos últimos estudios, la DA moderada se registró en el 28,8% hasta el 50,3% de los pacientes, y la DA grave en el 4,1% hasta el 12,6% de los pacientes17,25,27. La DA leve fue la enfermedad más prevalente en 2 de esos estudios según PtGA/POEM25,27; mientras que la DA moderada fue la más prevalente en el estudio #3 según el IGA17.
Ortiz de Frutos et al. utilizaron varias herramientas para evaluar la gravedad de la enfermedad. Un 70,7% de los pacientes pediátricos habían sido diagnosticados inicialmente de DA moderada, según el mejor juicio clínico del especialista, y por lo tanto, fueron incluidos en el estudio. Sin embargo, en el momento de la consulta médica, solo el 53,4 y el 50,9% presentaban DA de moderada a grave según la IGA y la CGI-SI, respectivamente19. El 6% de los pacientes habían sido incluidos inicialmente en el estudio como pacientes con DA de moderada a grave, pero obtuvieron una puntuación SCORAD<15, lo que terminó por categorizar su DA como leve. En cambio, Silverberg et al. evaluaron la gravedad de la enfermedad mediante el PtGA y el POEM, observando tasas similares25.
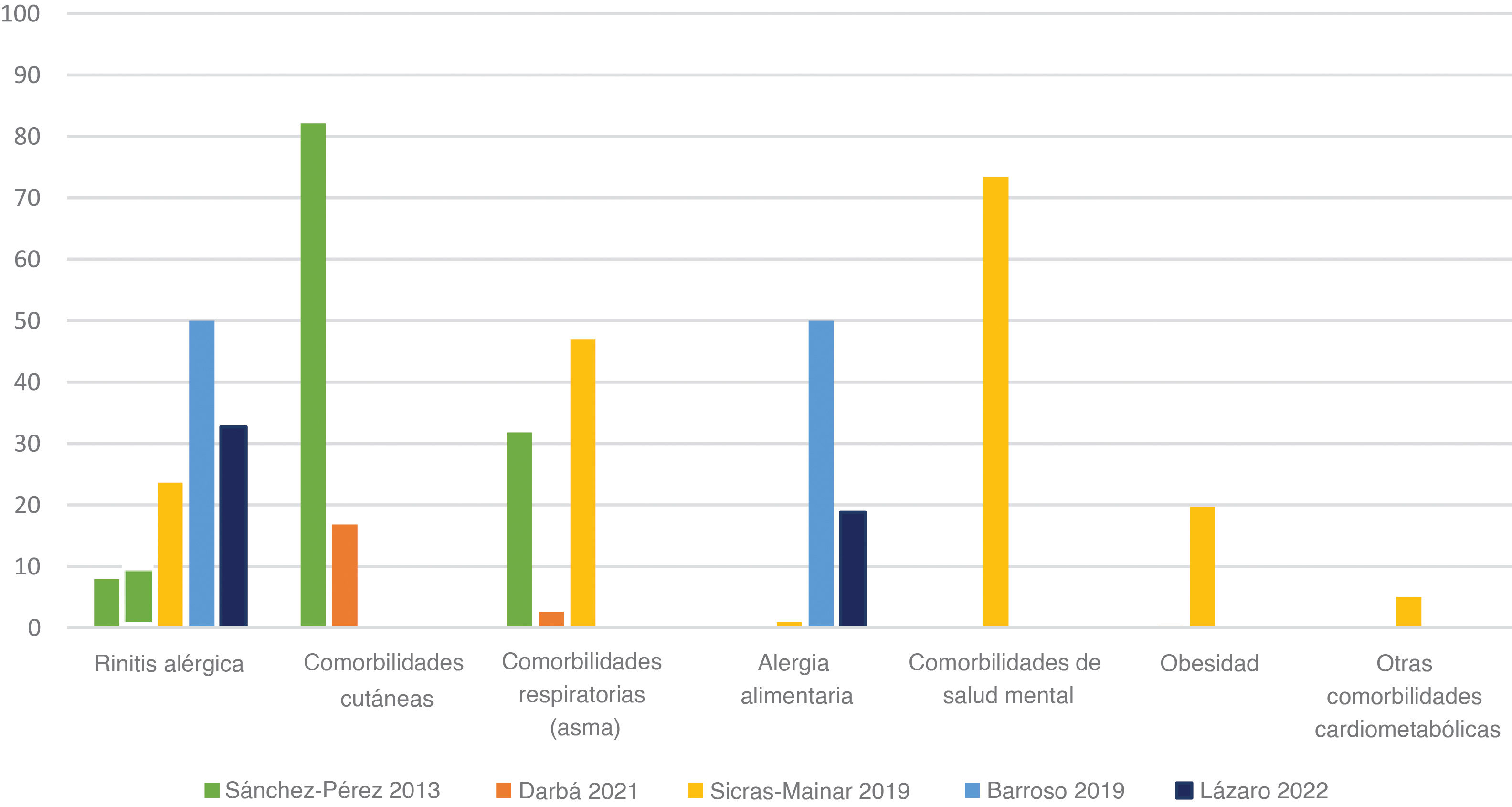
ComorbilidadesCinco estudios17,21,22,24,27 aportaron datos específicos sobre comorbilidades asociadas a la DA en los pacientes pediátricos españoles (fig. 3). Un estudio adicional26 enumeró las comorbilidades sin aportar porcentajes de prevalencia.
Un estudio presentó datos agregados, confirmando que el 84,4% de los pacientes pediátricos con DA tenían, al menos, una comorbilidad, con una media de 2,5 comorbilidades por paciente27. En general, las afecciones respiratorias como el asma y las alergias como la rinitis alérgica fueron las afecciones más reportadas en los estudios observacionales revisados, oscilando entre el 2,6 y el 47% y entre el 7,9 y el 50%, respectivamente.
Curiosamente, en el estudio realizado por Almenara-Blasco et al.26 se identificaron diferentes patrones de comorbilidad relacionados con el sexo. Los trastornos mentales, la dislipidemia y las afecciones respiratorias eran más frecuentes entre los varones, mientras que las afecciones respiratorias/alérgicas, sensitivo/digestivas, menstrual-disfórico-metabólicas y cardiometabólicas eran más frecuentes entre las mujeres (porcentajes no proporcionados)26.
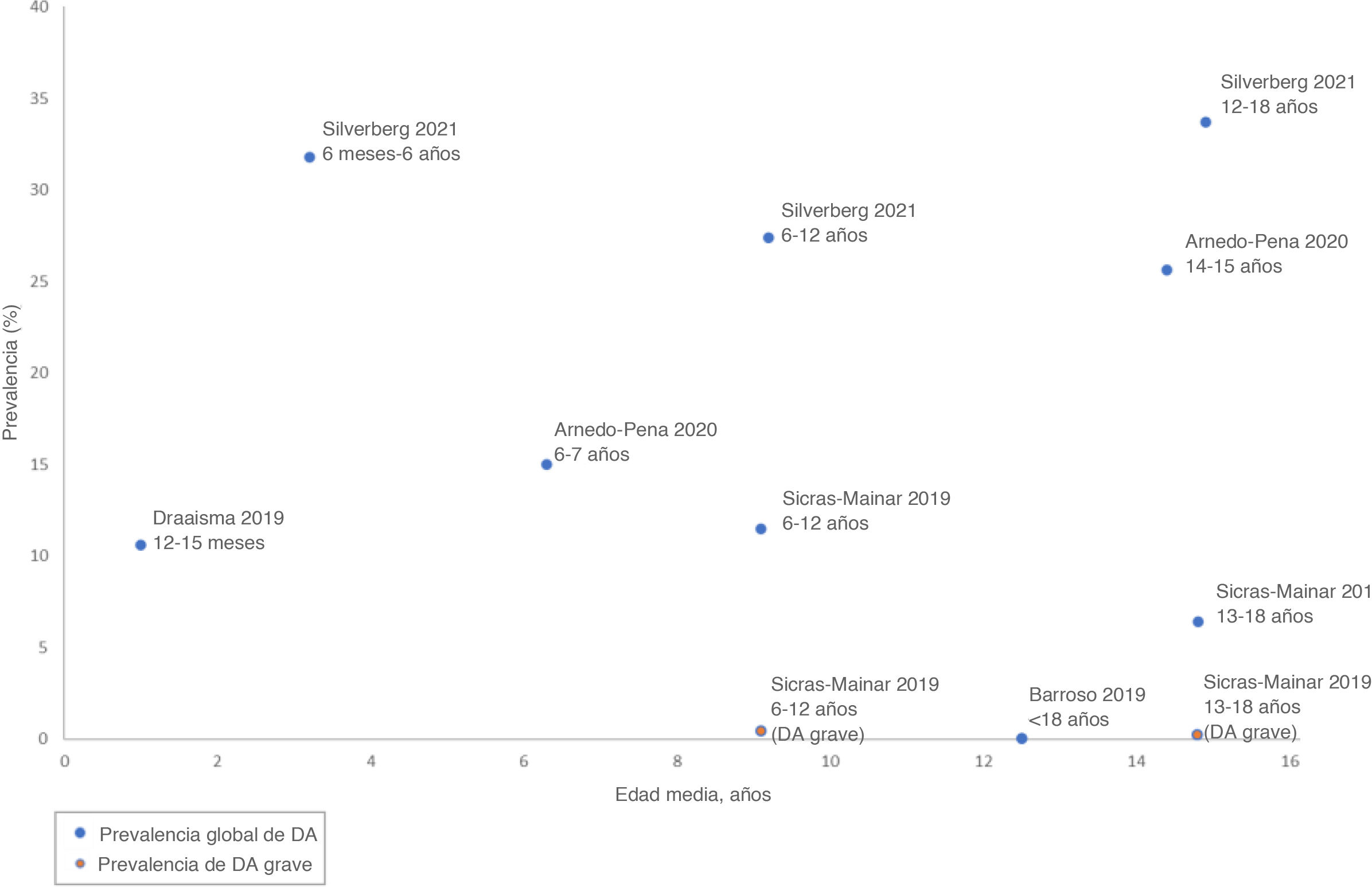
Carga de la enfermedadEpidemiologíaSeis artículos20–25 proporcionaron datos epidemiológicos, incluida la prevalencia (n=5) y la incidencia (n=2) de DA en la población pediátrica de España. Las tasas de prevalencia comunicadas variaron significativamente entre los distintos estudios, oscilando entre el 0,01 y el 30% (fig. 4).
Sicras-Mainar et al.22 evaluaron la prevalencia de la DA por diferentes grupos de edad, siendo mayor tanto la prevalencia global como la de la DA grave en los niños de 6-12 años (11,5 vs. 6,4%; p<0,001) frente a los de 13-18 años (0,39 vs. 0,23; p<0,001), respectivamente22. Del mismo modo, Arnedo-Pena et al.23. informaron de una mayor prevalencia en adolescentes mayores de 12 años frente a niños más pequeños, así como en mujeres frente a varones tanto en 2002 como en 2012 (29,80 vs. 21,50% y 41,40 vs. 28,30%, respectivamente). Este estudio también informó de un aumento en la razón de prevalencia desde 1994 (1,02 [IC 95%: 0,86-1,21]) hasta 2012 (1,41 [IC 95%: 1,21-1,73])23.
En cuanto a la incidencia de la DA, se extrajeron datos de 2 estudios23,24. Arnedo-Pena et al.23 identificaron un total de 182 nuevos casos de DA entre 1994 y 2002, con una tasa de incidencia de 15,9 por 1.000 personas/año. Darbà y Marsà24 confirmaron una tasa de incidencia de DA entre 2000 y 2017 de 5,8 por 100.000 personas, con una mayor incidencia en niños de 0 a 5 años (30,0 por 100.000 personas), y una incidencia global estable durante todo el periodo de estudio24.
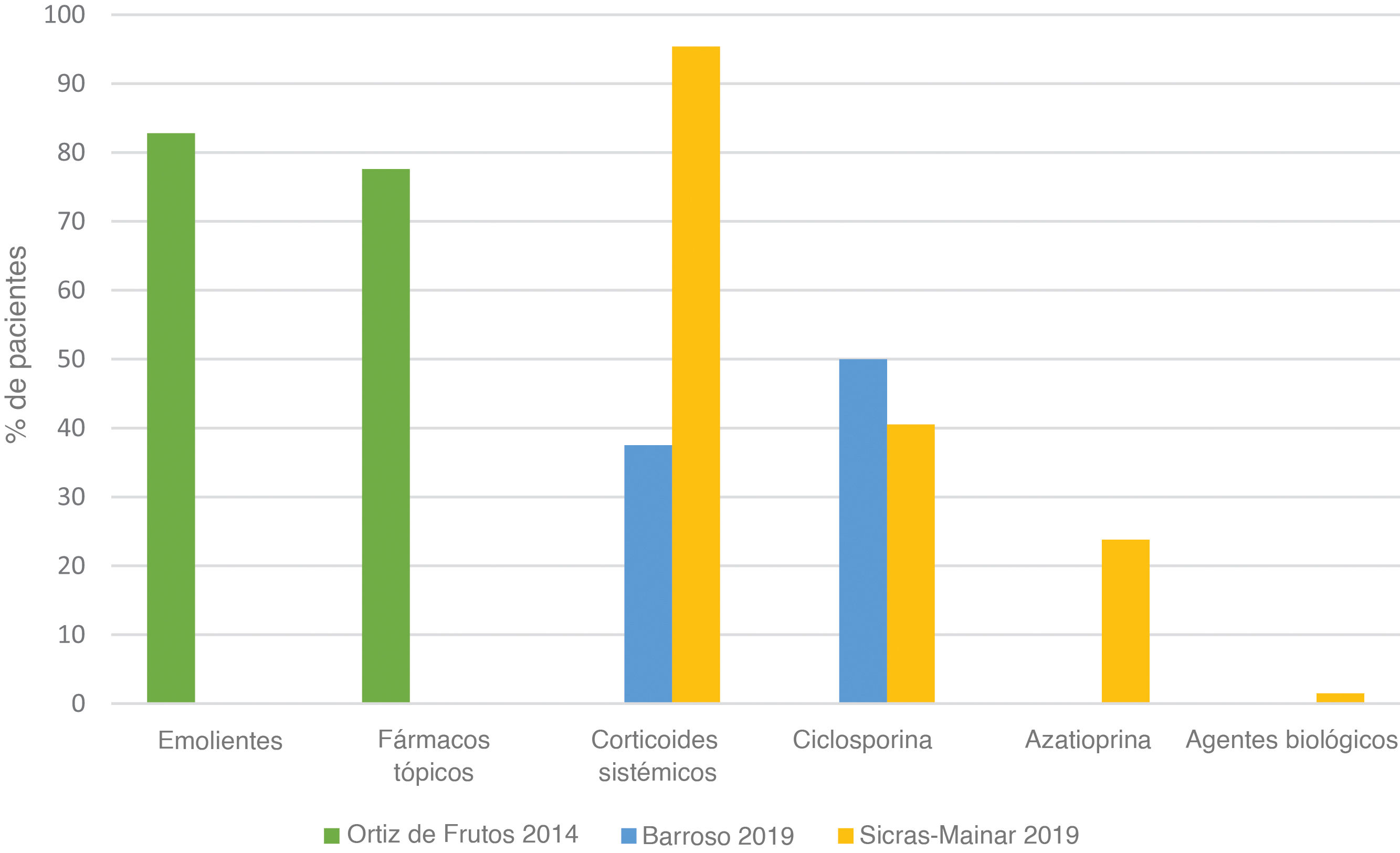
Pautas de tratamientoTres estudios19,21,22 evaluaron las diferentes pautas de tratamiento indicadas en los pacientes pediátricos con DA moderada-grave en España (fig. 5).
El tratamiento de primera línea en niños con DA moderada/grave fue el uso de emolientes (82,8%)19, seguido del tratamiento farmacológico tópico (77,6%) incluyendo corticoides21. Los corticosteroides sistémicos también se utilizaron en niños a partir de los 6 años (37,5 hasta 95,4%), siendo la ciclosporina (40,5 hasta 50%) y la azatioprina (23,8%) los fármacos más utilizados21,22. Solo un pequeño porcentaje de pacientes recibió fármacos biológicos (1,5%), en niños mayores de 6 años22.
A pesar de que los pacientes pediátricos padecían una DA de moderada a grave, llamó la atención que el 24,1% de los pacientes refiriera no utilizar ningún tratamiento farmacológico tópico o retrasar su uso19.
Resultados referidos por los pacientesTres artículos17–19 aportaron datos sobre los PROs que cubrían aspectos como la HRQoL (n=3)17–19, la satisfacción con el tratamiento (n=1)18, y la adherencia al tratamiento (n=2)18,19.
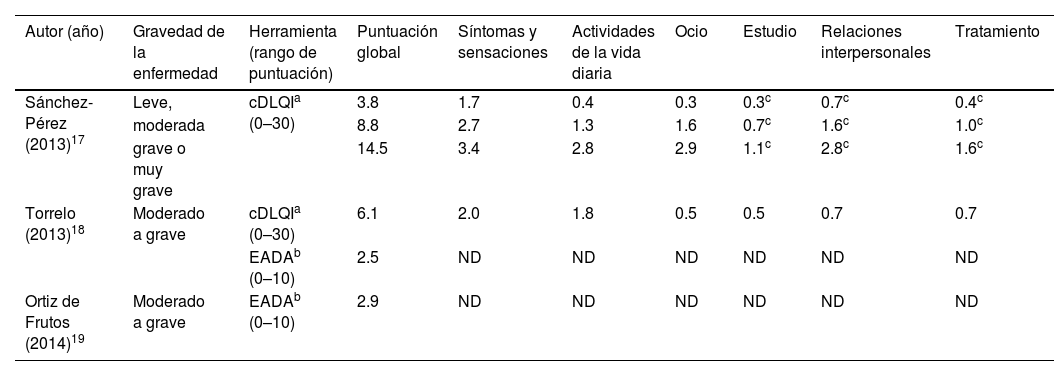
HRQoLEl impacto de la DA en la HRQoL de los pacientes se evaluó mediante la versión infantil del índice de calidad de vida en dermatología (cDLQI), el índice de calidad de vida en dermatitis infantil (IDQoL) y la versión infantil de la escala de afectación de la dermatitis atópica (EADA). Las puntuaciones más bajas representaban un menor deterioro y una mejor HRQoL en todos los cuestionarios utilizados, con puntuaciones finales que oscilaban entre 0 y 30 en los índices cDLQI e IDQoL, y entre 0 y 10 en la escala EADA. En la tabla 3 se presenta un resumen de los resultados.
Resumen de los resultados del HRQoL
| Autor (año) | Gravedad de la enfermedad | Herramienta (rango de puntuación) | Puntuación global | Síntomas y sensaciones | Actividades de la vida diaria | Ocio | Estudio | Relaciones interpersonales | Tratamiento |
|---|---|---|---|---|---|---|---|---|---|
| Sánchez-Pérez (2013)17 | Leve, | cDLQIa (0–30) | 3.8 | 1.7 | 0.4 | 0.3 | 0.3c | 0.7c | 0.4c |
| moderada | 8.8 | 2.7 | 1.3 | 1.6 | 0.7c | 1.6c | 1.0c | ||
| grave o muy grave | 14.5 | 3.4 | 2.8 | 2.9 | 1.1c | 2.8c | 1.6c | ||
| Torrelo (2013)18 | Moderado a grave | cDLQIa (0–30) | 6.1 | 2.0 | 1.8 | 0.5 | 0.5 | 0.7 | 0.7 |
| EADAb (0–10) | 2.5 | ND | ND | ND | ND | ND | ND | ||
| Ortiz de Frutos (2014)19 | Moderado a grave | EADAb (0–10) | 2.9 | ND | ND | ND | ND | ND | ND |
DE: desviación estándar; HRQoL: calidad de vida relacionada con la salud («health-related quality of life»); ND: no disponible.
El cDLQI consta de 10 ítems, cada uno de los cuales incluye 4 categorías de respuesta que van de 3 (mucho) a 0 (nada). Las dimensiones del cuestionario incluyen síntomas y sensaciones, actividades de la vida diaria, ocio, trabajo/estudio, relaciones interpersonales, sexualidad y tratamiento. La puntuación final oscila entre 0 (impacto mínimo en el HRQOL) hasta 30 puntos (impacto máximo en el HRQOL).
La escala de la EADA es un instrumento breve de autoinforme que consta de 9 ítems para adultos y 8 para pacientes pediátricos. Incluye 4 opciones de respuesta. Las puntuaciones globales brutas obtenidas en cada versión se transforman linealmente en una escala que va desde 0 (impacto mínimo en el HRQoL) hasta 10 (impacto máximo en el HRQoL del paciente). En el caso de los pacientes pediátricos, la encuesta fue cumplimentada por los padres o cuidadores para evaluar el impacto de la DA en el HRQoL de los menores.
Dos estudios utilizaron el cDLQI: uno informó de una puntuación global de 6,1, siendo los síntomas y sensaciones (2,0) y las actividades cotidianas (1,8) las dimensiones más afectadas18; mientras que el otro informó de puntuaciones medias globales de 3,8, 8,8 y 14,5 en función de la gravedad de la enfermedad (leve, moderada y grave o muy grave, respectivamente)17. De forma similar al cDLQI, las puntuaciones globales de IDQoL y EADA mostraron un impacto moderado, con puntuaciones medias de 7,6 y 2,5, respectivamente, en estos pacientes de moderados a graves18.
Torrelo et al. observaron mayores niveles de deterioro emocional, físico y social en los pacientes con DA grave frente a los pacientes con DA leve18. En consonancia con esto, en los graves, en comparación con los leves, las puntuaciones individuales de los dominios del cDLQI revelaron un impacto significativamente mayor en los síntomas (puntuación media, 3,4 [DE: 1,8] vs. 1,7 [DE: 1,1]; p<0,05), las actividades de la vida diaria (puntuación media, 2,8 [DE: 1,6] vs. 0,4 [DE: 1,7]; p<0,05), y el ocio (puntuación media, 2,9 [DE: 2,2] vs. 0,3 [DE: 0,7]; p<0,05)17. Además, la DA provocaba cambios en el estado de ánimo (79,9%), que provocaban sentimientos de inquietud (91,6%), dificultad en la concentración (35,3%) y depresión (7,6%), sobre todo entre los que padecían DA grave17. La DA afectó significativamente a la vida diaria de los pacientes en todos los grupos de gravedad, y el 24,5% de la muestra global experimentó prurito fuerte o muy fuerte17. El prurito privó del sueño, y la mayoría de los pacientes con DA de moderada a grave refirieron dificultades para conciliar el sueño (90,1% con DA moderada y 87,5% con DA grave), y una proporción de ellos se despertaba por la noche (76,8% con DA moderada y 97,5% con DA grave)17.
Satisfacción con el tratamiento y adherencia al tratamientoSe evaluaron la satisfacción y la adherencia al tratamiento en los pacientes que utilizaban tratamiento farmacológico tópico de mantenimiento para la prevención de las reagudizaciones. En general, los pacientes expresaron una alta satisfacción (7,2), evaluada mediante una escala analógica visual (EAV: 0-10), sin diferencias significativas en cuanto a la gravedad de la enfermedad18. Sin embargo, la adherencia al tratamiento, informada mediante la prueba de Morisky-Green, fue baja (18,4%), con un 49,9% de los pacientes que admitieron olvidar ocasionalmente la aplicación del tratamiento, y un 34,0% que admitieron no cumplirlo durante los periodos libres de síntomas18. Por el contrario, en otro estudio se observó que la mayoría de los pacientes cumplían el tratamiento farmacológico19. Se encontraron discrepancias entre las percepciones de médicos y pacientes sobre el cumplimiento comunicado. Mientras que los dermatólogos consideraron que muchos de sus pacientes cumplían el tratamiento de mantenimiento (88,7%), el porcentaje de pacientes que se declararon cumplidores fue menor (18,4 hasta el 42,6%)18. Curiosamente, los pacientes calificaron de excelente, bueno o suficiente el control de la enfermedad en el 62,7% de los casos, mientras que los dermatólogos lo hicieron en el 40,5% de los casos19.
Uso de recursos y costes asociadosSolo un informe mostró datos sobre el uso de recursos de atención especializada y costes asociados en los pacientes pediátricos (<5 años)24.
El estudio realizado entre 2000 y 2017 incluyó el 84,3% de los ingresos en urgencias con una estancia media de 4,3 días. Los procedimientos médicos más comunes al ingreso incluyeron un examen de sangre (30,6%), corticoides inyectables (18,6%), antibióticos (12,1%) y biopsias de piel (14,3%). Además, las intervenciones farmacológicas registradas en los centros de atención primaria incluyeron la administración de antibióticos (8,7%), corticosteroides (tópicos, 25,7%; sistémicos, 17,8%), analgésicos (paracetamol, 27,1%; ibuprofeno, 20,2%; otros, 28,3%) y antihistamínicos (14,3%).
Los costes médicos directos anuales medios por paciente se estimaron en 2.310€. Estos costes se mantuvieron estables en su mayor parte durante la primera mitad del periodo de estudio (entre 1.500 y 2.500€/por paciente aprox., 2000-2009), observándose un aumento importante de 2009 a 2010 hasta 4000 euros/por paciente (p<0,0001), seguido de una tendencia decreciente en el periodo 2011-2017, volviendo a 2.500€/por paciente aprox.
DiscusiónNuestra revisión sistemática sintetizó los hallazgos de 11 estudios observacionales que proporcionan una visión general de las características de la población, la carga de la enfermedad, la epidemiología, las pautas de tratamiento, los PRO, el uso de recursos y los costes asociados con el manejo de la DA en los pacientes pediátricos españoles.
Basándonos en los estudios que evaluaron la gravedad de la DA, pudimos concluir que las diferencias en la clasificación pueden derivarse del uso de diferentes instrumentos de medida. Los resultados observados sugirieron que el uso de medidas PRO como PtGA y POEM correlacionarían bien entre ellas. Sin embargo, los resultados obtenidos utilizando medidas clínicas como IGA o CGI-SI podrían subestimar la gravedad frente a los resultados obtenidos utilizando SCORAD, ya que combina la perspectiva clínica y la del paciente.
Entre los estudios incluidos en nuestra revisión que aportaron datos sobre comorbilidades, las enfermedades respiratorias y las alergias resultaron ser las más frecuentes. Cabe destacar que uno de los estudios de pacientes pediátricos con DA grave informó de una alta prevalencia (>70%) de enfermedades mentales17,21,22,24,27. En este contexto, existen pruebas de una asociación significativa entre la DA en niños y los síntomas de salud mental28. En un estudio longitudinal de cohortes de control de natalidad basado en la población se observó que los niños con DA grave tenían más de 2 veces una mayor probabilidad de presentar síntomas de depresión que los que no padecían DA28. Además, los niños con DA tenían más probabilidades de interiorizar conductas como la ansiedad o las quejas somáticas28. También se ha descrito una mayor prevalencia de TDAH en los pacientes pediátricos con DA29.
Como se observa en los 3 estudios incluidos en nuestra revisión, la DA afecta no solo al ámbito emocional, sino también a otros ámbitos de la HRQoL, como el deterioro físico y social, sobre todo en la DA grave17–19. El prurito es el síntoma con mayor impacto en la HRQoL, ya que interfiere negativamente en la calidad del sueño, los cambios de humor y la inquietud8. En consonancia con esto, se ha señalado que la DA es la enfermedad cutánea que con mayor frecuencia causa un peor deterioro de la HRQoL a causa de síntomas como el prurito y el insomnio30. Un estudio reveló que el 79% de los niños con DA informaron de alteraciones del sueño31, incluso entre los pacientes con enfermedad leve e inactiva32.
Los datos de prevalencia de los estudios analizados revelaron una gran heterogeneidad. Por ejemplo, se observó una variabilidad significativa en la prevalencia e incidencia de la DA entre regiones y grupos de edad. Esta variabilidad podría atribuirse a variaciones en las metodologías y el diseño de los estudios, los entornos de investigación y las definiciones de DA.
La prevalencia de la DA es heterogénea, oscilando generalmente entre el 10% y el 30% incluso en niños menores de 2 años, lo que sugiere un inicio precoz durante la infancia. Este inicio precoz suele estar asociado a una predisposición genética y a factores ambientales33. Aunque los patrones de diferencia entre sexos parecían no ser significativos, el largo estudio realizado por Arnedo-Pena et al. en una pequeña región de España desde 1994 hasta 2012 dio como resultado que las mujeres mostraban una mayor prevalencia de DA23, una tendencia que aún no se ha observado en el estudio global de práctica clínica realizado por Silverberg et al.25, que incluye 18 países. Se observó una tendencia creciente en la prevalencia de DA en España desde 1994 hasta 201223. Por el contrario, se observó una disminución en la prevalencia de DA desde el 22,8% (1996) hasta el 21,3% (2006), y hasta el 16,3% (2017), p, ej., en Suecia34, lo que pone de relieve las variaciones geográficas.
En cuanto a la incidencia de la DA, en nuestra revisión se observó una tendencia estable en niños de 0 a 5 años desde 2000 hasta 201724. Del mismo modo, un estudio de Dinamarca y Suecia apoya esta estabilidad, con tasas de incidencia consistentes a lo largo del tiempo35. Esta estabilidad sugiere factores de riesgo sin cambios para el desarrollo de la DA en este grupo de edad34.
En España, las actuales guías de tratamiento de la DA para la población pediátrica sugieren una adecuada hidratación de la piel y el uso de corticoides tópicos36, lo que concuerda con las pautas de tratamiento recogidas en los estudios revisados19,20, aunque debemos mencionar que el 24,1% de los pacientes moderados/graves retrasaron el inicio o no aplicaron tratamiento farmacológico tópico de mantenimiento19. La adherencia al tratamiento fue baja, a pesar de la satisfacción expresada por el paciente con el tratamiento18, e independientemente de la gravedad de la enfermedad37. También debemos mencionar las diferentes percepciones entre los pacientes y los especialistas en la materia, siendo frecuente que los especialistas sobrestimen el cumplimiento por parte del paciente de las recomendaciones y la aplicación del tratamiento prescrito18.
El uso de fármacos biológicos como tratamiento de elección entre los pacientes pediátricos parece ser limitado, ya que solo el 1,5% de los pacientes mayores de 6 años se benefician de esta opción22. Este uso limitado de fármacos biológicos en la población pediátrica española puede deberse a que su autorización de uso es muy reciente y a las barreras de acceso que podrían haber impedido su prescripción38. Sin embargo, los fármacos biológicos pueden proporcionar un control adecuado en casos moderados-graves, cubriendo una necesidad en esta población pediátrica39.
Cabe destacar el importante vacío existente en la literatura sobre la carga económica de la DA pediátrica en España. Mientras que varios estudios se han centrado en las implicaciones económicas en los pacientes adultos40,41, existen escasas investigaciones acerca de la población pediátrica, a pesar de las investigaciones realizadas en otros países europeos que destacan el importante uso de recursos en atención secundaria, como las visitas ambulatorias y la dispensación de fármacos42. El coste médico directo medio en Suecia (DE) se estimó en 1.111€ (3.416) y 1.906€ (7.067) para la DA leve a moderada y grave, respectivamente, lo que coincide con los datos españoles observados en nuestra revisión. No obstante, se necesitan estudios más específicos en este ámbito.
Esta revisión presenta algunas limitaciones. Las variaciones en la definición y gravedad de la DA en las diferentes escalas tuvieron implicaciones para la comparabilidad y generalización de nuestros hallazgos. Además, la heterogeneidad de los datos disponibles, incluidas las diferencias en el diseño de los estudios, los métodos de recopilación de datos y las medidas de resultado, complicaron la interpretación de los resultados. Además, las metodologías y las poblaciones diana también difirieron entre los estudios, lo que dio lugar a resultados variables. Se carecía de datos exhaustivos sobre el uso de recursos y los costes asociados a la DA en la población pediátrica, lo que limita nuestra comprensión de la carga económica asociada a la DA.
ConclusionesEsta revisión sistemática proporciona una imagen completa de la carga clínica, humanística y económica de la DA en los pacientes pediátricos en España, que puede ser beneficiosa para los médicos y los responsables de la toma de decisiones sanitarias que manejan esta afección, así como para los investigadores que buscan determinar las lagunas de conocimiento que siguen existiendo y que deben abordarse en futuros estudios de investigación. La alta prevalencia y la aparición precoz ponen de manifiesto la necesidad de una atención integral, centrada en el paciente y adaptada a esta subpoblación. A pesar de la existencia de pautas de tratamiento establecidas, la baja adherencia al tratamiento indica la necesidad de desarrollar estrategias mejores y más eficaces. Por otro lado, la terapia biológica, incluidos los nuevos tratamientos disponibles y los inhibidores de JAK de molécula pequeña, presentan una oportunidad prometedora para la innovación y la expansión de las intervenciones terapéuticas. A medida que se desarrollen estrategias de tratamiento modernas y eficaces, deberán tenerse en cuenta estos factores clave para mejorar los resultados de los pacientes.
AutoríaRosa Moro, Silvia Díaz-Cerezo, Luis Lizán y Mercedes Núñez contribuyeron a la concepción del trabajo, el diseño, la adquisición y el análisis de los datos. Todos los autores participaron en la interpretación de los datos para el trabajo, la revisión crítica del manuscrito y aprobaron la versión final presentada.
FinanciaciónEli Lilly patrocinó este estudio y la publicación de este artículo.
Responsabilidades éticasEste artículo se basa en estudios realizados previamente y no contiene ningún estudio nuevo con participantes humanos o animales realizado por ninguno de los autores.
Conflicto de interesesAntonio Torrelo Fernández es miembro del consejo asesor de Eli Lilly y Viatris, ha recibido honorarios como conferenciante de Eli Lilly, Viatris, Pfizer, Sanofi y Novartis, y honorarios por asistencia a reuniones de Sanofi y Pierre Fabre.
Asunción Vicente es miembro del consejo asesor de Eli Lilly y Amryt, ha recibido honorarios por consultoría de Abbvie, Amgen, Amryt, Boehringer Ingelheim, Bristol-Myers Squibb, Eli Lilly, Novartis, Pierre Fabre y Sanofi Genzyme, honorarios por conferencias de Abbvie, Amgen, Amryt, Boehringer Ingelheim, Bristol-Myers Squibb, Ferrer, Galderma, Janssen, Eli Lilly, Novartis, Pierre Fabre, Pfizer y Sanofi Genzyme y honorarios por asistencia a reuniones de Abbvie, Almirall, Amgen, Amryt, Boehringer Ingelheim, Bristol-Myers Squibb, Ferrer, Galderma, Eli Lilly, Novartis, Pierre Fabre, Pfizer y Sanofi Genzyme.
Ana Martín-Santiago ha recibido honorarios como ponente de Abbvie, Amgen, Leo-Pharma, Leti, Novartis, Pfizer y Sanofi, pagos por su testimonio como experta de Abbvie, Amryt, Leo-Pharma, Pfizer y Sanofi, y honorarios por asistir a reuniones de Abbvie, Almirall, Janssen, Leo-Pharma, Leti, Eli Lilly, Novartis, Pfizer, Pierre Fabre, Sanofi, UCB y Viatrix. Raúl de Lucas Laguna es miembro del consejo asesor de Novartis, Abbvie, Lilly, Pfizer, Sanofi, Leo-Pharma, Johnson & Johnson, UCB, Almirall, Galderma, LetiPharma, ha recibido honorarios como consultor de Novartis, Abbvie, Lilly, Pfizer, Sanofi, Leo-Pharma, Johnson & Johnson, UCB, Almirall, Galderma, y LetiPharma, honorarios como conferenciante de Novartis, Abbvie, Lilly, Pfizer, Sanofi, LetiPharma, Johnson & Johnson, UCB, Almirall, Galderma, y LetiPharma, pagos por su testimonio como experto de Novartis, Abbvie, Lilly, Pfizer, Sanofi, LetiPharma, Johnson & Johnson, UCB, Almirall, Galderma y LetiPharma, y ayudas para asistir a reuniones de Novartis, Abbvie, Lilly, Pfizer, Sanofi, Leo-Pharma, Johnson & Johnson, UCB, Almirall, Galderma y LetiPharma.
José Carlos Armario Hita es miembro del consejo asesor de Abbvie, Novartis, Lilly, Sanofi, Galderma, Leo-Pharma, Janssen, Pfizer, UCB farma, y Almirall, ha recibido honorarios por consultoría de Abbvie, Novartis, Lilly, Sanofi, Galderma, Leo-Pharma, Janssen, Pfizer, UCB farma, Almirall, honorarios como ponente de Abbvie, Novartis, Lilly, Sanofi, Galderma, Leo-Pharma, Janssen, Pfizer, UCB farma, Almirall, y honorarios por asistencia a reuniones de Abbvie, Novartis, Lilly, Sanofi, Galderma, Leo-Pharma, Janssen, Pfizer, UCB farma y Almirall. Rosa Moro, Silvia Díaz-Cerezo y Mercedes Núñez son empleadas de Eli Lilly. Luis Lizán trabaja como consultor científico independiente (Outcomes’10) y declaró haber recibido honorarios por realizar las tareas de revisión sistemática de la literatura y redacción del manuscrito.
La asistencia en la metodología y la preparación editorial de este artículo fue proporcionada por Outcomes’10. Los autores agradecen a Patricia Felip, Ana Causanilles y Héctor David de Paz su ayuda durante las tareas de análisis de datos y redacción médica.