El factor fundamental en la alteración de la respuesta inmune en la inflamación sistémica es la liberación de una gran cantidad de mediadores pro y antiinflamatorios, principalmente citocinas. No obstante, todavía no hay artículos sobre los cambios similares en la piel, un órgano que juega un papel importante en el mantenimiento de la homeostasis inmunológica.
En nuestro estudio utilizamos ratones sexualmente maduros de la población C57BL/6 (30-35g; 12semanas: grupoI [experimental; n=40], grupoII [control, n=10]). Los ratones se sometieron al procedimiento cecal ligation and puncture (CLP) para crear las condiciones de sepsis experimental y se retiraron del experimento mediante la administración de dosis altas de anestésico1. Los animales se mantuvieron en el vivero; todas las manipulaciones se llevaron a cabo conforme a la guía sobre el cuidado y utilización de los animales de laboratorio del National Institutes of Health (NIH Publications No. 8023, revisado 1978).
El estudio inmunohistoquímico (IHC) se realizó según el protocolo estándar en modo automático en un Inmunohistostainer Bond-Max (Leica, Alemania) usando los anticuerpos primarios de conejo (Abcam, EE.UU.): TGF-β, IL-12, IL-10, IL-6, CD206, CD163, CD68; los anticuerpos secundarios fueron los universales (HiDefDetection™HRPPolymersystem, «Cell Marque», EE.UU.). El número de células positivas se evaluó en 10 campos de visión seleccionados al azar con un aumento ×400 (en %). Los datos obtenidos se procesaron utilizando el paquete de software estadístico SPSS 7.5 para Windows (IBM Analytics, EE.UU.).
Los animales del grupo experimental murieron por desarrollar una sepsis durante los primeros 3días. Se encontraron manifestaciones clínicas de sepsis en aproximadamente el 90% de los ratones durante el período de observación.
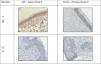
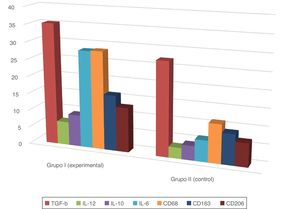
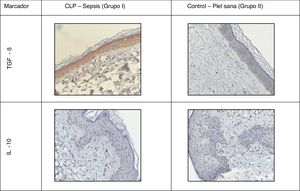
En todas las muestras de piel estudiadas se encontró una reacción inmunohistoquímica positiva a los marcadores mencionados, pero el grado de gravedad de la sepsis fue mayor que en el grupo control con la piel sana (tabla 1; figs. 1 y 2).
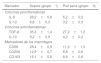
La proporción de células de piel inmunopositivas en ratones con sepsis y en piel sana (%)
| Marcador | Sepsis (grupoI) | Piel sana (grupoII) |
|---|---|---|
| Citocinas proinflamatorias | ||
| IL-6 | 28,2±0,8 | 6,2±0,2 |
| IL-12 | 6,8±0,3 | 3,2±0,3 |
| Citocinas antiinflamatorias | ||
| TGF-β | 35,3±1,4 | 27,2±1,2 |
| IL-10 | 9,2±0,9 | 4,2±0,2 |
| Marcadores de los macrófagos | ||
| CD68 | 28,4±0,9 | 11,2±1,3 |
| CD206 | 12,9±0,7 | 6,8±0,6 |
| CD163 | 16,1±0,8 | 8,9±0,8 |
La distribución de TGF-β se mantuvo predominantemente intracelular. En la piel sana se observó una tinción moderada en todas las capas de la epidermis y la dermis, con un ligero aumento en el área de los folículos pilosos. En los casos de sepsis, se reveló un aumento en la intensidad de la tinción debido a la migración de macrófagos.
Además, en la epidermis de los animales con sepsis se encontró un aumento en la proporción de células inmunopositivas a interleucinas en comparación con el grupo control: IL-10, 2,2 veces; IL-6, 4,5 veces; IL-12, 2,2 veces.
Las reacciones IHC mediante la fenotipicación de los macrófagos también mostraron un aumento en la proporción de células inmunopositivas en sepsis en comparación con el grupo control: CD68, 2,5 veces; CD163, 1,8 veces; CD206, 1,9 veces. La distribución de CD163 permaneció predominantemente intradérmica, mientras CD68 y CD206 se visualizó en la dermis y la epidermis.
Se supone que el aumento de las citocinas proinflamatorias en la piel durante la inflamación sistémica puede tener un efecto negativo en las propiedades cutáneas defensivas y provocar diversas enfermedades, tanto locales como sistémicas. No obstante, en nuestro estudio no se encontraron trastornos morfológicos o funcionales de la piel ni signos de enfermedades de la piel, posiblemente porque las citocinas antiinflamatorias neutralizan los efectos inflamatorios2,3.
Como se sabe, el TGF-β secretado por los macrófagos inhibe las célulasT CD4 y CD8 y algunos tipos de célulasB, evitando así la respuesta autoinmune del cuerpo durante la inflamación4. El aumento detectado de TGF-β en el foco de inflamación es más probable que sea de carácter compensatorio y se produzca en respuesta a una mayor cantidad de mediadores proinflamatorios.
La diferenciación de macrófagos hacia el fenotipo M1 se caracteriza por el aumento del nivel de interleucinas proinflamatorias (IL-6, IL-12) junto con una prevalencia de las células CD68+ sobre CD206+ y CD163+, lo que hemos encontrado en la inflamación sistémica. En general, se acepta que IL-6 activa una respuesta inmune mediada por Th-2, mientras IL-12 activa la diferenciación de Th-1, lo que altera la función de barrera cutánea5,6. IL-10, por su parte, inhibe la reactivación de las célulasT, lo que previene los cambios autoinmunes masivos7.
Basándose en los resultados de nuestro trabajo, se puede suponer que la epidermis participa en el proceso inflamatorio general debido a un cambio en el equilibrio de las citocinas hacia el predominio de los mediadores proinflamatorios y macrófagos M1. No obstante, es necesario seguir estudiando la interacción de los mediadores, ya que un aumento en la cantidad de IL-6 e IL-12 se puede desarrollar en la disfunción cutánea8. También suponemos que no se detectan los cambios destructivos autoinmunes más profundos en la piel debido a que en la sepsis severa el daño a los órganos vitales ocurre mucho más rápido y conlleva un fallo orgánico múltiple.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.