El lupus eritematoso túmido (LET) es una forma rara de lupus eritematoso cutáneo (LEC) con vínculos inciertos con el lupus eritematoso sistémico (LES). Estudiamos retrospectivamente a 34 pacientes con LET entre 2007 y 2019. La mayoría eran mujeres (52,9% 18/34) (mediana de edad de 53,5 años). El 52,9% (18/34) presentaba trastornos autoinmunitarios o reumatológicos y el 26,5% (9/34), otras variantes de LEC. Tres pacientes (8,2%) desarrollaron LES. El 64,7% (22/34) presentaba autoanticuerpos. La inmunohistoquímica de CD123 fue positiva en el 75,9% (22/34) y la inmunofluorescencia directa (IFD) en el 31,8% (7/22). El tratamiento incluyó agentes tópicos (100%), antipalúdicos (73,5%), corticoides orales (23,5%) y otros inmunosupresores (14,7%). Todos alcanzaron la remisión clínica. Una respuesta tardía (>3 meses) se asoció a la presencia de LES (p=0,002) y de anticuerpos anti-ADN (p=0,003).
El LET suele asociarse con trastornos autoinmunitarios y autoanticuerpos. CD123 e IFD podrían ser útiles para el diagnóstico. Puede requerirse tratamiento sistémico, especialmente en casos de LES y presencia de anticuerpos anti-ADN.
Lupus erythematosus tumidus (LET) is a rare form of cutaneous lupus erythematosus (CLE) with a controversial connection to systemic lupus erythematosus (SLE). We conducted a retrospective study with 34 LET patients in a Spanish tertiary referral center from 2007 to 2019. Most were women (52.9% [18/34]), with a median age of 53.5 years. Autoimmune or rheumatologic disorders were reported in 52.9% (18/34) of cases, and other CLE variants in 26.5% (9/34). SLE occurred in 8.82% (3/34), while 64.7% (22/34) had autoantibodies. Immunohistochemical CD123 testing tested positive in 75.9% (22/34), while direct immunofluorescence (DIF) showed positivity in 31.8% (7/22) of cases. Treatment included topical agents (100%), antimalarials (73.5%), oral corticosteroids (23.5%), and immunosuppressants (14.7%). All achieved clinical remission, but a delayed response (>3 months) was linked to SLE (P=.002) and anti-DNA antibodies (P=.003).
LET usually associates with autoimmune disorders and autoantibodies. CD123 and DIF aid diagnosis, and systemic treatment may be needed, especially with SLE and anti-DNA antibodies.
El lupus eritematoso túmido (LET) es una variante rara y controvertida del lupus eritematoso cutáneo (LEC), caracterizado por pápulas y placas eritematosas no cicatriciales predominantemente en el rostro y el tronco. Se ha reportado que su asociación con los trastornos autoinmunes o el lupus eritematoso sistémico (LES) es extremadamente rara1,2 y existen solo unas pocas series grandes descritas en la literatura1-3. Nuestro objetivo fue describir las características clínico-epidemiológicas e histológicas, los hallazgos de la inmunofluorescencia directa (IFD) y la respuesta terapéutica al LET.
Materiales y métodosPacientesRealizamos un estudio retrospectivo con pacientes de LET diagnosticados en el Departamento de Dermatología de un centro de referencia terciario español, de enero del 2007 a mayo del 2019. Se registraron las características clínico-epidemiológicas, las comorbilidades, los hallazgos histológicos y de IFD y la respuesta al tratamiento. El diagnóstico de LET se basó en las características clínicas tales como la presencia de pápulas y placas eritematosas no cicatriciales localizadas predominantemente en las zonas expuestas al sol, junto con las características histológicas tales como edema dérmico, infiltración linfocítica perivascular y perianexial y depósito de mucina intersticial.
El diagnóstico de LES se basó en los criterios de clasificación de la European League Against Rheumatism (ELAR)/American College of Rheumatology (ACR) del 2019. Se supervisó a todos los pacientes durante 6 meses, al menos. La respuesta al tratamiento se definió como respuesta clínica temprana (RCT) o respuesta tardía (RT) cuando se logró en un plazo de 3meses, o con posterioridad al mismo, respectivamente.
Resultados de las pruebas de laboratorioSe realizaron pruebas de autoanticuerpos utilizando una técnica de inmunofluorescencia indirecta estándar. Se calcularon anti-dsDNA (anti-ADN de doble cadena, anti-La y anti-Ro) mediante pruebas ELISA estandarizadas.
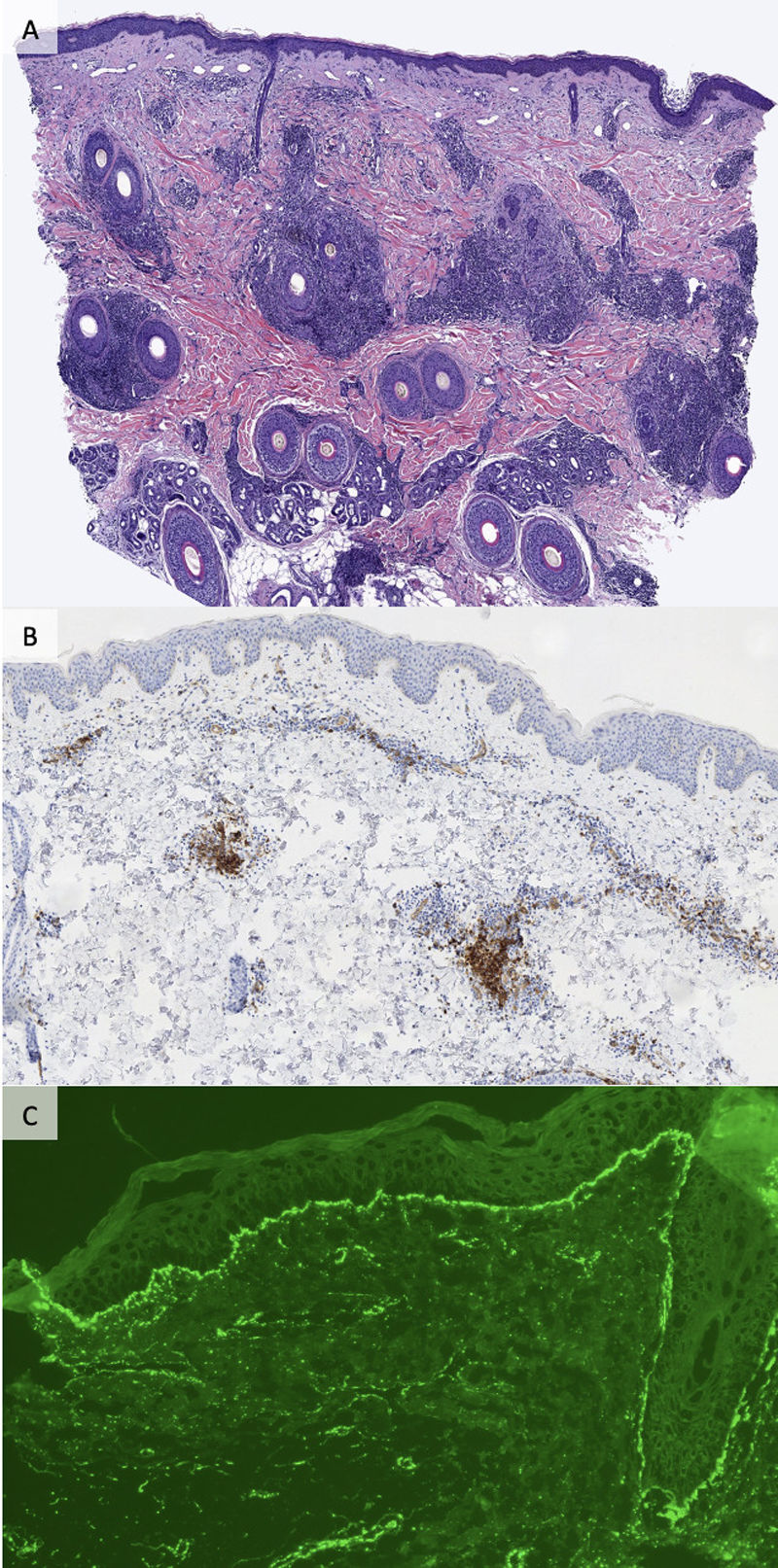
Estudios histopatológicos e inmunohistoquímicosSe evaluaron los cambios de la unión dermoepidérmica, el tipo y patrón del infiltrado inflamatorio, la presencia de depósito de mucina intersticial y la reactividad de la tinción inmunohistoquímica de CD123 por parte de un dermopatólogo experto (AGH). Se utilizaron hierro coloidal o azul alcián para detectar la presencia de mucina. Se definió la positividad para CD123 como la presencia de clústeres de células dendríticas plasmacitoides de CD123+(PDC) dispuestos en agregados de ≥ 15 CD123+PDC.
Inmunofluorescencia directaSe tiñeron secciones de criostato de 4micrómetros, obtenidas de biopsias cutáneas de piel afectada con anticuerpos policlonales conjugados con fluoresceína isotiocianato frente a IgA, IgG, IgM y C3 humano, conforme a las pruebas clínicas rutinarias.
Análisis estadísticoLas características clínico-epidemiológicas y los resultados se expresaron como frecuencias. El uso de terapia sistémica con corticoides o inmunosupresores y la respuesta al tratamiento se analizaron utilizando la prueba unidireccional de varianza ANOVA de Kruskal-Wallis. Se consideró estadísticamente significativo un valor p<0,05. Los análisis se realizaron mediante el software SPSS versión 18.0 (SPSS Inc., Chicago, IL, EE. UU.).
Resultados (Anexo)Características clínico-epidemiológicasSe incluyó un total de 34 pacientes (52,9% [18/34] mujeres). La edad media fue de 53,5 años (rango, 31-78). El seguimiento clínico medio fue de 47 meses (rango, 6-240). Todos los pacientes presentaron lesiones típicas de LET (placas o pápulas eritematosas sin cicatrices). Las lesiones se localizaron en la espalda ([82,4%] [28/34]) y el rostro ([58,8%] [20/34]) en muchos pacientes. La demora diagnóstica media fue de 6 meses (rango, 1-312).
Comorbilidades (tabla 1): se encontraron trastornos autoinmunes o reumatológicos en el 52,9% (18/34) de los pacientes, siendo el síndrome de Sjögren el más frecuentemente detectado (17,4% [6/34] de los casos). Se observaron otras variantes de LEC en el 26,5% (9/34) de los pacientes. De ellos, el 66,7% (6/9) de los casos fueron diagnosticados de LEC subagudo (LECS), el 44,4% (4/9) de lupus eritematoso discoide (LED) y el 22,2% (2/9) de perniosis lúpica. Se observó asociación con LES —de acuerdo con los criterios de clasificación de EULAR/ACR de 2019— en el 8,82% (3/34) de los individuos: 2con compromiso articular y renal concomitante y uno con compromiso pulmonar y articular. Se detectó al menos un autoanticuerpo positivo en el 64,7% (22/34) de los pacientes: anticuerpos antinucleares (ANA) positivos (títulos>1/80) en el 90,9% (20/22) de dichos casos, anticuerpos anti-ADN en el 22,7% (5/22), anti-Ro en el 40,9% (9/22) y anti-RNP en el 9,1% (2/22) (tabla 1).
Características clínico-epidemiológicas, comorbilidades autoinmunológicas/reumatológicas y presencia de autoanticuerpos en los pacientes con lupus eritematoso túmido
| Características | Valora |
|---|---|
| Sexo | |
| Hombres | 16 (47,1) |
| Mujeres | 18 (52,9) |
| Edad | |
| < 40 años | 3 |
| 40-50 años | 10 |
| >50 años | 21 |
| Mediana | 53,5 y (rango, 31-78) |
| Edad al inicio (LET) | |
| Mediana | 47 y (rango, 30-65) |
| Demora diagnóstica | |
| Mediana | 6 m (rango, 1-312) |
| Seguimientoclínico | |
| Mediana | 47 m (rango, 6–240) |
| Distribución de las lesiones cutáneas | |
| Espalda | 28 (82,4) |
| Rostro | 20 (58,8) |
| Brazos | 10 (29,4) |
| Línea del cuello | 6 (17,6) |
| Fumadores | |
| Sí | 13 (54,2) |
| No | 11 (45,8) |
| Sin datos | 10 |
| Presencia de autoanticuerpos | |
| Sí | 22 (64,7) |
| ANA | 20 (90,9) |
| Anti-ADN | 5 (22,7) |
| Anti-Ro | 9 (40,9) |
| Anti-RNP | 2 (9,1) |
| No | 12 (35,3) |
| Títulos de ANA | |
| 1/80 | 1 (5) |
| 1/160 | 11 (55) |
| 1/320 | 3 (15) |
| 1/640 | 4 (20) |
| 1/1280 | 1 (5) |
| Total | 20 (100) |
| LES | |
| Sí | 3 (8,8) |
| No | 31 (91,2) |
| Otras variantes de LECS | |
| Sí | 9 (26,5) |
| LECS | 6 (66,7) |
| LED | 4 (44,4) |
| Perniosis lúpica | 2 (22,2) |
| No | 25 (73,5) |
| Trastornosautoinmunes/reumatológicos | |
| Sí | 18 (52,9) |
| Síndrome de Sjögren | 6 (33,3) |
| Artritis reumatoide | 5 (27,8) |
| Artritis seronegativa | 5 (27,8) |
| Espondilitis anquilosante | 1 (5,6) |
| Vasculitis de vasos pequeños | 1 (5,6) |
| No | 16 (47,1) |
a: años; ANA: anticuerpos antinucleares; LECS: lupus eritematoso cutáneo subagudo; LED: lupus eritematoso discoide; LES: lupus eritematoso sistémico; LET: lupus eritematoso túmido; m: meses.
Se evidenció infiltrado linfocítico inflamatorio perivascular y presencia de mucina intersticial en el 100% (34/34) de las muestras (tabla 2). Se observó compromiso leve de la unión dermoepidérmica con vacuolización focal de la capa basal en el 14,7% (5/34) de los casos. Se realizó estudio inmunohistoquímico de CD123 en 29 muestras, reflejando positividad en el 75,9% (22/29) de los casos. Se realizó IFD en el 64,7% (22/34) de los casos, resultando positivo el 31,8% (7/22) de los mismos. Los patrones más comunes observados fueron depósito homogéneo de IgG y depósito granular de C3 en la membrana basal (5/7).
Hallazgos histológicos y de inmunofluorescencia directa y terapia requerida para lograr la respuesta clínica completa en los pacientes con lupus eritematoso túmido
| Hallazgos histológicos y de inmunofluorescencia directa | N (%) |
|---|---|
| Vacuolización de la capa celular basal | |
| Sí | 5 (14,7) |
| No | 29 (85,13 |
| Presencia de vasculitis | |
| Sí | 0 (0) |
| No | 36 (100) |
| Infiltradoinflamatorio linfocítico perivascular | |
| Sí | 34 (100) |
| Leve | 3 (8,8) |
| Demoderado a intense | 31 (91,2) |
| No | 0 (0) |
| Mucina | |
| Sí | 34 (100) |
| Leve | 3 (8,8) |
| De moderada a intensa | 31 (91,2) |
| No | 0 (0) |
| CD123 | |
| Positivo | 22 (75,9) |
| Negativo | 7 (24,1) |
| No realizado | 5 |
| IFD | |
| Positivo | 7 (31,8)a |
| Negativo | 15 (68,2) |
| No realizado | 12 |
| Tratamiento | |
| Uso exclusivo de CS o CI tópico | 8 (23,5) |
| Solo antimaláricos | 16 (47,1) |
| Antimaláricos+CS oralb | 5 (14,7) |
| Antimaláricos+CS oral+inmunosupresoresc | 2 (5,9) |
| Oral CS+inmunosupresoresd | 2 (5,9) |
| Respuesta al tratamiento | |
| RCC | 34 (100) |
| PR | 0 (0) |
| Sin respuesta | 0 (0) |
| Tiempo hasta la RCC | |
| < 3 meses | 27 (79,4) |
| ≥ 3 meses | 7 (20,6) |
CI: inhibidores de calcineurina; CS: corticoides; IFD: inmunofluorescencia directa; N: número; RCC: respuesta clínica completa; RP: respuesta parcial.
Cinco casos mostraron un depósito homogéneo de IgG y C3 granular en la membrana basal. En un caso existieron depósitos granulares de C3 alrededor de los vasos y en otra muestra depósitos perivasculares de IgM.
Aunque todos los pacientes lograron una respuesta clínica completa (RCC), se requirieron agentes terapéuticos múltiples. Se observó RCT en el 79,4% (27/34) de los pacientes y RT en el 26,5% (9/34) de los casos. Todos los pacientes con LES (3/3) y el 80% (4/5) de los individuos con anticuerpos anti-ADN presentaron RT.
Todos los individuos recibieron tratamiento tópico (corticoides o inhibidores de calcineurina). La RCC se logró exclusivamente con tratamiento tópico en el 23,5% de los casos (8/34), reflejando todos ellos RCT. Se prescribieron antimaláricos en el 73,5% de los casos (25/34), corticoides orales en el 23,5% (8/34) e inmunosupresores en el 14,7% (5/34) (micofenolato [1/5], metotrexato [1/5], azatioprina+metotrexato [1/5] y micofenolato+metotrexato [2/5]).
En cuanto a los pacientes que recibieron antimaláricos, el 45,7% (16/25) recibieron estos en exclusividad. Se observó respuesta parcial (RP) en el 81,3% (13/16) y RCC en el 18,7% (3/16). El 20% (5/25) recibió antimaláricos y corticoides orales, con RP en el 40% (2/5) y RCC en el 60% (3/5). Dos pacientes recibieron antimaláricos e inmunosupresores (metotrexato o micofenolato) y lograron RCC; otros 2pacientes recibieron antimaláricos, corticoides orales e inmunosupresores (metotrexato o micofenolato), con RP en un paciente, y RCC en el otro. Solo un caso fue tratado exclusivamente con corticoides orales e inmunosupresores (azatioprina y metotrexato, dado que el paciente tenía artritis reumatoide) y reflejaron RP.
La RP se asoció significativamente a la edad<50 años (p=0,034). RT se asoció significativamente a la presencia de LES (p=0,002) y anticuerpos anti-ADN (p=0,003). La respuesta terapéutica no estuvo asociada al sexo, consumo habitual de tabaco, edad de presentación de LET, concomitancia con otros tipos de LEC o enfermedades autoinmunes, ni a la presencia de anticuerpos antinucleares, anti-Ro o anti-RNP, o positividad para CD123 o inmunofluorescencia.
DiscusiónEl LET afecta a hombres y mujeres en proporción similar1,4, que también se observó en nuestra serie. La presentación clínica de nuestra serie fue consistente con los datos previamente descritos en la literatura que exhiben placas o pápulas eritematosas y edematosas no cicatriciales en el rostro, el tronco o las extremidades superiores5. En cuanto a la asociación con enfermedades autoinmunes, se ha reportado que el LET está raramente asociado al LES o a la presencia de autoanticuerpos circulantes1,4,5. Sin embargo, Schmitt et al.6 reportaron que el > 40% de los pacientes de LET tuvieron anticuerpos antinucleares positivos y el 20% de ellos presentaron LES. En nuestra serie observamos que muchos pacientes tuvieron autoanticuerpos circulantes, más frecuentemente ANA (títulos>80), diagnosticándose LES en el 9% de los casos. Además, se observaron otras variantes de LEC en > 25% de los pacientes. Sorprendentemente, se observaron trastornos autoinmunes/reumatológicos en la mitad de los individuos. Dichos hallazgos sugieren que el trasfondo autoinmune en el LET puede ser mayor al descrito previamente.
Los hallazgos histológicos en nuestra serie fueron similares a los reportados previamente, como la presencia de infiltrado inflamatorio linfocítico perivascular y de depósito de mucina en muchos casos, y los cambios de la unión dermoepidérmica en una minoría de muestras2,4-7, aunque esta tasa puede elevarse al 50%4,8.
La tinción de CD123 permite la identificación de los PDC y puede utilizarse en el diagnóstico de LEC9,10, aunque la evidencia sobre su uso en el LET es escasa5,10. Observamos positividad para CD123 (con patrón perivascular) en casi el 80% de los casos con LET. Pensamos que CD123 puede resultar una herramienta diagnóstica útil en los casos difíciles de LET.
Puede utilizarse IFD para el diagnóstico de LEC5,7. A pesar de haberse reportado que la IFD es negativa para el LET, se ha descrito su positividad en un porcentaje variable de casos, que fluctúan de < 10%2 hasta > 50%5,7. En nuestra serie, la positividad mediante IFD se observó en > 30% de las muestras. El depósito homogéneo de IgG y granular de C3 en la membrana basal fueron los patrones más frecuentes. Consideramos que IFD puede ser una técnica útil para el diagnóstico de LET y ayudar a diferenciarlo de otras dermatosis con presentación clínica similar5. Sin embargo, dichos resultados deberán interpretarse con cautela, ya que IFD resultó positiva en solo 7 de 22 pacientes.
En cuanto al tratamiento, muchos autores sugieren que la respuesta clínica es buena y rápida1 y que el LET puede resolverse incluso espontáneamente en el 40% de los casos6. La fotoprotección, la administración de corticosteroides o tópicos o los inhibidores de calcineurina son las terapias de primera línea, junto con los antimaláricos1,4,8. En nuestra serie, todos los pacientes lograron la RCC, aunque requirieron diversos agentes terapéuticos. El tratamiento exclusivamente tópico condujo a la RCC en <25% de los casos. Muchos pacientes requirieron tratamiento sistémico, siendo los antimaláricos los más frecuentemente indicados. Se observaron respuestas excelentes en muchos casos. Sin embargo, un cuarto de ellos requirió ≥ 3 meses para lograr la RCC. Se ha descrito previamente la lenta mejora de las lesiones en los pacientes de LET7. Sorprendentemente, casi el 30% de los casos de nuestra serie requirió CS orales o inmunosupresores para lograr la RCC. Más de la mitad de dichos pacientes presentaron trastornos autoinmunes. La edad≤50 años, la ausencia de LES o los anticuerpos anti-ADN circulantes estuvieron asociados a la RCT. Dados dichos hallazgos, consideramos que, en los pacientes mayores o los individuos con LES o anticuerpos anti-ADN, podría considerarse el inicio temprano del tratamiento sistémico.
Las limitaciones de nuestro estudio son su diseño retrospectivo y el número relativamente pequeño de pacientes incluidos, a pesar de ser una de las series de mayor tamaño descritas hasta la fecha.
ConclusionesEl LET puede estar fuertemente asociado a trastornos autoinmunes/reumatológicos y a la presencia de autoanticuerpos. CD123 e IFD pueden resultar útiles para el diagnóstico de LET. Puede ser necesario utilizar corticosteroides sistémicos e inmunosupresores, especialmente para los pacientes con LES o anticuerpos anti-ADN.