Numerosos científicos informan de una tendencia actual al calentamiento global y a la disminución de las precipitaciones. Su cuantía, sus causas y la influencia de la actividad humana son motivo de controversia. Un aumento de la temperatura podría incrementar la prevalencia de algunas patologías cutáneas; más personas padecerían piel sensible y una mayor xerosis cutánea por disminución de la humedad relativa. Las alteraciones de la función de la barrera cutánea aumentarían la gravedad y prevalencia de la dermatitis atópica. La mayor proporción de radiación UVB que alcanza la superficie terrestre, unida a hábitos poblacionales de aumento de fotoexposición, junto con una fotoprotección incorrecta, hacen esperables mayores tasas de cáncer cutáneo y de fotoenvejecimiento. Además, los hábitats de diversos vectores de patologías infecciosas están cambiando. Afrontar estos problemas, en caso de que se produjesen, será un reto para el dermatólogo, que tendrá una importante labor de prevención, diagnóstico y tratamiento precoz de estas patologías.
Scientifics are warning us about a global warming tendency and diminished rainfalls. Quantity, causes and human activity influence remain controversial. Warming could increase prevalence of some cutaneous pathology. Sensible skin and skin xerosis would be more prevalent if relative humidity decreases. Alterations of skin barrier`s function would increase seriousness and prevalence of atopic dermatitis. Furthermore, the higher UVB proportion reaching Earth′s surface, in conjunction with increased sunbathing population habits, will increase cutaneous cancer and photoaging rates without a correct photoprotection. Also, habitats of some infectious diseases` vectors are changing. The facing of these problems will be a real challenge for the dermatologist, who will have a very important role on prevention, diagnoses and early treatment of them.
Se han escrito numerosos artículos basados tanto en observaciones como en diferentes modelos predictivos de cómo el cambio climático puede afectar a los sistemas sociales, económicos y sanitarios de los seres humanos, pero hay pocos estudios centrados en averiguar cómo puede afectar a nuestra piel.
Cambio climático: verdades y mentirasAntes de plantearnos las implicaciones del cambio climático sobre la piel conviene hacer una breve reseña del estado de conocimiento actual sobre dicho tema.
El último Panel Intergubernamental de 2007 estima un aumento de temperatura de entre 1,1°C y 6,4°C en el periodo comprendido entre 1990 hasta 21001, ejemplificando su importancia con datos como que el verano de 2003 fue el más cálido de los últimos 500 años2. La responsabilidad humana es un tema muy debatido; los que la consideran determinante argumentan que el aumento de temperatura es proporcional al de emisiones de los conocidos como gases con efecto invernadero (dióxido de carbono, metano, gases clorofluorocarbonados [CFC] y óxido nitroso, principalmente)3; otros autores, posicionados en contra, argumentan que la temperatura atmosférica depende también de otros factores como la actividad solar y la termorregulación de los océanos y otras masas de agua, o que desconocemos la relación entre los diversos factores4,5. También se ha predicho un aumento global de los eventos climáticos extremos (olas de calor, frío extremo, ciclones, etc.), si bien el tipo y la intensidad podrían ser muy diferentes en función de las características ambientales de los distintos países y continentes6.
Poco se sabe de la precisión de los modelos predictivos meteorológicos, en especial a largo plazo7. Además, las mediciones climatológicas fiables no son globales y no se remontan más allá de un siglo8. Así, resulta fácil encontrar en revistas de impacto datos contrapuestos a lo comúnmente divulgado por los medios de comunicación acerca del estado de los glaciares9, o las consecuencias económicas de eventos climáticos extremos como El Niño10. Valga como ejemplo la noticia recientemente publicada del uso de trifluoruro de nitrógeno, gas con un potente efecto invernadero11, en la fabricación de, entre otros productos, paneles solares.
Aclarar hasta qué punto hay un verdadero calentamiento global inducido por la actividad humana, o en qué proporción los eventos registrados se engloban en los patrones de variabilidad climática habituales, va más allá del propósito de este artículo y requerirá, probablemente, de numerosas mejoras en los sistemas de inferencia climatológicos y de un concienzudo estudio.
Respecto a la humedad ambiental se supone que el aumento de la temperatura y los cambios en la biomasa vegetal, secundarios al incremento de CO2,cambiarán los patrones de precipitaciones ocasionando un mayor número de eventos climatológicos extremos, con sequías e inundaciones más intensas6. Los patrones de pluviosidad están mucho más influenciados por las condiciones locales que la temperatura12, y resulta aún más arriesgado realizar estimaciones globales sobre ellos.
Aumento de temperatura y pielLos efectos de la temperatura sobre la piel se pueden clasificar en directos (acción física, como quemaduras) e indirectos (a través de las alteraciones de la distribución de vectores de diversas enfermedades, cambios en la humedad relativa ambiental y otros). Aunque pueden existir tendencias globales, la temperatura presenta importantes variaciones en función de la climatología local.
Calentamiento global y enfermedades mediadas por vectoresSe han observado variaciones recientes de la distribución geográfica de vectores de algunas enfermedades (malaria, dengue, leishmaniosis, enfermedades trasmitidas por garrapatas, etc.) y se ha planteado su posible relación con alteraciones climatológicas. Uno de los fenómenos más conocidos de variabilidad climática natural, «El Niño», también conocido como oscilación austral, aumenta en un 30% el número de casos de malaria en Venezuela y Colombia, y permite su aparición en lugares como el norte de Pakistán13. «El Niño» altera también la incidencia de encefalitis del Valle de Murray, de fiebre del Valle del Rift y de leishmaniasis visceral en diversas zonas geográficas13.
La temperatura es un factor crítico en la capacidad epidémica de una enfermedad trasmitida por vectores, ya que de ella depende la densidad vectorial y la capacidad del vector de trasmitir el agente patógeno (afecta a la supervivencia del vector y también condiciona la tasa de crecimiento de la población, modificando la susceptibilidad del mismo a los patógenos, los períodos de incubación del patógeno en el vector y su patrón de transmisión)14. Así, un incremento térmico de casi 2°C ha podido influir en el aumento de la temporada de cría de muchos mosquitos, y en la colonización de latitudes superiores, aunque a partir de determinado límite disminuye la viabilidad del vector. Los mosquitos del género Anopheles tienen una temperatura óptima de desarrollo de entre 20–27°C, y no existe transmisión de Plasmodium spp. con temperaturas mantenidas inferiores a 15°C o superiores a 38°C, ya que la esquizogonia se paraliza14. Como ejemplo, el aumento de temperatura media en Suecia, unido a la construcción de casas rurales (que favorecen el contacto entre el hombre, los vectores y los reservorios de la enfermedad) y a la menor cantidad de predadores del ciervo, se considera una explicación plausible del aumento encontrado de casos de enfermedad de Lyme15. Al afectar a diversos parámetros simultáneamente, el efecto de un incremento de temperatura sobre la incidencia de una enfermedad trasmitida por vectores puede aumentarla en unas zonas y disminuirla en otras8.
En cuanto a la pluviosidad, un incremento de las precipitaciones aumenta la densidad de vegetación, creando microclimas húmedos locales que favorecen la expansión de los insectos y aumentan las fuentes de alimentación de reservorios de patógenos, como los roedores y otros herbívoros14. Pero, por otro lado, las sequías en lugares húmedos producen remansos de agua que aumentan las zonas de cría y la necesidad de las hembras fértiles de alimentarse, incrementando el número de picaduras.
No obstante, los ciclos vitales de los insectos y artrópodos se modifican por otros muchos factores como el uso del terreno, la disponibilidad de agua, los cambios demográficos y las alteraciones de los hospedadores intermedios o de reservorios naturales y, por tanto, es de esperar que estos cambios sean modulados en los distintos lugares por todas estas influencias locales16. El CO2 al estimular el crecimiento de muchas plantas favorece la expansión de los insectos, y el aumento de la urbanización facilita la aparición de epidemias, en especial en condiciones higiénicas deficitarias17. Otros factores, como la deforestación o el uso de determinado tipo de pesticidas tienen efectos más variables.
Dada la compleja interrelación ya esbozada entre factores climáticos, sociales y algunos artrópodos e insectos vectores de enfermedad, resulta difícil encontrar evidencias científicas consistentes que relacionen el cambio climático y la enfermedad, ya que habitualmente se simplifica la relación entre temperatura e incidencia de patología, tomándola como lineal, y sin realizar un análisis estadístico exhaustivo en el que se tengan en cuenta los posibles factores de confusión (mejoría en métodos diagnósticos de la enfermedad, resistencias del vector a antibióticos, humedad ambiental y movimientos demográficos, entre otros)18,19.
Centrándonos en España podría haber un aumento de dengue, encefalitis y fiebres víricas hemorrágicas, fiebre botonosa, enfermedad de Lyme y leishmaniosis. Respecto a la malaria es poco probable que se restablezca en nuestro medio14, ya que el único vector potencial aún presente es Anopheles atroparvus, que es refractario a las cepas tropicales de P. falciparum. No ocurre lo mismo con el Dengue, cuyo vector Aedes albopictus también capaz de trasmitir algunos arbovirus, que se detectó en Europa en 1979 y en España en 2004.
No obstante, independientemente de la influencia del clima y de los hechos ya reseñados, es esperable un aumento de la incidencia de este tipo de patologías en nuestro medio debido al continuo incremento de la movilidad geográfica de la población.
Alteración de algunas características cutáneasEl término «piel sensible» ha sido considerado por algunos autores como una disminución de la tolerancia cutánea al uso de productos cosméticos y de limpieza habituales20, si bien podría definirse en un sentido más amplio como una piel que produce sensación de quemazón, tirantez o prurito en respuesta a diversos agentes físicos, químicos o psicológicos. En este tipo de pieles está descrita una mayor pérdida transepidérmica de líquido, que altera la barrera cutánea, produciendo mayor contacto con los alérgenos. También se ha propuesto una alteración neurocutánea como responsable de las sensaciones anormales que la acompañan21. Su prevalencia puede alcanzar hasta un 40% en varones y un 60% en mujeres, siendo más frecuente en verano y en fototipos claros22. Numerosos factores climáticos tales como la sequedad ambiental, el viento, el frío, el sol, los cambios bruscos de temperatura, el uso de aire acondicionado y la polución ambiental son considerados por los pacientes como factores desencadenantes importantes22, en especial entre sujetos de raza caucásica23. Por tanto, el aumento de prevalencia estacional de esta entidad con el calor, así como sus numerosos eventos físicos desencadenantes, hace esperable un aumento de las consultas dermatológicas relacionadas con este problema.
La temperatura ambiental externa, más fría en invierno, se asocia con una respuesta vasoconstrictora cutánea que produce una temperatura cutánea basal menor y el requerimiento de tiempos mayores para alcanzar una temperatura dada. Dicha vasoconstricción, que se cree mediada principalmente por GMPc es más intensa en mujeres y, en especial, en pacientes con fenómeno de Raynaud. Como consecuencia de la misma se produce una peor irrigación de las partes acras24. Un aumento medio de temperatura podría disminuir el número de fenómenos de Raynaud y mejorar la irrigación de los territorios acrales aunque, probablemente, este efecto tenga una escasa relevancia clínica si se producen mayor número de eventos climatológicos extremos.
La secreción sebácea es mayor en los meses más cálidos y en los pacientes más jóvenes25. Además, hay varios estudios publicados en los que se observa que entre un 30 y un 50% de los mismos empeoran en el verano debido al incremento del sudor26,27. Por tanto, existe la posibilidad de que asistamos a un aumento de la incidencia y, sobre todo, de la sintomatología del acné, si bien es difícil realizar predicciones en este campo.
El crecimiento de muchas especies vegetales se ve estimulado por el incremento del CO2 atmosférico, entre ellas la hiedra venenosa, planta cuya toxina (uroshiol) produce eccema agudo irritativo de contacto en un alto porcentaje de expuestos, y posee además mayor poder alergénico en presencia de más cantidad de CO2 atmosférico28.
Calentamiento global e infección cutáneaLas piodermitis tienen una mayor prevalencia en zonas más cálidas, especialmente si se acompañan de una alta humedad relativa29–31. Así, en la población marginal negra de áreas del sur de EE.UU. se han comunicado cifras de hasta un 50% de incidencia de infecciones cutáneas de origen bacteriano en niños de 2 a 6 años en los meses cálidos y húmedos, con cifras del 4% de incidencia en invierno32. Desde un punto de vista microbiológico, dado que la mayoría de estas infecciones se producen por flora cutánea habitual, predominan los gérmenes gram positivos y, entre ellos, el Staphylococcus aureus y el Streptococcus pyogenes, agentes etiológicos de la mayoría de estas infecciones33. No obstante, también la colonización cutánea por gérmenes gram negativos se estimula en un ambiente húmedo y cálido34, y además los eventos climatológicos extremos (inundaciones y tsunamis) pueden producir infecciones cutáneas debidas a gérmenes «atípicos» como Vibrio vulnificus, Vibrio parahaemolyticus, Burkholderia pseudomallei y otros, debido a un contacto prolongado con aguas contaminadas35.
Humedad y pielXerosis cutáneaLa «piel seca» posee alteraciones en su funcionalidad y una disminución en el contenido de agua de su capa córnea, que en condiciones óptimas debe oscilar entre un 10–15%. La hidratación cutánea se debe a un mecanismo molecular aún no conocido completamente —como demuestran las dificultades para conseguir una correcta hidratación de los cultivos de epidermis36—pero que se sustenta en la interrelación entre los corneocitos y los lípidos intercelulares. De manera simplificada se puede considerar que hay dos tipos de contenidos acuosos: estáticos y dinámicos. La hidratación estática, también conocida como agua ligada, es la contenida en los corneocitos como consecuencia del poder osmótico de los factores humectantes naturales originados por la degradación enzimática de la filagrina. En cambio, la hidratación dinámica o agua libre se localiza entre las membranas lipídicas intercelulares, y su cantidad depende del gradiente entre el contenido de agua de los queratinocitos del estrato malpighiano y la humedad relativa del ambiente. Como resultado del flujo a este nivel se produce la evaporación del agua en las capas superficiales de la epidermis, que es lo que se conoce como eliminación transepidérmica de agua37.
En un estudio realizado en voluntarios sanos se comprobó que la exposición a bajas humedades relativas (HR) del 10% durante 6h producía una disminución de la cantidad de agua contenida en el estrato córneo, de la pérdida de agua transepidérmica y de la temperatura cutánea38. En este contexto las arrugas de expresión finas se modifican rápidamente, haciéndose más evidentes tras 30min de exposición a un ambiente con baja HR39.
Resumiendo, la baja humedad ambiental (sobre todo de forma aguda), combinada con bajas temperaturas, aumenta la pérdida transepidérmica de agua y disminuye los niveles de lípidos y de factor hidratante natural, produciendo xerosis cutánea. De forma crónica se producen una serie de cambios compensadores, como el engrosamiento de la capa córnea y la mayor síntesis de ceramidas, que evitan, parcialmente, la excesiva deshidratación40.
A pesar de la indudable relación que existe entre la HR y el grado de hidratación cutánea, también participan otros factores, y así numerosos productos como los jabones (sobre todo los que incluyen detergentes aniónicos como el laurilsulfato de sodio, por su capacidad de alterar el pH cutáneo) o fármacos como la clofazimina, los retinoides, los hipocolesterolemiantes, la cimetidina o el carbonato de litio, que disminuyen la secreción de sebo y alteran su composición lipídica, favorecen la sequedad cutánea40.
La edad de los individuos también influencia la hidratación cutánea y la percepción de sequedad. A los mayores de 60 años les afecta más la HR (con HR del 30% se observa sequedad de la piel y de la conjuntiva, con un 10%; además se manifiesta la sequedad de la mucosa nasal con un empeoramiento de la función ciliar), pero subjetivamente necesitan más tiempo para percibirlo y tomar las medidas necesarias41. Asimismo, en las mujeres postmenopáusicas el uso de terapia hormonal sustitutiva mejora la hidratación cutánea, disminuyendo la pérdida transepidérmica de agua42.
Dermatosis de baja humedad y síndrome del edificio enfermoLos niveles óptimos de humedad relativa (HR) se encuentran entre el 40 y el 60%. Se sabe que disminuciones de la HR pueden producir alteraciones cutáneas. Así, las «dermatosis de baja humedad» se describieron en 198043. Estas entidades engloban un grupo de alteraciones cutáneas consistentes en prurito, eritema y xerosis cutánea, especialmente en zonas expuestas, que aumenta a lo largo de la jornada de trabajo y que mejora durante los fines de semana y en vacaciones. Profesiones como la medicina hospitalaria, la fabricación de material informático o la biblioteconomía, desempeñadas habitualmente en entornos en que se debe mantener baja la humedad para evitar la corrosión o la proliferación de agentes biológicos, están especialmente predispuestas44. Recientemente Chou et al compararon las analíticas y los cuestionarios de síntomas a lo largo de tres años de 12 varones que trabajaban en entornos de HR muy baja (HR: 1,5%) con los de controles apareados por edad, y comprobaron también una mayor incidencia de prurito cutáneo y de alteraciones en los miembros inferiores que fueron diagnosticadas como eccema de contacto45.
Relacionado con esto está también el síndrome del edificio enfermo, que agrupa una serie de problemas inespecíficos tales como cefaleas, mareos, náuseas y prurito cutáneo y ocular. Respecto a esta entidad se postula un origen multifactorial que agrupa: contaminantes ambientales (polvo, humos, olores, irritantes), climatización subóptima (baja HR, flujo de aire acondicionado alto, excesiva temperatura) y factores psicológicos (es más prevalente en mujeres con puestos no cualificados y en personas bajo condicionantes físicos o psicológicos estresantes)46. En muchas ocasiones es difícil encontrar una causa concreta y las mejoras ambientales no palian el problema, por lo que algunos lo consideran una neurosis de renta47. Se considera que estas alteraciones provocan una disminución del rendimiento y absentismo en cerca del 20–40% de los trabajadores expuestos.
Por último, cabe comentar que en otros entornos en los que se asocian contaminantes ambientales y condiciones de baja humedad también se han identificado este tipo de problemas; valgan como ejemplo las recientemente denominadas dermatitis de la tripulación de aviones48.
Influencia en algunas dermatosis crónicasLos brotes de diversas dermatosis, como la dermatitis atópica y otras, están relacionados con factores ambientales. El clima tiene una importante repercusión en la cantidad de brotes de dermatitis atópica, así como en la intensidad de los mismos y, por tanto, en la afectación social que genera. Así, en climas cálidos y húmedos se produce una importante mejoría49. El empeoramiento de está dermatosis se debe tanto a bajas HR (que agravan las alteraciones de la barrera cutánea50) como a bajas temperaturas51. Independientemente de la influencia del cambio climático la mayoría de los autores consideran que su prevalencia seguirá aumentando.
Barrera cutánea y sensibilización cutáneaLa baja humedad ambiental produce un aumento de la permeabilidad cutánea52, un engrosamiento de la epidermis como mecanismo de defensa y una mayor producción de mediadores de la inflamación53. Además, se ha demostrado en ratones que en condiciones de baja HR aumentan los mastocitos y la histamina en la dermis y se producen más conductas de rascado. Estos efectos pueden evitarse con la aplicación de vaselina pura54.
Estos cambios también se observan en pacientes con dermatosis inflamatorias crónicas como la psoriasis, la dermatitis atópica y la xerosis senil, en las que también se produce mayor prurito en los climas secos y fríos.
Estudios experimentales en ratones a los que se les provoca una reacción de hipersensibilidad cutánea en condiciones de HR controlada muestran que la intensidad de las fases inductora y efectora de dicha reacción es mayor en los ratones sometidos a bajas HR, observándose un incremento del número de células de Langerhans presentes en su epidermis, así como una mayor migración del antígeno a los ganglios regionales de drenaje55.
Igualmente, en humanos se ha comprobado que las bajas temperaturas y las bajas HR producen un aumento de las reacciones de tipo irritativo, así como las débilmente positivas a diversas sustancias presentes en las series estándar alemanas para pruebas epicutáneas, por lo que el Grupo Alemán de Contacto recomienda repetir dichas pruebas en condiciones climatológicas más cálidas, así como emplear un test de verificación como el ROAT (repeated open application test) en caso de reacciones débilmente positivas de relevancia dudosa56. Los alergenos cuya positividad aparecía como más influenciada por las condiciones climatológicas fueron la mezcla de fragancias, el formaldehído y la mezcla de parabenos56.
Radiación solar y pielLa radiación solar puede producir distintos problemas: de forma aguda quemaduras solares y reacciones de fotosensibilidad y a más a largo plazo fotodermatosis crónicas, fotoenvejecimiento, inmunosupresión local o sistémica y fotocarcinogénesis. Nosotros vamos a centrarnos en la fotocarcinogénesis y en las alteraciones inmunitarias que puede originar.
La capa de ozono y su influencia en la radiación ultravioletaLa cantidad de radiación ultravioleta B (UVB) que alcanza la superficie terrestre se modifica por una serie de factores: la hora del día (el 50% de la radiación ultravioleta [RUV] alcanza la superficie entre las 12 y las 15h), la estación del año (la inclinación del eje terrestre respecto a su órbita alrededor del sol produce variaciones en la proporción de luz solar que alcanza la tierra; en el hemisferio norte, por ejemplo, los mayores niveles se producen en verano), la latitud, la altitud (por cada 300 metros de ascenso un 4% más de RUV57), la capa de ozono, la nubosidad y la HR (a menor HR mayor RUV). Aparte de esto hay que tener en cuenta que determinadas superficies, como la arena y la nieve, son capaces de reflejar entre el 25 y el 90% de la radiación que reciben58.
La pérdida media de ozono desde la década de los noventa en latitudes medias del hemisferio norte ha oscilado del 3% (en verano) hasta el 6% (en primavera e invierno) cada década59. No obstante, el ritmo de pérdida actual de densidad de ozono en la estratosfera está disminuyendo60.
Aunque existen discrepancias entre los aumentos de radiación UVB previstos por las Naciones Unidas61 (un aumento entre el 1–5% por década en función de la latitud) respecto a los que algunos autores han medido en la superficie terrestre (hasta un 12% de aumento), posiblemente debido a los múltiples factores que afectan la cantidad de radiación UVB que alcanza la superficie terrestre, sí es esperable un aumento de dicha radiación. No obstante, dada la latencia de sus efectos crónicos y los cambios de hábitos poblacionales será difícil estimar qué proporción de efectos adversos producidos por una mayor fotoexposición se van a deber a un cambio real en el espectro de la radiación causado por las alteraciones en la capa de ozono59.
A este respecto, relacionando la fotocarcinogénesis (que será comentada con mayor detalle en el correspondiente epígrafe) con las alteraciones de la capa de ozono conviene reseñar que se han hecho estimaciones basadas en modelizaciones acerca del aumento de la incidencia de cáncer cutáneo debido a la destrucción de la misma, con la suposición de que el resto de factores implicados se mantuvieran inalterados. Dichas estimaciones prevén valores entre un exceso de incidencia del 9% en 2050 (en caso de cesar inmediatamente la liberación de compuestos con capacidad de destrucción de la capa de ozono) y del 300% en el peor escenario posible62. Estas modelizaciones se determinan extrapolando las dosis carcinogénicas en modelos murinos sin pelo, ajustando los datos en función de diferencias epidérmicas conocidas entre ambas especies e introduciendo el aumento esperable debido a la radiación UVB como «factor de amplificación biológico»63. En el caso del melanoma se estima que por cada 1% de disminución del grosor de la capa de ozono su incidencia aumentará entre un 1–2%64. Con ese mismo 1% de disminución de la capa de ozono el riesgo de desarrollar un carcinoma espinocelular aumentará entre 3–4,6% y el de un basocelular entre 1,7–2,7%65,66.
Así, la tasa de incidencia anual ajustada por edad del melanoma se ha triplicado entre 1975 y 2004, pasando de 6,8 a 18,5 casos por 100.000 habitantes67. En los Países Bajos se calcula que las incidencias de cáncer cutáneo no melanoma se doblarán en el período 2000–2015, en parte debido a un importante envejecimiento poblacional, pero también por el aumento de la radiación ultravioleta68.
InmunosupresiónExisten numerosos modelos animales en los que se ha comprobado que la luz UV (sobre todo UVB) es capaz de inhibir la respuesta inmunitaria producida por el contacto de un antígeno con la piel, actuando sobre las fases aferente y eferente69. Su efecto se produce a través de mutaciones en el ADN y de alteraciones de la isomerización del ácido urocánico y de las membranas lipídicas. Así, en ratones, puede conseguirse una supresión tanto de la sensibilidad de contacto como de las reacciones de hipersensibilidad retardadas. Pero no todos los modelos murinos ni todos los humanos son inmunosuprimidos por igual, ya que existe dependencia de la dosis (con baja dosis inmunosupresión local y con altas dosis sistémica) y la necesidad de una cierta base genética, como se ha visto al descubrir que ciertos polimorfismos del factor de necrosis tumoral α confieren mayor susceptibilidad a la inmunosupresión por UVB en humanos70.
Las propiedades inmunosupresoras de la RUV también están implicadas en la fotocarcinogénesis, puesto que los tumores inducidos por la RUV son muy inmunógenos, y se ha visto que la inmunosupresión secundaria a la fotoexposición es muy importante a la hora de permitir su proliferación71. La inducción mediada por la RUV de linfocitos T reguladores CD4+ y CD25+, que son mantenidos en circulación debido a la coestimulación que reciben a través de la señalización de CD80 y CD86, evita el reconocimiento de los tumores cutáneos incipientes. Por otra parte, la luz UVB, mediante la producción de dímeros de ciclobutano-pirimidina, altera el patrón de las citoquinas producidas por los queratinocitos, estimulando la secreción de interleucina-10, que tiene un papel principal en el desarrollo de supresión por parte de los linfocitos T CD4+ y CD25+, aunque el mecanismo exacto aún no se comprende completamente71.
Además, las propiedades inmunosupresoras de la luz UV se usan ampliamente en Dermatología para el tratamiento de ciertas patologías como la psoriasis, la dermatitis atópica o la micosis fungoide. De igual modo, se ha observado en un experimento que dosis únicas de UVB cuadriplican la dosis eritematógena mínima e inhiben la respuesta del tracto respiratorio a la ovoalbúmina en ratones asmáticos, lo que plantea la posibilidad de intentar ampliar su espectro terapéutico en humanos72.
La exposición solar a través de estos mecanismos inmunosupresores induce brotes de herpes labial73 y, posiblemente, también tenga influencia sobre la incidencia de los papilomavirus. Asimismo, también puede producir un empeoramiento de diversas infecciones cutáneas bacterianas o piodermitis74.
Cáncer cutáneoFotocarcinogénesisLa capacidad de la radiación solar para producir tumores cutáneos es conocida desde hace muchos años75. La RUV es capaz de producir tumores cutáneos a través de un mecanismo directo (produciendo mutaciones) e indirecto (a través de fenómenos de inmunosupresión, como se ha comentado en el epígrafe previo).
Celular y molecularmente, de forma muy resumida, la RUV produce varias alteraciones que inducen, promueven y mantienen mutaciones responsables de la aparición de tumores cutáneos. De forma directa, la UVB tras penetrar en la epidermis e interaccionar con el ADN, principal cromóforo de la misma, puede producir mutaciones76 (en especial dímeros de pirimidina) y especies reactivas del oxígeno que dañan tanto el ADN como las proteínas o las membranas lipídicas. A pesar de que la luz UVA es un productor débil de fotoproductos derivados del ADN, produce un espectro de mutaciones similar al de la luz UVB77, originando también dímeros de ciclobutano-pirimidina, así como una inhibición de la respuesta al daño actínico, con menor producción de p53 (que al aumentar en la célula estimula sus sistemas de reparación)78, menor tasa de apoptosis79 y, como consecuencia de estos efectos, la posibilidad de una mayor capacidad de fotocarcinogénesis. No obstante, la mayoría de su poder mutagénico es indirecto, a través de la producción de especies reactivas del oxígeno al interaccionar con otros cromóforos intracelulares80.
Un metanálisis sobre factores de riesgo de melanoma, realizado por Gandini et al, que analizó 57 estudios publicados antes del 2002, demuestra como factores de riesgo del melanoma la exposición solar intermitente (riesgo relativo [RR]: 1,61; IC: 1,31–1,99) y las quemaduras en la infancia (RR: 2,03; IC: 1,73–2,37)81.
Desde hace años experimentos murinos han demostrado un aumento de la eficacia tumoral de la RUV mediada por la temperatura82. Estos experimentos han mostrado incrementos de entre el 3 y el 7% en la eficacia inductora de la RUV por cada aumento de 1°C. Usando como aproximación un valor de aumento del 5% de eficacia inductora, los autores calculan que con un incremento de temperatura de 2°C globalmente pasaríamos de un exceso de incidencia de tumores, originado por el aumento de UVB del 9% a uno del 11% en el 205062. Evidentemente, la asunción del valor de eficacia inductora no tiene en cuenta los diferentes sistemas termorreguladores de las dos especies, y debe considerarse como una posibilidad teórica que deberá ser sometida a estudios en humanos para poder ser validada o refutada.
Nuevos hábitos de fotoexposición poblacionalesLa percepción del bronceado como signo de mejor posición social, unido al aumento de la temperatura, que estimula exposiciones más largas con menos ropa, puede estar aumentando de forma significativa la exposición a la RUV, independientemente de posibles cambios en el espectro de radiación que alcance la superficie59. Este es un posible factor de confusión que habrá que considerar al estudiar las causas del actual incremento de cáncer cutáneo.
En el contexto de los hábitos de exposición solar poblacionales el uso de cabinas de bronceado es cada vez más extenso; gozan de una gran aceptación y, de momento, no requieren un control estricto para su uso. La intensidad de la radiación UVA de estos aparatos puede ser entre 10–15 veces mayor que la recibida en un país como el nuestro al mediodía83. Un metanálisis realizado en 2005 con los diferentes estudios sobre el riesgo de cáncer cutáneo no melanoma y melanoma obtiene datos que merece la pena comentar. Para el análisis se incluyeron 19 artículos (18 de ellos tipo caso-control) publicados entre 1981 y 2005, con 7.355 casos de melanoma, y obtuvieron un RR de 1,15 (IC: 1,00–1,31) en los usuarios de cabinas de bronceado. Cuando se restringe el estudio a menores de 35 años el RR es mayor, de 1,75 (IC: 1,35–2,26). No obstante, cuando se analizan los 8 estudios en los que se han tenido en cuenta factores de confusión como la fotosensibilidad y la exposición al sol, los resultados ya no son significativos (RR: 1,19; IC: 0,33–4,30). Tampoco encuentran relación entre la dosis y el efecto84. Con estos datos parece cauto considerar el uso de estas cabinas como un probable factor de riesgo para el desarrollo de melanoma, en especial en caso de exposiciones tempranas, aunque no está demostrado. También en dicho metanálisis se observa que de los 5 estudios realizados sobre el RR de desarrollo de carcinoma basocelular y espinocelular en usuarios de cabinas de bronceado fue del 2,25 (IC: 1, 08–4,70) en el caso del carcinoma espinocelular, con resultados no significativos en el caso del basocelular84.
Contaminantes ambientales, partículas en suspensión y pielMerece la pena esbozar brevemente las alteraciones cutáneas producidas por la contaminación ambiental y las partículas en suspensión, así como aquellas directamente relacionadas con la tecnificación y la urbanización.
Se cree que las radiaciones de onda emitidas por gran parte de los electrodomésticos de nuestro entorno pueden producir alteraciones cutáneas, si bien la radiación UV es la más significativa. La dermatitis irritativa de contacto y la alérgica, la dermatitis atópica, el cloracné (especialmente relacionado con productos halogenados), la despigmentación química, las enfermedades esclerodermiformes, el cáncer cutáneo no melanoma, la micosis fungoide85 (relacionada con hidrocarburos halogenados) y una larga lista de patologías pueden verse producidas o agravadas por diversas sustancias presentes en nuestro entorno86.
Cómo afrontar los problemas desde el punto de vista dermatológicoHidratación cutáneaNo es el propósito de este artículo revisar en profundidad los diferentes componentes químicos que se pueden utilizar de forma tópica con fines emolientes (agentes dirigidos a aumentar la hidratación del estrato córneo mediante la formación de una película que limita la evaporación del agua) o humectantes (sustancias capaces de aumentar la capacidad del estrato córneo de capturar agua por otros mecanismos)87. Las sustancias emolientes se consideran muy seguras, ya que tienen una baja tasa de efectos secundarios, si bien se han descrito diversas patologías asociadas a su uso como dermatitis irritativas, dermatitis alérgicas de contacto, foliculitis y alteraciones pigmentarias, entre otras88.
Como alternativas de sustancias clásicas o como coadyuvantes de las mismas se podría destacar la posibilidad de aplicar tópicamente productos como: a) mezclas de ceramida, colesterol y ácidos grasos en proporciones similares a las de la barrera lipídica; b) inhibidores de serín-proteasa similares a la tripsina, o c) sustancias como el farnesil que activan el PPAR α y que son capaces de actuar estimulando los sistemas de regeneración habituales de la epidermis y aumentando la velocidad con la que se restaura la barrera cutánea89.
Asimismo, conviene hacer hincapié en medidas conductuales que eviten mayores alteraciones de la barrera cutánea, como los baños templados con geles no agresivos, evitando la fricción intensa y usando emolientes tras el mismo, evitación de lavados muy frecuentes de las manos y la cara o el uso de ropa fabricada con materiales transpirables y no muy ajustada90.
Humidificación ambientalComo hemos visto previamente la HR óptima para mantener una correcta hidratación cutánea está entre el 40–60%. Se pueden emplear desde métodos caseros, como la colocación de recipientes con agua sobre los radiadores, hasta aparatos de aire acondicionado de gama alta, capaces tanto de regular la humedad como la temperatura para obtener valores óptimos; lo importante es intentar aproximarse a dichos valores de HR.
Evitar flujos de aire dirigidos directamente hacia el usuario en el caso de aparatos de aire acondicionado o climatizadores, así como una adecuada ventilación del habitáculo también son importantes.
FotoprotecciónEstudios de pigmentación racial indican que el grado de pigmentación melánica de la piel depende del equilibrio entre las ventajas y desventajas de tener baja cantidad de pigmento. Como principal ventaja de los bajos niveles de pigmentación destaca una apropiada síntesis de vitamina D. Entre sus desventajas se encuentra la mayor fotocatálisis de folatos y una menor protección frente a la RUV91. Aunque es difícil definir un mínimo de RUV necesario para lograr una adecuada síntesis de vitamina D, parece que una exposición de 5–10min de la cara, los brazos y las manos tres veces por semana podría ser suficiente92.
Aunque nuestra piel posee un conjunto de mecanismos de defensa naturales como el engrosamiento de la epidermis, la síntesis de melanina y sistemas enzimáticos de reparación del ADN y de detoxificación, estos pueden ser insuficientes, en especial en personas de fototipo bajo.
Por ello, en nuestra consulta debemos informar a los pacientes sobre ciertas precauciones que pueden incorporar a su vida diaria para evitar en lo posible los daños fotoinducidos. En este aspecto es especialmente importante la educación de niños y jóvenes, ya que por ser el grupo de edad con mayor número de actividades en el exterior y tener una larga esperanza de vida los efectos adversos pueden ser más intensos en ellos.
Se debe evitar en lo posible la exposición solar (sobre todo en los momentos centrales del día). Se debe recomendar el uso de ropa, sombreros (en especial con visera o ala ancha) y gafas de sol, ya que son medidas de fotoprotección básicas. A este respecto conviene recordar que la capacidad de la ropa para protegernos del sol depende de su grosor, peso, material y densidad de las fibras textiles, entre otros factores, y que las diferentes modas influencian enormemente su uso. Asimismo, para que un cristal proteja efectivamente el ojo deber permitir el paso de menos del 0,001% de las longitudes de onda entre 200 y 320nm, y menos del 0,01% de las comprendidas entre 320 y 400nm93.
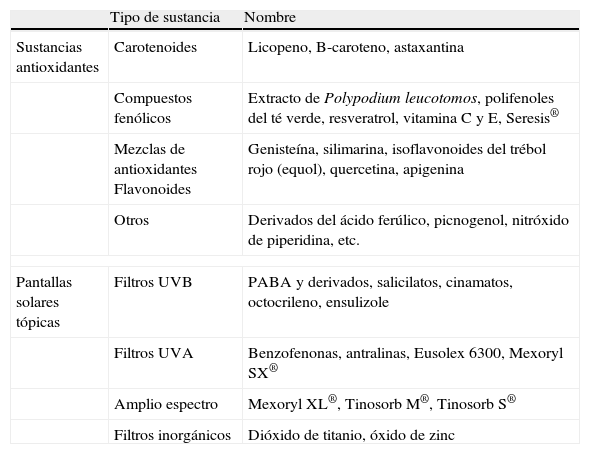
Hay diferentes sustancias que pueden proporcionar cierta fotoprotección sistémica por poseer propiedades antioxidantes, como la genisteína o los polifenoles del té verde, y que se están empleando por vía oral para obtener una cobertura cutánea general. Por otra parte, en fotoprotección tópica se han empleado numerosas sustancias (tabla 1), generalmente combinadas para obtener una protección óptima, tanto en el espectro de la radiación UVA como en el de la UVB94, y parecen prevenir el fotoenvejecimiento95. Por tanto, en áreas de piel no cubiertas por medios físicos se debe recomendar su uso. Se recomienda emplear un factor de protección solar superior a 15 en cantidad generosa (ya que los índices de protección se miden con aplicaciones de 2mg/cm2, raramente empleadas en la práctica), de manera homogénea, inicialmente 15–30min antes de la exposición y con reaplicaciones frecuentes (al menos cada dos o tres horas si se mantiene la exposición)64. Como curiosidad cabe comentar que se está investigando la aplicación tópica de pequeñas moléculas que activen p53, inhibiendo la molécula MDM2 (implicada en la cascada bioquímica de la melanogénesis), con el objetivo de que produzcan un «moreno artificial» sin necesidad de RUV96. Asimismo, también se ha comprobado la eficacia del uso de sustancias capaces de disminuir el daño actínico aumentando la reparación del ADN por diversos mecanismos enzimáticos como son la fotoliasa, la T4 endonucleasa (que está siendo empleada en pacientes con xeroderma pigmentoso93,97) o la aplicación tópica de oligonucleótidos de ADN, cafeína y creatinina tópicas93.
Algunas sustancias usadas en fotoprotección tópica
| Tipo de sustancia | Nombre | |
| Sustancias antioxidantes | Carotenoides | Licopeno, B-caroteno, astaxantina |
| Compuestos fenólicos | Extracto de Polypodium leucotomos, polifenoles del té verde, resveratrol, vitamina C y E, Seresis® | |
| Mezclas de antioxidantes Flavonoides | Genisteína, silimarina, isoflavonoides del trébol rojo (equol), quercetina, apigenina | |
| Otros | Derivados del ácido ferúlico, picnogenol, nitróxido de piperidina, etc. | |
| Pantallas solares tópicas | Filtros UVB | PABA y derivados, salicilatos, cinamatos, octocrileno, ensulizole |
| Filtros UVA | Benzofenonas, antralinas, Eusolex 6300, Mexoryl SX® | |
| Amplio espectro | Mexoryl XL®, Tinosorb M®, Tinosorb S® | |
| Filtros inorgánicos | Dióxido de titanio, óxido de zinc | |
Aunque aparentemente la mayoría de estas medidas son sencillas, no suelen llevarse a cabo. Como muestra, un tercio de la población de EE.UU. encuestada refiere que sufre quemaduras solares al menos una vez al año68. Además las encuestas sobre hábitos de fotoprotección no encuentran relación entre el fototipo de los encuestados y el uso de protección. Muchos pacientes alegan el excesivo calor y la sudoración como factores que les dificultan la toma de medidas adecuadas, así como el deseo de broncearse98. Por otro lado, en otros países con menores índices de radiación ultravioleta que los medidos en España tal vez el beneficio del uso diario de fotoprotección no supere sus perjuicios (coste y problemas de sensibilización entre otros) en los meses de menor radiación solar, como planteó Diffey en un estudio realizado en el Reino Unido99. Aunque sí se ha demostrado un moderado beneficio de su uso diario en lugares con altos índices de radiación ultravioleta como Tejas, Australia y Queensland100.
Respecto al control del riesgo demostrado con el uso de cabinas de bronceado, España lideró la modificación de la norma EN 60335-2-27 para lograr limitar la irradiancia efectiva eritematógena máxima de las lámparas a 0,3W/m2 y la ausencia de emisión de radicación UVC101. No obstante, encuestas a los usuarios de dichas cabinas muestran que los establecimientos que lo ofertan no suelen informar sobre los riesgos, que un porcentaje importante de los usuarios no usan protección ocular y que muchos sobrepasan los tiempos y las sesiones recomendadas84. Por tanto, tenemos también por delante una importante labor de información y educación del consumidor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.