El término «calcifilaxia» se ha utilizado desde la década de los 601 para referirse a casos con ulceraciones cutáneas secundarias a la calcificación vascular en pacientes con insuficiencia renal terminal con hiperparatiroidismo secundario2. Sin embargo, han sido publicados casos no urémicos3 y se ha profundizado en el mecanismo de la calcificación vascular cutánea, determinándose que es un complejo proceso multifactorial y no un simple depósito. Daudén et al.4 propusieron una nueva clasificación de estos procesos, denominándolos genéricamente «calcificaciones vasculares cutáneas» (CVC), que nosotros compartimos.
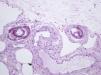
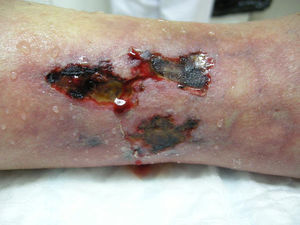
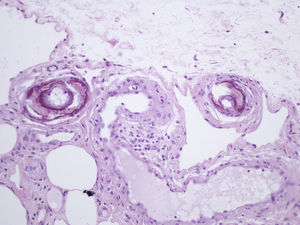
Presentamos el caso de una mujer de 80 años con antecedentes de osteoporosis severa refractaria, hipertensión arterial, obesidad, fibrilación auricular y polimialgia reumática en tratamiento esteroideo. Debido a la resistencia de su osteoporosis a los tratamientos habituales se le pautó teriparatida, que es un péptido recombinante humano, el fragmento activo de 34 aminoácidos de la hormona paratiroidea (rhPTH) y que se administra por vía subcutánea a dosis de 20 microgramos cada 24 horas. A los 2 meses del inicio del tratamiento la paciente desarrolló úlceras necróticas dolorosas sobre áreas livedoides en las piernas (fig. 1). El estudio ecográfico-doppler, la función renal, el producto fosfocálcico y el estudio de autoinmunidad eran normales. En la biopsia cutánea (fig. 2) se demostraba ulceración y necrosis en la epidermis, dilatación de los vasos dérmicos y calcificación circunferencial en la pared de las arterias de pequeño tamaño en la unión dermo-hipodérmica, con inmunofluorescencia negativa. Estos hallazgos eran compatibles con una calcifilaxia, sin el antecedente de insuficiencia renal. Sin embargo, al administrar teriparatida, que actúa igual que la hormona paratiroidea (PTH) endógena, se creó farmacológicamente una situación de hiperparatiroidismo. Se retiró el fármaco con mejoría progresiva de sus lesiones a las 3 semanas de la suspensión. La paciente falleció por una descompensación de su patología cardiológica a los 6 meses del inicio del cuadro, ya sin lesiones cutáneas (fig. 3).
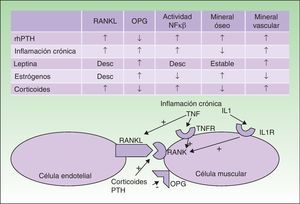
La CVC se va a producir en pacientes en los que existan determinados factores de riesgo predisponentes, como obesidad, inflamación crónica, tratamiento corticoideo o menopausia, y en los que además se altere el metabolismo fosfocálcico y de la PTH. En los últimos años se han ido conociendo progresivamente las relaciones patogénicas entre estos factores. Se ha visto que en estos pacientes las células endoteliales vasculares van a adoptar un fenotipo osteogénico. Tanto las células endoteliales vasculares como los osteoblastos, osteoclastos y las células de músculo liso vascular pueden expresar en su membrana el receptor RANK y su ligando RANKL; cuando RANK se activa aumenta la actividad del factor de transcripción NFκβ (factor de necrosis κβ). La osteoprotegerina (OPG) es un antagonista soluble de RANKL producido por los mismos tipos celulares. Tanto los factores de riesgo que hemos mencionado como la PTH van a interactuar en esta cadena de señalización5–7.
Cuando aumenta la actividad de NFκβ se deposita calcio en los vasos, y se pierde en el hueso. Los trastornos inflamatorios crónicos, los corticoides y la PTH activan RANK y RANKL; los corticoides y la PTH además disminuyen la OPG; por lo tanto inducen un aumento en la actividad de NFκβ. Los estrógenos tienen una acción protectora frente a la osteoporosis y la CVC, al aumentar la expresión de OPG; en la menopausia se perderá esta protección. Un efecto parecido tiene la leptina, elevada en la obesidad. Sin embargo, la hiperleptinemia en pacientes con inflamación crónica parece estimular la CVC (fig. 3).
La teriparatida actúa igual que la PTH endógena y ha demostrado su eficacia en la osteoporosis refractaria8. En los ensayos clínicos se comprobó que únicamente eran detectables alteraciones de calcio y fósforo en las primeras horas tras la administración9; en las analíticas solo se detecta PTH intacta, por lo que tampoco se elevan sus niveles. Nuestra hipótesis es que en nuestra paciente confluían factores de riesgo como obesidad, menopausia, inflamación crónica y tratamiento con corticoides, y la administración de rhPTH desestabilizó el equilibrio de la cascada de señalización de NFκβ desencadenando la CVC. La cronología, la mejoría tras la retirada y los mecanismos de actuación del fármaco parecen apoyar nuestra teoría.