INTRODUCCION
Los estudios en genética y biología molecular han experimentado sustanciales avances en los últimos años, materializándose en el denominado Proyecto Genoma Humano, un proyecto de investigación cooperativa internacional que ha permitido la secuenciación completa del genoma humano y el desarrollo de la medicina biomolecular. El progreso en este campo ha sido particularmente significativo en el estudio de las genodermatosis, y ha puesto de manifiesto la importancia de la integridad funcional y morfológica de la epidermis para el mantenimiento de la homeostasia cutánea. En este artículo se estudian los hallazgos biomoleculares más recientes referidos a los trastornos estructurales y metabólicos de los queratinocitos y las uniones intercelulares, mencionando los genes alterados y/o las proteínas defectuosas que las condicionan. Existen otras enfermedades que pudieran incluirse en este trabajo, pero resulta imposible detallar todas ellas. Es importante advertir que, aunque en este artículo hemos tratado de consignar los datos científicos más recientes, la medicina biomolecular es una disciplina en constante evolución, por lo que alguna de las conclusiones expuestas pueden sufrir modificaciones importantes más adelante.
FISIOLOGIA DE LA EPIDERMIS
El proceso de diferenciación de las células epidérmicas o queratinocitos en su trayecto desde la capa basal al estrato córneo se denomina queratinización, y representa una serie de cambios morfológicos y acontecimientos metabólicos cuya consecuencia final es la aparición de los corneocitos. Estas células carecen de núcleo y organelas citoplasmáticas, conteniendo únicamente filamentos de queratina y una matriz proteica que los agrega. En la cara interna de la periferia celular existe una membrana plasmática rica en proteínas y lípidos, denominada envoltura cornificada, en torno a la cual se localiza la membrana celular bilipídica.
Los filamentos de queratina constituyen el citoesqueleto de los queratinocitos, participando, entre otras funciones, en la coordinación de la forma celular y en la integridad estructural de la epidermis mediante la conexión a desmosomas y hemidesmosomas. Se conocen al menos 20 queratinas epiteliales (K1-K20) y 10 queratinas distintas en el pelo. Cada una de ellas es producto de un único gen, localizado en el cromosoma 17 en el tipo I, y en el cromosoma 12 en el tipo II 1, y se expresan como heterodímeros obligados, es decir, los filamentos intermedios formados por una queratina de tipo I (K9-K20) se unen obligatoriamente a un filamento intermedio compuesto por queratina de tipo II (K1-K8) 2. La presencia de estos pares de queratinas es muy específica del tejido y grado de diferenciación tisular; así, en el estrato basal de la epidermis se encuentra el par K5-K14, mientras que en capas más altas de la epidermis es sustituido por el par K1-K10 y la queratina K2e (salvo en palmas y plantas, donde se agrupan la K1 y la K9). Las uñas y las células progenitoras del pelo expresan las queratinas K6, K16 y K17, mientras que la mucosa expresa K6, K16, K4 y K13 3. La matriz proteica es una sustancia ultraestructuralmente electrondensa originada a partir de los gránulos de queratohialina, que desaparecen como tales en la zona de transición entre la capa granulosa y la capa córnea. Su componente principal es la filagrina, que se sintetiza en el estrato granuloso a partir de un precursor de alto peso molecular denominado profilagrina, el cual es codificado por un gen localizado en la región proximal del brazo corto del cromosoma 1 (cr 1q21) 4. La misión fundamental de la filagrina es la agregación de los filamentos de queratina 5,6. Además de la filagrina, en la matriz proteica existen otras proteínas como la involucrina y la proteína rica en serina que, además, forman parte de la envoltura cornificada 7. En la cara interna de la membrana celular se encuentra la envoltura cornificada, que consta de una capa de proteínas insolubles unidas gracias a la enzima transglutaminasa epidérmica o queratinocítica (TGK), siendo la loricrina su sustrato principal 8. La loricrina y la involucrina son codificadas por un gen que se localiza, al igual que el de la filagrina, en el cromosoma 1 (cr 1q21) 9. La función principal de TGK es la formación de la envoltura cornificada durante la diferenciación terminal de las células epidérmicas, creando enlaces isopeptídicos entre las mencionadas proteínas para conferir resistencia al corneocito ante las agresiones físicas, químicas y enzimáticas 10. En consecuencia, la regulación de la actividad de la TGK repercute directamente en la diferenciación terminal de la epidermis. El locus del gen que codifica la transglutaminasa epidérmica se ha localizado en el cromosoma 14 (14q11) 11.
La composición lipídica de la epidermis también cambia de manera sustancial durante la queratinización 12. Los lípidos epidérmicos ejercen un papel esencial en la formación de la membrana lipídica, en la cohesión y descamación de los corneocitos, y en el mantenimiento de la función barrera de la epidermis, impidiendo la pérdida transepidérmica de agua. Los fenómenos bioquímicos que afectan a los lípidos epidérmicos ocurren en la interfase entre la capa granulosa y la capa córnea, lugar donde los lípidos intracelulares son vertidos al espacio intercelular desde los cuerpos lamelares por un mecanismo de exocitosis. El colesterol sulfato es uno de los escasos lípidos polares que persisten en la capa córnea, y su desulfatación gracias a la enzima sulfatasa esteroidea parece ser fundamental en la desestabilización de las conexiones intercelulares, hecho responsable de la descamación de los corneocitos. Por el contrario, los fosfolípidos, elemento principal de la membrana celular bilipídica, predominan en los estratos inferiores de la epidermis, mientras que son muy escasos en el estrato córneo, donde la membrana plasmática termina siendo monolipídica 13.
Las células epidérmicas se comunican entre sí por medio de los desmosomas y los puentes de unión intercelulares (gap junctions). Los desmosomas son unos complejos de adhesión intercelulares que permiten la conexión de los filamentos de queratina con la membrana plasmática, y que están involucrados en la comunicación intercelular y la organización de las funciones celulares. Sus principales componentes son las cadherinas desmocolina y desmogleína (unas glucoproteínas con capacidad de unión al calcio), la placoglobina, la placofilina y la desmoplaquina 14,15. Por su lado, los puentes de unión intercelular están formados por la yuxtaposición de las conexinas, unas estructuras canaliculares que permiten el emparejamiento electroquímico entre dos células adyacentes 15,16. En cuanto a la unión dermoepidérmica, esta se divide en tres elementos: los hemidesmosomas (que constan de placa citoplásmica, porción membranosa y componentes extracelulares), los filamentos de anclaje y las fibrillas de anclaje. La placa citoplásmica de los hemidesmosomas contiene plectina, mientras que la porción membranosa posee el antígeno BP180 y la integrina α6β4. Los filamentos de anclaje se extienden desde los hemidesmosomas hasta la lámina densa, y están formados principalmente por laminina 5. Las fibrillas de anclaje van desde la lámina densa hasta la dermis, y se componen de moléculas de colágeno VII 15.
En resumen, el proceso de la queratinización comprende una serie de transformaciones celulares estructurales y metabólicas desde el estrato basal, el único nivel epidérmico donde proliferan los queratinocitos, hasta la capa córnea. Cualquier alteración estructural o metabólica en el proceso anteriormente descrito conlleva la aparición de un trastorno cutáneo, que clínicamente se traduce en una alteración de la descamación cutánea o en un aumento de la fragilidad de la piel (tablas 1 y 2).
ICTIOSIS
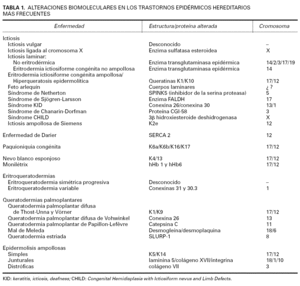
Ictiosis vulgar
Es la ictiosis más frecuente, con una incidencia estimada de 1/250 individuos. Se hereda según un patrón autosómico dominante en la gran mayoría de los casos. Las flexuras suelen estar respetadas, y es frecuente que se asocie a hiperqueratosis folicular, hiperlinearidad palmar y dermatitis atópica. Su origen fisiopatológico reside en la retención anormal de los corneocitos, cuya cohesividad está aumentada por razones desconocidas, y tampoco se sabe el defecto genético exacto que la determina. En algunos casos, la expresión de filagrina en la epidermis está disminuida, por lo que se sospecha que existe un defecto postraslacional en la expresión de profilagrina, pero no se han logrado detectar mutaciones en este gen 17.
Ictiosis ligada al cromosoma X
Tiene una incidencia aproximada de 1 de cada 6.000 varones, y se hereda de manera recesiva ligada al sexo. Se caracteriza por la existencia de grandes escamas poligonales de color marrón en la superficie de extensión de las extremidades. Desde el punto de vista genético, esta enfermedad se debe a una deleción del gen de la enzima sulfatasa esteroidea (STS), que se localiza en la parte distal del cromosoma X (Xp22.3-pter) 18. El 90 % de los pacientes con ictiosis X sufre una deleción completa del gen de la STS 19,20, mientras que el resto de los casos muestra deleciones parciales 21,22 o mutaciones puntuales 23. Cuando la magnitud de la deleción de este locus es amplia pueden aparecer síndromes de contigüidad genética, en los que la ictiosis ligada al cromosoma X se asocia a retraso mental 24, talla baja 25, la forma recesiva de condrodisplasia punctata o a síndrome de Kallmann, caracterizado por hipogonadismo y anosmia 26. Los métodos diagnósticos más recientes se basan en el análisis directo del material genético. El empleo de técnicas de laboratorio como la reacción en cadena de la polimerasa (PCR) 27 o la hibridación in situ con fluoresceína (FISH) 28 han permitido detectar y estudiar las deleciones del gen de la STS, tanto en varones enfermos como en mujeres portadoras 29.
Ictiosis laminar
Las ictiosis laminares son un grupo de ictiosis congénitas no ampollosas de herencia autosómica recesiva que afectan a 1 de cada 200.000-300.000 individuos. Su espectro clínico es muy amplio, y no se correlaciona con las características fenotípicas lo cual hace difícil realizar una clasificación en subgrupos de la ictiosis laminar, por lo que se ha propuesto una denominación genérica de ictiosis recesivas 30. Las manifestaciones clínicas comienzan desde el nacimiento, momento en que se observan eritema y descamación generalizadas. Durante la vida adulta, algunos pacientes no sufren eritrodermia, sino que la piel aparece extremadamente seca, apergaminada, resquebrajada por unos surcos superficiales que delimitan extensas escamas adheridas en la zona central y con bordes ligeramente despegados. Durante algún tiempo, las mutaciones genéticas en el gen de la TGK se consideraron el factor causal de la ictiosis laminar 11,31; sin embargo, la evidencia de que una parte de estos enfermos no presenta alteraciones en dicho gen, localizado en el cromosoma 14 (14q11), dificulta extraordinariamente el estudio genético como método diagnóstico 32-34. Adicionalmente, estudios de ligamiento genético han localizado otros loci en el cromosoma 2 (2q33-35) 35,36, en el cromosoma 3 (3p21) 37, en el cromosoma 17 38 y en el cromosoma 19 (19p12-q12 y 19p13.2-13.1) 37. Recientemente se ha descrito una variante de ictiosis recesiva en la que todos los individuos afectados presentan una queratodermia palmoplantar, y cuya alteración genética reside en el gen de la ictina, un gen desconocido hasta ahora localizado en el cromosoma 5 (5q33) que codifica una proteína transmembrana 39.
Hiperqueratosis epidermolítica (eritrodermia ictiosiforme congénita ampollosa)
La hiperqueratosis epidermolítica o eritrodermia ictiosiforme congénita ampollosa es un cuadro ictiosiforme de herencia autosómica dominante muy raro que afecta a 1 de cada 300.000 recién nacidos. Aparece desde el nacimiento, y se caracteriza en las fases iniciales por eritema generalizado y ampollas superficiales que dejan áreas denudadas y exudativas. Posteriormente, aparece una hiperqueratosis difusa, más acentuada en áreas flexurales y yuxtaarticulares. Se sabe que la enfermedad se debe a una mutación en los genes de las queratinas K1 y K10, localizados en los cromosomas 17 y 12, respectivamente 40. La hiperqueratosis palmoplantar está presente únicamente en los casos en los que la alteración genética reside en el gen de la queratina K1 41. En algunos casos, las lesiones presentan una distribución segmentaria, observándose áreas de hiperqueratosis, por lo general unilaterales, que se disponen siguiendo las líneas de Blaschko, mientras que en otros pacientes solamente existen lesiones lineales solitarias o en forma de nevo epidérmico epidermolítico aislado. Desde el punto de vista genético, estas formas parciales o «en mosaico» se deben a una mutación poszigótica precoz que determina una pérdida de homozigosidad en el locus responsable de la enfermedad 42. Es importante destacar que si la línea germinal está afectada, los individuos con formas mosaico de hiperqueratosis epidermolítica pueden transmitir la mutación a su descendencia, que puede presentar una alteración generalizada, hecho esencial a la hora del consejo genético en los pacientes con nevos epidérmicos epidermolíticos focales 43.
Otros síndromes ictiosiformes
Feto arlequín
Es una forma excepcional de ictiosis de herencia autosómica recesiva de pronóstico infausto en la que se aprecian grandes placas queratósicas de tono marrón o amarillento separadas por profundas fisuras eritematosas. En la cara existe un llamativo ectropión y eclabium. Desde el punto de vista fisiopatológico, se cree que la alteración básica reside en los cuerpos lamelares, pero no se sabe con certeza el defecto molecular subyacente. Algunos autores proponen subclasificar la entidad en subgrupos, en función de la presencia o ausencia de filagrina, de la morfología de los cuerpos lamelares y de la expresión de queratinas epidérmicas 44. Se ha descrito un paciente portador de una deleción genética en el cromosoma 18 (18q21.3) 45.
Síndrome de Netherton
El síndrome de Netherton es una enfermedad rara de herencia autosómica recesiva en la que se asocian ictiosis, defectos estructurales del pelo y atopia. La ictiosis lineal circunfleja es el tipo de ictiosis más característica, y consiste en la aparición intermitente, en tronco y extremidades, de lesiones eritematosas descamativas de carácter migratorio, que muestran un peculiar borde descamativo doble en la periferia de la lesión. Prácticamente todos los pacientes presentan tricorrexis invaginada, pero las manifestaciones atópicas están presentes en un número muy variable de pacientes, de modo que su presencia no es un elemento indispensable para el diagnóstico de la enfermedad. La alteración genética se localiza en el cromosoma 5 (5q32), en el gen SPINK5, que codifica un inhibidor de la serina proteasa LEKTI 46. Publicaciones recientes apuntan la posibilidad del diagnóstico de la enfermedad mediante técnicas inmunohistoquímicas que midan la expresión de LEKTI en la epidermis 47.
Síndrome de Sjögren-Larsson
Es una enfermedad autosómica recesiva muy infrecuente que cursa con ictiosis, espasticidad y retraso mental. La ictiosis, presente desde el nacimiento, puede ser una eritrodermia descamativa semejante a la ictiosis laminar o consistir en un engrosamiento no descamativo de la capa córnea, con hiperqueratosis en cuello, abdomen y flexuras. El proceso se debe a una mutación del gen de la enzima aldehído deshidrogenasa grasa (FALDH), localizado en el cromosoma 17 (17p11.2) 48,49.
Síndrome KID
Es una forma rara de ictiosis de herencia autosómica dominante que asocia queratitis, ictiosis y sordera (keratitis, ictiosis, deafness). Los pacientes presentan una grave queratitis con fotofobia y ceguera progresiva, una descamación ictiosiforme generalizada y sordera de tipo sensorial. Se han descrito mutaciones en el gen de la conexina 26, localizado en el cromosoma 13 (13q11) 50, la cual está implicada en la queratinización y la carcinogénesis, y en el gen GJB6, que codifica la conexina 30 51.
Condrodisplasia punctata de herencia dominante ligada al cromosoma X
A diferencia de la forma recesiva leve que se asocia a la ictiosis ligada al cromosoma X, la condrodisplasia punctata dominante afecta exclusivamente a mujeres y es letal en el caso de los varones heterozigotos. Los niños nacen con frecuencia con aspecto de bebé colodión y luego presentan lesiones eritematosas descamativas arciformes en tronco y extremidades; con el paso del tiempo, los cambios ictiosiformes desaparecen y, en algunos casos, esas mismas zonas muestran una hiperpigmentación residual parecida a la que se observa en la incontinencia pigmentaria. Es característico el punteado epifisario de los huesos largos, las vértebras, la laringe y la tráquea, y no son infrecuentes otras anomalías como la hipoplasia de las falanges distales, la hipoplasia nasal, la laringomalacia y la talla baja (enanismo rizomélico). La enfermedad se debe a una mutación de la proteína ligadora del emopamil, localizada en el cromosoma X (Xp11.22-23), que funciona como 7,8-δ -isomerasa en la síntesis del colesterol 52. Se han descrito casos de mosaicismo genético de la enfermedad 53,54, incluso en un paciente varón 55.
Síndrome CHILD
Es una enfermedad de herencia dominante ligada al cromosoma X y, por lo tanto, afecta casi exclusivamente a mujeres. Su denominación deriva de los hallazgos clínicos que presenta: Congenital Hemidisplasia with Ictiosiform nevus and Limb Defects. Las lesiones ictiósicas aparecen precozmente, y son llamativamente unilaterales. A veces, la zona afectada presenta áreas lineales de piel normal que siguen la distribución de las líneas de Blaschko, y lo mismo ocurre con el hemicuerpo sano, donde se pueden observar zonas blaschkoides afectadas, por lo que es posible que este fenotipo se corresponda con un mosaicismo funcional del cromosoma X42. Los pacientes con este síndrome presentan una alteración genética de la enzima 3-β -hidroxiesteroide deshidrogenasa 56. El único caso descrito en un paciente varón parece corresponder a una mutación poszigótica precoz 57.
Síndrome de Chanarin-Dorfman
Es una enfermedad autosómica recesiva caracterizada por la acumulación de triglicéridos en el citoplasma de los leucocitos, el músculo, el hígado, los fibroblastos y otros tejidos como el cristalino. Clínicamente se asocia ictiosis congénita de tipo eritrodermia ictiosiforme, hígado graso y un variable grado de afectación neurológica y ocular. Las concentraciones sanguíneas de lípidos son normales, pero es característica la presencia de vacuolas lipídicas dentro de los granulocitos y los monocitos 58. El trastorno genético reside en el cromosoma 3, donde se localiza el gen de una hidrolasa denominada CGI-58 59.
Tricotiodistrofia
Es una enfermedad autosómica recesiva debida a un déficit de sulfuro y caracterizada porque los pacientes presentan eritrodermia ictiosiforme, cabello quebradizo y retraso físico y mental. Este conjunto de manifestaciones, clásicamente conocido como síndrome de Tay, puede asociarse a fotofobia y dismorfismo facial, hablándose entonces del síndrome PIBIDS (Photophobia, Ichthyosis, Brittle hair, Intellectual impairement, Decreased fertility and Short stature). Con luz polarizada, el tallo del pelo tiene un típico aspecto de cebra, mostrando una alternancia de bandas clarooscuras. Ambos procesos se deben a una mutación en el gen del xeroderma pigmentoso, pero no se asocian a riesgo elevado de cáncer cutáneo 60,61.
Eritrodermia congénita de Siemens
Es un proceso similar a la hiperqueratosis epidermolítica o eritrodermia ictiosiforme congénita ampollosa, aunque de menor intensidad. No está presente desde el nacimiento, y las ampollas aparecen únicamente en las zonas de fricción y traumatismos, sobre todo en las manos y los pies. Los estudios genéticos han demostrado una alteración en el gen de la queratina K2e, perteneciente a la familia de las queratinas tipo II 62,63.
ENFERMEDAD DE DARIER
De herencia autosómica dominante, esta enfermedad se caracteriza por la aparición de lesiones papulosas pruriginosas de tono rosado-amarillento o pardusco en áreas seborreicas. Las uñas presentan una estriación longitudinal de color blanco y rojo, hiperqueratosis y apolillamiento subungueal y destrucción de la parte distal en forma de «V», mientras que en las superficies mucosas se aprecian pápulas blanquecinas en placas con aspecto de «empedrado». Existen formas mosaico de enfermedad de Darier que, en función de su distribución y extensión, se denominan lineales, zosteriformes, segmentarias o unilaterales. Más raramente, los pacientes pueden presentar manifestaciones difusas de la enfermedad de Darier con áreas en las que la afectación es más intensa (mosaicismos de tipo II) 42,64,65. El proceso se debe a una mutación genética en el gen ATP2A2, localizado en el cromosoma 12 (12q23-24.1) 66. Este gen codifica una ATPasa dependiente del calcio denominada SERCA2, localizada en el sarcoplasma y el retículo endoplásmico, la cual se encarga de mantener la homeostasia cálcica intracelular, y cuya ausencia determina la desestabilización de las cadherinas, uno de los componentes de la placa desmosómica 67,68.
PAQUIONIQUIA CONGÉNITA
Es una enfermedad de herencia autosómica dominante caracterizada por la discoloración y el engrosamiento de todas las uñas desde los primeros meses de la vida. Pueden asociarse otros hallazgos clínicos, en función de los cuales se distinguen cuatro tipos de paquioniquia congénita: el tipo I (el más frecuente), que se asocia a queratosis palmoplantar, leucoqueratosis oral y queratosis folicular; el tipo II, con los hallazgos del tipo I más ampollas palmoplantares, hiperhidrosis palmoplantar, dentición precoz y esteatocistomas múltiples; el tipo III, que engloba todo lo anterior más queilitis angular, disqueratosis corneal y cataratas; y el tipo IV, que asocia los tipos I, II y III junto con lesiones laríngeas, ronquera, retraso mental, anomalías del pelo y alopecia 69. Se han descrito alteraciones en los genes de las queratinas K6a 70,71, K6b 72, y K16 71, que se expresan en el lecho ungueal, palmas, plantas y epitelio mucoso) y K17 71,73, que aparece en la vaina radicular externa del pelo y los conductos de las glándulas sebáceas.
NEVO BLANCO ESPONJOSO
Es una enfermedad autosómica dominante de alta penetrancia que se presenta desde el nacimiento o a lo largo de las primeras décadas de la vida. Su localización más frecuente es la mucosa oral, fundamentalmente la zona yugal, donde se aprecian placas blanquecinas difusas, de consistencia blanda y superficie aterciopelada o rugosa. El proceso, asintomático, se debe a una alteración en las queratinas K4 74 y K13 75, de expresión mucosa.
MONILÉTRIX
Los enfermos que sufren este proceso, de herencia autosómica dominante, presentan una alteración en el diámetro del tallo del pelo, el cual presenta alternancia de zonas anchas y estrechas como si fuera un collar de perlas. La alteración genética se localiza en las queratinas del folículo del pelo hHb1 y hHb6, pertenecientes a la familia de las queratinas de tipo II 76-78.
ERITROQUERATODERMIAS
Eritroqueratodermia simétrica progresiva
Es una enfermedad autosómica dominante rara de expresividad clínica variable caracterizada por la presencia de placas eritematosas descamativas simétricas en cara, nalgas y extremidades. No existe afectación troncular, y en la mitad de los casos hay eritroqueratodermia palmoplantar. La alteración genética se desconoce, aunque se ha descrito un caso de eritroqueratodermia simétrica progresiva en el que se detectó una alteración en el gen de la loricrina 79 que resultaba en una proteína anormalmente larga (1q21). Para algunos autores, sería muy similar clínica y genéticamente a la variante ictiósica del síndrome de Vohwinkel, por lo que proponen una denominación común como queratodermia de tipo loricrina 80.
Eritroqueratodermia variable
Es una rara genodermatosis de herencia autosómica dominante caracterizada por hiperqueratosis difusa generalizada o en placas persistentes sobre las que aparecen lesiones eritematosas transitorias de morfología y localización variables. Se han descrito familias en las que se asociaban eritroqueratodermia variable y sordera. Los estudios de ligamiento genético han permitido detectar una alteración en las conexinas 31 81 y 30.3 82,83, codificadas en los genes GJB3 y GJB4 del cromosoma 1, respectivamente (1p34-35.1). Para algunos autores, la interacción física entre las dos conexinas permitiría explicar la variabilidad clínica del proceso, ya que individuos con una alteración genética similar pueden desarrollar fenotipos muy distintos y diferentes mutaciones pueden producir el mismo fenotipo clínico 84. Algunos pacientes no presentan mutaciones en ninguno de los dos genes implicados 85.
QUERATODERMIAS PALMOPLANTARES
Las queratodermias palmoplantares incluyen numerosas enfermedades cuyo denominador común es la presencia de una hiperqueratosis en palmas y plantas, pero cuyo patrón hereditario, y características clínicas e histológicas son variables. Se sabe que los genes implicados en la queratodermia palmoplantar codifican proteínas estructurales, proteínas desmosómicas, componentes de los complejos de unión intercelular o enzimas que intervienen en la formación de la envoltura cornificada de los queratinocitos y en el proceso de diferenciación terminal de la epidermis 86. Se excluyen de este grupo otros procesos en los que se asocia hiperqueratosis palmoplantar, como la paquioniquia congénita, las eritroqueratodermias, la epidermolisis ampollosa, las displasias ectodérmicas y algunos síndromes cutáneos complejos.
Queratodermia palmoplantar de Thost-Unna y Vörner
Históricamente, se distinguía entre la queratodermia palmoplantar de Thost-Unna (variante no epidermolítica), y la de Vörner (de tipo epidermolítico), pero ambas entidades no sólo son clínicamente indistinguibles, sino que comparten hallazgos genéticos similares. Son de herencia autosómica dominante y se manifiestan desde los primeros meses de la vida con una hiperqueratosis palmoplantar difusa y simétrica. La variante epidermolítica se debe a mutaciones de las queratinas K1 87 o K9 88,89, mientras que la queratodermia palmoplantar no epidermolítica se debe a una alteración de la queratina K1 90. Parece, no obstante, que es el tipo de mutación existente en cada caso lo que condiciona la existencia o no de epidermolisis; así, en las formas epidermolíticas se localiza en el dominio a helicoidal de la molécula, mientras que en las variantes no epidermolíticas se afecta la porción aminoterminal 90.
Queratodermia palmoplantar mutilante de Vohwinkel
De herencia autosómica dominante, este tipo de queratodermia palmoplantar se caracteriza por la existencia de una hiperqueratosis palmoplantar difusa y simétrica desde la primera infancia. A diferencia de la queratodermia palmoplantar de Thost-Unna y Vörner, en este cuadro aparecen bandas fibrosas constrictivas en torno a los dedos que acaban provocando la amputación de estos. El defecto genético reside en el gen de la conexina 26 91, que también se expresa en las células cocleares del oído, por lo que no es infrecuente la asociación de sordera 92. Existe una variante del síndrome de Vohwinkel clásico que asocia ictiosis y queratodermia palmoplantar mutilante sin sordera en la que se ha detectado a una mutación en el gen de la loricrina, localizado en el cromosoma 1 (1q21) 93,94.
Queratodermia palmoplantar de Papillon-Lefèvre
Es una queratodermia palmoplantar difusa de herencia autosómica dominante caracterizada porque junto a una hiperqueratosis que sobrepasa la región palmoplantar se produce una periodontitis que conduce a la pérdida definitiva de los dientes. El trastorno genético reside en el gen de la catepsina C, localizado en el cromosoma 11 (11q14.1-3), una enzima lisosomal responsable de catalizar la degradación de residuos proteicos intracelulares y coordinar la activación de diversas serina proteasas inflamatorias 95,96.
Mal de Meleda
De herencia autosómica recesiva, se manifiesta queratodermia e hiperhidrosis palmoplantar, placas hiperqueratósicas sobre las articulaciones, distrofia ungueal y eritema perioral. En 19 familias afectadas se ha detectado una alteración en el gen que codifica la proteína SLURP-1 (secreted mammalian Ly-6/uPAR-related protein 1), localizado en el cromosoma 8 (8qter) 97. Su papel fisiológico no es bien conocido, pero se cree que participa en la función de los receptores celulares transmembrana.
Queratodermia palmoplantar estriada
Es una queratodermia palmoplantar de herencia autosómica dominante en la que la hiperqueratosis palmoplantar se dispone linealmente desde la superficie palmar de los dedos hasta la propia palma. Desde el punto de vista biomolecular, el tipo estriado se debe a una mutación en el gen de las cadherinas desmosómicas (desmogleínas y desmocolinas) 98-100, localizado en el cromosoma 18q12, o en el de la desmoplaquina 1 100,101 (cromosoma 6p24).
EPIDERMOLISIS AMPOLLOSAS
Las epidermolisis ampollosas hereditarias (EAH) son un conjunto de enfermedades relativamente heterogéneo cuyo denominador común es la gran fragilidad cutánea ante los traumatismos menores. Las primeras clasificaciones se llevaron a cabo en función de las observaciones clínicas y genéticas, por lo que se distinguían una amplia variedad de entidades, muchas de ellas denominadas según el autor que las había estudiado o la región donde fueron descritas. En la actualidad, los hallazgos ultraestructurales y biomoleculares han permitido simplificar las antiguas y extensas clasificaciones (tabla 3) 102. En función de la localización microscópica de la ampolla, se distinguen tres tipos de epidermolisis ampollosas hereditarias: la simple, en la que el despegamiento se forma a nivel intraepidérmico; la juntural, en la que el clivaje es en el seno de la lámina lúcida, y la distrófica, en la que la ampolla se produce bajo la lámina densa. Desde el punto de vista clínico, cuanto más superficial es el nivel de clivaje de la ampolla, menor es la secuela cicatrizal.
Epidermolisis ampollosas simples
La mayoría de estos cuadros son de herencia autosómica dominante, salvo en el caso de la epidermolisis ampollosa simple asociada a distrofia muscular, cuya herencia es autosómica recesiva. El sustrato etiopatogénico de las epidermolisis, con la misma excepción anterior, reside en la alteración de las queratinas K5 y K14, codificadas en los cromosomas 17 (17q12-21) y 12 (12q11-13), respectivamente 103,104. Se han descrito numerosas mutaciones puntuales en la K5 y en la K14, tanto en el tipo herpetiforme o de Dowling-Meara como en el tipo localizado o de Weber-Cockayne y en la generalizada o de Koebner 105. Sin embargo, hay pocos casos descritos en los que la mutación conlleve la ausencia completa de la queratina afectada. Hasta el momento sólo se conocen casos con carencia absoluta de K14 106-108, pero no de K5, lo cual hace pensar que la ausencia de K5 es letal en seres humanos 109. En la epidermolisis ampollosa simple con pigmentación moteada, a diferencia de las formas clínicas anteriores, parece existir una clara correspondencia genotípica y fenotípica, ya que se ha identificado la misma alteración genética en siete familias afectadas por la enfermedad 110. En todas ellas se ha caracterizado la mutación P25L, en la cual se produce la sustitución de la prolina por la leucina en la posición 25 del extremo aminoterminal de la K5, dentro de uno de los dominios no helicoidales. Algunos pacientes con epidermolisis ampollosa simple presentan una queratodermia palmoplantar importante, pero no se sabe el defecto biomolecular que justifica este fenotipo 111,112.
La epidermolisis ampollosa simple asociada a distrofia muscular se debe a un defecto en la expresión de plectina, una proteína intracitoplasmática que se localiza en la placa de anclaje de los hemidesmosomas de la capa basal de la epidermis y en el sarcolema y los sarcómeros del músculo, y cuyo gen se localiza en el cromosoma 8q24 113,114. Se ha descrito un caso puntual de una familia consanguínea en el que una mutación de homozigótica del gen de la plectina provocó una epidermolisis ampollosa simple letal 115.
Epidermolisis ampollosas junturales
Las epidermolisis ampollosas junturales, de herencia autosómica recesiva, se desarrollan como consecuencia de mutaciones en genes que codifican componentes estructurales del complejo hemidesmosoma-filamentos de anclaje, es decir, los genes de la laminina 5, el colágeno XVII (COL17A1) y la integrinaa6b4 116. El tipo letal o de Herlitz aparece cuando hay mutaciones en la laminina 5, que consta de tres cadenas polipeptídicas, denominadas α3, β3 y γ2, y que son codificadas por los genes LAMA3 (localizado en 18q11.2), LAMB3 (localizado en 1q32) o LAMC2 (localizado en 1q25-q31), respectivamente 117-120. En Europa y Estados Unidos, la más frecuente es la que afecta al gen LAMB3 (especialmente la R635X), mientras que en Japón y Oriente la proporción es similar 116. La mayoría de las epidermolisis ampollosas junturales de tipo no Herlitz se deben a alteraciones en el colágeno XVII, que se codifica en el gen COL17A1 (cromosoma 10q24.3) 121, pero también hay pacientes en los que se detecta una expresión anormal de laminina 5 122. En general, las mutaciones del gen COL17A1 afectan a diferentes zonas de la ectorregión BP180, siendo mucho más raro que se altere la porción intracelular del BP180 123,124. Se ha descrito un caso excepcional de epidermolisis ampollosa juntural no Herlitz en el que se asociaban mutaciones simultáneas en el gen COL17A1 y el LAMA3125. Finalmente, la alteración de cualquiera de las dos subunidades de la integrina codificadas por el gen ITGB4 (subunidad β4), y el gen ITGA6 (subunidad α6), respectivamente, condiciona la presencia de una epidermolisis ampollosa juntural asociada a atresia pilórica 126,127. En otras formas raras, como la variante inversa, la cicatrizal o la de inicio tardío progresiva, se desconoce la alteración molecular.
Epidermolisis ampollosas distróficas
El patrón hereditario es de tipo autosómico dominante o recesivo, pero también existen casos esporádicos en los que es imposible determinar si se trata de casos dominantes de novo o formas menores de herencia recesiva 128. Todas las epidermolisis ampollosas distróficas descritas hasta el momento se deben a una mutación en el gen COL7A1, localizado en el cromosoma 3 (cr. 3p21), que codifica el colágeno VII, el componente principal de las fibrillas de anclaje 129,130. La gravedad de las manifestaciones clínicas de las epidermolisis ampollosas distróficas depende del tipo de mutación genética del gen COL7A1. En los casos de epidermolisis ampollosa distrófica recesiva grave o de tipo Hallopeau-Siemens existe una alteración homozigota del gen que determina la finalización prematura de la traslación y la aparición de una proteína truncada. En el tipo recesivo clínicamente menos grave (también denominado de tipo no Hallopeau-Siemens), la mutación se produce a nivel del extremo amino del gen (NC1), mientras que en las formas dominante, pruriginosa y pretibial, la mutación se localiza en la parte central del gen, determinando la aparición de moléculas de colágeno VII inestables 131. No obstante, recientemente se ha publicado un caso familiar en el que la terminación prematura de la traslación cursó únicamente con manifestaciones leves de la enfermedad 132. En algunos estudios se ha visto que las mutaciones genéticas que originan las epidermolisis ampollosas distróficas presentan variaciones geográficas, siendo algunas de ellas específicas de Gran Bretaña (R578X, 7786delG y R2814X) o Japón (5818delC,6573 + 1G → C y E2857X), mientras que otras mutaciones pueden aparecer en cualquier parte del mundo (425A → G y G2043R) 133. Se desconoce la alteración genética exacta que determina las variantes de epidermolisis ampollosas distróficas recesivas inversa y centrípeta; así, en la inversa las fibrillas de anclaje están alteradas, pero el inmunomarcaje del colágeno VII es normal 134,135. Finalmente, en la dermolisis transitoria del recién nacido, caracterizada porque la tendencia a desarrollar ampollas desaparece en los primeros años de vida, se observan agregados anormales intracelulares de colágeno VII que se atribuyen a una secreción anormal transitoria del colágeno 136-138, mientras que la ausencia congénita de piel (síndrome de Bart), actualmente excluida de las formas de epidermolisis ampollosa distrófica dominante porque puede aparecer en otras formas 102,139, también de observa una alteración del colágeno VII 140.