Ibrutinib es un inhibidor de tirosina quinasa de Bruton (BTK) aprobado para el manejo del linfoma de células del manto (MCL) recidivante o refractario, y leucemia linfocítica crónica (CLL). Se está estudiando también ibrutinib como terapia potencial para diversas condiciones dermatológicas incluyendo la enfermedad del injerto contra el huésped, urticaria espontánea crónica, pénfigo y lupus eritematoso sistémico, con resultados preliminares prometedores en algunos casos1–3.
Aunque los episodios adversos cutáneos son un hallazgo común en los pacientes con terapia de ibrutinib4,5, no se han reportado casos de vasculitis linfocítica (LyV) en la literatura médica hasta la fecha.
Un varón de 57 años fue ingresado en el departamento de dermatología. Tenía antecedentes clínicos significativos de MCL blástico en estadio IV, y había sido tratado con quimioterapia de primera línea con R-CHOP/R-DHAP (rituximab, ciclofosplamida, doxorubicina, vincristina y prednisona/rituximab dexametasona, citarabina, cisplatina), trasplante aut>logo de células madre y rituximab, con enfermedad progresiva. También fue tratado con quimioterapia de segunda línea con ibrutinib (560mg/día) con enfermedad progresiva, y quimioterapia de tercera línea con CAR-T19 aut>logo, logrando la remisión completa.
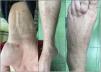
Mientras seguía la terapia de ibrutinib, tuvo historia de tres semanas de lesiones papulares eritematosas múltiples en piernas y brazos (fig. 1). Reportó episodios previos de lesiones similares que no fueron examinadas por el dermatólogo, con administración concomitante de ibrutinib, y resolución espontánea. No se reportaron síntomas sistémicos, historia previa de enfermedad cutánea y autoinmune, ni reacciones por fármacos. Todas las pruebas ANCA y serológicas para infecciones múltiples resultaron negativas, incluyendo la prueba RT-PCR para SARS-CoV-2. Transcurridos ocho días las lesiones se resolvieron espontáneamente, sin necesidad de discontinuar el tratamiento.
Se biopsió una de las lesiones, revelando la presencia de infiltrado denso de linfocitos, monocitos y eosinófilos dispersos alrededor de vasos de tamaño pequeño y mediano en la dermis superficial y profunda. Se apreciaron imágenes de LyV, con células que alcanzaban las paredes de los vasos, mostrando tumefacción endotelial marcada, oclusión trombótica luminal, depósito de fibrina y extravasación de glóbulos rojos (fig. 2). La epidermis reflejó espongiosis ligera con acantosis irregular. La tinción inmunohistoquímica reflejó un infiltrado de células CD3+T reactivas con mezcla de linfocitos CD4+y CD8+y linfocitos CD20+B dispersos. CD5, SOX11, y ciclina D1 confirmaron la ausencia de MCL.
La biopsia reveló la presencia de infiltrado inflamatorio denso en la dermis superficial y media, compuesto principalmente de linfocitos (A, B). Se observaron imágenes de vasculitis linfocítica, con tumefacción endotelial, oclusión trombótica luminal, depósito de fibrina y extravasación de glóbulos rojos (C, D).
Se ha reportado toxicidad cutánea como uno de los efectos secundarios no hematológicos más comunes de ibrutinib. Algunos autores han reportado erupciones cutáneas relacionadas con ibrutinib en el 13–27% de los pacientes con CLL y MZL4,5. Dichas erupciones pueden oscilar entre equimosis asintomática, erupción petequial no palpable y púrpura palpable leucocitoclástica de tipo vasculitis4,5. Pileri et al.6 revisaron los episodios adversos cutáneos de los pacientes tratados con ibrutinib en su centro. Se describió paroniquia del pliegue ungueal en 7 de 50 pacientes que recibieron ibrutinib, en algunos casos junto con granuloma piogénico, mientras que nueve pacientes experimentaron reacciones eccematosas. Otros hallazgos incluyen un caso de queilitis angular y glositis aguda, infección fúngica e impétigo perinasal.
Nuestro paciente reflejó LyV. Hasta la fecha se han identificado cinco pacientes que siguen terapia de ibrutinib con vasculitis leucocitoclásica (LCV), pero ninguno con LyV.
Otras reacciones cutáneas relacionadas con ibrutinib incluyen dermatosis neutrofílica7, paniculitis con o sin vasculitis, y nódulos cutáneos dolorosos purpúricos y bilaterales formados por inflamación mixta de tipo linfocítico, neutrofílico y granulomatoso8.
La vasculitis linfocítica cutánea es una inflamación de los vasos sanguíneos con potencial de dañar la piel y otros órganos corporales. No se comprende plenamente la etiopatogenia de la vasculitis linfocítica cutánea, aunque se cree que es una respuesta autoinmune desencadenada por diversos factores, siendo las infecciones, fármacos y enfermedades del tejido conectivo las más destacadas1.
En nuestro caso, el principal diagnóstico dermatológico diferencial es la vasculitis leucémica9, una forma específica de vasculitis, mediada por células blásticas leucémicas en lugar de células inflamatorias reactivas. En nuestro paciente, tanto los estudios inmunohistoquímicos como el curso benigno de las lesiones descartaron esta posibilidad.
En conclusión, reportamos el primer caso de vasculitis linfocítica secundaria a ibrutinib con resolución espontánea, que no requirió discontinuación del tratamiento. El origen de este trastorno sigue siendo incierto, pero podría estar asociado a una respuesta inflamatoria anormal inducida por el fármaco.
FinanciaciónEste estudio no ha recibido financiación alguna.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.