Las escalas Psoriasis Area and Severity Index (PASI) utilizada para evaluación clínica y Dermatology Life Quality Index (DLQI) que valora la calidad de vida, son los instrumentos más frecuentemente referenciados1.
Aunque podría esperarse que la severidad de la psoriasis coincidiera con las escalas de calidad de vida relacionada con la salud (CVRS), la correlación hallada entre estas herramientas ha sido impredecible2. Por tanto, nuestro objetivo fue evaluar la sensibilidad de la versión colombiana de DLQI en los pacientes que inician terapia biológica.
Realizamos un estudio longitudinal observacional (con al menos dos mediciones) basado en datos retrospectivos. Se examinó a pacientes >16 años con diagnóstico clínico de psoriasis/artropatía psoriásica entre 2014 y 2022 en Medicarte-IPS de Medellín, Colombia. Se excluyó a aquellos sin historia clínica, o con al menos dos medidas de DLQI/PASI. Se evaluaron las variables sociodemográficas, clínicas, terapéuticas y CVRS.
Se efectuó un análisis univariante para describir la frecuencia de las variables. La capacidad de respuesta se evalúo calculando los valores delta de Glassy y d de Cohen, entre la primera medida de los pacientes y cada medición adicional del DLQI3. También se calificó la capacidad de respuesta en virtud del subtipo de psoriasis, valorándose la severidad de la enfermedad basal mediante PASI. Todos los análisis se realizaron utilizando el software R versión 4.1.1 (Core Team, Foundation for Statistical Computing, 2022. Viena, Austria).
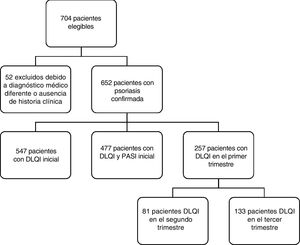
De los 704 pacientes potencialmente elegibles, solo 652 tenían diagnóstico confirmado de psoriasis y, entre ellos, solo 257 poseían información sobre las medidas iniciales y > 2 de las puntuaciones DLQI/PASI (fig. 1).
La edad media de los participantes fue de 52,8 años (desviación estándar [DE] = 14,4). Las características sociodemográficas y clínicas se resumen en el Anexos A y B del material adicional – tabla A.
El subtipo principal fue la psoriasis en placas (88,3%), las comorbilidades más frecuentes fueron el sobrepeso (43,1%), la hipertensión (27,6%) y la obesidad (22,9%) (Anexo 1 – tablaB). Además, > 50% de los pacientes recibieron un inhibidor del factor de necrosis tumoral (TNF) (57,8%), siendo el adalimumab el agente biológico más comúnmente utilizado (Anexos A y B del material adicional – tablaC).
El valor de la media inicial de PASI fue de 5,58 (DE 8,79) y los de las medidas subsiguientes fueron de 2,64; 2,46 y 2,19, respectivamente, siendo la media de DLQI inicial de 5,33 (DE 6,75), con cifras subsiguientes de 3,10; 2,46 y 2,14 (tabla 1). El mayor deterioro de CVRS se encontró en la psoriasis pustulosa (DLQI = 14,2 [DE 13,1]), seguido de compromiso en el cuero cabelludo y plantar/palmar, hallándose un valor d de Cohen = 0,37 (intervalo de confianza [IC] 95% = 0,24–0,50) (Anexos A y B del material adicional – tabla 1 y fig. 2A) y, para las segundas, terceras y últimas medidas, fueron de 0,38 (IC 95% = 0,22–0,53); 0,45 (IC 95% = 0,28–0,63); 0,46 (IC 95% = 0,26–0,67), respectivamente (p<0,05). En cuanto al delta de Glass, dichas medidas fueron de 0,40 (IC 95% = 0,21–0,60), respectivamente (Anexos A y B del material adicional - tabla 2 y fig. 2B-D).
Capacidad de respuesta de la medida con DLQI
| Capacidad de respuesta en el primer trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 257) | Trim. 1 (n = 257) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 5,33 (6,75) | 3,10 (5,53) | 0,37 [0,24–0,50] | 0,40 [0,21–0,60] |
| Mediana [IQR] | 2,00 [0,8–00] | 1,00 [0,3–00] | ||
| Capacidad de respuesta en el segundo trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 173) | Trim. 2(n = 173) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 4,55 (6,29) | 2,46 (4,94) | 0,38 [0,22–0,53] | 0,42 [0,18–0,67] |
| Mediana [IQR] | 1,80 [0–7,00] | 0 [0–2,00] | ||
| Capacidad de respuesta en el tercer trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 133) | Trim. 3(n = 133) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 5,02 (6,93) | 2,14 (4,10) | 0,45 [0,28–0,63] | 0,70 [0,36–1,05] |
| Mediana [IQR] | 2,00 [0–7,00] | 0 [0–2,00] | ||
| Capacidad de respuesta en el cuarto trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 101) | Trim. 4(n = 101) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 4,91 (7,34) | 2,22 (4,65) | 0,46 [0,26–0,67] | 0,58 [0,21–0,95] |
| Mediana [IQR] | 1,20 [0–7,00] | 0 [0–2,00] | ||
DE: desviación estándar; DLQI: Dermatology Life Quality Index; IC: intervalo de confianza; IQR: rango intercuartílico (25° percentil–75° percentil).
Se encontraron valores d de Cohen de 0,25 (0,10–0,41); 0,43 (0,12–0,74) y 0,68 (0,34–1,02) en las formas leve, moderada y severa, respectivamente (tabla 2).
Capacidad de respuesta en virtud de la severidad de la psoriasis
| Psoriasis leve PASI < 5 | ||||
|---|---|---|---|---|
| Primer trimestre | ||||
| DLQI | Inicial(n = 170) | Trim. 1 (n = 170) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 2,94 (4,70) | 1,84 (3,79) | 0,25 [0,10, 0,41] | 0,29 [0,05, 0,53] |
| Mediana [IQR] | 1,00 [0,4,00] | 0 [0,2,00] | ||
| Segundo trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 121) | Trim. 2 (n = 121) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 2,61 (4,43) | 1,45 (3,17) | 0,29 [0,10, 0,47 | 0,29 [0,10, 0,47 |
| Mediana [IQR] | 1,00 [0,4,00] | 0 [0,1,00] | ||
| Tercer trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 95) | Trim. 3 (n = 95) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 2,77 (4,66) | 1,66 (3,75) | 0,24 [0,03, 0,44] | 0,30 [−0,03, 0,62] |
| Mediana [IQR] | 1,00 [0,4,00] | 0 [0,1,00] | ||
| Cuarto trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 74) | Trim. 4 (n = 74) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 2,95 (5,61) | 1,15 (2,67) | 0,32 [0,08, 0,55] | 0,68 [0,13, 1,21] |
| Mediana [IQR] | 1,00 [0,3,75] | 0 [0,1,00] | ||
| Psoriasis moderada PASI ≥ 5–10 | ||||
|---|---|---|---|---|
| Primer trimestre | ||||
| DLQI | Inicial(n = 44) | Trim. 1 (n = 44) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 7,49 (5,78) | 4,77 (6,30) | 0,43 [0,12, 0,74] | 0,43 [0,02, 0,84] |
| Mediana [IQR] | 6,50 [1,98, 12,3] | 2,00 [0,6,25] | ||
| Segundo trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 31) | Trim. 2 (n = 31) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 7,15 (5,53) | 3,45 (5,63) | 0,78 [0,28, 1,31] | 1,07 [0,29, 1,82] |
| Mediana [IQR] | 5,00 [1,95, 11,5] | 1,00 [0,4,50] | ||
| Tercer trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 20) | Trim. 3 (n = 20) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 7,74 (5,63) | 2,75 (4,67) | 0,24 [0,03, 0,44] | 0,30 [−0,03, 0,62] |
| Mediana [IQR] | 8,00 [2,73, 12,5] | 2,00 [0,3,00] | ||
| Cuarto trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 16) | Trim. 4 (n = 16) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 7,17 (6,14) | 2,88 (4,80) | 0,80 [0,23, 1,40] | 0,89 [0,03, 1,74] |
| Mediana [IQR] | 5,50 [1,60, 12,5] | 1,00 [0,3,00] | ||
| Psoriasis severa PASI ≥ 10 | ||||
|---|---|---|---|---|
| Primer trimestre | ||||
| DLQI | Inicial(n = 42) | Trim. 1 (n = 42) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 12,1 (8,14) | 5,98 (7,87) | 0,68 [0,34, 1,02] | 0,78 [0,31, 1,25] |
| Mediana [IQR] | 11,0 [6,00, 18,0] | 2,00 [0,9,75] | ||
| Segundo trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 20) | Trim. 2 (n = 20) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 10,9 (8,48) | 7,05 (8,80) | 0,51 [0,04, 1,00] | 0,44 [−018, 1,06] |
| Mediana [IQR] | 9,5 [3,00, 18,3] | 3,00 [0,13,5] | ||
| Tercer trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 17) | Trim. 3 (n = 17) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 12,8 (9,21) | 4,18 (4,84) | 1,26 [0,63, 1,95] | 1,79 [0,57, 2,96] |
| Mediana [IQR] | 15,0 [3,00, 19,0] | 2,00 [0,4,00] | ||
| Cuarto trimestre | ||||
|---|---|---|---|---|
| DLQI | Inicial(n = 10) | Trim. 4 (n = 10) | d de Cohen/IC 95%** | delta de Glass/IC 95% |
| Media (DE) | 13,2 (9,34) | 7,70 (8,96) | 0,96 [0,20, 1,80] | −0,34 [0,34, 1,54] |
| Mediana [IQR] | 14,00 [4,75, 18,8] | 3,50 [2,00, 14,8] | ||
DE: desviación estándar; DLQI: Dermatology Life Quality Index; IC: intervalo de confianza; IQR: rango intercuartílico (25° percentil–75° percentil); PASI: Psoriasis Area and Severity Index.
Nuestros hallazgos sugieren que la versión colombiana del DLQI tiene una ligera capacidad de respuesta en las personas con psoriasis, aun cuando se administró una terapia biológica altamente efectiva. Ello contrasta con otros trabajos, en los que se había demostrado que el instrumento era altamente sensible al cambio en el curso de la enfermedad, tras iniciar una terapia4, aunque concuerda con publicaciones recientes que abogan por revisar el DLQI en los pacientes psoriásicos5,6. De manera importante, en nuestro estudio se encontró específicamente que el DLQI era más sensible al cambio en los sujetos con psoriasis severa, hallazgo que es consistente con su mayor especificidad en las dermatosis inflamatorias severas.
Prevaleció el uso de anti-TNF, lo cual contrasta con la práctica clínica actual, pero dicho hallazgo puede explicarse por la inclusión de pacientes con menos información ausente en la etapa temprana del estudio, lapso en el cual estos agentes biológicos eran los únicos comercialmente disponibles en Colombia.
Nuestro estudio encontró una puntuación DLQI inicial con un efecto moderado en CVRS, lo cual contradice a los informes previos4, aunque puede deberse a la falta de equivalencia de la versión traducida del DLQI (no validada) al colombiano.
Las diferencias de las puntuaciones DLQI/PASI, en comparación con otros informes, podrían explicarse por el inicio de la terapia en la mayoría de los pacientes. Además, la puntuación puede haberse visto influida por la no equivalencia transcultural anteriormente mencionada de DLQI y/o las propiedades de la medida del instrumento PASI, ya que carece de sensibilidad para evaluar las variantes clínicas de la psoriasis (es decir, palmoplantar, cuero cabelludo, pustulosa, y artritis psoriásica).
La fortaleza principal de este estudio reside en haberse centrado en pacientes pertenecientes a la mayor cohorte de sujetos psoriásicos que recibieron terapia biológica en Colombia, y la evaluación de la capacidad de respuesta del DLQI en aquellos con la enfermedad leve, moderada y severa, ya que esta propiedad psicométrica del instrumento se ha estudiado poco a nivel global. Las limitaciones fueron su diseño retrospectivo, que es más propenso a los sesgos de información, debido a los datos ausentes. Además, la escasez de la información en años recientes en que pudo incluirse el uso de agentes biológicos más actuales se vio influida por la pandemia de COVID-19 durante los años 2020 y 2021, ya que los seguimientos presenciales fueron limitados.
En conclusión, la versión colombiana no validada del DLQI mostró una falta de capacidad de respuesta al evaluar a los pacientes con psoriasis leve y moderada, lo cual apela a la adaptación y validación transcultural de esta herramienta, para obtener una versión más equivalente al instrumento original.
FinanciaciónEste trabajo fue financiado por el Grupo de Investigación Dermatológica (GRID) de la Universidad de Antioquía (Medellín, Colombia), habiendo contribuido M.F. Tibaduiza y Y.K. Berbeo con sus propios recursos, para adquirir algunos materiales y servicios relacionados con el estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Queremos expresar nuestro agradecimiento a Medicarte S.A.S. y EPS Sura por proporcionarnos acceso a su base de datos codificada de pacientes. También agradecemos a Catalina Orozco, Carolina Hincapié, Alejandro Berbeo y Sebastián Burgos por su colaboración, así como al Group of Investigative Dermatology (GRID) de la Universidad de Antioquía (Medellín, Colombia) por su respaldo a la logística del estudio.